Строение атома.
В результате
экспериментов, посвященных выяснению
строения атома, было установлено, что
атомы состоят из положительно заряженных
ядер и электронной оболочки. Заряд ядра
атома определяется находящимися в нем
положительно заряженными частицами-протонами.
Например, заряд ядра атома фтора равен
+9. Из этого следует, что в состав ядра
атома фтора входит девять протонов.
Почему числом протонов в ядре отмечаются
атомы разных элементов? По сравнению с
протонами и нейтронами электроны имеют
несравнимо меньшую массу, поэтому массу
всего атома считают, принимая во внимание
находящиеся в ядре нейтроны и протоны.
При расчете числа протонов и нейтронов,
находящихся в ядре протонов, необходимо
учесть, что масса протона приблизительно
равна массе нейтрона. Таким образом,
масса атома считается равной суммарной
массе находящихся в ядре протонов и
нейтронов. Так если в состав атома
кремния входит 14 нейтронов и 14 протонов
то атомная масса кремния будет равна
28.Если известны заряд атома, то можно
рассчитать, сколько нейтронов находится
в ядре. Например, заряд ядра атома бора
равен +5, а относительная атомная масса
11. Это означает, что в ядре находится,
пять протонов и 11-5=6 нейтронов. Число
электронов, составляющих электронную
оболочку атома, равно числу протонов,
входящих в состав атомного ядра (атом
электронейтрален). Это следует из того,
что заряд электрона численно равен
заряду протона. Таким образом, атомный
номер элемента показывает число
электронов, составляющих электронную
оболочку атома. Например, атомный номер
кислорода равен 8. Электронную оболочку
атома кислорода составляют восемь
электронов. Необходимо помнить, что
электроны располагаются в атоме не как
угодно, а по слоям. Зная номер периода,
можно определить число электронных
слоев атома, на которых находятся
электроны. Так, если рубидий находится
в пятом периоде, то электроны этого
элемента располагаются на пяти электронных
слоях.
Модели атома(Морозова,
Резерфорда, Бора) В 1900 г. М. Планк (Германия)
высказал предположение, что вещества
поглощают и испускают энергию дискретными
порциями, названными им квантами. Энергия
кванта Е пропорциональна частоте
излучения (колебания) v:где h — постоянная
Планка (6, 626*10″-34 Дж-с.); v = с /Лямбда, с
— скорость света; X — длина волны.
В 1910 г. В лаборатории
Э. Резерфорда (Англия) в опытах по
бомбардировке металлической фольги
α-частицами было установлено, что
некоторые α-частицы рассеиваются
фольгой. Отсюда Резерфорд заключил, что
в центре атома существует положительно
заряженное ядро малого размера, окруженное
электронами. Наличие положительного
ядра в атоме получило подтверждение
в дальнейших экспериментах. Радиусы
ядер лежат в пределах 10-14—10-15 м, т.е. в
104—105 раз меньше размера атома. Резерфорд
предсказал существование протона и его
массу, которая в 1800 раз превышает массу
электрона. В этом же 1910 г Резерфорд
предложил ядерную планетарную модель
атома, состоящего из тяжелого ядра,
вокруг которого двигаются по орбиталям
электроны, подобно планетам солнечной
системы. Однако, как показывает теория
электромагнитного поля, электроны в
этом случае должны двигаться по спирали,
непрерывно излучая энергию, и падать
на ядро.
В 1910 г. датский
ученый Н.Бор, используя модель Резерфорда
и теорию Планка, предложил модель
строения атома водорода, согласно
которой электроны двигаются вокруг
ядра не по любым, а лишь по разрешенным
орбитам, на которых электрон обладает
определенными энергиями. При переходе
электрона с одной орбиты на другую атом
поглощает или испускает энергию в виде
квантов. Каждая орбита имеет номер
п (1, 2, 3, 4, …), который назвали главным
квантовым числом.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Урок 3. Элементарные сведения о строении атома

АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
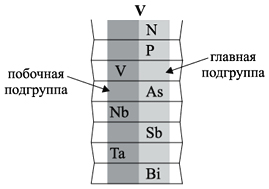
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
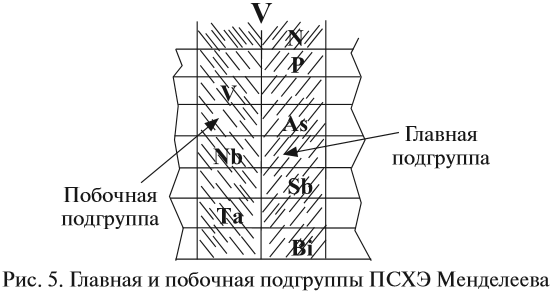
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
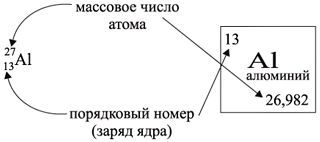
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
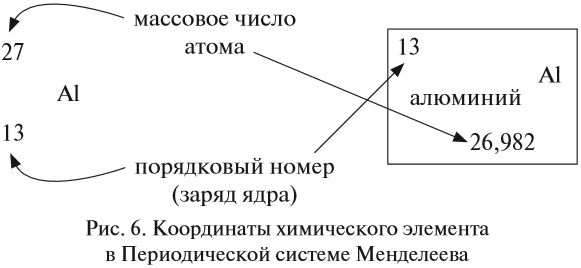
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
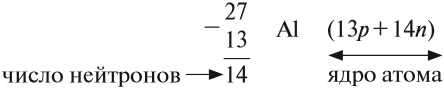
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
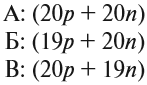
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 ( 14 С) имеет такие же химические свойства, как и углерод-12 ( 12 С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
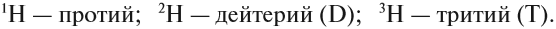
Химический элемент «кислород» также представлен тремя природными изотопами:
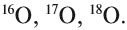
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Но вернемся к описанию строения атома.

Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
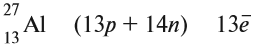
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
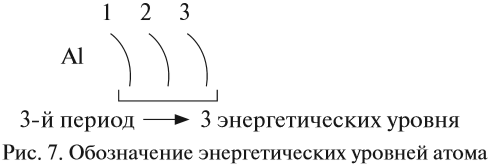
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
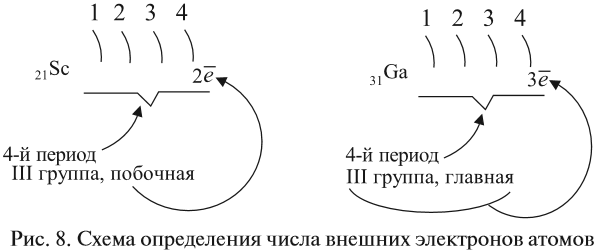
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
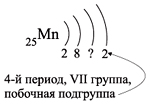
Например, согласно пунктам 1…4 для атома марганца определено:

Получили распределение электронов в атоме марганца (рис. 9):
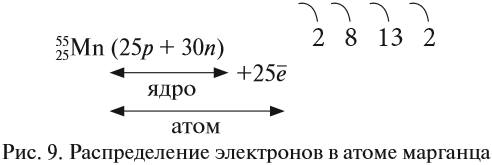
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
На каждом подуровне может находиться строго ограниченное число электронов:
Подуровни одного уровня заполняются в строго определённом порядке:
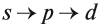
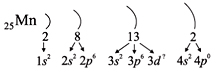
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
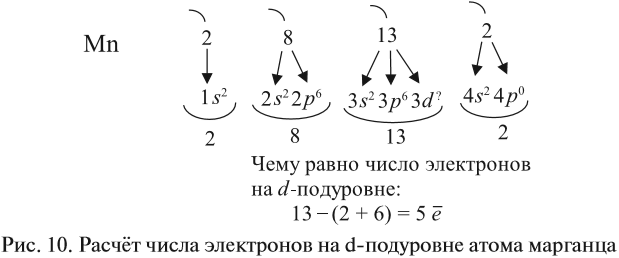
В целом электронная конфигурация атома марганца выглядит так:
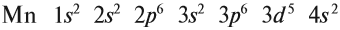
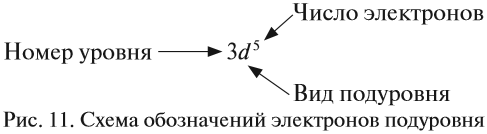
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:

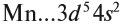

Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
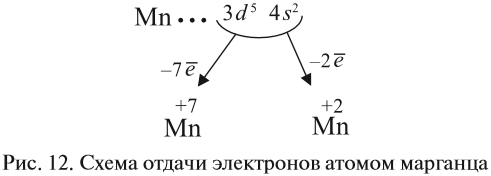
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
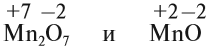
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.

Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
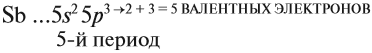
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
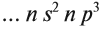
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
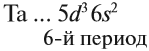
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
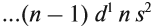
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
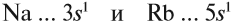
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
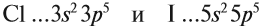
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:

На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Сравним строение атомов и свойства химических элементов одного периода:
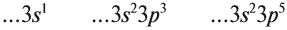
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.

Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Источник
По номеру периода в котором расположен химический элемент можно определить
Ответ или решение 2
![]()
Периодическая система химических элементов имеет семь периодов.
Номер периода показывает количество энергетических уровней.
![]()
В этом вопросе нам необходимо разобраться, что можно определить по номеру периода в котором расположен химический элемент. Это самые первые азы, которые вы должны знать, чтобы продолжить изучение такого интересного предмета как химия.
Что можно определить по номеру периода
Чтобы ответить на этот вопрос нам потребуется таблица Менделеева:
Итак, все очень просто, по номеру периода в котором расположен химический элемент можно определить количество электронных слоев. Например, магний имеет 3 электронных слоя, а фтор-2. Вот видите все очень просто.
Что такое электронный слой
Чтобы закрепить материал, ответьте на следующие вопросы
Также предоставляю вам задание из ОГЭ
Число энергетических слоёв и число электронов во внешнем энергетическом слое атома селена равны соответственно
1. 4,6
2. 3,6
3. 4,7
4. 3,7
Ответ: Число энергетических уровней равно № периода. Селен находится в 4 периоде, следовательно, у него 4 энерг. уровня. Число электронов на внеш.слое равно № группы, следовательно, у селена 6.
ответ: 1) 4.6
Источник
По номеру периода можно определить
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов

На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
В пределах периодов (слева направо) свойства элементов меняются следующим образом:

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

 Попробовать бесплатно
Попробовать бесплатно

Интересное по рубрике
Найдите необходимую статью по тегам

Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством
 Посмотреть
Посмотреть
Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Источник
По номеру периода можно определить
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.

Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (
90%), называется орбиталью.
Виды электронных орбиталей
Форма орбитали в пространстве
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
(электронное облако s – электрона)

Электронное облако такой формы может занимать в атоме одно положение
(электронное облако p – электрона)

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(электронное облако d – электрона)

(электронное облако f – электрона)

Электронное облако такой формы может занимать в атоме семь положений.
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s 2 ); на p – орбитали максимально может разместиться шесть электронов (p 6 ) на d – орбитали максимально может разместиться десять электронов (d 10 ); f – четырнадцать электронов (f 14 ).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.

Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s 1
– электронная формула, отображает число электронов по орбиталям.
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.



У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.



IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
Порядок заполнения электронами атомных орбиталей определяется :
Принципом наименьшей энергии
Шкала энергий:
1s внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.


В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).


«Проскок» или «провал» электрона


Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
в) заряду ядра атома;
3. Число нейтронов в атоме цинка равно
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
6. Электронная формула строения атома меди, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 ;
в) 1s 2 2s 2 2p 6 3s 1 3p 6 4s 2 3d 10 ;
7. Заряд ядра атома кальция равен
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
в) порядковому номеру элемента;
9. Число нейтронов в атоме железа равно
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
12. Электронная формула строения атома мышьяка, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 11 4p 3 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 4p 4 ;
в) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 4p 4 ;
Источник
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13, 18, 23/2007
Глава 3. Элементарные сведения о
строении атома.
Периодический закон Д.И.Менделеева
В с п о м н и т е, что такое атом, из чего состоит
атом, изменяется ли атом в химических
реакциях.
Атом – это электронейтральная частица,
состоящая из положительно заряженного ядра и
отрицательно заряженных электронов.
Число электронов в ходе химических процессов
может изменяться, но заряд ядра всегда остается
неизменным. Зная распределение электронов в
атоме (строение атома), можно предсказать многие
свойства данного атома, а также свойства простых
и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение
электронов вокруг ядра, несложно определить по
положению элемента в периодической системе.
В периодической системе Д.И.Менделеева
химические элементы располагаются в
определенной последовательности. Эта
последовательность тесно связана со строением
атомов этих элементов. Каждому химическому
элементу в системе присвоен порядковый номер,
кроме того, для него можно указать номер периода,
номер группы, вид подгруппы.
Спонсор публикации статьи интернет-магазин «Мегамех». В магазине Вы найдёте изделия из меха на любой вкус — куртки, жилетки и шубы из лисы, нутрии, кролика, норки, чернобурки, песца. Компания также предлагает Вам приобрести элитные меховые изделия и воспользоваться услугами индивидуального пошива. Меховые изделия оптом и в розницу — от бюджетной категории до класса люкс, скидки до 50%, гарантия 1 год, доставка по Украине, России, СНГ и странам Евросоюза, самовывоз из шоу-рума в г.Кривой Рог, товары от ведущих производителей Украины, России, Турции и Китая. Посмотреть каталог товаров, цены, контакты и получить консультацию Вы сможете на сайте, который располагается по адресу: «megameh.com».
Зная точный «адрес» химического элемента –
группу, подгруппу и номер периода, можно
однозначно определить строение его атома.
Период – это горизонтальный ряд химических
элементов. В современной периодической
системе семь периодов. Первые три периода – малые,
т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na … Аr – 8 элементов.
Остальные периоды – большие. Каждый из них
содержит 2–3 ряда элементов:
4-й период (2 ряда) – K … Kr – 18 элементов;
6-й период (3 ряда) – Сs … Rn – 32 элемента. В этот
период входит ряд лантаноидов.
Группа – вертикальный ряд химических
элементов. Всего групп восемь. Каждая группа
состоит из двух подгрупп: главной подгруппы и
побочной подгруппы. Например:
Главную подгруппу образуют химические
элементы малых периодов (например, N, P) и больших
периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические
элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко.
Главная подгруппа «высокая», она начинается с
1-го или 2-го периода. Побочная подгруппа –
«низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической
системы имеет свой адрес: период, группу,
подгруппу, порядковый номер.
Например, ванадий V – это химический элемент
4-го периода, V группы, побочной подгруппы,
порядковый номер 23.
Задание 3.1. Укажите период, группу и
подгруппу для химических элементов с
порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и
название химического элемента, если известно,
что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о
положении элемента в периодической системе со
строением его атома?
Атом состоит из ядра (оно имеет положительный
заряд) и электронов (они имеют отрицательный
заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен
порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре
сосредоточена почти вся масса атома. Поскольку
химический элемент – совокупность атомов с
одинаковым зарядом ядра, то около символа
элемента указывают следующие его координаты:
По этим данным можно определить состав ядра.
Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1.
Нейтрон n заряда не имеет (нейтрален), а масса
его приблизительно равна массе протона (1,0087 а. е.
м.).
Заряд ядра определяют протоны. Причем число
протонов равно (по величине) заряду ядра
атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности
между величинами: «масса ядра» А и
«порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
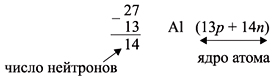
Задание 3.3. Определите состав ядер атомов,
если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Внимание! При определении массового числа ядра
атома приходится округлять атомную массу,
указанную в периодической системе. Так поступают
потому, что массы протона и нейтрона практически
целочисленны, а массой электронов можно
пренебречь.
Определим, какие из приведенных ниже ядер
принадлежат одному и тому же химическому
элементу:
А (20р + 20n),
Б (19р + 20n),
В (20р + 19n).
Атомам одного химического элемента
принадлежат ядра А и В, поскольку они
содержат одинаковое число протонов, т. е. заряды
этих ядер одинаковые. Исследования показывают,
что масса атома не оказывает существенного
влияния на его химические свойства.
Изотопами называют атомы одного и того же
химического элемента (одинаковое число
протонов), различающиеся массой (разное число
нейтронов).
Изотопы и их химические соединения отличаются
друг от друга по физическим свойствам, но
химические свойства у изотопов одного
химического элемента одинаковы. Так, изотопы
углерода-14 (14С) имеют такие же химические
свойства, как и углерода-12 (12С), которые
входят в ткани любого живого организма. Отличие
проявляется только в радиоактивности (изотоп 14С).
Поэтому изотопы применяют для диагностики и
лечения различных заболеваний, для научных
исследований.
Вернемся к описанию строения атома.
Как известно, ядро атома в химических
процессах не изменяется. А что изменяется?
Переменным оказывается общее число электронов в
атоме и распределение электронов. Общее число
электронов в нейтральном атоме определить
несложно – оно равно порядковому номеру, т.е.
заряду ядра атома:
![]()
Электроны имеют отрицательный заряд –1, а масса
их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны
отталкиваются друг от друга и находятся на
разных расстояниях от ядра. При этом электроны,
имеющие приблизительно равный запас энергии,
находятся на приблизительно равном расстоянии
от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно
номеру периода, в котором находится химический
элемент. Энергетические уровни условно
обозначают так (например, для Al):

Задание 3.4. Определите число энергетических
уровней в атомах кислорода, магния, кальция,
свинца.
На каждом энергетическом уровне может
находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати
электронов.
Эти числа показывают, что, например, на втором
энергетическом уровне может находиться 2, 5 или 7
электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера
энергетического уровня на внешнем уровне
(последнем) не может быть больше восьми
электронов. Внешний восьмиэлектронный
энергетический уровень является наиболее
устойчивым и называется завершенным. Такие
энергетические уровни имеются у самых
неактивных элементов – благородных газов.
Как определить число электронов на внешнем
уровне остальных атомов? Для этого существует
простое правило: число внешних электронов
равно:
• для элементов главных подгрупп – номеру
группы;• для элементов побочных подгрупп оно не может
быть больше двух.
Например (рис. 5):
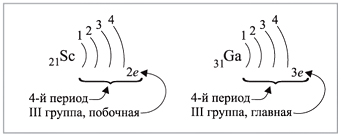 |
Рис. 5. |
Задание 3.5. Укажите число внешних
электронов для химических элементов с
порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе
химические элементы, в атомах которых имеется
завершенный внешний уровень.
Очень важно правильно определять число внешних
электронов, т.к. именно с ними связаны важнейшие
свойства атома. Так, в химических реакциях атомы
стремятся приобрести устойчивый, завершенный
внешний уровень (8е). Поэтому атомы, на внешнем
уровне которых мало электронов, предпочитают их
отдать.
Химические элементы, атомы которых способны
только отдавать электроны, называют металлами.
Очевидно, что на внешнем уровне атома металла
должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома
много электронов, то такие атомы стремятся
принять электроны до завершения внешнего
энергетического уровня, т. е. до восьми
электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам
относятся химические элементы побочных
подгрупп? Почему?
О т в е т. Металлы и неметаллы главных
подгрупп в таблице Менделеева отделяет линия,
которую можно провести от бора к астату. Выше
этой линии (и на линии) располагаются неметаллы,
ниже – металлы. Все элементы побочных подгрупп
оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или
неметаллам относятся: фосфор, ванадий, кобальт,
селен, висмут. Используйте положение элемента в
периодической системе химических элементов и
число электронов на внешнем уровне.
Для того, чтобы составить распределение
электронов по остальным уровням и подуровням,
следует воспользоваться следующим а л г о р и т м
о м.
1. Определить общее число электронов в атоме (по
порядковому номеру).
2. Определить число энергетических уровней (по
номеру периода).
3. Определить число внешних электронов (по виду
подгруппы и номеру группы).
4. Указать число электронов на всех уровнях,
кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем
уровне.
Например, согласно пунктам 1–4 для атома
марганца определено:
Всего 25е; распределили (2 + 8 + 2) = 12e;
значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме
марганца:

Задание 3.8. Отработайте алгоритм, составив
схемы строения атомов для элементов № 16, 26, 33, 37.
Укажите, металлы это или неметаллы. Ответ
поясните.
Составляя приведенные выше схемы строения
атома, мы не учитывали, что электроны в атоме
занимают не только уровни, но и определенные подуровни
каждого уровня. Виды подуровней обозначаются
латинскими буквами: s, p, d.
Число возможных подуровней равно номеру
уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух
подуровней – s и р. Третий уровень – из
трех подуровней – s, p и d.
На каждом подуровне может находиться строго
ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго
определенном порядке: s ![]() p
p ![]() d.
d.
Таким образом, р-подуровнь не может начать
заполняться, если не заполнен s-подуровень
данного энергетического уровня, и т.д. Исходя из
этого правила, несложно составить электронную
конфигурацию атома марганца:
В целом электронная конфигурация атома марганца
записывается так:
25Мn 1s22s22p63s23p63d54s2.
Здесь и далее приняты следующие обозначения:
![]()
Задание 3.9. Составьте электронные
конфигурации атомов для химических элементов №
16, 26, 33, 37.
Для чего необходимо составлять электронные
конфигурации атомов? Для того, чтобы
определять свойства этих химических элементов.
Следует помнить, что в химических процессах
участвуют только валентные электроны.
Валентные электроны находятся на внешнем
энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для
марганца:
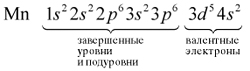
или сокращенно: Мn … 3d54s2.
Что можно определить по формуле электронной
конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом)
уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают
электроны.
3. Какие электроны и сколько будет отдавать атом
марганца?
В реакциях атом марганца отдает два внешних
электрона (они дальше всех от ядра и слабее
притягиваются им), а также пять предвнешних d-электронов.
Общее число валентных электронов – семь (2 + 5).
В этом случае на третьем уровне атома
останется восемь электронов, т.е. образуется
завершенный внешний уровень.
Все эти рассуждения и заключения можно
отразить при помощи схемы (рис. 6):
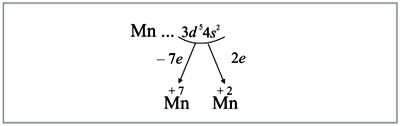 |
Рис. 6. |
Полученные условные заряды атома
называют степенями окисления.
Рассматривая строение атома, аналогичным
способом можно показать, что типичными степенями
окисления для кислорода является –2, а для
водорода +1.
В о п р о с. С каким из химических
элементов может образовывать соединения
марганец, если учесть полученные выше степени
его окисления?
О т в е т. Только с кислородом, т.к. его атом
имеет противоположную по заряду степень
окисления. Формулы соответствующих оксидов
марганца (здесь степени окисления соответствуют
валентностям этих химических элементов):
![]()
Строение атома марганца подсказывает, что
большей степени окисления у марганца быть не
может, т.к. в этом случае пришлось бы
затрагивать устойчивый, теперь уже завершенный
предвнешний уровень. Поэтому степень окисления +7
является высшей, а соответствующий оксид Мn2О7
– высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим
строение атома теллура и некоторые его свойства:
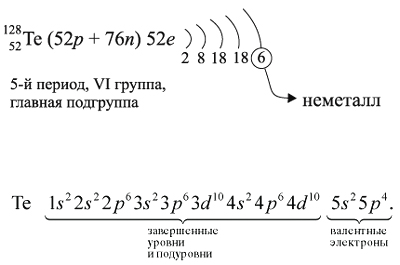
Как неметалл, атом Te может принять 2 электрона
до завершения внешнего уровня и отдать «лишние» 6
электронов:
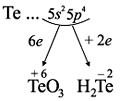
Задание 3.10. Изобразите электронные
конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите
свойства этих химических элементов, формулы их
простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только
валентные электроны, которые могут находиться
только на двух последних уровнях.
2. Атомы металлов могут только отдавать
валентные электроны (все или несколько), принимая
положительные степени окисления.
3. Атомы неметаллов могут принимать электроны
(недостающие – до восьми), приобретая при этом
отрицательные степени окисления, и отдавать
валентные электроны (все или несколько), при этом
они приобретают положительные степени
окисления.
Сравним теперь свойства химических элементов
одной подгруппы, например натрия и рубидия:
Nа …3s1 и Rb …5s1.
Что общего в строении атомов этих элементов?
На внешнем уровне каждого атома по одному
электрону – это активные металлы. Металлическая
активность связана со способностью отдавать
электроны: чем легче атом отдает электроны, тем
сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их
к ядру. Чем ближе электроны к ядру, тем сильнее
они притягиваются ядром атома, тем труднее их
«оторвать».
Исходя из этого, ответим на вопрос: какой
элемент – Nа или Rb – легче отдает внешний
электрон? Какой из элементов является более
активным металлом? Очевидно, рубидий, т.к. его
валентные электроны находятся дальше от ядра (и
слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз
металлические свойства усиливаются, т.к.
возрастает радиус атома, и валентные электроны
слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa
группы: Cl …3s23p5 и I …5s25p5.
Оба химических элемента – неметаллы, т.к. до
завершения внешнего уровня не хватает одного
электрона. Эти атомы будут активно притягивать
недостающий электрон. При этом чем сильнее
притягивает атом неметалла недостающий
электрон, тем сильнее проявляются его
неметаллические свойства (способность принимать
электроны).
За счет чего происходит притяжение электрона?
За счет положительного заряда ядра атома.
Кроме того, чем ближе электрон к ядру, тем сильнее
их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее
выражены неметаллические свойства: у хлора или
йода?
О т в е т. Очевидно, у хлора, т.к. его валентные
электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах
сверху вниз убывает, т.к. возрастает радиус
атома и ядру все труднее притянуть недостающие
электроны.
Сравним свойства кремния и олова: Si …3s23p2
и Sn …5s25p2.
На внешнем уровне обоих атомов по четыре
электрона. Тем не менее эти элементы в
периодической системе находятся по разные
стороны от линии, соединяющей бор и астат.
Поэтому у кремния, символ которого находится
выше линии В–At, сильнее проявляются
неметаллические свойства. Напротив, у олова,
символ которого находится ниже линии В–At,
сильнее проявляются металлические свойства. Это
объясняется тем, что в атоме олова четыре
валентных электрона удалены от ядра. Поэтому
присоединение недостающих четырех электронов
затруднено. В то же время отдача электронов
с пятого энергетического уровня происходит
достаточно легко. Для кремния возможны оба
процесса, причем первый (прием электронов)
преобладает.
Выводы по главе 3. Чем меньше внешних
электронов в атоме и чем дальше они от ядра, тем
сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем
ближе они к ядру, тем сильнее проявляются
неметаллические свойства.
Основываясь на выводах, сформулированных в
этой главе, для любого химического элемента
периодической системы можно составить
«характеристику».
Алгоритм описания свойств
химического элемента по его положению
в периодической системе
1. Составить схему строения атома, т.е.
определить состав ядра и распределение
электронов по энергетическим уровням и
подуровням:
• определить общее число протонов, электронов
и нейтронов в атоме (по порядковому номеру и
относительной атомной массе);• определить число энергетических уровней (по
номеру периода);• определить число внешних электронов (по виду
подгруппы и номеру группы);• указать число электронов на всех
энергетических уровнях, кроме предпоследнего;• рассчитать число электронов на
предпоследнем уровне.
2. Определить число валентных электронов.
3. Определить, какие свойства – металла или
неметалла – сильнее проявляются у данного
химического элемента.
4. Определить число отдаваемых (принимаемых)
электронов.
5. Определить высшую и низшую степени окисления
химического элемента.
6. Составить для этих степеней окисления
химические формулы простейших соединений с
кислородом и водородом.
7. Определить характер оксида и составить
уравнение его реакции с водой.
8. Для указанных в пункте 6 веществ составить
уравнения характерных реакций (см. главу 2).
Задание 3.11. По приведенной выше схеме
составить описания атомов серы, селена, кальция и
стронция и свойства этих химических элементов.
Какие общие свойства проявляют их оксиды и
гидроксиды?
Если вы выполнили упражнения 3.10 и 3.11, то
легко заметить, что не только атомы элементов
одной подгруппы, но и их соединения имеют общие
свойства и похожий состав.
Периодический закон Д.И.Менделеева:
свойства химических элементов, а также свойства
простых и сложных веществ, образованных ими,
находятся в периодической зависимости от заряда
ядер их атомов.
Физический смысл периодического закона: свойства
химических элементов периодически повторяются
потому, что периодически повторяются
конфигурации валентных электронов
(распределение электронов внешнего и
предпоследнего уровней).
Так, у химических элементов одной и той же
подгруппы одинаковое распределение валентных
электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы
пять валентных электронов. При этом в атомах
химических элементов главных подгрупп – все
валентные электроны находятся на внешнем уровне:
… ns2np3, где n – номер
периода.
У атомов элементов побочных подгрупп на
внешнем уровне находятся только 1 или 2 электрона,
остальные – на d-подуровне предвнешнего
уровня: … (n – 1)d3ns2, где n
– номер периода.
Задание 3.12. Составьте краткие электронные
формулы для атомов химических элементов № 35 и 42,
а затем составьте распределение электронов в
этих атомах по алгоритму. Убедитесь, что ваше
предсказание сбылось.
Упражнения к главе 3
1. Сформулируйте определения понятий
«период», «группа», «подгруппа». Что общего у
химических элементов, которые составляют: а)
период; б) группу; в) подгруппу?
2. Что такое изотопы? Какие свойства –
физические или химические – совпадают у
изотопов? Почему?
3. Сформулируйте периодический закон
Д.И.Менделеева. Поясните его физический смысл и
проиллюстрируйте примерами.
4. В чем проявляются металлические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
5. В чем проявляются неметаллические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
6. Составьте краткие электронные формулы
химических элементов № 43, 51, 38. Подтвердите свои
предположения описанием строения атомов этих
элементов по приведенному выше алгоритму.
Укажите свойства этих элементов.
7. По кратким электронным формулам
а) …4s24p1;
б) …4d15s2;
в) …3d54s1
определите положение соответствующих
химических элементов в периодической системе
Д.И.Менделеева. Назовите эти химические элементы.
Свои предположения подтвердите описанием
строения атомов этих химических элементов по
алгоритму. Укажите свойства этих химических
элементов.
Продолжение следует








