1) Атом является
сложной системой, в состав которой
входят определенные частицы. Английский
физик Э. Резерфорд предложил ядерную
(планетарную) модель строения атома.
Основные положения ядерной модели
атома.
1. Атом имеет форму шара, в
центре которого находится ядро.
2.
Ядро имеет очень маленький размер
(диаметр атома 10-10
м, диаметр ядра ~10-15
м).
3. Ядро имеет положительный заряд.
4. Почти вся масса атома находится в
ядре.
5. Вокруг ядра движутся электроны.
6. Электроны движутся вокруг ядра,
как планеты вокруг Солнца.
Все
положения модели Резерфорда, кроме
последнего — шестого, современная наука
считает правильными. Г. Мозли (Англия)
установил, что положительный заряд ядра
атома (в условных единицах) равен
порядковому номеру элемента в периодической
системе. Положительный заряд ядра атома
(в условных единицах) равен порядковому
номеру элемента в периодической системе
Менделеева. Каждый протон имеет заряд
+1, поэтому заряд ядра равен числу
протонов. Атом — это электронейтральная
частица, поэтому положительный заряд
ядра численно равен сумме отрицательных
зарядов всех электронов, или числу
электронов (т. к. заряд электрона равен
—1) Следовательно: Порядковый номер
элемента = Заряд ядра атома = Число
протонов в ядре = Число электронов в
атоме. Например, элемент железо Fe имеет
порядковый номер 26. Следовательно, заряд
ядра атома железа равен +26, т. е. ядро
содержит 26 протонов, а вокруг ядра
движутся 26 электронов.
Ква́нтовая
меха́ника — раздел теоретической
физики, описывающий квантовые
системы и законы их движения.
Классическая
механика, хорошо описывающая
системы макроскопических масштабов,
не способна описать явления на уровне
атомов, молекул, электронов
и фотонов.
Квантовая механика адекватно описывает
основные свойства и поведение атомов,
ионов, молекул, конденсированных
сред, и других систем с
электронно-ядерным строением. Квантовая
механика также способна описывать
поведение электронов, фотонов, а также
других элементарных
частиц, если пренебречь
взаимопревращением элементарных частиц.
Описание превращений элементарных
частиц строится в рамках квантовой
теории поля. Эксперименты
подтверждают результаты, полученные с
помощью квантовой механики.
Основными
понятиями квантовой кинематики являются
понятия наблюдаемой
и состояния.
Двойств природа электрона
Подтвержденная экспериментально в
1927 г. двойственная природа электрона,
обладающего свойствами не только
частицы, но и волны, побудила ученых к
созданию новой теории строения атома,
учитывающей оба этих свойства. Современная
теория строения атома опирается на
квантовую механику.
Двойственность свойств электрона
проявляется в том, что он, с одной стороны,
обладает свойствами частицы (имеет
определенную массу покоя), а с другой —
его движение напоминает волну и может
быть описано определенной амплитудой,
длиной волны, частотой колебаний и др.
Поэтому нельзя говорить о какой-либо
определенной траектории движения
электрона — можно лишь судить о той или
иной степени вероятности его нахождения
в данной точке пространства.
Следовательно, под электронной орбитой
следует понимать не определенную линию
перемещения электрона, а некоторую
часть пространства вокруг ядра, в
пределах которого вероятность пребывания
электрона наибольшая. Иными словами
электронная орбита не характеризует
последовательность перемещения электрона
от точки к точке, а определяется
вероятностью нахождения электрона на
определенном расстоянии от ядра.
Волновая функция
в квантовой механике, величина, полностью
описывающая состояние микрообъекта
(например, электрона, протона, атома,
молекулы) и вообще любой квантовой
системы (например, кристалла).
Описание состояния микрообъекта с
помощью В. ф. имеет статистический, т.
е. вероятностный характер: квадрат
абсолютного значения (модуля) В. ф.
указывает значение вероятностей тех
величин, от которых зависит В. ф.
![]()
2) Электро́нная пло́тность —
плотность
вероятности обнаружения
электрона
в данной точке пространства.
Главное квантовое
число n
характеризует энергию электронной
орбитали. Чем больше n, тем выше энергия
орбитали. Переходы электронов с одной
орбитали на другую сопровождается
излучением или поглощением квантов
энергии.
Главное
квантовое число
характеризует также удаленность
максимума электронной плотности от
ядра. Чем больше n, тем больше объем
орбитали.
Орбитальное
(побочное, азимутальное) квантовое число
l принимает
значения от 0 до (n-1) и характеризует
форму граничной поверхности атомной
орбитали.
Орбитальное
квантовое число
характеризует также энергию электронов
подуровня в пределах данного энергетического
уровня.
Энергия
подуровней возрастает в ряду s, p, d, f
Магнитное
квантовое число ml
характеризует ориентацию орбитали в
пространстве и может принимать
целочисленные значения от +l до –l,
включая 0. d-подуровень содержит пять
орбиталей, s-подуровень – одну (рис.4.1,a),
p-подуровень – три (рис.4.1,b-d), а f-подуровень
– семь орбиталей.
Атомной
орбиталью называют также волновую
функцию, характеризуемую определенным
набором трех квантовых чисел
Спиновое
квантовое число ms
характеризует собственное вращение
электрона вокруг своей оси и может
принимать два значения — +1/2 и -1/2.
Состояние
электрона в атоме полностью характеризуется
с помощью четырех квантовых чисел n, l,
ml,s.
3)
Точное решение уравнения Шредингера
удается найти лишь в редких случаях,
например, для атома водорода и
гипотетических одноэлектронных ионов,
таких как He+,
Li2+,
Be3+.
Атом следующего за водородом элемента
— гелия — состоит из ядра и двух электронов,
каждый из которых притягивается к обоим
ядрам и отталкивается от другого
электрона. Уже в этом случае волновое
уравнение не имеет точного решения.
Поэтому большое
значение имеют различные приближенные
методы. С помощью таких методов удалось
установить электронное строение атомов
всех известных элементов. Эти расчеты
показывают, что орбитали в многоэлектронных
атомах не сильно отличаются от орбиталей
атома водорода (эти орбитали называют
водородоподобными). Главное отличие —
некоторая сжатость орбиталей из-за
большего заряда ядра. Кроме того, для
многоэлектронных атомов найдено, что
для каждого энергетического
уровня (при
данном значении главного квантового
числа n)
происходит расщепление на подуровни.
Энергия электрона зависит уже не только
от n,
но и от орбитального квантового числа
l.
Она увеличивается в ряду s-,
p-,
d-,
f-орбиталей
Для высоких
энергетических уровней различия в
энергиях подуровней достаточно велики,
так что один уровень может проникать в
другой, например
6s
< 5d![]()
4f
< 6p.
Заселение атомных
орбиталей для многоэлектронного атома
в основном (то есть энергетически
наиболее выгодном) состоянии происходит
в соответствии с определенными правилами.
Энергетические уровни и подуровни
Совокупность
состояний электрона в атоме с одним и
тем же значением n
называют энергетическим
уровнем.
Число уровней, на которых находятся
электроны в основном состоянии атома,
совпадает с номером периода, в котором
располагается элемент. Номера этих
уровней обозначают цифрами: 1, 2, 3,… (реже
— буквами K,
L,
M,
…).
Энергетический
подуровень
— совокупность энергетических состояний
электрона в атоме, характеризующихся
одними и теми же значениями квантовых
чисел n
и l.
Подуровни обозначают буквами: s,
p,
d,
f…
Первый энергетический уровень имеет
один подуровень, второй — два подуровня,
третий — три подуровня и так далее.
Если на схеме
орбитали обозначить в виде ячеек
(квадратных рамок), а электроны — в виде
стрелок (↑ или ↓), то можно увидеть, что
главное квантовые число характеризуют
энергетический уровень (ЭУ), совокупность
главного и орбитального квантовых чисел
— энергетический подуровень (ЭПУ),
совокупность главного, орбитального и
магнитного квантовых чисел — атомную
орбиталь, а
все четыре квантовые числа — электрон.
Каждой
орбитали отвечает определенная энергия.
Обозначение орбитали включает номер
энергетического уровня и букву, отвечающую
соответствующему подуровню: 1s,
3p,
4d
и т.п. Для каждого энергетического
уровня, начиная со второго, возможно
существование трех равных по энергии
p-орбиталей,
расположенных в трех взаимно
перпендикулярных направлениях. На
каждом энергетическом уровне, начиная
с третьего, имеется пять d-орбиталей,
имеющих более сложную четырехлепестковую
форму. Начиная с четвертого энергетического
уровня, появляются еще более сложные
по форме f-орбитали;
на каждом уровне их семь. Атомную орбиталь
с распределенным по ней зарядом электрона
нередко называют электронным облаком.
Последовательность
заполнения электронами орбиталей
осуществляется в соответствии с принципом
минимальной энергии, согласно которому
электроны заполняют орбитали в порядке
повышения уровня энергии орбиталей.
Очередность орбиталей по энергии
определяется правилом Клечковского:
увеличение энергии и соответственно
заполнение орбиталей происходит в
порядке возрастания суммы (n+l),
а при равной сумме (n+l)
– в порядке возрастания n.
Правило
Клечковского — эмпирическое правило,
описывающее энергетическое распределение
орбиталей в многоэлектронных атомах.
Заполнение электронами орбиталей в
атоме происходит в порядке возрастания
суммы главного и орбитального квантовых
чисел.
При
одинаковой сумме раньше заполняется
орбиталь с меньшим значением
![]()
.
Правило
Клечковского (также Правило n+l;
также используется название правило
Маделунга) — эмпирическое правило,
описывающее энергетическое распределение
орбиталей
в многоэлектронных атомах.
Правило Хунда
(Гунда) определяет порядок заполнения
орбиталей
определённого подслоя и формулируется
следующим образом: суммарное значение
спинового
квантового
числа электронов
данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей
подслоя заполняется сначала один
электрон, а только после исчерпания
незаполненных орбиталей на эту орбиталь
добавляется второй электрон. При этом
на одной орбитали находятся два электрона
с полуцелыми спинами
противоположного знака, которые
спариваются (образуют двухэлектронное
облако) и, в результате, суммарный спин
орбитали становится равным нулю.
4)
Принцип Паули. Изучая многочисленные,
спектры атомов швейцарский физик В.
Паули в 1925 году пришел к выводу, который
получил название принципа или запрета
Паули: „Двум электронам атома запрещено
быть во всех отношениях похожими друг
на друга» или, что то же самое, „в
атоме не может быть даже двух электронов
с одинаковыми значениями всех четырех
квантовых чисел». Энергетические
состояния электронов, характеризуемые
одинаковыми значениями трех квантовых
чисел: n, I и m1 принято обозначать
энергетической ячейкой
![]()
.
Согласно принципу Паули, в энергетической
ячейке может быть только два электрона,
причем с противоположными спинами
![]()
Нахождение
в одной энергетической ячейке третьего
электрона означало бы, что у двух из них
все четыре квантовых числа одинаковы.
Число, возможных состояний электронов
(рис. .4) на данной подуровне равно числу
значений магнитного квантового числа
для этого подуровня, т. е. 21+ 1. Максимальное
число электронов на этом подуровне,
согласно принципу Паули будет 2(21+ 1).
Таким образом, на s-подуровне возможно
2 электрона ; на p-подуровне 6 электронов
; на d-подуровне 10 электронов ; на
f-подуровне 14 электронов . Число возможных
состояний электронов на каком-либо
уровне равно квадрату главного квантового
числа
![]()
а
максимальное число электронов на этом
уровне
![]()
огласно
принципу Паули в атоме не может быть
двух электронов с одинаковыми значениями
всех четырех квантовых чисел. Принцип
Паули определяет максимальное число
электронов на одной орбитали, уровне и
подуровне. Так как АО характеризуется
тремя квантовыми числами n, l,
ml,
электроны данной орбитали могут
различаться только спиновым квантовым
числом ms.
Но ms может иметь только два значения +½
и –½. противоположно направленными
спинами ↓↑. Максимальное число электронов
на энергетическом уровне определяется
как 2n2,
а на подуровне – как 2(2l+1).
Максимальное число электронов,
размещающихся на различных уровнях и
подуровнях, приведены в табл. 1.
Таблица
1.
Максимальное
число электронов на квантовых уровнях
и подуровняхСледовательно,
на одной орбитали может находиться не
более двух электронов с
5)
Периодический закон :«свойства
химических элементов, а также формы и
свойства образуемых ими простых веществ
и соединений находятся в периодической
зависимости от величины зарядов ядер
их атомов».
Структура периодической
системы химических элементов тесно
связана со строением атомов химических
элементов. По мере роста Z периодически
повторяются сходные типы конфигурации
внешних электронных оболочек. А именно
они определяют основные особенности
химического поведения элементов. Эти
особенности по-разному проявляются для
элементов A-подгрупп (s- и р-элементы),
для элементов b-подгрупп (переходные
d-элементы) и элементов f-семейств —
лантаноидов и актиноидов. Особый случай
представляют элементы первого периода
— водород и гелий. Для водорода характерна
высокая химическая активность, потому
что его единственный b-электрон легко
отщепляется. В то же время конфигурация
гелия (1st) весьма устойчива, что
обусловливает его полную химическую
бездеятельность.
У элементов А-подгрупп происходит
заполнение внешних электронных оболочек
(с n, равным номеру периода); поэтому
свойства этих элементов заметно
изменяются по мере роста Z. Так, во втором
периоде литий (конфигурация 2s) — активный
металл, легко теряющий единственный
валентный электрон; бериллий (2s~) — также
металл, но менее активный вследствие
того, что его внешние электроны более
прочно связаны с ядром. Далее, бор (2з’р)
имеет слабо выраженный металлический
характер, а все последующие элементы
второго периода, у которых происходит
построение 2р-подоболочки, являются уже
неметаллами. Восьмиэлектронная
конфигурация внешней электронной
оболочки неона (2s~р~) — инертного газа
— очень прочна.
связь
структура
электронной оболочки атомов элемента
изменяется периодически с ростом
порядкового номера элемента. С другой
стороны, свойства определяются строением
электронной оболочки и, следовательно,
находятся в периодической зависимости
от заряда ядра атома. Далее рассматриваются
некоторые периодические свойства
элементов.
| Энергетический | Энергетический | Возможные | Число | Максимальное | ||
| в | в | на | на | |||
| K | s | 0 | 1 | 1 | 2 | 2 |
| L | s p | 0 –1, | 1 3 | 4 | 2 6 | 8 |
| M | s p d | 0 –1, –2, | 1 3 5 | 9 | 2 6 10 | 18 |
| N | s p d f | 0 –1, –2, –3, | 1 3 5 7 | 16 | 2 6 10 14 | 32 |
6)
Атомные
радиусы имеют порядок 0,1 нм. Определяются
главным образом из данных рентгеновского
структурного анализа.
*
* *
АТОМНЫЕ
РАДИУСЫ
А́ТОМНЫЕ
РА́ДИУСЫ, характеристики, позволяющие
приближенно оценивать межатомные
(межъядерные) расстояния в молекулах и
кристаллах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
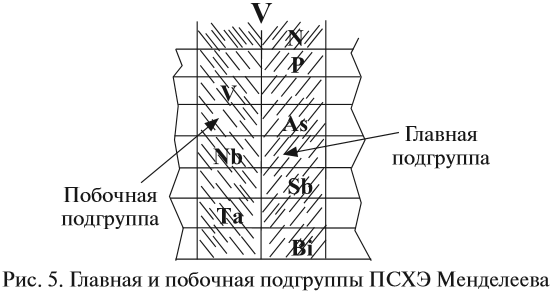
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
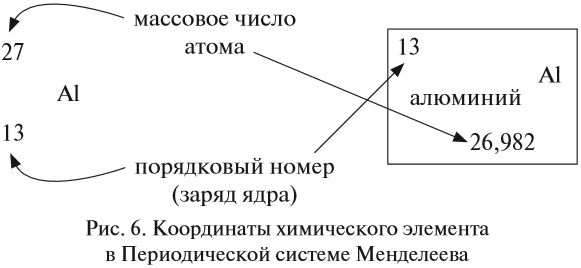
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
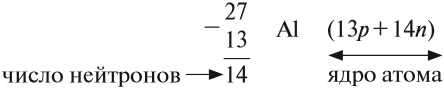
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
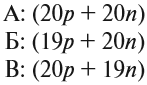
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
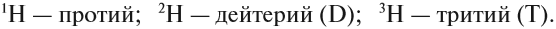
Химический элемент «кислород» также представлен тремя природными изотопами:
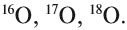
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.

Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
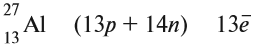
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
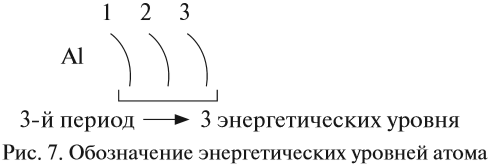
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
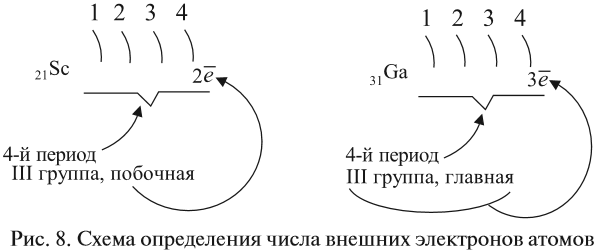
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
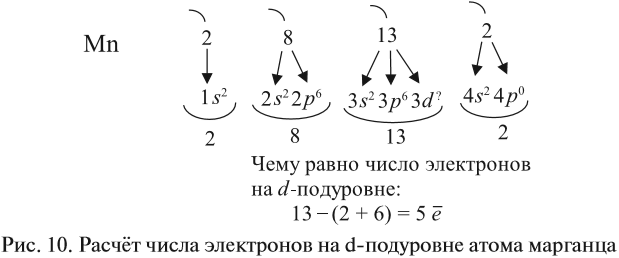
Например, согласно пунктам 1…4 для атома марганца определено:

Получили распределение электронов в атоме марганца (рис. 9):
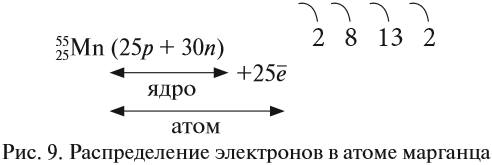
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
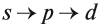
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
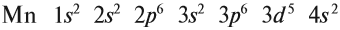
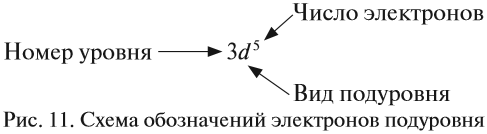
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:

или сокращённо:
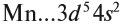

Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
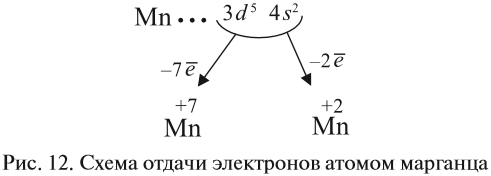
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
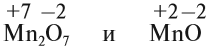
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.

Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
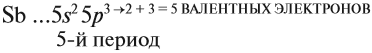
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
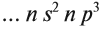
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
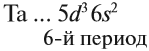
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
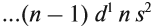
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
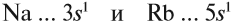
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
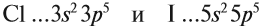
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:

На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
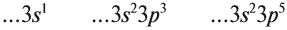
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.

Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Заряд ядра
Определение и заряд ядра
Заряд ядра (![]() ) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре.
) определяет местоположение химического элемента в таблице Д.И. Менделеева. Число Z – это количество протонов в ядре. ![]() Кл — заряд протона, который равен по величине заряду электрона.
Кл — заряд протона, который равен по величине заряду электрона.
Еще раз подчеркнем, что заряд ядра определяет количество положительных элементарных зарядов, носителями которых являются протоны. А так как атом является в целом нейтральной системой, то заряд ядра определяет и количество электронов в атоме. А мы помним, что электрон имеет отрицательный элементарный заряд. Электроны в атоме распределяются по энергетическим оболочкам и подоболочкам в зависимости от их количества, следовательно, заряд ядра оказывает существенное влияние на распределение электронов по их состояниям. От количества электронов на последнем энергоуровне зависят химические свойства атома. Получается, заряд ядра определяет химические свойства вещества.
В настоящее время принято обозначать различные химические элементы следующим образом: ![]() , где X – символ химического элемента в периодической таблице, который соответствует заряду
, где X – символ химического элемента в периодической таблице, который соответствует заряду ![]() .
.
Элементы, у которых равны Z, но разные атомные массы (A) (это означает, что в ядре одинаковое число протонов, но разное количество нейтронов) называют изотопами. Так, водород имеет два изотопа: 11H-водород; 21H-дейтерий; 31H-тритий
Существуют устойчивые и неустойчивые изотопы.
Ядра, обладающие одинаковыми массами, но разными зарядами называются изобарами. Изобары в основном, встречаются среди тяжелых ядер, причем парами или триадами. Например, ![]() и
и ![]() .
.
Первым косвенное измерение заряда ядра сделал Мозли в 1913 г. Он установил связь между частотой характеристического рентгеновского излучения (![]() ) и зарядом ядра (Z):
) и зарядом ядра (Z):
![]()
где C и B постоянные не зависящие от элемента для рассматриваемой серии излучения.
Напрямую заряд ядра был определен Чедвиком в 1920 г. при исследовании рассеяния ядер атома гелия на металлических пленках.
Состав ядра
Ядро атома водорода ![]() ) называется протоном. Масса протона равна:
) называется протоном. Масса протона равна:
![]()
Ядро состоит из протонов и нейтронов (вместе их называют нуклонами). Нейтрон был открыт в 1932 г. Масса нейтрона очень близка к массе протона. Нейтрон электрического заряда не имеет.
Сумму количества протонов (Z) и числа нейтронов (N) в ядре называют массовым числом A:
![]()
Поскольку массы нейтрона и протона очень близкие, каждая из них равна почти атомной единице массы. Масса электронов в атоме много меньше, массы ядра, поэтому считают, что массовое число ядра приблизительно равно относительной атомной массе элемента, если округлить его до целого.
