Дано 8 веществ: Воздух Карбонат кальция Метан Углекислый газ Столовый уксус Сода Перманганат калия Иод.Запишите порядковые номера тех веществ, которые являются твердыми при обычных условиях. Ответ оформите в виде последовательности цифр в порядке возрастания (например, 123). Запишите порядковые номера смесей. Ответ оформите в виде последовательности цифр в порядке возрастания (например, 123). Запишите порядковые номера окрашенных веществ. Ответ оформите в виде последовательности цифр в порядке возрастания (например, 123). Запишите порядковые номера тех веществ, которые являются солями. Ответ оформите в виде последовательности цифр в порядке возрастания (например, 123).
Ответом к заданиям 1–25 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22–25 могут повторяться.
Задание №1
Из указанных в ряду химических элементов выберите два элемента, наиболее распространенные изотопы которых содержат одинаковое число нейтронов:
1) Cu 2) V 3) Mg 4) Li 5) Cr
Запишите в поле ответа номера выбранных элементов.
Задание №2
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева принадлежат к главной подгруппе одной группы.
Расположите выбранные элементы в порядке уменьшения атомного радиуса.
1) Rb 2) Ag 3) Li 4) Cu 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Задание №3
Из предложенного перечня химических элементов выберите два таких, низшую степень окисления которых нельзя рассчитать по формуле: № группы − 8.
1) Si 2) Mn 3) Cr 4) N 5) P
Запишите в поле ответа номера выбранных элементов.
Задание №4
Из предложенного перечня соединений выберите два с одинаковым типом химической связи.
1) фтор
2) алмаз
3) хлороводород
4) хлорид калия
5) марганец
Запишите в поле ответа номера выбранных соединений.
Задание №5
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислой соли; Б) гидроксида; В) пероксида.
| 1) K2[Zn(OH)4] | 2) Tl2O3 | 3) H2SO4 |
| 4) Na2SiO3 | 5) K2HPO3 | 6) SrO2 |
| 7) BaHPO4 | | 9) MnO2 |
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Задание №6
В одну пробирку с раствором щелочи добавили вещество X, и в результате окислительно-восстановительной реакции выделение газа не наблюдали. В другую пробирку с раствором щелочи добавили вещество Y, в результате чего газ выделился. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) железо
2) медь
3) сера
4) углерод
5) цинк
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №7
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) ZnSO4 Б) Cu(NO3)2 В) FeI2 Г) CH3COOAg | 1) HI, O2, N2 2) KOH, KI, H2S 3) Cl2, Br2, AgNO3 4) NaOH, BaCl2, Sr(NO3)2 5) NaOH, H2S, C |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №8
Установите соответствие между исходными веществами, вступающими в реакцию, и одним из продуктов, образующимся в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ |
| А) NaH2PO4 + NaOH(изб.) Б) NaH2PO4(изб.) + NaOH В) H3PO4(большой изб.) + NaOH Г) H3PO4 + NaOH(большой изб.) | 1) NaH2PO3 2) NaH2PO4 3) Na2HPO3 4) NaH2PO2 5) Na2HPO4 6) Na3PO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №9
В заданной схеме превращений
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно:
1) бромид калия
2) бром
3) бромоводород
4) бромат калия
5) бертолетова соль
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №10
Установите соответствие между тривиальным названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ТРИВИАЛЬНОЕ НАЗВАНИЕ | КЛАСС/ГРУППА |
| А) кумол Б) толуол В) изопропанол | 1) спирты 2) углеводороды 3) фенолы 4) амины |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №11
Из предложенного перечня соединений выберите два таких, молекулы которых содержат только σ-связи.
1) глицерин
2) анилин
3) бензиламин
4) пропин
5) этиленгликоль
Запишите в поле ответа номера выбранных веществ.
Задание №12
Из предложенного перечня выберите все вещества, в которые можно превратить ацетилен под действием растворов KMnO4 в различной среде.
1) С2H4
2) K2C2O4
3) CH3COOH
4) CO2
5) CH4
Запишите в поле ответа номера выбранных веществ.
Ответ:___________________
Задание №13
Из предложенного перечня соединений выберите два вещества, которые могут вступать в реакцию этерификации между собой.
1) этанол
2) анилин
3) этаналь
4) метиламин
5) аланин
Запишите в поле ответа номера выбранных веществ.
Задание №14
Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | УГЛЕРОДСОДЕРЖАЩИЙ ПРОДУКТ РЕАКЦИИ |
| А) СН≡СН Б) НС≡С-СН3 В) СН3-С≡С-СН3 Г) СН3-С≡С-СН3 | 1) ацетат калия 2) уксусная кислота и углекислый газ 3) ацетальдегид 4) ацетон 5) уксусная кислота 6) оксалат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №15
Установите соответствие между реагирующими веществами и продуктом, образующимся в результате их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) циклогексанол + HCl Б) бензиловый спирт + HCl В) циклогексанол + Na Г) бензиловый спирт + CH3OH | 1) циклогексанолят натрия 2) бензилат натрия 3) бензоат натрия 4) метилбензиловый эфир 5) хлорциклогексан 6) хлорфенилметан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №16
Представлена следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) пропен
2) ацетилен
3) пропаналь
4) пропанол-2
5) пропин
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задание №17
Из предложенного перечня реакций выберите все, которые являются обратимыми.
1) N2 + O2 = 2NO
2) 2CuS + 3O2 = 2CuO + 2SO2
3) 4NH3 + 3O2 = 2N2 + 6H2O
4) 2NH3 = N2 + 3H2
5) 2H2O2 = 2H2O + O2
6) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Запишите в поле ответа номера выбранных реакций.
Ответ:___________________
Задание №18
Из предложенного перечня воздействий выберите все такие, которые приводят к изменению скорости реакции:
2H+ + ZnS = H2S + Zn2+
1) добавление сульфида цинка
2) снижение концентрации катионов цинка в растворе
3) пропускание в раствор газообразного хлороводорода
4) понижение температуры
5) добавление воды
Запишите в поле ответа номера выбранных внешний воздействий.
Ответ:___________________
Задание №19
Установите соответствие между уравнением реакции и свойством серы в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО ВЕЩЕСТВА |
| А) 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O Б) S + Zn → ZnS В) 2S + Cl2 → S2Cl2 | 1) и окислитель, и восстановитель 2) не проявляет окислительно-восстановительных свойств 3) окислитель 4) восстановитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №20
Установите соответствие между веществом и продуктами, выделяющимися на платиновых электродах при электролизе его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТЫ НА ЭЛЕКТРОДАХ |
| А) Cs2S Б) Ba(CH3COO)2 В) RbF | 1) H2, O2 2) H2, F2 3) Rb, O2 4) H2, CO2, C2H6 5) H2, S |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
Задание №21
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) пероксид водорода
2) нитрат алюминия
3) гидроксид натрия
4) формиат калия
Запишите номера веществ в порядке возрастания значения рН их водных растворов.
Задание №22
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия при данном воздействии (к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой):
C6H6(г) + 3H2(г) ⇄ C6H12(г) + Q.
| ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) охлаждение системы Б) добавление катализатора В) уменьшение объема реакционного сосуда Г) уменьшение давления | 1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) не происходит смещения равновесия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №23
В замкнутый стальной реактор, содержащий катализатор, поместили смесь аммиака с водородом и нагрели. В результате протекания обратимой реакции
2NH3(г) ⇆ N2(г) + 3H2(г)
в системе установилось равновесие.
Используя данные, приведенные в таблице, определите исходную концентрацию аммиака (X) и равновесную концентрацию водорода (Y).
| ВЕЩЕСТВО | NH3 | N2 | H2 |
| ИСХОДНАЯ КОНЦЕНТРАЦИЯ, МОЛЬ/Л | 0,3 | ||
| РАВНОВЕСНАЯ КОНЦЕНТРАЦИЯ, МОЛЬ/Л | 0,3 | 0,2 |
Выберите из списка номера правильных ответов:
1) 0,4 моль/л
2) 0,2 моль/л
3) 0,5 моль/л
4) 0,7 моль/л
5) 0,9 моль/л
6) 1,0 моль/л
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №24
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) HI и AgNO3 Б) H2SO4 и NaHCO3(р-р) В) K2Cr2O7 и NaOH Г) NaOH(р-р) и ZnO | 1) растворение твёрдого вещества 2) изменение окраски раствора на оранжевую 3) образование белого осадка 4) выделение газа 5) образование жёлтого осадка 6) изменение окраски раствора на желтую |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №25
Установите соответствие между названием вещества и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) ацетон Б) толуол В) анилин | 1) производство волокон 2) в качестве удобрения 3) получение красителей 4) в качестве растворителя 5) водоочистка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 26–28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
Задание №26
Из раствора массой 180 г с массовой долей хлорида калия 8% выпарили 10 г и добавили 5 г этой же соли. Рассчитайте массовую долю соли (в %) в полученном растворе. (Запишите число с точностью до сотых.)
Ответ:___________________ %.
Задание №27
Обжиг сульфида алюминия происходит согласно термохимическому уравнению
2Al2S3(тв) + 9O2(г) → 2Al2O3(тв) + 6SO2(г) + 3864 кДж
Рассчитайте массу (в граммах) навески сульфида алюминия, если в результате обжига выделилось 90 кДж энергии. (Запишите число с точностью до целых.)
Ответ:___________________ г.
Задание №28
Определите объем (в литрах) водорода (н.у.), который можно получить при взаимодействии избытка цинкового порошка со 174 мл 10%-ного раствора соляной кислоты (плотность 1,05 г/мл). (Запишите число с точностью до десятых.)
Ответ:___________________ л.
Не забудьте перенести все ответы в бланк ответов № 1 в соответствии с инструкцией по выполнению работы. Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Для выполнения заданий 29, 30 используйте следующий перечень веществ:
хлорат калия, силикат калия, оксид хрома (III), карбонат натрия, диоксид кремния, азотная кислота. Допустимо использование водных растворов веществ.
Задание №29
Из предложенного перечня веществ выберите вещества, между которыми при сплавлении протекает окислительно-восстановительная реакция с образованием плава желтого цвета.
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание №30
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена с образованием бесцветного газа без запаха. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Задание №31
Через водный раствор силиката калия пропустили избыток углекислого газа. Образовавшийся осадок отделили, высушили и прокалили. Полученный в результате прокаливания твердое вещество сплавили с фосфатом кальция и углем. Образовавшееся простое вещество растворили в избытке водного раствора перманганата калия, подкисленного серной кислотой. Напишите уравнения четырёх описанных реакций.
Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Задание №33
Навеску меди массой 12,8 г внесли в 300 мл 70%-ного раствора азотной кислоты (плотность раствора 1,35 г/мл). После окончания реакции к раствору добавили 100 мл 10%-ного раствора карбоната калия (плотность раствора 1,1 г/мл). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание №34
При сгорании 27 г органического соединения образовались углекислый газ объемом 39,2 л (н.у.) и вода массой 18 г. Известно, что данное вещество не реагирует с водным раствором гидроксида натрия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции искомого соединения с избытком водного раствора дихромата калия, подкисленного серной кислотой.
Ответы к первой части варианта №3
| № задания, ответ | № задания, ответ |
| 1) 25 2) 513 3) 23 4) 12 5) 736 6) 35 7) 4232 9) 24 10) 221 11) 15 12) 24 13) 15 14) 6251 | 15) 5614 16) 54 17) 14 18) 345 19) 134 20) 541 21) 2143 22) 1312 23) 45 24) 5461 25) 443 26) 11,09 27) 7 28) 5,6 |
Ответы ко второй части варианта №3
Задание 29
KClO3 + Cr2O3 + 2Na2CO3 → 2Na2CrO4 + KCl + 2CO2
1∙ | Cl+5 + 6ē → Cl-1
1∙ | 2Cr+3 – 6ē → 2Cr+6
Хлор в степени окисления +5 (или хлорат калия) является окислителем.
Хром в степени окисления +3 (или оксид хрома (III)) – восстановителем.
Задание 30
Вариант ответа:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
2Na+ + CO32— + 2H+ + 2NO3— = 2Na+ + 2NO3— + CO2 + H2O
CO32— + 2H+ = CO2 + H2O
*Вариант ответа, в котором в качестве исходного вещества фигурирует оксид, считать неверным, поскольку оксиды не относятся к электролитам, а реакциями ионного обмена называют реакции между электролитами в водном растворе.
См. официальный документ от ФИПИ «МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для учителей, подготовленные на основе анализа типичных ошибок участников ЕГЭ 2018 года»: 
Задание 31
1) K2SiO3 + 2CO2 + 2H2O → 2KHCO3 + H2SiO3↓
2) H2SiO3 → SiO2 + H2O
3) 3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 2P + 5CO
4) 2P + 2KMnO4 + 3H2SO4 → 2H3PO4 + 2MnSO4 + K2SO4
Задание 32
1)
2)
3)
4)
5)
Задание 33
Навеску меди массой 12,8 г внесли в 300 мл 70%-ного раствора азотной кислоты (плотность раствора 1,35 г/мл). После окончания реакции к раствору добавили 100 мл 10%-ного раствора карбоната калия (плотность раствора 1,1 г/мл). Определите массовую долю кислоты в полученном растворе. Ответ округлите до десятых.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (I)
K2CO3 + 2HNO3 → 2KNO3 + CO2 + H2O (II)
Вычислим количество вещества меди и азотной кислоты, вступивших в реакцию:
mр-ра(HNO3) = 300 мл ⋅ 1,35 г/мл = 405 г;
mисх.(HNO3) = 405 г ⋅ 70%/100% = 283,5 г; nисх.(HNO3) = 283,5 г/63 г/моль = 4,5 моль;
n(Cu) = 12,8 г/64 г/моль = 0,2 моль.
Вычислим массу и количество вещества карбоната калия:
mр-ра(K2CO3) = V(р-ра) ⋅ ρ(р-ра) = 100 мл ⋅ 1,1 г/мл = 110 г;
m(K2CO3) = mр-ра(K2CO3) ⋅ w(K2CO3)/100% = 110 г ⋅ 10%/100% = 11 г;
n(K2CO3) = m/M = 11 г/138 г/моль ≈ 0,08 моль.
Азотная кислота содержится в избытке.
Исходя из уравнения реакции (I), количество вещества азотной кислоты, вступившей в реакцию (I), будет равно:
nI(HNO3) = 4n(Cu) = 4 ⋅ 0,2 моль = 0,8 моль.
Таким образом, количество азотной кислоты, оставшейся после реакции (I), будет равно:
nост.I(HNO3) = nисх.(HNO3) − nI(HNO3) = 4,5 моль − 0,8 моль = 3,7 моль.
Количество вещества азотной кислоты, вступившей в реакцию (II), будет равно:
nII(HNO3) = 2n(K2CO3) = 2 ⋅ 0,08 моль = 0,16 моль.
Таким образом, количество вещества и масса оставшейся азотной кислоты равны:
nост.II(HNO3) = 3,7 моль − 0,16 моль = 3,54 моль;
mост.(HNO3) = n ⋅ M = 63 г/моль ⋅ 3,54 моль = 223,02 г.
При взаимодействии меди и карбоната калия с азотной кислотой выделяются NO2 и CO2 соответственно. Вычислим их количества и массы.
n(NO2) = 2n(Cu) = 0,2 моль ⋅ 2 = 0,4 моль, m(NO2) = M ⋅ n = 0,4 моль ⋅ 46 г/моль = 18,4 г;
n(CO2) = 0,08 моль, m(CO2) = M ⋅ n = 0,08 моль ⋅ 44 г/моль = 3,52 г.
Вычислим массу образовавшегося раствора и массовую долю азотной кислоты:
m(р-ра) = mр-ра(HNO3) + mр-ра(K2CO3) + m(Cu) − m(NO2) − m(CO2) = 405 г + 110 г + 12,8 г − 3,52 г − 18,4 г = 505,88 г;
wконечн.(HNO3) = mост.II(HNO3)/m(р-ра) ⋅ 100% = 223,02 г/505,88 г ⋅ 100% ≈ 44,1%.
Ответ: wконечн.(HNO3) = 44,1%
Задание 34
При сгорании 27 г органического соединения образовались углекислый газ объемом 39,2 л (н.у.) и вода массой 18 г. Известно, что данное вещество не реагирует с водным раствором гидроксида натрия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции искомого соединения с избытком водного раствора дихромата калия, подкисленного серной кислотой.
Решение:
1) n(CO2) = V(CO2)/Vm = 39,2 л/22,4 л/моль = 1,75 моль; n(C) = n(CO2) = 1,75 моль; m(C) = M ⋅ n = 1,75 моль . 12 г/моль = 21 г.
n(H2O) = m(H2O)/M(H2O) = 18 г/18 г/моль = 1 моль, n(H) = 2n(H2O), n(H) = 1 моль . 2 = 2 моль, m(H) = M ⋅ n = 2 моль . 1 г/моль = 2 г.
Вычислим массу и количество вещества кислорода.
m(O) = m(в-ва) − m(C) − m(H) = 27 г − 21 г − 2 г = 4 г, n(O) = m(O)/M(O) = 4 г/16 г/моль = 0,25 моль.
Обозначим искомое органическое соединение в виде CxHyOz,
тогда x : y : z = n(C) : n(H) : n(O) = 1,75 : 2 : 0,25 = 7 : 8 : 1.
Простейшая формула искомого соединения C7H8O.
2) Поскольку исходное органическое соединение не реагирует с водным раствором гидроксида натрия, этим соединением является бензиловый спирт, структурная формула которого:
3) Тогда уравнение его взаимодействия избытком водного раствора дихромата калия, подкисленного серной кислотой, будет записываться следующим образом:


ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
1.Установите соответствие между левыми и правыми частями уравнений реакций (коэффициенты в обеих частях не приведены).C + HNO3 =
CO + NH3 =
(NH4)2CO3 =
(NH2)2CO + H2O =
CH4 + NH3 + O2 =
CO2 + NH3
CO2 + NH3 + H2O
HCN + H2O
CO2 + NO2 + H2O
2.Сколько атомов содержит молекула простейшего двухатомного спирта, устойчивого при обычных условиях?
При окислении этого спирта кислородом в присутствии катализатора можно получить в качестве единственного углеродсодержащего продукта простейшую двухосновную органическую кислоту. Сколько молекул кислорода потребуется для окисления одной молекулы спирта в соответствии с уравнением реакции?
3.Даны утверждения, каждое из которых относится к двум из четырёх ёмкостей, содержащих различные газы.Установите соответствия между этими утверждениями и ёмкостями.
В ёмкостях находится одинаковое количество молекул
В ёмкостях находится одинаковое количество атомов
В ёмкостях находится одинаковое количество атомов водорода
Первая ёмкость 0,25 моль аммиака
Вторая ёмкость 11 г диоксида углерода
Третья ёмкость 1,15 л хлороводорода при температуре 25 С и давлении 10 атмосфер
Четвёртая ёмкость 4,2 л метана при нормальных условиях

ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
4.На рисунке изображена схема реакции изомеризации, в которой молекулы представлены в виде моделей,отображающих реальные размеры атомов.
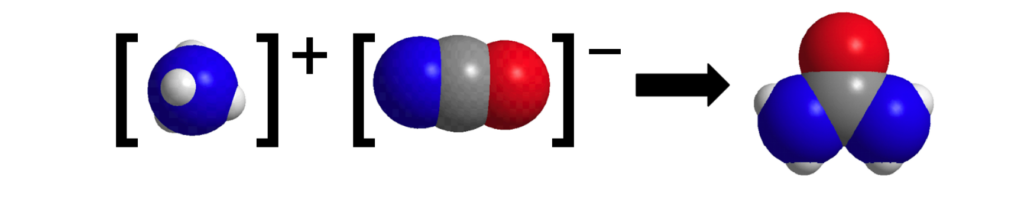
Атомам каких элементов соответствуют шары разного цвета и размера в моделях?
![]()



H
C
N
O
F
Na
Cl
P
S
5.Правило Вант‑Гоффа гласит, что при увеличении температуры на 10 С скорость реакции v возрастает в = 2-4‑ раза.
v2/v1=γ (t2−t1)/10
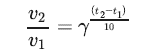
Пусть для первой реакции коэффициент γ = 4 , а константа скорости составляет 0.07 c-1 при 30 C, для второй реакции γ=2, а константа скорости равна 36C-1 при 70 C
Во сколько раз увеличится скорость первой реакции при нагревании
от 30 до 70 C?
При какой температуре константы скорости реакций сравняются? Ответ выразите в градусах Цельсия.
6.Соединения висмута‑211 находят применение в радиоиммунотерапии, так как альфа‑частицы, возникающие при радиоактивном распаде данного изотопа, способны воздействовать на патогенные клетки. Недостатком применения данного излучателя является образование в результате распада ядра элемента X соединения которого высокотоксичны. Соединение X с одним из неметаллов разлагается при слабом нагревании,при этом образуется жёлто‑зелёный газ и вещество Y , масса которого на 22.8 % меньше массы исходного
соединения.
Запишите порядковый номер элемента Х в таблице Менделеева.
Запишите формулу Y соединения

ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
7.При попадании кристалликов иода водный раствор некоторого вещества сразу стал коричневым.

Какое вещество могло быть растворено в воде?
Хлорид натрия
Этиловый спирт
Крахмал
Сульфат натрия
Гидроксид натрия
Иодид калия
8.

X бесцветный газ без вкуса и запаха, обладающий высокой токсичностью. Долгое время, вплоть до конца 20 века, для обнаружения в воздухе газа X шахтёры использовали канареек: если птицы переставали петь,то это свидетельствовало о высоких концентрациях газа X. Химически этот газ можно обнаружить с помощью реакции с I2O5, в результате которой образуется фиолетовое простое вещество и безопасный бесцветный газ.
Запишите формулу газа X
Известно, что газ X в определённых условиях вступает в реакцию с железом с образованием жидкости,кипящей при температуре
около 100 C из 1.0 г. железа при этом получается 3.5 г. жидкости. Сколько всего атомов содержит 1 молекула этой жидкости?
9.С помощью картинок зашифрован химический состав некоторого вещества. Числа показывают процентное содержание элементов по массе.
Запишите в таблицу химические символы этих элементов.

Чему равна молярная масса вещества? Ответ выразите в г/моль, округлите до целых.
10.

A бесцветный малорастворимый в воде газ без запаха. В начале века 20 он активно использовался в лампах, которые устанавливались на различные виды транспорта, как на велосипеды, так и на кареты.Такие лампы по сей день можно встретить на старых маяках. Принцип работы ламп основан на капельной подаче воды к бинарному соединению B, в результате чего образуется газ A. Газ поджигают, и он горит в кислороде воздуха ярким белым пламенем. При сжигании 1 литра A образуется 2 литра CO2. Соединение B содержит 62.5% металла по массе.
Определите молярную массу A. Ответ выразите в г/моль, округлите до целых.
Определите порядковый номер металла из соединения в Периодической системе Д.И. Менделеева

ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
11.Установите соответствие между утверждениями и формулами неорганических солей, для которых они неверны
Соль не изменяет массу при нагревании до 400 C ∘
Соль окрашивает пламя в фиолетовыйцвет
Соль образует белый осадок в растворе в присутствии солей
бария (II)
K2CO3
Na2CO3
K2SO4
KCl
K2SO3
K2HPO4
K2SiO3
12. Известны стандартные энтальпии образования ΔfH∘ (кДж/моль) ряда соединений из простых веществ:
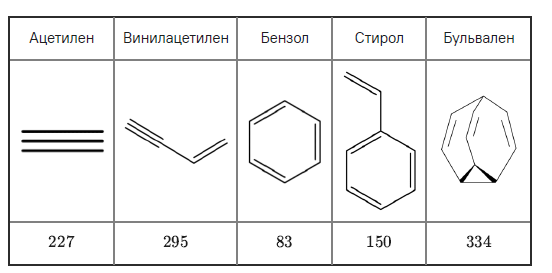
Ацетилен
227
Винилацетилен
295
Бензол
83
Стирол
150
Бульвален
334
Выберите вещество, при сгорании 1 г которого количество выделившейся теплоты будет…
наибольшим
наименьшим
Ацетилен
Винилацетилен
Бензол
Стирол
Бульвален

ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
ГДЗ к учебнику ХИМИЯ 8 КЛАСС Еремина и др. §7 Атомы. Химические элементы РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение.
Задание 1
Дайте определение понятия «химический элемент». Атомы определённого вида принято называть химическим элементом.
Задание 2
Сколько химических элементов встречается в природе, а сколько синтезировано искусственно? В природе встречается 94 химических элементов, а остальные 24 синтезированы искусственно.
Задание 3
Какими символами обозначают следующие химические элементы: железо, натрий, кальций, хром, алюминий, сера, углерод, кислород, водород, медь, калий, магний, кремний? Найдите эти элементы в Периодической системе и выпишите их порядковые номера.
Железо Fe 26
натрий Na 23
кальций Ca 20
хром Cr 24
алюминий Al 13
сера S 16
углерод C 6
кислород O 8
водород H 1
медь Cu 29
калий K 19
магний Mg 12
кремний Si 14
Задание 4
Какой химический элемент имеет порядковый номер 1? Водород.
Задание 5
Почему атомная и массовая доли водорода во Вселенной не равны друг другу? Атомную долю рассчитывают, принимая за 100% общее число всех атомов во Вселенной, а в случае массовой доли ― за 100% принимают общую массу атомов.
Задание 6
Найдите в Периодической системе:
а) три элемента, названные в честь великих учёных;
Кюрий Cm (Мари и Пьера Кюри), эйнштейний Es (Альберт Энштейн), менделевий Md (Д.И.Менделеев)
б) три элемента, названные в честь небесных тел;
б) уран U, нептуний Np, плутоний Pu
в) три элемента, названные в честь стран;
Германий Ge (Германия), франций Fr (Франция), рутений Ru (латинское название Руси).
г) три элемента, названные в честь мифологических персонажей;
Прометий Pm (в честь титана Прометея), ванадий V (в честь древнескандинавской богини красоты Ванадис), титан Ti (в честь титанов).
д) три элемента, названия которых имеют отношение к России.
Рутений Ru, дубний Db, московий Mc.
Задание 7
Используя обозначения элементов из Периодической системы, составьте слова на английском языке:
а) Moscow;
Mo-S-Co-W — молибден-сера-кобальт-вольфрам.
б) carbon;
C-Ar-B-O-N — углерод-аргон-бор-кислород-азот.
в) water;
W-At-Er — вольфрам-астат-эрбий.
г) reaction
Re-Ac-Ti-O-N — рений-актиний-титан-кислород-азот.
