Видеоурок: Изменение свойств элементов и их соединений по периодам и группам
Лекция: Закономерности изменения свойств элементов и их соединений по периодам и группам
 Закон Д.И. Менделеева
Закон Д.И. Менделеева
 Русский ученый Д. И. Менделеев успешно работал во многих областях науки. Однако наибольшую известность ему принесло уникальное открытие периодического закона химических элементов в 1869 г. Изначально, он звучал таким образом: «Свойства всех элементов, а вследствие и качества образуемых ими простых, а также сложных веществ, стоят в периодической зависимости от их атомного веса».
Русский ученый Д. И. Менделеев успешно работал во многих областях науки. Однако наибольшую известность ему принесло уникальное открытие периодического закона химических элементов в 1869 г. Изначально, он звучал таким образом: «Свойства всех элементов, а вследствие и качества образуемых ими простых, а также сложных веществ, стоят в периодической зависимости от их атомного веса».
В настоящее время формулировка закона иная. Дело в том, что во времена открытия закона ученые не имели представления о строении атома, а за атомный вес принимался вес химического элемента. Впоследствии активного изучения атома и получения новых сведений о его строении, был выведен закон, имеющий актуальность в наши дни: «Свойства атомов хим. элементов и образованных ими простых веществ в периодической зависимости от зарядов ядер их атомов».
Закон так же выражен графически. Наглядно его изображает таблица:

 Периодическая таблица Д.И. Менделеева
Периодическая таблица Д.И. Менделеева
На данном уроке мы научимся извлекать из неё важную и нужную для постижения науки информацию. В ней вы видите строки. Это периоды. Всего их семь. Вспомните из предыдущего урока, что номер каждого периода демонстрирует количество энергетических уровней, на которых размещаются электроны атома химического элемента. Например, натрий (Na) и магний (Mg) находятся в третьем периоде, значит их электроны размещены на трех энергетических уровнях. Все периоды, за исключением 1 – го берут начало со щелочного металла, и завершаются благородным газом.
Электронная конфигурация:
-
щелочного металла — ns1,
-
благородного газа — ns2p6, за исключением гелия (Не) — 1s2.
Где n — является номером периода.
Еще мы видим в таблице вертикальные столбцы – это группы. В одних таблицах вы можете увидеть 18 групп, нумерованных арабскими цифрами. Такая форма таблица называется длинной, она появилась после обнаружения отличий d-элементов от s- и p-элементов. Но традиционной, созданной Менделеевым является короткая форма, где элементы сгруппированы в 8 групп, нумерованных римскими цифрами:
 В дальнейшем мы будем пользоваться уже знакомой и привычной для вас короткой таблицей.
В дальнейшем мы будем пользоваться уже знакомой и привычной для вас короткой таблицей.
Итак, какую информацию нам дают номера групп? Из номера мы узнаем число электронов, образующих химические связи. Они называются
валентными
. 8 групп подразделены на две подгруппы: главная и побочная.
-
В главную входят электроны s- и p-подуровней. Это подгруппы IА, IIА, IIIА, IVА, VА, VIА, VIIА и VIIIА. Например, аллюминий (Al) – элемент главной подгруппы III группы имеет … 3s2 3p1 валентных электрона.
-
Элементы, располагающиеся в побочных подгруппах, содержат электроны d — подуровня. Побочными являются группы IБ, IIБ, IIIБ, IVБ, VБ, VIБ, VIIБ и VIIIБ. Например, марганец (Mn) – элемент главной подгруппы VII группы имеет …3d5 4s2 валентных электрона.
-
В короткой таблице s- элементы обозначены красным, p-элементы желтым, d-элементы синим и f-элементы белым цветами.
- Какую еще информацию мы можем извлечь из таблицы? Вы видите, что каждому элементу присвоен порядковый номер. Тоже не случайно. Судя по номеру элемента, мы можем судить о количестве электронов в атоме данного элемента. К примеру, кальций (Ca) находится под номером 20, значит электронов в его атоме 20.
Но следует помнить, что численность валентных электронов периодически меняется. Связанно это с периодическими изменениями электронных оболочек. Так, при перемещении вниз по подгруппе атомные радиусы всех химических элементов начинают расти. Потому что растет количество электронных слоев. Если же перемещаться горизонтально по одному ряду радиус атома уменьшается. Почему так происходит? А связанно это с тем, что при заполнении одной электронной оболочки атома, происходящем поочередно, ее заряд возрастает. Это приводит к увеличению взаимопритяжения электронов и их сжиманию вокруг ядра.
Еще из таблицы можно сделать и такой вывод, чем выше порядковый номер элемента, тем меньше радиус атома. Почему? Дело в том, что при увеличении общего количества электронов, происходит уменьшение радиуса атома. Чем больше электронов, тем выше энергия их связи с ядром. Например, ядро атома фосфора (Р) намного сильнее удерживает электроны своего внешнего уровня, чем ядро атома натрия (Na), имеющего один электрон на внешнем уровне. И если атомы фосфора и натрия вступят в реакцию, фосфор отберет этот электрон у натрия, потому что фосфор более электроотрицательный. Этот процесс называется электроотрицательностью. Запомните, при движении вправо по одному ряду элементов таблицы их электроотрицательность возрастает, а внутри одной подгруппы она уменьшается. О данном свойстве элементов мы подробнее скажем на следующих уроках.
Запомните:
1. В периодах с увеличением порядкового номера мы можем наблюдать:
- увеличение ядерного заряда и уменьшение атомного радиуса;
- увеличение числа внешних электронов;
- увеличение ионизации и электроотрицательности;
- возрастание неметаллических окислительных свойств и убывание металлических восстановительных свойств;
- возрастание кислотности и ослабевание основности гидроксидов и оксидов.
2. В А-группах с увеличением порядкового номера мы можем наблюдать:
- увеличение ядерного заряда и увеличение атомного радиуса;
- уменьшение ионизации и электроотрицательности;
- убывание неметаллических окислительных свойств и возрастание металлических восстановительных свойств;
- возрастание основности и ослабевание кислотности гидроксидов и оксидов.
Вспомним химическую терминологию:
Ионизация — это процесс превращения атомов в ионы (положительно заряженные катионы или отрицательно заряженные анионы) во время химической реакции.
Электроотрицательность — это способность атома к притягиванию электрона другого атома во время химических реакций.
Окисление — процесс передачи электрона атома восстановителя (донора электрона) атому окислителя (акцептору электрона) и увеличение степени окисления атома вещества.
Существуют три значения степени окисления:
- при высокой электроотрицательности элемента, он сильнее притягивает к себе электроны и его атомы приобретают отрицательную степень окисления (к примеру, фтор всегда имеет степень окисления — 1);
- при низкой электроотрицательности, элемент отдает электроны и приобретает положительную степень окисления (все металлы имеют +степень, к примеру, калий +1, кальций +2, алюминий +3);
- атомы простых веществ, состоящих из одного элемента у атомов с высокими и свободные атому имеют нулевую степень.
Степень окисления ставится над символом элемента:
Восстановление — встречный окислению процесс приема электрона атома окислителя (акцептора электрона) атомом восстановителя (донором электрона) и уменьшение степени окисления атома вещества.
Кислотность — способность вещества (органического соединения) отдавать протон другим атомам, т. е. быть донором протона.
Основность — способность вещества (органического соединения) принимать протон другого атома, т. е. быть акцептором протона.
-
-
Предмет:
Химия
-
Автор:
carterporter237
-
Создано:
3 года назад
Знаешь ответ? Добавь его сюда!
-
-
Русский язык33 секунд назад
мужики, помогите
расставьте буквы и запятые, а также пропуски
Б_ётся (на) смерть парень бравый — так как б_ются на войне.
-
Алгебра46 секунд назад
Функция задана формулой f(x)=2×2+5x-1 Найдите f(-4)
-
Русский язык52 секунд назад
Русский язык 8 класс помогите пожалуйста ??
-
Русский язык1 минута назад
Может ли быть у шубы шизофрения?
-
Русский язык1 минута назад
Может ли быть у шерсти шизофрения?
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Свойства химических элементов определяются строением их атомов. Рассмотрим закономерности изменения строения атомов, свойств химических элементов и образованных ими веществ на примере третьего периода периодической системы.
С возрастанием порядкового номера (слева направо) в периоде:
- увеличивается заряд ядра атома;
- число электронных слоёв в атомах всех элементов не изменяется (равно номеру периода);
- возрастает число электронов на внешнем энергетическом уровне;
- из-за сжатия электронных слоёв уменьшается радиус атома.

Рис. (1). Изменение радиусов атомов элементов третьего периода
Свойства химических элементов
Определим, как с увеличением заряда ядра изменяются свойства химических элементов.
В периоде уменьшаются:
- способность атомов отдавать электроны (восстановительные свойства);
- металлические свойства;
- низшие степени окисления (степени окисления в летучих водородных соединениях).
В периоде возрастают:
- электроотрицательность;
- способность принимать электроны (окислительные свойства);
- неметаллические свойства;
- высшие степени окисления (степени окисления в высших оксидах и гидроксидов).
| Элемент | Na11 | Mg12 | Al13 | Si14 | P15 | S16 | Cl17 | Ar18 |
| Внешний слой | 3s1 | 3s2 | 3s23p1 | 3s23p2 | 3s23p3 | 3s23p4 | 3s23p5 | 3s23p6 |
| Свойства простого вещества | щелочной металл | металл | металл | неметалл | неметалл | неметалл | неметалл | инертный газ |
| Высшая степень окисления | (+1) | (+2) | (+3) | (+4) | (+5) | (+6) | (+7) | — |
| Низшая степень окисления | — | — | — | (-4) | (-3) | (-2) | (-1) | — |
-
Основные свойства высших оксидов и гидроксидов ослабевают.
-
Кислотные свойства высших оксидов и гидроксидов усиливаются.
-
Водородные соединения металлов (гидриды) имеют ионное строение, это твёрдые вещества.
-
Водородные соединения неметаллов имеют молекулярное строение, это летучие вещества.
| Высший оксид | Na2O основный оксид | MgO основный оксид | Al2O3 амфотерный оксид | SiO2 кислотный оксид | P2O5 кислотный оксид | SO3 кислотный оксид | Cl2O7 кислотный оксид |
| Высший гидроксид | NaOH щёлочь | Mg(OH)2 основание | Al(OH)3 амфотерный | H2SiO3 слабая кислота | H3PO4 кислота средней силы | H2SO4 сильная | HClO4 сильная |
| Водородное соединение | NaH гидрид | MgH2 гидрид | AlH3 гидрид | SiH4 газ | PH3 газ | H2S газ | HCl газ |
Обрати внимание!
В больших периодах наблюдаются такие же закономерности изменения радиусов атомов, металлических и неметаллических свойств. Но из-за того, что у элементов побочных групп заполняется предвнешний электронный слой, изменения происходят более плавно.
Источники:
Рис. 1. Изменение радиусов атомов элементов третьего периода. © ЯКласс.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Содержание
- Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
- Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
- Тренировочные задания
- Ответы
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
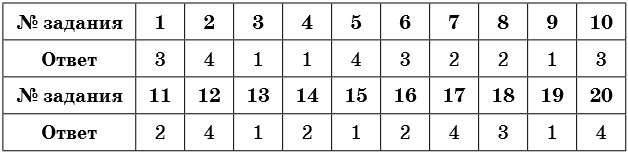
Ответы