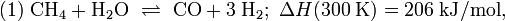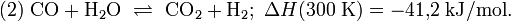| ||
| ||
 | ||
| Names | ||
|---|---|---|
| Pronunciation | ||
| Preferred IUPAC name Methanol[1] | ||
| Other names Carbinol | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| 3DMet |
| |
| Beilstein Reference | 1098229 | |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| ECHA InfoCard | 100.000.599 | |
| EC Number |
| |
| Gmelin Reference | 449 | |
| KEGG |
| |
| MeSH | Methanol | |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| UN number | 1230 | |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | CH 3OH or CH 4O | |
| Molar mass | 32.04 g mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Sweet and pungent | |
| Density | 0.792 g/cm3[2] | |
| Melting point | −97.6 °C (−143.7 °F; 175.6 K) | |
| Boiling point | 64.7 °C (148.5 °F; 337.8 K) | |
| Solubility in water | miscible | |
| log P | −0.69 | |
| Vapor pressure | 13.02 kPa (at 20 °C) | |
| Acidity (pKa) | 15.5[3] | |
| Conjugate acid | Methyloxonium[4] | |
| Conjugate base | Methanolate[5] | |
| Magnetic susceptibility (χ) | −21.40·10−6 cm3/mol | |
| Refractive index (nD) | 1.33141[6] | |
| Viscosity | 0.545 mPa·s (at 25 °C)[7] | |
| Dipole moment | 1.69 D | |
| Thermochemistry | ||
| Heat of combustion, higher value (HHV) | 725.7 kJ/mol, 173.4 kcal/mol, 5.77 kcal/g | |
| Hazards[12][13] | ||
| Occupational safety and health (OHS/OSH): | ||
| Main hazards | Methanol and its vapours are flammable. Moderately toxic for small animals – Highly toxic to large animals and humans (in high concentrations) – May be fatal/lethal or cause blindness and damage to the liver, kidneys, and heart if swallowed – Toxicity effects from repeated over exposure have an accumulative effect on the central nervous system, especially the optic nerve – Symptoms may be delayed, become severe after 12 to 18 hours, and linger for several days after exposure[9] | |
| GHS labelling: | ||
| Pictograms |    [8] [8] | |
| Signal word | Danger[8] | |
| Hazard statements | H225, H301, H302, H305, H311, H331, H370[8] | |
| Precautionary statements | P210, P233, P235, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P310, P311, P312, P337+P313, P361, P363, P370+P378, P403+P233, P405, P501[8] | |
| NFPA 704 (fire diamond) | [12][14]
1 3 0 | |
| Flash point | 11 to 12 °C (52 to 54 °F; 284 to 285 K) | |
| Autoignition | 470 °C (878 °F; 743 K)[15] 385 °C (725 °F; 658 K)[16] | |
| Explosive limits | 6–36%[10] | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) | 58 mg/kg (rat, oral) 730 mg/kg (mouse, oral) 1280 mg/kg (rat, oral) 1400 mg/kg (rabbit, oral)[11] | |
| LC50 (median concentration) | 64,000 ppm (rat, 4 h)[11] | |
| LCLo (lowest published) | 33,082 ppm (cat, 6 h) 37,594 ppm (mouse, 2 h)[11] | |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 200 ppm (260 mg/m3)[10] | |
| REL (Recommended) | TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [skin][10] | |
| IDLH (Immediate danger) | 6000 ppm[10] | |
| Safety data sheet (SDS) | [1] | |
| Related compounds | ||
| Related compounds | Methanethiol Silanol Ethanol | |
| Supplementary data page | ||
| Methanol (data page) | ||
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Methanol (also called methyl alcohol and wood spirit, amongst other names) is an organic chemical and the simplest aliphatic alcohol, with the formula CH3OH (a methyl group linked to a hydroxyl group, often abbreviated as MeOH). It is a light, volatile, colourless, flammable liquid with a distinctive alcoholic odour similar to that of ethanol (potable alcohol).[17]
A polar solvent, methanol acquired the name wood alcohol because it was once produced chiefly by the destructive distillation of wood. Today, methanol is mainly produced industrially by hydrogenation of carbon monoxide.[18]
Methanol consists of a methyl group linked to a polar hydroxyl group. With more than 20 million tons produced annually, it is used as a precursor to other commodity chemicals, including formaldehyde, acetic acid, methyl tert-butyl ether, methyl benzoate, anisole, peroxyacids, as well as a host of more specialised chemicals.[18]
Occurrence[edit]
Small amounts of methanol are present in normal, healthy human individuals. One study found a mean of 4.5 ppm in the exhaled breath of test subjects.[19] The mean endogenous methanol in humans of 0.45 g/d may be metabolized from pectin found in fruit; one kilogram of apple produces up to 1.4 g of pectin (0.6 g of methanol.)[20]
Methanol is produced by anaerobic bacteria and phytoplankton.[21][22]
Interstellar medium[edit]
Methanol is also found in abundant quantities in star-forming regions of space and is used in astronomy as a marker for such regions. It is detected through its spectral emission lines.[23]
In 2006, astronomers using the MERLIN array of radio telescopes at Jodrell Bank Observatory discovered a large cloud of methanol in space 463 terametres (288 billion miles) across.[24][25] In 2016, astronomers detected methanol in a planet-forming disc around the young star TW Hydrae using the Atacama Large Millimeter Array radio telescope.[26]
Safety[edit]
Methanol is highly flammable. Its vapours are slightly heavier than air, can travel and ignite. Methanol fires should be extinguished with dry chemical, carbon dioxide, water spray or alcohol-resistant foam.[12]
Toxicity[edit]
Ingesting as little as 10 mL (0.34 US fl oz) of pure methanol can cause permanent blindness by destruction of the optic nerve. 30 mL (1.0 US fl oz) is potentially fatal.[27] The median lethal dose is 100 mL (3.4 US fl oz), i.e., 1–2 mL/kg body weight of pure methanol.[28] The reference dose for methanol is 0.5 mg/kg in a day.[29][30] Toxic effects begin hours after ingestion, and antidotes can often prevent permanent damage.[27] Because of its similarities in both appearance and odor to ethanol (the alcohol in beverages), it is difficult to differentiate between the two; such is also the case with denatured alcohol, adulterated liquors or very low quality alcoholic beverages.
Methanol is toxic by two mechanisms. First, methanol can be fatal due to effects on the central nervous system, acting as a central nervous system depressant in the same manner as ethanol poisoning. Second, in a process of toxication, it is metabolised to formic acid (which is present as the formate ion) via formaldehyde in a process initiated by the enzyme alcohol dehydrogenase in the liver.[31] Methanol is converted to formaldehyde via alcohol dehydrogenase (ADH) and formaldehyde is converted to formic acid (formate) via aldehyde dehydrogenase (ALDH). The conversion to formate via ALDH proceeds completely, with no detectable formaldehyde remaining.[32] Formate is toxic because it inhibits mitochondrial cytochrome c oxidase, causing hypoxia at the cellular level, and metabolic acidosis, among a variety of other metabolic disturbances.[33]
Outbreaks of methanol poisoning have occurred primarily due to contamination of drinking alcohol. This is more common in the developing world.[34] In 2013 more than 1700 cases nonetheless occurred in the United States. Those affected are often adult men.[35] Outcomes may be good with early treatment.[36] Toxicity to methanol was described as early as 1856.[37]
Because of its toxic properties, methanol is frequently used as a denaturant additive for ethanol manufactured for industrial uses. This addition of methanol exempts industrial ethanol (commonly known as «denatured alcohol» or «methylated spirit») from liquor excise taxation in the U.S. and other countries.
During the course of the COVID-19 pandemic, the U.S. Food and Drug Administration (FDA) found a number of hand sanitizer products being sold that were labeled as containing ethanol but tested positive for methanol contamination.[38] Due to the toxic effects of methanol when absorbed through the skin or ingested, in contrast to the relatively safer ethanol, the FDA ordered recalls of such hand sanitizer products containing methanol, and issued an import alert to stop these products from illegally entering the U.S. market.[39]
Applications[edit]
Formaldehyde, acetic acid, methyl tert-butylether[edit]
Methanol is primarily converted to formaldehyde, which is widely used in many areas, especially polymers. The conversion entails oxidation:
Acetic acid can be produced from methanol.

Methanol and isobutene are combined to give methyl tert-butyl ether (MTBE). MTBE is a major octane booster in gasoline.
Methanol to hydrocarbons, olefins, gasoline[edit]
Condensation of methanol to produce hydrocarbons and even aromatic systems is the basis of several technologies related to gas to liquids. These include methanol-to-hydrocarbons (MtH), methanol to gasoline (MtG), methanol to olefins (MtO), and methanol to propylene (MtP). These conversions are catalyzed by zeolites as heterogeneous catalysts. The MtG process was once commercialized at Motunui in New Zealand.[41][42]
Gasoline additive[edit]
The European Fuel Quality Directive allows fuel producers to blend up to 3% methanol, with an equal amount of cosolvent, with gasoline sold in Europe. China uses more than 4.5 billion liters of methanol per year as a transportation fuel in low level blends for conventional vehicles, and high level blends in vehicles designed for methanol fuels.[citation needed] In recent years, however, most modern gasoline-using vehicles can use a variety of alcohol fuels, resulting in similar or higher horsepower, but for a simple change in the vehicle’s software settings and possibly a 50 cent seal or tube part.[43]
Other chemicals[edit]
Methanol is the precursor to most simple methylamines, methyl halides, and methyl ethers.[18] Methyl esters are produced from methanol, including the transesterification of fats and production of biodiesel via transesterification.[44][45]
Niche and potential uses[edit]
Energy carrier[edit]
Methanol is a promising energy carrier because, as a liquid, it is easier to store than hydrogen and natural gas. Its energy density is, however, lower than methane, per kg. Its combustion energy density is 15.6 MJ/L (LHV), whereas that of ethanol is 24 and gasoline is 33 MJ/L.
Further advantages for methanol is its ready biodegradability and low environmental toxicity. It does not persist in either aerobic (oxygen-present) or anaerobic (oxygen-absent) environments. The half-life for methanol in groundwater is just one to seven days, while many common gasoline components have half-lives in the hundreds of days (such as benzene at 10–730 days). Since methanol is miscible with water and biodegradable, it is unlikely to accumulate in groundwater, surface water, air or soil.[46]
Fuel[edit]
Methanol is occasionally used to fuel internal combustion engines. It burns forming carbon dioxide and water:
Methanol fuel has been proposed for ground transportation. The chief advantage of a methanol economy is that it could be adapted to gasoline internal combustion engines with minimum modification to the engines and to the infrastructure that delivers and stores liquid fuel. Its energy density, however, is less than gasoline, meaning more frequent fill ups would be required. However, it is equivalent to super high-octane gasoline in horsepower, and most modern computer-controlled fuel injection systems can already use it.[47]
Methanol is an alternative fuel for ships that helps the shipping industry meet increasingly strict emissions regulations. It significantly reduces emissions of sulphur oxides (SOx), nitrogen oxides (NOx) and particulate matter. Methanol can be used with high efficiency in marine diesel engines after minor modifications using a small amount of pilot fuel (Dual fuel).[48][49]
In China, methanol fuels industrial boilers, which are used extensively to generate heat and steam for various industrial applications and residential heating. Its use is displacing coal, which is under pressure from increasingly stringent environmental regulations.[50]
Direct-methanol fuel cells are unique in their low temperature, atmospheric pressure operation, which lets them be greatly miniaturized.[51][52] This, combined with the relatively easy and safe storage and handling of methanol, may open the possibility of fuel cell-powered consumer electronics, such as laptop computers and mobile phones.[53]
Methanol is also a widely used fuel in camping and boating stoves. Methanol burns well in an unpressurized burner, so alcohol stoves are often very simple, sometimes little more than a cup to hold fuel. This lack of complexity makes them a favorite of hikers who spend extended time in the wilderness. Similarly, the alcohol can be gelled to reduce risk of leaking or spilling, as with the brand «Sterno».
Methanol is mixed with water and injected into high performance diesel and gasoline engines for an increase of power and a decrease in intake air temperature in a process known as water methanol injection.
Other applications[edit]
Methanol is used as a denaturant for ethanol, the product being known as «denatured alcohol» or «methylated spirit». This was commonly used during the U.S. prohibition to discourage consumption of bootlegged liquor, and ended up causing several deaths.[54] These types of practices are now illegal in the U.S., being considered homicide.[55]
Methanol is used as a solvent and as an antifreeze in pipelines and windshield washer fluid. Methanol was used as an automobile coolant antifreeze in the early 1900s.[56] As of May 2018, methanol was banned in the EU for use in windscreen washing or defrosting due to its risk of human consumption[57][58] as a result of 2012 Czech Republic methanol poisonings.[59]
In some wastewater treatment plants, a small amount of methanol is added to wastewater to provide a carbon food source for the denitrifying bacteria, which convert nitrates to nitrogen gas and reduce the nitrification of sensitive aquifers.
Methanol is used as a destaining agent in polyacrylamide gel electrophoresis.
Production[edit]
From synthesis gas[edit]
Carbon monoxide and hydrogen react over a catalyst to produce methanol. Today, the most widely used catalyst is a mixture of copper and zinc oxides, supported on alumina, as first used by ICI in 1966. At 5–10 MPa (50–100 atm) and 250 °C (482 °F), the reaction
is characterized by high selectivity (>99.8%). The production of synthesis gas from methane produces three moles of hydrogen for every mole of carbon monoxide, whereas the synthesis consumes only two moles of hydrogen gas per mole of carbon monoxide. One way of dealing with the excess hydrogen is to inject carbon dioxide into the methanol synthesis reactor, where it, too, reacts to form methanol according to the equation
.
In terms of mechanism, the process occurs via initial conversion of CO into CO2, which is then hydrogenated:[60]
where the H2O byproduct is recycled via the water-gas shift reaction
.
This gives an overall reaction
,
which is the same as listed above. In a process closely related to methanol production from synthesis gas, a feed of hydrogen and CO2 can be used directly.[61] The main advantage of this process is that captured CO2 and hydrogen sourced from electrolysis could be used, removing the dependence on fossil fuels.
Biosynthesis[edit]
The catalytic conversion of methane to methanol is effected by enzymes including methane monooxygenases. These enzymes are mixed-function oxygenases, i.e. oxygenation is coupled with production of water[62] and NAD+:[63]
.
Both Fe- and Cu-dependent enzymes have been characterized.[63] Intense but largely fruitless efforts have been undertaken to emulate this reactivity.[64][65] Methanol is more easily oxidized than is the feedstock methane, so the reactions tend not to be selective. Some strategies exist to circumvent this problem. Examples include Shilov systems and Fe- and Cu containing zeolites.[66] These systems do not necessarily mimic the mechanisms employed by metalloenzymes, but draw some inspiration from them. Active sites can vary substantially from those known in the enzymes. For example, a dinuclear active site is proposed in the sMMO enzyme, whereas a mononuclear iron (alpha-oxygen) is proposed in the Fe-zeolite.[67]
Global emissions of methanol by plants are estimated at between 180 and 250 million tons per year.[68] This is between two and three times larger than man-made industrial production of methanol.
Quality specifications and analysis[edit]
Methanol is available commercially in various purity grades. Commercial methanol is generally classified according to ASTM purity grades A and AA. Both grade A and grade AA purity are 99.85% methanol by weight. Grade «AA» methanol contains trace amounts of ethanol as well.[69]
Methanol for chemical use normally corresponds to Grade AA. In addition to water, typical impurities include acetone and ethanol (which are very difficult to separate by distillation). UV-vis spectroscopy is a convenient method for detecting aromatic impurities. Water content can be determined by the Karl-Fischer titration.
History[edit]
In their embalming process, the ancient Egyptians used a mixture of substances, including methanol, which they obtained from the pyrolysis of wood. Pure methanol, however, was first isolated in 1661 by Robert Boyle, when he produced it via the distillation of buxus (boxwood).[70] It later became known as «pyroxylic spirit». In 1834, the French chemists Jean-Baptiste Dumas and Eugene Peligot determined its elemental composition.[71]
They also introduced the word «methylène» to organic chemistry, forming it from Greek methy = «alcoholic liquid» + hȳlē = «forest, wood, timber, material». «Methylène» designated a «radical» that was about 14% hydrogen by weight and contained one carbon atom. This would be CH2, but at the time carbon was thought to have an atomic weight only six times that of hydrogen, so they gave the formula as CH.[71] They then called wood alcohol (l’esprit de bois) «bihydrate de méthylène» (bihydrate because they thought the formula was C4H8O4 = (CH)4(H2O)2). The term «methyl» was derived in about 1840 by back-formation from «methylene», and was then applied to describe «methyl alcohol». This was shortened to «methanol» in 1892 by the International Conference on Chemical Nomenclature.[72] The suffix -yl, which, in organic chemistry, forms names of carbon groups, is from the word methyl.
French chemist Paul Sabatier presented the first process that could be used to produce methanol synthetically in 1905. This process suggested that carbon dioxide and hydrogen could be reacted to produce methanol.[9] German chemists Alwin Mittasch and Mathias Pier, working for Badische-Anilin & Soda-Fabrik (BASF), developed a means to convert synthesis gas (a mixture of carbon monoxide, carbon dioxide, and hydrogen) into methanol and received a patent. According to Bozzano and Manenti, BASF’s process was first utilized in Leuna, Germany in 1923. Operating conditions consisted of «high» temperatures (between 300 and 400 °C) and pressures (between 250 and 350 atm) with a zinc/chromium oxide[disambiguation needed] catalyst.[69]
US patent 1,569,775 (US 1569775) was applied for on 4 Sep 1924 and issued on 12 January 1926 to BASF; the process used a chromium and manganese oxide catalyst with extremely vigorous conditions: pressures ranging from 50 to 220 atm, and temperatures up to 450 °C. Modern methanol production has been made more efficient through use of catalysts (commonly copper) capable of operating at lower pressures. The modern low pressure methanol (LPM) process was developed by ICI in the late 1960s US 3326956 with the technology patent since long expired.
During World War II, methanol was used as a fuel in several German military rocket designs, under the name M-Stoff, and in a roughly 50/50 mixture with hydrazine, known as C-Stoff.
The use of methanol as a motor fuel received attention during the oil crises of the 1970s. By the mid-1990s, over 20,000 methanol «flexible fuel vehicles» (FFV) capable of operating on methanol or gasoline were introduced in the U.S. In addition, low levels of methanol were blended in gasoline fuels sold in Europe during much of the 1980s and early-1990s. Automakers stopped building methanol FFVs by the late-1990s, switching their attention to ethanol-fueled vehicles. While the methanol FFV program was a technical success, rising methanol pricing in the mid- to late-1990s during a period of slumping gasoline pump prices diminished interest in methanol fuels.[73]
In the early 1970s, a process was developed by Mobil for producing gasoline fuel from methanol.[74]
Between the 1960s and 1980s methanol emerged as a precursor to the feedstock chemicals acetic acid and acetic anhydride. These processes include the Monsanto acetic acid synthesis, Cativa process, and Tennessee Eastman acetic anhydride process.
See also[edit]
- Aminomethanol
- Methanol (data page)
- Trimethyl carbinol
References[edit]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 692. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ballinger, P.; Long, F. A. (1960). «Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds». J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ «Methyloxonium». pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
- ^ «Methanolate». pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
Methoxide is an organic anion that is the conjugate base of methanol. … It is a conjugate base of a methanol.
- ^ «RefractiveIndex.INFO – Refractive index database». refractiveindex.info.
- ^ González, Begoña (2007). «Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K». The Journal of Chemical Thermodynamics. 39 (12): 1578–1588. doi:10.1016/j.jct.2007.05.004.
- ^ a b c d «Methanol» (PDF). Lab Chem. Valtech. Retrieved 10 March 2016.
- ^ a b Toxicity on PubChem
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0397». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «Methanol». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «The Emergency Response Safety and Health Database: Systematic Agent: METHANOL». Centers for Disease Control and Prevention. Retrieved 3 August 2018.
- ^ «PubChem: Safety and Hazards — GHS Classification». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ «Methanol Safe Handling Manual» (PDF). Methanol Institute. 2017. p. 253. Retrieved 3 August 2018.
- ^ «Technical Information & Safe Handling Guide for Methanol». Methanex Corporation. Archived from the original on 11 March 2012.
- ^ «Methanol Safe Handling Manual» (PDF). Methanol Institute. 2017. p. 243. Retrieved 3 August 2018.
- ^ National Institute for Occupational Safety and Health (22 August 2008). «The Emergency Response Safety and Health Database: Methanol». Retrieved 17 March 2009.
- ^ a b c Fiedler, E.; Grossmann, G.; Burkhard Kersebohm, D.; Weiss, G. and Witte, C. (2005). «Methanol». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_465. ISBN 978-3527306732.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Turner C (2006). «A longitudinal study of methanol in the exhaled breath of 30 healthy volunteers using selected ion flow tube mass spectrometry, SIFT-MS». Physiological Measurement. 27 (7): 637–48. Bibcode:2006PhyM…27..637T. doi:10.1088/0967-3334/27/7/007. PMID 16705261. S2CID 22365066.
- ^ Lindinger W (1997). «Endogenous production of methanol after the consumption of fruit». Alcoholism: Clinical and Experimental Research. 21 (5): 939–43. doi:10.1111/j.1530-0277.1997.tb03862.x. PMID 9267548.
- ^ «Major Source of Methanol in the Ocean Identified». Woods Hole Oceanographic Institution. 10 March 2016. Retrieved 30 March 2016.
- ^ Mincer, Tracy J.; Aicher, Athena C. (2016). «Methanol Production by a Broad Phylogenetic Array of Marine Phytoplankton». PLOS ONE. 11 (3): e0150820. Bibcode:2016PLoSO..1150820M. doi:10.1371/journal.pone.0150820. PMC 4786210. PMID 26963515.
- ^ Brooks Hays (17 April 2015). «Why astronomers hate the lawn-mowing Roomba». Space Daily.
- ^ «Upgraded MERLIN spies cloud of alcohol spanning 288 billion miles» (Press release). Jodrell Bank Centre for Astrophysics. 19 April 2006. Archived from the original on 20 July 2011.
- ^ Amos, Jonathan (5 April 2006). «Merlin sees vast alcohol stream». BBC News.
- ^ «First Detection of Methyl Alcohol in a Planet-forming Disc». Retrieved 22 June 2016.
- ^ a b Vale A (2007). «Methanol». Medicine. 35 (12): 633–4. doi:10.1016/j.mpmed.2007.09.014.
- ^ «Methanol Poisoning Overview». Antizol. Archived from the original on 5 October 2011.
- ^ «Integrated Risk Information System». US EPA, ORD, NCEA, IRISD. 15 March 2013.
- ^ «Toxicological Review of Methanol (Noncancer) (CAS No. 67-56-1) In Support of Summary Information on the Integrated Risk Information System (IRIS)» (PDF). EPA. September 2013. EPA/635/R-11/001Fa. Retrieved 30 March 2021.
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM (2009). «A seaman with blindness and confusion». BMJ. 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790. S2CID 6367081.
- ^ McMartin KE, Martin-Amat G, Noker PE, Tephly TR (1979). «Lack of a role for formaldehyde in methanol poisoning in the monkey». Biochem. Pharmacol. 28 (5): 645–9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- ^ Liesivuori J, Savolainen H (September 1991). «Methanol and formic acid toxicity: biochemical mechanisms». Pharmacol. Toxicol. 69 (3): 157–63. doi:10.1111/j.1600-0773.1991.tb01290.x. PMID 1665561.
- ^ Beauchamp, GA; Valento, M (September 2016). «Toxic Alcohol Ingestion: Prompt Recognition And Management in the Emergency Department». Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
- ^ Ferri, Fred F. (2016). Ferri’s Clinical Advisor 2017: 5 Books in 1. Elsevier Health Sciences. p. 794. ISBN 9780323448383.
- ^ Kruse, JA (October 2012). «Methanol and ethylene glycol intoxication». Critical Care Clinics. 28 (4): 661–711. doi:10.1016/j.ccc.2012.07.002. PMID 22998995.
- ^ Clary, John J. (2013). The Toxicology of Methanol. John Wiley & Sons. p. 3.4.1. ISBN 9781118353103.
- ^ «Hand Sanitizers COVID-19». U.S. Food and Drug Administration. 9 July 2020. Archived from the original on 9 July 2020.
- ^ «FDA updates hand sanitizers consumers should not use». U.S. Food and Drug Administration. 31 July 2020. Archived from the original on 1 August 2020.
- ^ Sunley, G. J.; Watson, D. J. (2000). «High productivity methanol carbonylation catalysis using iridium – The Cativa process for the manufacture of acetic acid». Catalysis Today. 58 (4): 293–307. doi:10.1016/S0920-5861(00)00263-7.
- ^ Olsbye, U.; Svelle, S.; Bjorgen, M.; Beato, P.; Janssens, T. V. W.; Joensen, F.; Bordiga, S.; Lillerud, K. P. (2012). «Conversion of Methanol to Hydrocarbons: How Zeolite Cavity and Pore Size Controls Product Selectivity». Angew. Chem. Int. Ed. 51 (24): 5810–5831. doi:10.1002/anie.201103657. hdl:2318/122770. PMID 22511469. S2CID 26585752.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Tian, P.; Wei, Y.; Ye, M.; Liu, Z. (2015). «Methanol to Olefins (MTO): From Fundamentals to Commercialization». ACS Catal. 5 (3): 1922–1938. doi:10.1021/acscatal.5b00007.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «Pump The Movie Methanol Clip». YouTube. Retrieved 7 June 2022.
- ^ «Biodiesel – METHANOL INSTITUTE». METHANOL INSTITUTE. Retrieved 24 March 2018.
- ^ «Biodiesel Production Principles and Processes – eXtension». Retrieved 24 March 2018.
- ^ Evaluation of the Fate and Transport of Methanol in the Environment Archived 16 May 2016 at the Portuguese Web Archive, Malcolm Pirnie, Inc., January 1999.
- ^ «Methanol Wins». National Review. December 2011. Retrieved 7 June 2022.
- ^ «Methanol as a Marine Fuel». Methanex Corporation. Retrieved 10 April 2021.
- ^ Andersson, Karin; Márquez Salazar, Carlos (2015). Methanol as a Marine Fuel Report (PDF) (Report). FC Business Intelligence. Retrieved 10 April 2021.
- ^ «Methanol as an Industrial Boiler Fuel». Methanex Corporation. Retrieved 10 April 2021.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2008). «Miniaturized microDMFC using silicon microsystems techniques: Performances at low fuel flow rates» (PDF). Journal of Micromechanics and Microengineering. 18 (12): 125019. Bibcode:2008JMiMi..18l5019K. doi:10.1088/0960-1317/18/12/125019. S2CID 110214840.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2011). «Microfabricated microfluidic fuel cells». Sensors and Actuators B: Chemical. 154 (2): 174. doi:10.1016/j.snb.2009.11.014.
- ^ Berger, Sandy (30 September 2006). «Methanol Laptop Fuel». Compu·Kiss. Retrieved 22 May 2007.
- ^ Blum, Deborah (19 February 2010). «The little-told story of how the U.S. government poisoned alcohol during Prohibition». Slate Magazine. Retrieved 10 June 2010.
- ^ «22 USC Ch. 75: CHEMICAL WEAPONS CONVENTION IMPLEMENTATION». uscode.house.gov.
- ^ Yant, W. P.; Schrenk, H. H.; Sayers, R. R. (1931). «Methanol Antifreeze and Methanol Poisoning». Industrial & Engineering Chemistry. 23 (5): 551. doi:10.1021/ie50257a020.
- ^ «EUR-Lex – 32018R0589 – EN – EUR-Lex». eur-lex.europa.eu. Retrieved 28 November 2018.
- ^ «Corrigendum to Commission Regulation (EU) 2018/589 of 18 April 2018 amending Annex XVII to Regulation (EC) No 1907/2006 of the European Parliament and of the Council concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) as regards methanol (OJ L 99, 19.4.2018)». 23 April 2018. Retrieved 7 July 2020.
- ^ «Annex XV Restriction Report: Proposal For a Restriction Substance Name: Methanol – table D.1-4-page 79». 16 January 2015.
- ^ Deutschmann, Olaf; Knözinger, Helmut; Kochloefl, Karl and Turek, Thomas (2012) «Heterogeneous Catalysis and Solid Catalysts, 3. Industrial Applications» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.o05_o03
- ^ Bozzano, Giulia; Manenti, Flavio (2016). «Efficient methanol synthesis: Perspectives, technologies and optimization strategies». Progress in Energy and Combustion Science. 56: 76. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ Mu-Hyun Baik, Martin Newcomb, Richard A. Friesner, Stephen J. Lippard (2003). «Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase». Chem. Rev. 103 (6): 2385–2420. doi:10.1021/cr950244f. PMID 12797835.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b Lawton, T. J.; Rosenzweig, A. C. (2016). «Biocatalysts for methane conversion: big progress on breaking a small substrate». Curr. Opin. Chem. Biol. 35: 142–149. doi:10.1016/j.cbpa.2016.10.001. PMC 5161620. PMID 27768948.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Alayon, E. M. C.; Nachtegaal, M.; Ranocchiari, M.; Van Bokhoven, J. A. (2012). «Catalytic Conversion of Methane to Methanol Using Cu-Zeolites». CHIMIA International Journal for Chemistry. 66 (9): 668–674. doi:10.2533/chimia.2012.668. PMID 23211724.
- ^ Hammond, C.; Jenkins, R. L.; Dimitratos, N.; Lopez-Sanchez, J. A.; Ab Rahim, M. H.; Forde, M.M.; Thetford, A.; Murphy, D.M.; Hagen, H.; Stangland, E.E.; Moulijn, J.M.; Taylor, S. H.; Willock, D. J.; Hutchings, G.J. (2012). «Catalytic and Mechanistic Insights of the Low-Temperature Selective Oxidation of Methane over Cu-Promoted Fe-ZSM-5». Chemistry: A European Journal. 18 (49): 15735–45. doi:10.1002/chem.201202802. PMID 23150452.
- ^ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (19 December 2017). «Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes». Chemical Reviews. 118 (5): 2718–2768. doi:10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^ Snyder, Benjamin E. R.; Vanelderen, Pieter; Bols, Max L.; Hallaert, Simon D.; Böttger, Lars H.; Ungur, Liviu; Pierloot, Kristine; Schoonheydt, Robert A.; Sels, Bert F. (2016). «The active site of low-temperature methane hydroxylation in iron-containing zeolites». Nature. 536 (7616): 317–321. Bibcode:2016Natur.536..317S. doi:10.1038/nature19059. PMID 27535535. S2CID 4467834.
- ^ Stavrakou, T.; Guenther, A.; Razavi, A.; Clarisse, L.; Clerbaux, C.; Coheur, P.-F.; Hurtmans, D.; Karagulian, F.; De Mazière, M.; Vigouroux, C.; Amelynck, C.; Schoon, N.; Laffineur, Q.; Heinesch, B.; Aubinet, M. (25 May 2011). «First space-based derivation of the global atmospheric methanol emission fluxes». Atmospheric Chemistry and Physics. 11 (10): 4873–4898. Bibcode:2011ACP….11.4873S. doi:10.5194/acp-11-4873-2011. ISSN 1680-7324. S2CID 54685577.
- ^ a b Bozzano, Giulia; Manenti, Flavio (1 September 2016). «Efficient methanol synthesis: Perspectives, technologies and optimization strategies». Progress in Energy and Combustion Science. 56: 71–105. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ Boyle discusses the distillation of liquids from the wood of the box shrub in: Robert Boyle, The Sceptical Chymist (London, England: J. Cadwell, 1661), pp. 192–195.
- ^ a b A report on methanol to the French Academy of Sciences by J. Dumas and E. Péligot began during the Academy’s meeting of 27 October 1834 and finished during the meeting of 3 November 1834. See: Procès-verbaux des séances de l’Académie, 10 : 600–601. Available on: Gallica. The complete report appears in: J. Dumas and E. Péligot (1835) «Mémoire sur l’espirit de bois et sur les divers composés ethérés qui en proviennent» (Memoir on spirit of wood and on the various ethereal compounds that derive therefrom), Annales de chimie et de physique, 58 : 5–74; from page 9: Nous donnerons le nom de méthylène (1) à un radical … (1) Μεθυ, vin, et υλη, bois; c’est-à-dire vin ou liqueur spiritueuse du bois. (We will give the name methylene (1) to a radical … (1) methy, wine, and hulē, wood; that is, wine or spirit of wood.)
- ^ For a report on the International Conference on Chemical Nomenclature that was held in April 1892 in Geneva, Switzerland, see:
- Armstrong, Henry E (1892). «The International Conference on Chemical Nomenclature». Nature. 46 (1177): 56–9. Bibcode:1892Natur..46…56A. doi:10.1038/046056c0.
- Armstrong’s report is reprinted with the resolutions in English in: Armstrong, Henry (1892). «The International Conference on Chemical Nomenclature». The Journal of Analytical and Applied Chemistry. 6 (1177): 390–400. Bibcode:1892Natur..46…56A. doi:10.1038/046056c0.
p. 398: 15. The alcohols and the phenols are named after the hydrocarbon from which they derive, terminated with the suffix ol (ex. pentanol, pentenol, etc.).
- ^ Halderman, James D.; Martin, Tony (2009). Hybrid and alternative fuel vehicles. Pearson/Prentice Hall. ISBN 978-0-13-504414-8.
- ^ Ronald Smith (1 December 2011). «Methanol to Gasoline: A Private Report by the Process Economics Program» (PDF). Retrieved 4 December 2019.
Further reading[edit]
- Robert Boyle, The Sceptical Chymist (1661) – contains account of distillation of wood alcohol.
External links[edit]
- International Chemical Safety Card 0057
- Methyl Alcohol (Methanol) CDC/NIOSH, links to safety information
- CDC – NIOSH Pocket Guide to Chemical Hazards – Methyl Alcohol
- Methanol Fact Sheet – National Pollutant Inventory
| ||
| ||
 | ||
| Names | ||
|---|---|---|
| Pronunciation | ||
| Preferred IUPAC name Methanol[1] | ||
| Other names Carbinol | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| 3DMet |
| |
| Beilstein Reference | 1098229 | |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| ECHA InfoCard | 100.000.599 | |
| EC Number |
| |
| Gmelin Reference | 449 | |
| KEGG |
| |
| MeSH | Methanol | |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| UN number | 1230 | |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | CH 3OH or CH 4O | |
| Molar mass | 32.04 g mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Sweet and pungent | |
| Density | 0.792 g/cm3[2] | |
| Melting point | −97.6 °C (−143.7 °F; 175.6 K) | |
| Boiling point | 64.7 °C (148.5 °F; 337.8 K) | |
| Solubility in water | miscible | |
| log P | −0.69 | |
| Vapor pressure | 13.02 kPa (at 20 °C) | |
| Acidity (pKa) | 15.5[3] | |
| Conjugate acid | Methyloxonium[4] | |
| Conjugate base | Methanolate[5] | |
| Magnetic susceptibility (χ) | −21.40·10−6 cm3/mol | |
| Refractive index (nD) | 1.33141[6] | |
| Viscosity | 0.545 mPa·s (at 25 °C)[7] | |
| Dipole moment | 1.69 D | |
| Thermochemistry | ||
| Heat of combustion, higher value (HHV) | 725.7 kJ/mol, 173.4 kcal/mol, 5.77 kcal/g | |
| Hazards[12][13] | ||
| Occupational safety and health (OHS/OSH): | ||
| Main hazards | Methanol and its vapours are flammable. Moderately toxic for small animals – Highly toxic to large animals and humans (in high concentrations) – May be fatal/lethal or cause blindness and damage to the liver, kidneys, and heart if swallowed – Toxicity effects from repeated over exposure have an accumulative effect on the central nervous system, especially the optic nerve – Symptoms may be delayed, become severe after 12 to 18 hours, and linger for several days after exposure[9] | |
| GHS labelling: | ||
| Pictograms |    [8] [8] | |
| Signal word | Danger[8] | |
| Hazard statements | H225, H301, H302, H305, H311, H331, H370[8] | |
| Precautionary statements | P210, P233, P235, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P310, P311, P312, P337+P313, P361, P363, P370+P378, P403+P233, P405, P501[8] | |
| NFPA 704 (fire diamond) | [12][14]
1 3 0 | |
| Flash point | 11 to 12 °C (52 to 54 °F; 284 to 285 K) | |
| Autoignition | 470 °C (878 °F; 743 K)[15] 385 °C (725 °F; 658 K)[16] | |
| Explosive limits | 6–36%[10] | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) | 58 mg/kg (rat, oral) 730 mg/kg (mouse, oral) 1280 mg/kg (rat, oral) 1400 mg/kg (rabbit, oral)[11] | |
| LC50 (median concentration) | 64,000 ppm (rat, 4 h)[11] | |
| LCLo (lowest published) | 33,082 ppm (cat, 6 h) 37,594 ppm (mouse, 2 h)[11] | |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 200 ppm (260 mg/m3)[10] | |
| REL (Recommended) | TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [skin][10] | |
| IDLH (Immediate danger) | 6000 ppm[10] | |
| Safety data sheet (SDS) | [1] | |
| Related compounds | ||
| Related compounds | Methanethiol Silanol Ethanol | |
| Supplementary data page | ||
| Methanol (data page) | ||
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Methanol (also called methyl alcohol and wood spirit, amongst other names) is an organic chemical and the simplest aliphatic alcohol, with the formula CH3OH (a methyl group linked to a hydroxyl group, often abbreviated as MeOH). It is a light, volatile, colourless, flammable liquid with a distinctive alcoholic odour similar to that of ethanol (potable alcohol).[17]
A polar solvent, methanol acquired the name wood alcohol because it was once produced chiefly by the destructive distillation of wood. Today, methanol is mainly produced industrially by hydrogenation of carbon monoxide.[18]
Methanol consists of a methyl group linked to a polar hydroxyl group. With more than 20 million tons produced annually, it is used as a precursor to other commodity chemicals, including formaldehyde, acetic acid, methyl tert-butyl ether, methyl benzoate, anisole, peroxyacids, as well as a host of more specialised chemicals.[18]
Occurrence[edit]
Small amounts of methanol are present in normal, healthy human individuals. One study found a mean of 4.5 ppm in the exhaled breath of test subjects.[19] The mean endogenous methanol in humans of 0.45 g/d may be metabolized from pectin found in fruit; one kilogram of apple produces up to 1.4 g of pectin (0.6 g of methanol.)[20]
Methanol is produced by anaerobic bacteria and phytoplankton.[21][22]
Interstellar medium[edit]
Methanol is also found in abundant quantities in star-forming regions of space and is used in astronomy as a marker for such regions. It is detected through its spectral emission lines.[23]
In 2006, astronomers using the MERLIN array of radio telescopes at Jodrell Bank Observatory discovered a large cloud of methanol in space 463 terametres (288 billion miles) across.[24][25] In 2016, astronomers detected methanol in a planet-forming disc around the young star TW Hydrae using the Atacama Large Millimeter Array radio telescope.[26]
Safety[edit]
Methanol is highly flammable. Its vapours are slightly heavier than air, can travel and ignite. Methanol fires should be extinguished with dry chemical, carbon dioxide, water spray or alcohol-resistant foam.[12]
Toxicity[edit]
Ingesting as little as 10 mL (0.34 US fl oz) of pure methanol can cause permanent blindness by destruction of the optic nerve. 30 mL (1.0 US fl oz) is potentially fatal.[27] The median lethal dose is 100 mL (3.4 US fl oz), i.e., 1–2 mL/kg body weight of pure methanol.[28] The reference dose for methanol is 0.5 mg/kg in a day.[29][30] Toxic effects begin hours after ingestion, and antidotes can often prevent permanent damage.[27] Because of its similarities in both appearance and odor to ethanol (the alcohol in beverages), it is difficult to differentiate between the two; such is also the case with denatured alcohol, adulterated liquors or very low quality alcoholic beverages.
Methanol is toxic by two mechanisms. First, methanol can be fatal due to effects on the central nervous system, acting as a central nervous system depressant in the same manner as ethanol poisoning. Second, in a process of toxication, it is metabolised to formic acid (which is present as the formate ion) via formaldehyde in a process initiated by the enzyme alcohol dehydrogenase in the liver.[31] Methanol is converted to formaldehyde via alcohol dehydrogenase (ADH) and formaldehyde is converted to formic acid (formate) via aldehyde dehydrogenase (ALDH). The conversion to formate via ALDH proceeds completely, with no detectable formaldehyde remaining.[32] Formate is toxic because it inhibits mitochondrial cytochrome c oxidase, causing hypoxia at the cellular level, and metabolic acidosis, among a variety of other metabolic disturbances.[33]
Outbreaks of methanol poisoning have occurred primarily due to contamination of drinking alcohol. This is more common in the developing world.[34] In 2013 more than 1700 cases nonetheless occurred in the United States. Those affected are often adult men.[35] Outcomes may be good with early treatment.[36] Toxicity to methanol was described as early as 1856.[37]
Because of its toxic properties, methanol is frequently used as a denaturant additive for ethanol manufactured for industrial uses. This addition of methanol exempts industrial ethanol (commonly known as «denatured alcohol» or «methylated spirit») from liquor excise taxation in the U.S. and other countries.
During the course of the COVID-19 pandemic, the U.S. Food and Drug Administration (FDA) found a number of hand sanitizer products being sold that were labeled as containing ethanol but tested positive for methanol contamination.[38] Due to the toxic effects of methanol when absorbed through the skin or ingested, in contrast to the relatively safer ethanol, the FDA ordered recalls of such hand sanitizer products containing methanol, and issued an import alert to stop these products from illegally entering the U.S. market.[39]
Applications[edit]
Formaldehyde, acetic acid, methyl tert-butylether[edit]
Methanol is primarily converted to formaldehyde, which is widely used in many areas, especially polymers. The conversion entails oxidation:
Acetic acid can be produced from methanol.

Methanol and isobutene are combined to give methyl tert-butyl ether (MTBE). MTBE is a major octane booster in gasoline.
Methanol to hydrocarbons, olefins, gasoline[edit]
Condensation of methanol to produce hydrocarbons and even aromatic systems is the basis of several technologies related to gas to liquids. These include methanol-to-hydrocarbons (MtH), methanol to gasoline (MtG), methanol to olefins (MtO), and methanol to propylene (MtP). These conversions are catalyzed by zeolites as heterogeneous catalysts. The MtG process was once commercialized at Motunui in New Zealand.[41][42]
Gasoline additive[edit]
The European Fuel Quality Directive allows fuel producers to blend up to 3% methanol, with an equal amount of cosolvent, with gasoline sold in Europe. China uses more than 4.5 billion liters of methanol per year as a transportation fuel in low level blends for conventional vehicles, and high level blends in vehicles designed for methanol fuels.[citation needed] In recent years, however, most modern gasoline-using vehicles can use a variety of alcohol fuels, resulting in similar or higher horsepower, but for a simple change in the vehicle’s software settings and possibly a 50 cent seal or tube part.[43]
Other chemicals[edit]
Methanol is the precursor to most simple methylamines, methyl halides, and methyl ethers.[18] Methyl esters are produced from methanol, including the transesterification of fats and production of biodiesel via transesterification.[44][45]
Niche and potential uses[edit]
Energy carrier[edit]
Methanol is a promising energy carrier because, as a liquid, it is easier to store than hydrogen and natural gas. Its energy density is, however, lower than methane, per kg. Its combustion energy density is 15.6 MJ/L (LHV), whereas that of ethanol is 24 and gasoline is 33 MJ/L.
Further advantages for methanol is its ready biodegradability and low environmental toxicity. It does not persist in either aerobic (oxygen-present) or anaerobic (oxygen-absent) environments. The half-life for methanol in groundwater is just one to seven days, while many common gasoline components have half-lives in the hundreds of days (such as benzene at 10–730 days). Since methanol is miscible with water and biodegradable, it is unlikely to accumulate in groundwater, surface water, air or soil.[46]
Fuel[edit]
Methanol is occasionally used to fuel internal combustion engines. It burns forming carbon dioxide and water:
Methanol fuel has been proposed for ground transportation. The chief advantage of a methanol economy is that it could be adapted to gasoline internal combustion engines with minimum modification to the engines and to the infrastructure that delivers and stores liquid fuel. Its energy density, however, is less than gasoline, meaning more frequent fill ups would be required. However, it is equivalent to super high-octane gasoline in horsepower, and most modern computer-controlled fuel injection systems can already use it.[47]
Methanol is an alternative fuel for ships that helps the shipping industry meet increasingly strict emissions regulations. It significantly reduces emissions of sulphur oxides (SOx), nitrogen oxides (NOx) and particulate matter. Methanol can be used with high efficiency in marine diesel engines after minor modifications using a small amount of pilot fuel (Dual fuel).[48][49]
In China, methanol fuels industrial boilers, which are used extensively to generate heat and steam for various industrial applications and residential heating. Its use is displacing coal, which is under pressure from increasingly stringent environmental regulations.[50]
Direct-methanol fuel cells are unique in their low temperature, atmospheric pressure operation, which lets them be greatly miniaturized.[51][52] This, combined with the relatively easy and safe storage and handling of methanol, may open the possibility of fuel cell-powered consumer electronics, such as laptop computers and mobile phones.[53]
Methanol is also a widely used fuel in camping and boating stoves. Methanol burns well in an unpressurized burner, so alcohol stoves are often very simple, sometimes little more than a cup to hold fuel. This lack of complexity makes them a favorite of hikers who spend extended time in the wilderness. Similarly, the alcohol can be gelled to reduce risk of leaking or spilling, as with the brand «Sterno».
Methanol is mixed with water and injected into high performance diesel and gasoline engines for an increase of power and a decrease in intake air temperature in a process known as water methanol injection.
Other applications[edit]
Methanol is used as a denaturant for ethanol, the product being known as «denatured alcohol» or «methylated spirit». This was commonly used during the U.S. prohibition to discourage consumption of bootlegged liquor, and ended up causing several deaths.[54] These types of practices are now illegal in the U.S., being considered homicide.[55]
Methanol is used as a solvent and as an antifreeze in pipelines and windshield washer fluid. Methanol was used as an automobile coolant antifreeze in the early 1900s.[56] As of May 2018, methanol was banned in the EU for use in windscreen washing or defrosting due to its risk of human consumption[57][58] as a result of 2012 Czech Republic methanol poisonings.[59]
In some wastewater treatment plants, a small amount of methanol is added to wastewater to provide a carbon food source for the denitrifying bacteria, which convert nitrates to nitrogen gas and reduce the nitrification of sensitive aquifers.
Methanol is used as a destaining agent in polyacrylamide gel electrophoresis.
Production[edit]
From synthesis gas[edit]
Carbon monoxide and hydrogen react over a catalyst to produce methanol. Today, the most widely used catalyst is a mixture of copper and zinc oxides, supported on alumina, as first used by ICI in 1966. At 5–10 MPa (50–100 atm) and 250 °C (482 °F), the reaction
is characterized by high selectivity (>99.8%). The production of synthesis gas from methane produces three moles of hydrogen for every mole of carbon monoxide, whereas the synthesis consumes only two moles of hydrogen gas per mole of carbon monoxide. One way of dealing with the excess hydrogen is to inject carbon dioxide into the methanol synthesis reactor, where it, too, reacts to form methanol according to the equation
.
In terms of mechanism, the process occurs via initial conversion of CO into CO2, which is then hydrogenated:[60]
where the H2O byproduct is recycled via the water-gas shift reaction
.
This gives an overall reaction
,
which is the same as listed above. In a process closely related to methanol production from synthesis gas, a feed of hydrogen and CO2 can be used directly.[61] The main advantage of this process is that captured CO2 and hydrogen sourced from electrolysis could be used, removing the dependence on fossil fuels.
Biosynthesis[edit]
The catalytic conversion of methane to methanol is effected by enzymes including methane monooxygenases. These enzymes are mixed-function oxygenases, i.e. oxygenation is coupled with production of water[62] and NAD+:[63]
.
Both Fe- and Cu-dependent enzymes have been characterized.[63] Intense but largely fruitless efforts have been undertaken to emulate this reactivity.[64][65] Methanol is more easily oxidized than is the feedstock methane, so the reactions tend not to be selective. Some strategies exist to circumvent this problem. Examples include Shilov systems and Fe- and Cu containing zeolites.[66] These systems do not necessarily mimic the mechanisms employed by metalloenzymes, but draw some inspiration from them. Active sites can vary substantially from those known in the enzymes. For example, a dinuclear active site is proposed in the sMMO enzyme, whereas a mononuclear iron (alpha-oxygen) is proposed in the Fe-zeolite.[67]
Global emissions of methanol by plants are estimated at between 180 and 250 million tons per year.[68] This is between two and three times larger than man-made industrial production of methanol.
Quality specifications and analysis[edit]
Methanol is available commercially in various purity grades. Commercial methanol is generally classified according to ASTM purity grades A and AA. Both grade A and grade AA purity are 99.85% methanol by weight. Grade «AA» methanol contains trace amounts of ethanol as well.[69]
Methanol for chemical use normally corresponds to Grade AA. In addition to water, typical impurities include acetone and ethanol (which are very difficult to separate by distillation). UV-vis spectroscopy is a convenient method for detecting aromatic impurities. Water content can be determined by the Karl-Fischer titration.
History[edit]
In their embalming process, the ancient Egyptians used a mixture of substances, including methanol, which they obtained from the pyrolysis of wood. Pure methanol, however, was first isolated in 1661 by Robert Boyle, when he produced it via the distillation of buxus (boxwood).[70] It later became known as «pyroxylic spirit». In 1834, the French chemists Jean-Baptiste Dumas and Eugene Peligot determined its elemental composition.[71]
They also introduced the word «methylène» to organic chemistry, forming it from Greek methy = «alcoholic liquid» + hȳlē = «forest, wood, timber, material». «Methylène» designated a «radical» that was about 14% hydrogen by weight and contained one carbon atom. This would be CH2, but at the time carbon was thought to have an atomic weight only six times that of hydrogen, so they gave the formula as CH.[71] They then called wood alcohol (l’esprit de bois) «bihydrate de méthylène» (bihydrate because they thought the formula was C4H8O4 = (CH)4(H2O)2). The term «methyl» was derived in about 1840 by back-formation from «methylene», and was then applied to describe «methyl alcohol». This was shortened to «methanol» in 1892 by the International Conference on Chemical Nomenclature.[72] The suffix -yl, which, in organic chemistry, forms names of carbon groups, is from the word methyl.
French chemist Paul Sabatier presented the first process that could be used to produce methanol synthetically in 1905. This process suggested that carbon dioxide and hydrogen could be reacted to produce methanol.[9] German chemists Alwin Mittasch and Mathias Pier, working for Badische-Anilin & Soda-Fabrik (BASF), developed a means to convert synthesis gas (a mixture of carbon monoxide, carbon dioxide, and hydrogen) into methanol and received a patent. According to Bozzano and Manenti, BASF’s process was first utilized in Leuna, Germany in 1923. Operating conditions consisted of «high» temperatures (between 300 and 400 °C) and pressures (between 250 and 350 atm) with a zinc/chromium oxide[disambiguation needed] catalyst.[69]
US patent 1,569,775 (US 1569775) was applied for on 4 Sep 1924 and issued on 12 January 1926 to BASF; the process used a chromium and manganese oxide catalyst with extremely vigorous conditions: pressures ranging from 50 to 220 atm, and temperatures up to 450 °C. Modern methanol production has been made more efficient through use of catalysts (commonly copper) capable of operating at lower pressures. The modern low pressure methanol (LPM) process was developed by ICI in the late 1960s US 3326956 with the technology patent since long expired.
During World War II, methanol was used as a fuel in several German military rocket designs, under the name M-Stoff, and in a roughly 50/50 mixture with hydrazine, known as C-Stoff.
The use of methanol as a motor fuel received attention during the oil crises of the 1970s. By the mid-1990s, over 20,000 methanol «flexible fuel vehicles» (FFV) capable of operating on methanol or gasoline were introduced in the U.S. In addition, low levels of methanol were blended in gasoline fuels sold in Europe during much of the 1980s and early-1990s. Automakers stopped building methanol FFVs by the late-1990s, switching their attention to ethanol-fueled vehicles. While the methanol FFV program was a technical success, rising methanol pricing in the mid- to late-1990s during a period of slumping gasoline pump prices diminished interest in methanol fuels.[73]
In the early 1970s, a process was developed by Mobil for producing gasoline fuel from methanol.[74]
Between the 1960s and 1980s methanol emerged as a precursor to the feedstock chemicals acetic acid and acetic anhydride. These processes include the Monsanto acetic acid synthesis, Cativa process, and Tennessee Eastman acetic anhydride process.
See also[edit]
- Aminomethanol
- Methanol (data page)
- Trimethyl carbinol
References[edit]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 692. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ballinger, P.; Long, F. A. (1960). «Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds». J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ «Methyloxonium». pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
- ^ «Methanolate». pubchem.ncbi.nlm.nih.gov. Retrieved 21 December 2018.
Methoxide is an organic anion that is the conjugate base of methanol. … It is a conjugate base of a methanol.
- ^ «RefractiveIndex.INFO – Refractive index database». refractiveindex.info.
- ^ González, Begoña (2007). «Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K». The Journal of Chemical Thermodynamics. 39 (12): 1578–1588. doi:10.1016/j.jct.2007.05.004.
- ^ a b c d «Methanol» (PDF). Lab Chem. Valtech. Retrieved 10 March 2016.
- ^ a b Toxicity on PubChem
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0397». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «Methanol». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c «The Emergency Response Safety and Health Database: Systematic Agent: METHANOL». Centers for Disease Control and Prevention. Retrieved 3 August 2018.
- ^ «PubChem: Safety and Hazards — GHS Classification». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ «Methanol Safe Handling Manual» (PDF). Methanol Institute. 2017. p. 253. Retrieved 3 August 2018.
- ^ «Technical Information & Safe Handling Guide for Methanol». Methanex Corporation. Archived from the original on 11 March 2012.
- ^ «Methanol Safe Handling Manual» (PDF). Methanol Institute. 2017. p. 243. Retrieved 3 August 2018.
- ^ National Institute for Occupational Safety and Health (22 August 2008). «The Emergency Response Safety and Health Database: Methanol». Retrieved 17 March 2009.
- ^ a b c Fiedler, E.; Grossmann, G.; Burkhard Kersebohm, D.; Weiss, G. and Witte, C. (2005). «Methanol». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_465. ISBN 978-3527306732.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Turner C (2006). «A longitudinal study of methanol in the exhaled breath of 30 healthy volunteers using selected ion flow tube mass spectrometry, SIFT-MS». Physiological Measurement. 27 (7): 637–48. Bibcode:2006PhyM…27..637T. doi:10.1088/0967-3334/27/7/007. PMID 16705261. S2CID 22365066.
- ^ Lindinger W (1997). «Endogenous production of methanol after the consumption of fruit». Alcoholism: Clinical and Experimental Research. 21 (5): 939–43. doi:10.1111/j.1530-0277.1997.tb03862.x. PMID 9267548.
- ^ «Major Source of Methanol in the Ocean Identified». Woods Hole Oceanographic Institution. 10 March 2016. Retrieved 30 March 2016.
- ^ Mincer, Tracy J.; Aicher, Athena C. (2016). «Methanol Production by a Broad Phylogenetic Array of Marine Phytoplankton». PLOS ONE. 11 (3): e0150820. Bibcode:2016PLoSO..1150820M. doi:10.1371/journal.pone.0150820. PMC 4786210. PMID 26963515.
- ^ Brooks Hays (17 April 2015). «Why astronomers hate the lawn-mowing Roomba». Space Daily.
- ^ «Upgraded MERLIN spies cloud of alcohol spanning 288 billion miles» (Press release). Jodrell Bank Centre for Astrophysics. 19 April 2006. Archived from the original on 20 July 2011.
- ^ Amos, Jonathan (5 April 2006). «Merlin sees vast alcohol stream». BBC News.
- ^ «First Detection of Methyl Alcohol in a Planet-forming Disc». Retrieved 22 June 2016.
- ^ a b Vale A (2007). «Methanol». Medicine. 35 (12): 633–4. doi:10.1016/j.mpmed.2007.09.014.
- ^ «Methanol Poisoning Overview». Antizol. Archived from the original on 5 October 2011.
- ^ «Integrated Risk Information System». US EPA, ORD, NCEA, IRISD. 15 March 2013.
- ^ «Toxicological Review of Methanol (Noncancer) (CAS No. 67-56-1) In Support of Summary Information on the Integrated Risk Information System (IRIS)» (PDF). EPA. September 2013. EPA/635/R-11/001Fa. Retrieved 30 March 2021.
- ^ Schep LJ, Slaughter RJ, Vale JA, Beasley DM (2009). «A seaman with blindness and confusion». BMJ. 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790. S2CID 6367081.
- ^ McMartin KE, Martin-Amat G, Noker PE, Tephly TR (1979). «Lack of a role for formaldehyde in methanol poisoning in the monkey». Biochem. Pharmacol. 28 (5): 645–9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- ^ Liesivuori J, Savolainen H (September 1991). «Methanol and formic acid toxicity: biochemical mechanisms». Pharmacol. Toxicol. 69 (3): 157–63. doi:10.1111/j.1600-0773.1991.tb01290.x. PMID 1665561.
- ^ Beauchamp, GA; Valento, M (September 2016). «Toxic Alcohol Ingestion: Prompt Recognition And Management in the Emergency Department». Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
- ^ Ferri, Fred F. (2016). Ferri’s Clinical Advisor 2017: 5 Books in 1. Elsevier Health Sciences. p. 794. ISBN 9780323448383.
- ^ Kruse, JA (October 2012). «Methanol and ethylene glycol intoxication». Critical Care Clinics. 28 (4): 661–711. doi:10.1016/j.ccc.2012.07.002. PMID 22998995.
- ^ Clary, John J. (2013). The Toxicology of Methanol. John Wiley & Sons. p. 3.4.1. ISBN 9781118353103.
- ^ «Hand Sanitizers COVID-19». U.S. Food and Drug Administration. 9 July 2020. Archived from the original on 9 July 2020.
- ^ «FDA updates hand sanitizers consumers should not use». U.S. Food and Drug Administration. 31 July 2020. Archived from the original on 1 August 2020.
- ^ Sunley, G. J.; Watson, D. J. (2000). «High productivity methanol carbonylation catalysis using iridium – The Cativa process for the manufacture of acetic acid». Catalysis Today. 58 (4): 293–307. doi:10.1016/S0920-5861(00)00263-7.
- ^ Olsbye, U.; Svelle, S.; Bjorgen, M.; Beato, P.; Janssens, T. V. W.; Joensen, F.; Bordiga, S.; Lillerud, K. P. (2012). «Conversion of Methanol to Hydrocarbons: How Zeolite Cavity and Pore Size Controls Product Selectivity». Angew. Chem. Int. Ed. 51 (24): 5810–5831. doi:10.1002/anie.201103657. hdl:2318/122770. PMID 22511469. S2CID 26585752.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Tian, P.; Wei, Y.; Ye, M.; Liu, Z. (2015). «Methanol to Olefins (MTO): From Fundamentals to Commercialization». ACS Catal. 5 (3): 1922–1938. doi:10.1021/acscatal.5b00007.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ «Pump The Movie Methanol Clip». YouTube. Retrieved 7 June 2022.
- ^ «Biodiesel – METHANOL INSTITUTE». METHANOL INSTITUTE. Retrieved 24 March 2018.
- ^ «Biodiesel Production Principles and Processes – eXtension». Retrieved 24 March 2018.
- ^ Evaluation of the Fate and Transport of Methanol in the Environment Archived 16 May 2016 at the Portuguese Web Archive, Malcolm Pirnie, Inc., January 1999.
- ^ «Methanol Wins». National Review. December 2011. Retrieved 7 June 2022.
- ^ «Methanol as a Marine Fuel». Methanex Corporation. Retrieved 10 April 2021.
- ^ Andersson, Karin; Márquez Salazar, Carlos (2015). Methanol as a Marine Fuel Report (PDF) (Report). FC Business Intelligence. Retrieved 10 April 2021.
- ^ «Methanol as an Industrial Boiler Fuel». Methanex Corporation. Retrieved 10 April 2021.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2008). «Miniaturized microDMFC using silicon microsystems techniques: Performances at low fuel flow rates» (PDF). Journal of Micromechanics and Microengineering. 18 (12): 125019. Bibcode:2008JMiMi..18l5019K. doi:10.1088/0960-1317/18/12/125019. S2CID 110214840.
- ^ Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2011). «Microfabricated microfluidic fuel cells». Sensors and Actuators B: Chemical. 154 (2): 174. doi:10.1016/j.snb.2009.11.014.
- ^ Berger, Sandy (30 September 2006). «Methanol Laptop Fuel». Compu·Kiss. Retrieved 22 May 2007.
- ^ Blum, Deborah (19 February 2010). «The little-told story of how the U.S. government poisoned alcohol during Prohibition». Slate Magazine. Retrieved 10 June 2010.
- ^ «22 USC Ch. 75: CHEMICAL WEAPONS CONVENTION IMPLEMENTATION». uscode.house.gov.
- ^ Yant, W. P.; Schrenk, H. H.; Sayers, R. R. (1931). «Methanol Antifreeze and Methanol Poisoning». Industrial & Engineering Chemistry. 23 (5): 551. doi:10.1021/ie50257a020.
- ^ «EUR-Lex – 32018R0589 – EN – EUR-Lex». eur-lex.europa.eu. Retrieved 28 November 2018.
- ^ «Corrigendum to Commission Regulation (EU) 2018/589 of 18 April 2018 amending Annex XVII to Regulation (EC) No 1907/2006 of the European Parliament and of the Council concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) as regards methanol (OJ L 99, 19.4.2018)». 23 April 2018. Retrieved 7 July 2020.
- ^ «Annex XV Restriction Report: Proposal For a Restriction Substance Name: Methanol – table D.1-4-page 79». 16 January 2015.
- ^ Deutschmann, Olaf; Knözinger, Helmut; Kochloefl, Karl and Turek, Thomas (2012) «Heterogeneous Catalysis and Solid Catalysts, 3. Industrial Applications» in Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.o05_o03
- ^ Bozzano, Giulia; Manenti, Flavio (2016). «Efficient methanol synthesis: Perspectives, technologies and optimization strategies». Progress in Energy and Combustion Science. 56: 76. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ Mu-Hyun Baik, Martin Newcomb, Richard A. Friesner, Stephen J. Lippard (2003). «Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase». Chem. Rev. 103 (6): 2385–2420. doi:10.1021/cr950244f. PMID 12797835.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b Lawton, T. J.; Rosenzweig, A. C. (2016). «Biocatalysts for methane conversion: big progress on breaking a small substrate». Curr. Opin. Chem. Biol. 35: 142–149. doi:10.1016/j.cbpa.2016.10.001. PMC 5161620. PMID 27768948.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Alayon, E. M. C.; Nachtegaal, M.; Ranocchiari, M.; Van Bokhoven, J. A. (2012). «Catalytic Conversion of Methane to Methanol Using Cu-Zeolites». CHIMIA International Journal for Chemistry. 66 (9): 668–674. doi:10.2533/chimia.2012.668. PMID 23211724.
- ^ Hammond, C.; Jenkins, R. L.; Dimitratos, N.; Lopez-Sanchez, J. A.; Ab Rahim, M. H.; Forde, M.M.; Thetford, A.; Murphy, D.M.; Hagen, H.; Stangland, E.E.; Moulijn, J.M.; Taylor, S. H.; Willock, D. J.; Hutchings, G.J. (2012). «Catalytic and Mechanistic Insights of the Low-Temperature Selective Oxidation of Methane over Cu-Promoted Fe-ZSM-5». Chemistry: A European Journal. 18 (49): 15735–45. doi:10.1002/chem.201202802. PMID 23150452.
- ^ Snyder, Benjamin E. R.; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (19 December 2017). «Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes». Chemical Reviews. 118 (5): 2718–2768. doi:10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^ Snyder, Benjamin E. R.; Vanelderen, Pieter; Bols, Max L.; Hallaert, Simon D.; Böttger, Lars H.; Ungur, Liviu; Pierloot, Kristine; Schoonheydt, Robert A.; Sels, Bert F. (2016). «The active site of low-temperature methane hydroxylation in iron-containing zeolites». Nature. 536 (7616): 317–321. Bibcode:2016Natur.536..317S. doi:10.1038/nature19059. PMID 27535535. S2CID 4467834.
- ^ Stavrakou, T.; Guenther, A.; Razavi, A.; Clarisse, L.; Clerbaux, C.; Coheur, P.-F.; Hurtmans, D.; Karagulian, F.; De Mazière, M.; Vigouroux, C.; Amelynck, C.; Schoon, N.; Laffineur, Q.; Heinesch, B.; Aubinet, M. (25 May 2011). «First space-based derivation of the global atmospheric methanol emission fluxes». Atmospheric Chemistry and Physics. 11 (10): 4873–4898. Bibcode:2011ACP….11.4873S. doi:10.5194/acp-11-4873-2011. ISSN 1680-7324. S2CID 54685577.
- ^ a b Bozzano, Giulia; Manenti, Flavio (1 September 2016). «Efficient methanol synthesis: Perspectives, technologies and optimization strategies». Progress in Energy and Combustion Science. 56: 71–105. doi:10.1016/j.pecs.2016.06.001. ISSN 0360-1285.
- ^ Boyle discusses the distillation of liquids from the wood of the box shrub in: Robert Boyle, The Sceptical Chymist (London, England: J. Cadwell, 1661), pp. 192–195.
- ^ a b A report on methanol to the French Academy of Sciences by J. Dumas and E. Péligot began during the Academy’s meeting of 27 October 1834 and finished during the meeting of 3 November 1834. See: Procès-verbaux des séances de l’Académie, 10 : 600–601. Available on: Gallica. The complete report appears in: J. Dumas and E. Péligot (1835) «Mémoire sur l’espirit de bois et sur les divers composés ethérés qui en proviennent» (Memoir on spirit of wood and on the various ethereal compounds that derive therefrom), Annales de chimie et de physique, 58 : 5–74; from page 9: Nous donnerons le nom de méthylène (1) à un radical … (1) Μεθυ, vin, et υλη, bois; c’est-à-dire vin ou liqueur spiritueuse du bois. (We will give the name methylene (1) to a radical … (1) methy, wine, and hulē, wood; that is, wine or spirit of wood.)
- ^ For a report on the International Conference on Chemical Nomenclature that was held in April 1892 in Geneva, Switzerland, see:
- Armstrong, Henry E (1892). «The International Conference on Chemical Nomenclature». Nature. 46 (1177): 56–9. Bibcode:1892Natur..46…56A. doi:10.1038/046056c0.
- Armstrong’s report is reprinted with the resolutions in English in: Armstrong, Henry (1892). «The International Conference on Chemical Nomenclature». The Journal of Analytical and Applied Chemistry. 6 (1177): 390–400. Bibcode:1892Natur..46…56A. doi:10.1038/046056c0.
p. 398: 15. The alcohols and the phenols are named after the hydrocarbon from which they derive, terminated with the suffix ol (ex. pentanol, pentenol, etc.).
- ^ Halderman, James D.; Martin, Tony (2009). Hybrid and alternative fuel vehicles. Pearson/Prentice Hall. ISBN 978-0-13-504414-8.
- ^ Ronald Smith (1 December 2011). «Methanol to Gasoline: A Private Report by the Process Economics Program» (PDF). Retrieved 4 December 2019.
Further reading[edit]
- Robert Boyle, The Sceptical Chymist (1661) – contains account of distillation of wood alcohol.
External links[edit]
- International Chemical Safety Card 0057
- Methyl Alcohol (Methanol) CDC/NIOSH, links to safety information
- CDC – NIOSH Pocket Guide to Chemical Hazards – Methyl Alcohol
- Methanol Fact Sheet – National Pollutant Inventory



Имена и идентификаторы |
| наименование товара | метанол |
| Синонимы | МЕТИЛ КРАСНЫЙ СМЕШАННЫЙ РАСТВОР; МЕТИЛ КРАСНЫЙ СМЕШАННЫЙ РАСТВОР R; МЕТИЛ КРАСНЫЙ СМЕШИВАНИЕ R; МЕТИЛ КРАСНЫЙ ИНДИКАТОР; МЕТИЛ КРАСНЫЙ ЭТАНОЛ; |
| Номер CAS Registry | 67-56-1 |
| Молекулярная формула | CH4O |
| Молекулярная масса | 32.04 |
| EINECS | 200-659-6 |
| Другие номера реестра | ; |
| Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д.: | Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д. |
 |
Химические и физические свойства
| Температура плавления | -98 ° C (лит.) |
| Точка кипения | 65.4 ° C (лит.) |
| Плотность | 0.791 г / мл при 25 ° C |
| плотность пара | 1.11 (против воздуха) |
| давление газа | 410 мм рт.ст. (50 ° C) |
| Показатель преломления | n20 / Д 1.329 (светится.) |
| Точка возгорания | 52 ° F |
| СХД | Хранить при комнатной температуре. |
| Solubulity | бензол: смешиваемый (лит.) |
| ПКА | 15.2 (при 25 ℃) |
| форма | Жидкость без частиц |
| цвет | <10 (APHA) |
| Относительная полярность | 0.762 |
| Предел взрываемости | 5.5-44% (V), |
| Растворимость воды | смешивающийся |
| Merck | 14,5957 |
| BRN | 1098229 |
| Дополнительные свойства от PubChem | Топологическая полярная поверхность, моноизотопная масса и т. Д. |
| Справочник по химии NIST | Метиловый спирт (67-56-1) |
| Система регистрации веществ EPA | Метанол (67-56-1) |
| Коды опасности | Х, Т, Р |
| R-фраза | 10-20/21/22-68/20/21/22-39/23/24/25-23/24/25-11-40-36-36/38-23/25 |
| S Фраза | 36/37-7-45-16-24/25-23-24-26 |
| RIDADR | UN 1170 3 / PG 2 |
| WGK Германия | 1 |
| RTECS | PC1400000 |
| F | 3-10 |
| ЗКТВ | Да |
| Класс хранения | 3 |
| Группа упаковки | II |
| Данные о вредных веществах | 67-56-1 (данные о вредных веществах) |
Литература |
Патенты |
Транспортировка, хранение и использование |
| Применение | Нет информации |
Спектральные свойства |
Утвержденные производители | |
| Хотите, чтобы вас указали в списке одобренных производителей (бесплатное обслуживание, но требуется одобрение)? | Пожалуйста, скачайте и заполните эта форма и отправить обратно одобренные производители@chemwhat.com |
Свяжитесь с нами для получения другой помощи | |
| Свяжитесь с нами для получения других услуг, таких как передача технологий, синтетическая литература, поиск поставщиков, реклама и т. Д. | Нажмите здесь, чтобы связаться ChemWhat |
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Отдельно следует отметить увеличение индикаторного КПД при работе классического ДВС на метаноле по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха с топливом | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Недостатки
- Метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырцу, содержащему значительные количества примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащий воду, начинает реагировать с алюминием при температуре выше 50 °C, а с обычной углеродистой сталью не реагирует вовсе.
- Гидрофильность. Метанол втягивает воду, что является причиной расслоения топливных смесей бензин-метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, могут иметь проблемы с запуском при температуре ниже +10 °C и отличаться повышенным расходом топлива до достижения рабочей температуры. Данная проблема однако, легко решается добавлением в метанол 10—25 % бензина.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.

Свойства метанола и его реакции
Метанол — бесцветная жидкость с алкогольным запахом (запах этилового спирта). Температура кипения +64,7 °C.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4∙7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
| Молярная доля метанола % | Т кип. °C, 760 мм. рт. ст. |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2CH3OH; LiCl ∙ 3CH3OH; MgCl2 ∙ 6CH3OH; CaCl2 ∙ 4CH3OH представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение BaO ∙ 2CH3OH ∙ 2H2O получается в виде блестящих призм при растворении BaO в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Геттиг). При действии металлических калия и натрия легко даёт алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накалённую трубку получается C2H2 и другие продукты (Бертло). При пропускании паров метанола над накалённым цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2CH3OH+O2=2HCHO+2H2O. При действии хлористого цинка и высокой температуры метанол даёт воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырём в запаянной трубке до 300°, даёт моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно формиат, ацетат и, наконец, карбонат калия.
Концентрированная серная кислота даёт метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с метанолом даёт метиловый эфир. При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы даёт хлористый метил CH3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол даёт CO2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль CH2(OCH3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Нахождение в природе
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты C6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты C6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Токсичность

Метанол — опаснейший яд, приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению (одно из последствий — слепота), попадание в организм более 80-150 миллилитров метанола (1-2 миллилитра чистого метанола на килограмм тела) обычно смертельно. LD50 для животных — от единиц до десятка г/кг. Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред. Опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
В США максимальное допустимое суточное употребление метанола (референтная доза), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³ (у изопропилового спирта 10 мг/м³, у этанола — 1000 мг/м³), ПДК в воздухе населенных мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³).
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ жёлтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола).
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев.
Массовые отравления метанолом
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей, контрафактный алкоголь, метанол, выдаваемый за этиловый спирт.
- Массовое отравление метанолом в Испании в начале 1963 года; официальное число погибших 51 человек, однако существуют оценки в диапазоне от 1000 до 5000 человек.
- Массовое отравление метанолом в Бангалоре (Индия) в июле 1981 года. Число погибших — 308 человек.
- Массовое отравление вином с добавкой метанола в Италии весной 1986 года; погибли 23 человека.
- Массовое отравление метанолом в Сальвадоре в октябре 2000 года вызвало смерть 122 человек. Власти подозревали теракт, поскольку в спиртных напитках на заводах-производителях метанол при расследовании инцидента не был выявлен.
- Массовое отравление метанолом 9—10 сентября 2001 года в городе Пярну (Эстония); 68 человек погибли.
- Массовое отравление метанолом в Чехии, Польше и Словакии в сентябре 2012 года; 51 человек погиб.
- Массовое отравление метанолом 17-20 декабря 2016 года в Иркутске (Россия). Число погибших — 78 человек.
| Спирты | |
|---|---|
| (0°) | Метанол |
| Первичные спирты (1°) | Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол · Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метилбутан-2-ол |
| Основные виды органического топлива | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
| ||||||||
| Возобновляемое и биологическое |
| ||||||||
| Искусственное |
|
| Метанол | |
|---|---|
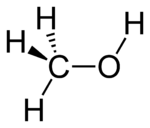 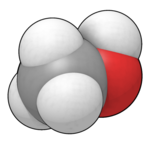 | |
| Общие свойства | |
| Молекулярная формула | CH3OH |
| Молярная масса | 32,04 г/моль |
| Внешний вид | бесцветная жидкость |
| Номер CAS | [67-56-1] |
| Свойства | |
| Плотность и агрегатное состояние | 791,8 кг/м³, жидкость |
| Растворимость в воде | Полностью растворим |
| Температура плавления | −97 °C (176,15 K) |
| Температура кипения | 64,7 °C (337,85 K) |
| Тройная точка | −97,7 °C (175,45 K), ? бар |
| Критическая точка | 240 °C (513,15 K), 78.5 бар |
| pKa | ~15,5 |
| Вязкость | 0,59 Пз при 20 °C |
| Поверхностное натяжение | 22,5•10-3 Н/м при 20 °C |
| Строение | |
| Форма молекулы | Тетраэдр с изгибом |
| Дипольный момент | 1,69 D (газ) |
| Опасность | |
| Температура вспышки | 11 °C |
| Температура самовоспламенения | 436 °C (709,15 K) |
| Пределы взрываемости | 6,72 — 36,5 % |
| Родственные соединения | |
| Родственные спирты | Этанол Бутанол |
| Другие соедининия | Диметиловый эфир Метилхлорид |
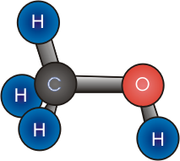
Метанол
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом образует взрывоопасные смеси (температура вспышки 11 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Содержание
- 1 Получение
- 2 Применение
- 2.1 Биометанол
- 3 Метанол в качестве топлива
- 4 Свойства М. спирта и его реакции.
- 5 Здравоохранение
- 6 Интересные факты
- 7 См. также
- 8 Примечания
- 9 Ссылки
- 10 Примечания
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400°С и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300°С и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H2) при следующих условиях:
- температура — 250 °C,
- давление — 7МПа (= 70 Бар = 71,38 кгс/см²),
- катализатор — смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
CO2 + 3H2 <—> CH3OH + H2O + 49.53 кДж/моль
H2O + CO <—> CO2 + H2 + 41.2 кДж/моль
Молекулярная формула — CH4O или CH3—OH, а структурная: 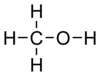 В настоящее время метиловый спирт добывают синтетическим способом из монооксида углерода и водорода при температуре 300—400°С и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: :CO + 2 H2 → CH3OH[1]
В настоящее время метиловый спирт добывают синтетическим способом из монооксида углерода и водорода при температуре 300—400°С и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: :CO + 2 H2 → CH3OH[1]
Производство метанола (в тыс. тон):
| год | США | Германия | Мир | Продажная цена ($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | нет данных | нет данных |
| 1936 | 97 | 93 | нет данных | нет данных |
| 1950 | 360 | 120 | нет данных | нет данных |
| 1960 | 892 | 297 | нет данных | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида и формалина, уксусной кислоты, ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокой скорости распространения пламени воздушной смеси и высокой теплоте испарения используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде и при его окислении образуется двуокись углерода и вода:
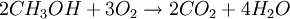
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основаны на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Реакции:
На аноде CH3OH + H2O → CO2 + 6H+ + 6e—
На катоде 1.5O2 + 6H+ + 6e— → 3H2O
Общая для топливного элемента: CH3OH + 1,5O2 → CO2 + 2H2O
Получение муравьиной кислоты окислением метанола:

Получение диметилового эфира дегидратацией метанола при 300-400 °С и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60% или цеолитов — селективность процесса близка к 100%. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90% меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол). 
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15%, в Польше — 5%. В России в среднем составе бензинов содержание МТБЭ составляет до 12% для АИ92 и до 15% для АИ95, АИ98.
Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива.[2]
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
- высокая продуктивность фитопланктона (до 100 т/га в год);
- в производстве не используются ни плодородные почвы, ни пресная вода;
- процесс не конкурирует с сельскохозяйственным производством;
- энергоотдача процесса достигает 14 на стадии получения метана и 7 на стадии получения метанола;
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объемная и массовая энергоемкость (теплота сгорания) метанола на 40-50% меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого рост мощности двигателя повышается на 10-15%. Двигатели гоночных автомобилей работающих на метаноле с более высоким октановым числом чем бензин имеют степень сжатия, превышающую 15:1, в то время как в обычном карбюраторном ДВС степень сжатия для неэтилированного бензина как правило не превышает 10.1:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Недостатки:
- метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС.
- гидрофильность. Метанол втягивает воду, что является причиной засорения систем подачи топлива в виде желеобразных ядовитых отложений.
- метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к повышению концентрации озона и возможно усилению солнечной радиации.
- уменьшенная летучесть при холодной погоде: Моторы, работающие на метаноле могут иметь проблемы с запуском и отличатся повышенным расходом топлива до достижения рабочей температуры.
- метанол может сравнительно быстро попасть в источники питьевой воды и отравить её. Этот сценарий исследован пока недостаточно, но к сожалению существует опыт утечки Метил-трет-бутилового эфира и загрязнения воды.
Свойства М. спирта и его реакции.
М. спирт есть бесцветная жидкость с запахом, напоминающим запах этилового спирта. Температура кипения 66,78° (Renault); 64,8° (Vincent и Delachanal); 65,75-66,25° (Grodzki и Kr ä mer); 65,8-66° (Perkin); 64,96° при 760 мм (Dittmar и Fawsitt); 64,8° при 763 мм (Schiff). Удельный вес при 0°/0° = 0,8142 (Kopp); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Schiff); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a 2 =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн). М. спирт смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. В крепких водных растворах М. спирт, принятый внутрь, ядовит. Безводный М. спирт, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в М. спирте; но он не растворяет CuSO 4.7H2 O (Клепль). М. спирт дает со многими солями соединения, подобные кристаллогидратам, например: CuSO 4.2СН 3 ОН; LiCl.3СН 3 ОН; MgCl 2.6СН 3 ОН; CaCl 2.4СН 3 ОН представляет собой шестисторонние таблицы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО.2СН 3 ОН.2Н 2 О получается в виде блестящих призм при растворении ВаО в водном М. спирте и испарении на холоде полученной жидкости при комнатной температуре (Форкранд). С едкими щелочами М. спирт образует соединения 5NaOH.6СН 3 ОН; 3KOH.5СН 3 OH (Геттиг). При действии металлических калия и натрия легко дает алкоголяты, присоединяющие к себе кристаллизационный М. спирт и иногда воду. При пропускании паров М. спирта через докрасна накаленную трубку получается C 2H2 и др. продукты (Бертело). При пропускании паров М. спирта над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров М. спирта при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН 3 ОН+О 2 =2НСНО+2Н 2 О. При действии хлористого цинка и высокой температуры М. спирт дает воду и углеводороды формулы С n Н 2n+2, а также небольшие количества гексаметилбензола (Лебедь и Грин). М. спирт, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертело). С белильной известью не дает хлороформа (Гольдберг). При пропускании паров М. спирта над едким кали при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий; концентрированная серная кислота дает метилсерную кислоту CH 3HSO4, которая при дальнейшем нагревании с М. спиртом дает метиловый эфир (см.). При перегонке М. спирта с избытком серной кислоты в отгон переходит диметилсерная кислота (CH 3)2SO4. При действии серного ангидрида SO 3 получается CH(OH)(SO 3H)2 и CH 2(SO3H)2 (см. Метилен). М. спирт при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН 3 Cl. Действием HBr и H 2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, М. спирт дает СО 2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН 2 (ОСН 3)2 (Ренар). При нагревании М. спирта с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и др. искусственных пигментов.
Здравоохранение

Метанол — яд, действующий на нервную и сосудистую системы. Токсическое действие метанола обусловлено так называемым «летальным синтезом» — метаболическим окислением в организме до очень ядовитого формальдегида. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению (одно из последствий — слепота), а 30 мл и более — к смерти.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи употребления метанола внутрь.
Как указано в электронном справочном руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки.[3] Полезный эффект в этом случае обеспечивается отвлечением АДГ I на окисление экзогенного этанола.[4]
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.[3]
Интересные факты
Изабелла американский сорт винограда. В последнее время, под предлогом о повышенном содержаниии метанола в винах, получаемых из данного сорта, запрещен к использованию в коммерческом виноделии в США и странах Евросоюза. Вероятная причина запрета — очень дешевые в производстве вина по сравнению с винами из винограда столовых сортов.
См. также
Гидрат метана
Экономика метанола
Железо- Комплексы железа, встречаются, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Примечания
- ↑ Рябчиков (1953 г.), «Общая химия», стр.253
- ↑ Waganer K. Mariculture on land. — Biomass, 1981
- ↑ 1 2 Острые отравления — Электронное справочное руководство для врача скорой медицинской помощи. Глава 15
- ↑ [1]
Ссылки
- Метанол убивает человека и природу (статья на сайте экологический правозащитного центра «Беллона»)
- ГОСТ 2222-95 «Метанол технический» (взамен ГОСТ 2222-78)
Примечания
| Порох | 3.8·106 [2] |
| Торф | 8.1·106 [1], 15·106 [4] |
| Дрова (березовые, сосновые) | 10.2·106 [1] |
| Бурый уголь | 15·106 [1], 14,7·106 [4] |
| Бытовой газ | 13.25·106 [3] |
| Каменный уголь | 22·106 [1], 29,3·106 [4] |
| Спирт этиловый | 25·106 [4] |
| Метанол | 22.7·106 [4] |
| Условное топливо | 29.308·106 (7000 ккал/кг) [1] |
| Древесный уголь | 31·106 [4] |
| Метан | 50.1·106 [3] |
| Мазут | 39.2·106 [1] |
| Дизельное топливо | 42.7·106 [4] |
| Нефть | 41·106 [4] |
| Бензин | 44·106 [1], 42·106 [4] |
| Керосин | 40,8·106 [4] |
| Этилен | 48.0·106 [3] |
| Пропан | 47.54·106 [3] |
| Водород | 120.9·106 [3] |
| Спирты | |
|---|---|
| (0°) | Метанол |
| Первичные спирты (1°) | Этанол · Пропанол · Бутиловый спирт/Изобутанол · Пентанол · Гексанол · Гептанол Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · 2-Бутанол · 2-Гексанол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метил-2-бутанол |
Wikimedia Foundation.
2010.
Метанол
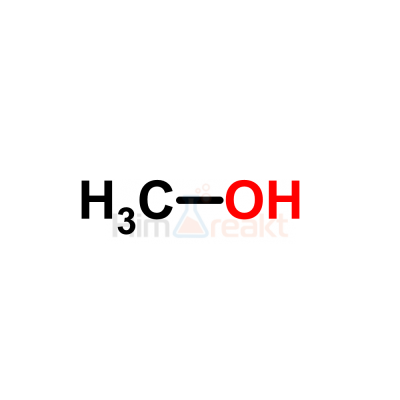
Артикул: 67-56-1
Производитель: Не указано
Основное описание
Идентификация
- Название
- Метанол
- Синонимы
- метиловый спирт; карбинол;
- Регистрационный номер CAS
- 67-56-1
- Молекулярная формула
- CH4O
- Молекулярный вес
- 32.05
- InChI
- InChI=1S/CH4O/c1-2/h2H,1H3
- InChIKey
- OKKJLVBELUTLKV-UHFFFAOYSA-N
- SMILES
- CO
- EINECS
- 200-659-6
Химические и физические свойства
- Плотность
- 0.7918 г/см3
- Точка кипения
- 48.1°C при 760 мм рт. ст.
- Точка плавления
- -98°C
- Температура вспышки
- 11.1°C
- Температура хранения
- Хранить при комнатной температуре.
- Показатель преломления
- 1.328-1.330
- Растворимость
- Смешивается с водой.
- Стабильность
- Может разлагаться под воздействием влажного воздуха или воды.
- Внешний вид
- Прозрачная бесцветная жидкость.
Риски, безопасность и условия использования
- Указания по безопасности
- 36/37-7-45-16-24/25-23-24
- Указания по риску
- R11; R23/24/25; R39/23/24/25
- Класс опасности
- 3
- Символы опасности
Классификация химических реактивов
- Чистый («ч.»)
- Метанол Ч. Содержание основного компонента 98% и выше (без примесей). Цвет полосы на упаковке — зелёный.
- Чистый для анализа («ч.д.а.», «чда»)
- Метанол ЧДА. Содержание основного компонента выше или значительно выше 98%. Примеси не превышают допустимого предела для точных аналитических исследований. Цвет полосы на упаковке — синий.
- Химически чистый («х.ч.», «хч»)
- Метанол ХЧ. Содержание основного компонента более 99%. Цвет полосы на упаковке — красный.
- Особо чистый («осч»)
- Метанол ОСЧ. Cодержание примесей в таком незначительном количестве, что они не влияют на основные свойства. Цвет полосы на упаковке — жёлтый.
Форма запроса
Чтобы купить метанол, отправьте запрос
Простейший спирт, также известный как метиловый спирт и древесный спирт
| ||
| ||
 | ||
| Имена | ||
|---|---|---|
| Произношение | ||
| Предпочтительное название ИЮПАК Метанол | ||
| Другие названия Карбинол. Колумбийский спирт. Гидроксиметан. МеОН. Метиловый спирт. Метилгидроксид. Метиловый спирт. Метилол. Метиленгидрат. Пирогенный спирт. Древесный спирт. Древесная нафта. Древесный спирт | ||
| Идентификаторы | ||
| Номер CAS |
| |
| 3D-модель ( JSmol ) |
| |
| 3DMet |
| |
| Ссылка Beilstein | 1098229 | |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| ECHA InfoCard | 100.000.599 | |
| Номер ЕС |
| |
| Справочник Gmelin | 449 | |
| KEGG |
| |
| MeSH | Метанол | |
| PubChem CID |
| |
| Номер RTECS |
| |
| UNII |
| |
| Номер ООН | 1230 | |
| Панель управления CompTox (EPA ) |
| |
InChI
| ||
УЛЫБКИ
| ||
| Свойства | ||
| Химическая формула | CH. 3OH или CH. 4O | |
| Молярная масса | 32,04 г моль | |
| Внешний вид | Бесцветная жидкость | |
| Запах | Сладкий и острый | |
| Плотность | 0,792 г / см | |
| Температура плавления | -97,6 ° C (-143,7 ° F; 175,6 K) | |
| Температура кипения | 64,7 ° C (148,5 ° F; 337,8 K) | |
| Растворимость в воде | смешиваемый | |
| log P | -0,69 | |
| Давление пара | 13,02 кПа (при 20 ° C) | |
| Кислотность (pK a) | 15,5 | |
| Конъюгированная кислота | Метилоксоний | |
| Основание конъюгата | Метанолат | |
| Магнитная восприимчивость (χ) | -21,40 · 10 см / моль | |
| Показатель преломления (nD) | 1,33141 | |
| Вязкость | 0,545 мПа · с (при 25 ° C) | |
| Дипольный момент | 1,69 D | |
| Опасности | ||
| Основные опасности | Метанол и его пары легко воспламеняются. Умеренно Токсичность для мелких животных — Высокая Токсичность для крупных животных и людей — Может быть смертельной / летальный или вызывает слепоту и повреждение печени, почек и сердца при проглатывании — Токсичность от многократного чрезмерного воздействия накапливается в центральной нервной системе, особенно на зрительный нерв — Симптомы могут проявляться с задержкой, становиться тяжелыми через 12-18 часов и задерживаться в течение нескольких дней после воздействия | |
| Паспорт безопасности | См.: страница данных. [1] | |
| Пиктограммы GHS |    | |
| Сигнальное слово GHS | Опасно | |
| Краткая характеристика опасности GHS | H225, H301, H311, H331, H370 | |
| Меры предосторожности GHS | P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301 + 330 + 331, P310, P302 + 352, P312, P303 + 361 + 353, P304 + 340, P311, P305 + 351 + 338, P307 + 311, P337 + 313, P361, P363, P370 + 378, P403 + 233 | |
| NFPA 704 (огненный алмаз) |  3 1 0 3 1 0 | |
| Температура вспышки | от 11 до 12 ° C (от 52 до 54 ° F; От 284 до 285 K) | |
| Самовоспламенение. Температура | 470 ° C (878 ° F; 743 K). 385 ° C (725 ° F; 658 K) | |
| Пределы взрываемости | 6–36% | |
| Смертельная доза или концентрация (LD, LC): | ||
| LD50(средняя доза ) | 5628 мг / кг (крыса, перорально). 7300 мг / кг (мышь, перорально). 12880 мг / кг (крыса, перорально). 14200 мг / кг (кролик, перорально) | |
| LC50(средняя концентрация ) | 64000 частей на миллион (крыса, 4 часа) | |
| LCLo(самая низкая опубликованная ) | 33,082 частей на миллион (кошка, 6 часов). 37,594 ppm (мышь, 2 часа) | |
| NIOSH (пределы воздействия на здоровье в США): | ||
| PEL (допустимое) | TWA 200 ppm (260 мг / м) | |
| REL (рекомендуется) | TWA 200 ppm (260 мг / м) ST 250 ppm (325 мг / м) [кожа] | |
| IDLH (непосредственная опасность) | 6000 частей на миллион | |
| Родственные соединения | ||
| Родственные соединения | Метантиол. Силанол. Этанол | |
| Страница дополнительных данных | ||
| Структура и. свойства | Показатель преломления ( n),. Диэлектрическая проницаемость (εr) и т. д. | |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ | |
| Спектральные данные | UV, IR, ЯМР, MS | |
| За исключением случаев, когда Следует отметить, что данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки в ink | ||
Метанол, также известный как метиловый спирт среди других названий, является химическим веществом с формулой C H 3O H (метил группа, связанная с гидроксильной группой, часто сокращенно MeOH). Это легкая, летучая, бесцветная, легковоспламеняющаяся жидкость с характерным спиртовым запахом, аналогичным запаху этанола. Полярный растворитель, метанол, получил название древесный спирт, потому что когда-то он производился главным образом деструктивной перегонкой древесины. Сегодня метанол в основном производят в промышленных масштабах путем гидрирования моноксида углерода.
. Метанол состоит из метильной группы, связанной с гидроксильной группой. Производя более 20 миллионов тонн в год, он используется в качестве прекурсора для других товарных химикатов, включая формальдегид, уксусную кислоту, метил-трет- бутиловый эфир, а также множество более специализированных химикатов.
Содержание
- 1 Происхождение
- 1.1 Межзвездная среда
- 2 Токсичность
- 3 Применения
- 3.1 Формальдегид, уксусная кислота, метил-трет-бутиловый эфир
- 3.2 Превращение метанола в углеводороды, олефины, бензин
- 3.3 Присадка к бензину
- 3.4 Другие химические вещества
- 3.5 Ниша и потенциальное использование
- 3.5.1 Энергоноситель
- 3.5.2 Топливо для транспортных средств
- 3.5.3 Другие применения
- 4 Производство
- 4.1 Из синтез-газа
- 4.2 Биосинтез
- 5 Безопасность
- 6 Спецификации качества и анализ
- 7 История
- 8 См. также
- 9 Ссылки
- 10 Дополнительная литература
- 11 Внешние ссылки
Возникновение
Небольшие количества метанола присутствуют у нормальных, здоровых людей. Одно исследование показало, что средний показатель выдыхаемого воздуха испытуемых составлял 4,5 ppm. Среднее значение эндогенного метанола у людей 0,45 г / день может метаболизироваться из пектина, обнаруженного во фруктах; один килограмм яблока производит до 1,4 г метанола.
Метанол производится анаэробными бактериями и фитопланктоном.
Межзвездная среда
Также обнаруживается метанол в больших количествах в областях звездообразования в космосе и используется в астрономии как маркер для таких областей. Он обнаруживается по его спектральным эмиссионным линиям.
В 2006 году астрономы с помощью массива радиотелескопов MERLIN в обсерватории Джодрелл-Бэнк обнаружили большое облако метанола в космосе., 288 миллиардов миль (463 миллиарда км) в поперечнике. В 2016 году с помощью радиотелескопа ALMA астрономы обнаружили метанол в планетообразующем диске вокруг молодой звезды TW Hydrae.
Токсичность
Проглатывание как всего 10 мл (0,34 жидких унций США) чистого метанола может вызвать необратимую слепоту из-за разрушения зрительного нерва. 30 мл (1,0 жидких унций США) потенциально смертельны. Средняя смертельная доза составляет 100 мл (3,4 жидких унций США), то есть 1-2 мл / кг массы тела чистого метанола. эталонная доза для метанола составляет 0,5 мг / кг в день. Токсические эффекты начинаются через несколько часов после приема внутрь, и антидоты часто могут предотвратить необратимое повреждение. Из-за его сходства как по внешнему виду, так и по запаху с этанолом (спирт в напитках), трудно провести различие между ними; то же самое касается денатурированного спирта, фальсифицированных спиртных напитков или алкогольных напитков очень низкого качества.
Метанол токсичен по двум причинам. Во-первых, метанол может быть фатальным из-за воздействия на центральную нервную систему, действуя как депрессант центральной нервной системы таким же образом, как отравление этанолом. Во-вторых, в процессе отравления он метаболизируется до муравьиной кислоты (которая присутствует в виде формиат-иона) через формальдегид в процесс, инициированный ферментом алкогольдегидрогеназой в печени. Метанол превращается в формальдегид через алкогольдегидрогеназу (ADH), а формальдегид превращается в муравьиную кислоту (формиат) через альдегиддегидрогеназу (ALDH). Преобразование в формиат с помощью ALDH происходит полностью, без обнаруживаемого формальдегида. Формиат токсичен, потому что он ингибирует митохондриальную цитохром с оксидазу, вызывая гипоксию на клеточном уровне и метаболический ацидоз среди множества других метаболических нарушений.
Вспышки отравления метанолом произошли в основном из-за заражения употребления алкоголя. Это чаще встречается в развивающемся мире. Тем не менее, в 2013 году в США было зарегистрировано более 1700 случаев. Часто страдают взрослые мужчины. При раннем лечении результаты могут быть хорошими. Токсичность по отношению к метанолу была описана еще в 1856 году.
Из-за своих токсичных свойств метанол часто используется в качестве денатурирующей добавки для этанола, производимого для промышленных целей. Это добавление метанола освобождает промышленный этанол (обычно известный как «денатурированный спирт » или «метилированный спирт») от уплаты акцизного налога на спиртные напитки в США и некоторых других странах.
Во время пандемии COVID-19 США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов обнаружило ряд продаваемых дезинфицирующих средств для рук, которые были отмечены как содержащие этанол, но оказались положительными на загрязнение метанолом. Из-за токсического действия метанола при всасывании через кожу или проглатывании, в отличие от относительно более безопасного этанола, FDA распорядилось отозвать такие дезинфицирующие средства для рук, содержащие метанол, и выпустило предупреждение об импорте, чтобы предотвратить незаконный выход этих продуктов на рынок США..
Области применения
Формальдегид, уксусная кислота, метил-трет-бутиловый эфир
Метанол в основном преобразуется в формальдегид, который широко используется во многих областях, особенно полимеры. Превращение влечет за собой окисление:
- 2 CH 3 OH + O 2 → 2 CH 2 O + 2 H 2O
Уксусная кислота может производиться из метанола.
 Процесс Cativa превращает метанол в уксусную кислоту.
Процесс Cativa превращает метанол в уксусную кислоту.
Метанол и изобутен объединяются с получением метил-трет-бутилового эфира (MTBE). МТБЭ является основным усилителем октанового числа бензина.
Метанол в углеводороды, олефины, бензин
Конденсация метанола с получением углеводородов и даже ароматических систем является основой нескольких технологий, связанных с газ в жидкости. К ним относятся превращение метанола в углеводороды (MTH), из метанола в бензин (MTG), из метанола в олефины (MTO) и из метанола в пропилен (MTP). Эти превращения катализируются цеолитами как гетерогенными катализаторами. Процесс MTG когда-то был коммерциализирован на Motunui в Новой Зеландии.
Добавка к бензину
Позволяет производителям топлива смешивать до 3% метанола с таким же количеством сорастворителя., при этом бензин продается в Европе. Китай использует более 4,5 миллиардов литров метанола в год в качестве транспортного топлива в смесях с низким содержанием для обычных транспортных средств и в смесях с высоким содержанием в транспортных средствах, предназначенных для использования в качестве топлива на метаноле.
Другие химические вещества
Метанол является предшественником большинства простых метиламинов, метилгалогенидов и метиловых эфиров. Метиловые эфиры производятся из метанола, включая переэтерификацию жиров и производство биодизеля посредством переэтерификации.
Ниша и потенциальные области применения
Энергоноситель
Метанол — это перспективный энергоноситель, потому что в жидком виде его легче хранить, чем водород и природный газ. Однако его удельная энергия является низкой, что отражает тот факт, что он представляет собой частично сгоревший метан. Его удельная энергия составляет 15,6 MJ /L, у этанола — 24, а у бензина — 33 МДж / л.
Другими преимуществами метанола являются его способность к биологическому разложению и низкая токсичность. Он не сохраняется ни в аэробной (при наличии кислорода), ни в анаэробной (при отсутствии кислорода) средах. Период полураспада метанола в грунтовых водах составляет всего от одного до семи дней, в то время как у многих обычных компонентов бензина период полураспада измеряется сотнями дней (например, бензол — 10-730 дней). Поскольку метанол смешивается с водой и поддается биологическому разложению, маловероятно, что он будет накапливаться в грунтовых водах, поверхностных водах, воздухе или почве.
Топливо для транспортных средств
Метанол иногда используется для топливо двигатели внутреннего сгорания. Он сгорает с образованием диоксида углерода и воды:
- 2 CH 3 OH + 3 O 2 → 2 CO 2 + 4 H 2O
Одна проблема с высокие концентрации метанола в топливе заключаются в том, что спирты разъедают некоторые металлы, в частности алюминий. Топливо на основе метанола предложено для наземного транспорта. Главное преимущество экономии метанола состоит в том, что его можно адаптировать к бензиновым двигателям внутреннего сгорания с минимальными изменениями двигателей и инфраструктуры, которая доставляет и хранит жидкое топливо. Однако его удельная энергия вдвое меньше, чем у бензина, а это означает, что потребуется вдвое больший объем метанола.
Другие применения
Метанол использовался в качестве денатурирующего агента (преднамеренного токсина) для этанола, причем продукт был известен как «денатурированный спирт » или «метилированный спирт». Это обычно использовалось во время запрета, чтобы препятствовать употреблению нелегальных спиртных напитков, и в конечном итоге привело к нескольким смертельным случаям. Подобные действия являются незаконными в наше время и считаются убийствами.
Метанол используется в качестве растворителя и в качестве антифриза в трубопроводах и жидкости для стеклоомывателя. Метанол использовался в качестве антифриза для охлаждающей жидкости в автомобилях в начале 1900-х годов. По состоянию на май 2019 года в ЕС было запрещено использование метанола для мытья или размораживания ветрового стекла из-за риска его употребления в пищу людьми.
На некоторых очистных сооружениях небольшое количество метанола используется добавляется в сточные воды для обеспечения источника углерода для денитрифицирующих бактерий, которые превращают нитраты в азот газ и уменьшают нитрификацию чувствительных водоносные горизонты.
Метанол используется в качестве обесцвечивающего агента в электрофорезе в полиакриламидном геле.
Топливные элементы с прямым метанолом уникальны своей работой при низкой температуре и атмосферном давлении, что позволяет значительно уменьшить их размеры. Это, в сочетании с относительно простым и безопасным хранением метанола и обращением с ним, может открыть возможность создания бытовой электроники на топливных элементах, например портативных компьютеров и мобильных телефонов.
Метанол также является широко используемое топливо в походных и лодочных печах. Метанол хорошо горит в горелке без давления, поэтому спиртовые печи часто бывают очень простыми, иногда чуть больше чашки для топлива. Отсутствие сложности делает их излюбленными туристами, которые проводят много времени в дикой природе. Точно так же спирт может быть превращен в гель, чтобы снизить риск утечки или разлива, как в случае с маркой «Sterno ».
Метанол смешивают с водой и впрыскивают в высокоэффективные дизельные и бензиновые двигатели для увеличения мощности и снижения температуры всасываемого воздуха в процессе, известном как впрыск водного метанола.
Производство
Из синтез-газа
Окись углерода и водород реагируют на катализаторе с образованием метанола. Сегодня наиболее широко используемым катализатором является смесь оксидов меди и цинка, нанесенных на оксид алюминия, как впервые использовала ICI в 1966 году. На 5–10 МПа (50–100 атм) и 250 ° C (482 ° F), реакция характеризуется высокой избирательностью (>99,8%):
- CO + 2 H 2 → CH 3OH
производство синтез-газа из метана дает три моля водорода на каждый моль монооксида углерода, тогда как при синтезе расходуется только два моля газообразного водорода на моль монооксида углерода. Один из способов справиться с избыточным водородом — это ввести диоксид углерода в реактор синтеза метанола, где он также реагирует с образованием метанола в соответствии с уравнением:
- CO2+ 3 H 2 → CH 3 OH + H 2O
С точки зрения механизма, процесс происходит через начальное превращение CO в CO 2, который затем гидрируется :
- CO2+ 3 H 2 → CH 3 OH + H 2O
, где побочный продукт H 2 O рециркулируется посредством реакции конверсии водяного газа
- CO + H 2 O → CO 2 + H 2,
Это дает общую реакцию, которая является такой же, как указано выше.
- CO + 2 H 2 → CH 3OH
Биосинтез
Каталитическое превращение метана в метанол осуществляется ферментами, включая метанмонооксигеназы. Эти ферменты являются оксигеназами со смешанными функциями, т.е. оксигенация сочетается с образованием воды и NAD.
CH4+ O 2 + NADPH + H → CH 3 OH + H 2 O + NAD
Были охарактеризованы как Fe-, так и Cu-зависимые ферменты. Были предприняты интенсивные, но в основном бесплодные попытки воспроизвести эту реактивность. Метанол окисляется легче, чем исходный метан, поэтому реакции, как правило, не являются селективными. Существуют некоторые стратегии, позволяющие обойти эту проблему. Примеры включают системы Шилова и цеолиты, содержащие Fe и Cu. Эти системы не обязательно имитируют механизмы, используемые металлоферментами, но черпают в них определенное вдохновение. Активные центры могут существенно отличаться от тех, что известны в ферментах. Например, биядерный активный центр предлагается в ферменте sMMO, тогда как одноядерное железо (альфа-кислород ) предлагается в Fe-цеолите.
Безопасность
Метанол легко воспламеняется. Его пары тяжелее воздуха, могут перемещаться и воспламеняться. Пожары метанола следует тушить с помощью сухих химикатов, углекислого газа, водного спрея или спиртоустойчивой пены.
Характеристики качества и анализ
Метанол — это коммерчески доступны с различной степенью чистоты. Коммерческий метанол обычно классифицируется в соответствии со степенью чистоты A и AA ASTM. Метанол для химического использования обычно соответствует классу AA. Помимо воды, типичные примеси включают ацетон и этанол (которые очень трудно отделить перегонкой). УФ-видимая спектроскопия — удобный метод обнаружения ароматических примесей. Содержание воды можно определить с помощью титрования по Карлу-Фишеру.
История
В процессе бальзамирования древние египтяне использовали смесь веществ, включая метанол, который они получили в результате пиролиза древесины. Однако чистый метанол был впервые выделен в 1661 году Робертом Бойлем, когда он получил его путем дистилляции самшита (самшит). Позже он стал известен как «пироксилиновый спирт». В 1834 году французские химики Жан-Батист Дюма и Эжен Пелиго определили его элементный состав. Они также ввели слово «метилен» в органическую химию, образовав его от греческого methy = «спиртовая жидкость» + hȳlē = «лес, древесина, древесина, материал». «Метилен» обозначает «радикал», который содержит около 14% водорода по массе и содержит один атом углерода. Это будет CH 2, но в то время считалось, что углерод имеет атомную массу только в шесть раз больше, чем у водорода, поэтому они дали формулу как CH. Затем они назвали древесный спирт (l’esprit de bois) «бигидрат метилена» (бигидрат, потому что они думали, что формула была C 4H8O4= (CH) 4(H2O)2). Термин «метил» был получен примерно в 1840 году путем обратного образования из «метилена», а затем был применен для описания «метилового спирта». Это было сокращено до «метанола» в 1892 году Международной конференцией по химической номенклатуре. Суффикс -ил, который в органической химии образует названия углеродных групп, происходит от слова метил.
В 1923 году немецкие химики Алвин Митташ и Матиас Пьер, работавшие на Badische-Anilin Soda-Fabrik (BASF), разработали средство преобразования синтез-газ (смесь оксида углерода, диоксида углерода и водорода ) в метанол. Патент США 1569775 (US 1569775 ) был подан 4 сентября 1924 года и выдан 12 января 1926 года; в процессе использовался катализатор хром и оксид марганца в чрезвычайно жестких условиях: давления в диапазоне от 50 до 220 атм и температуры до 450 ° С. Современное производство метанола стало более эффективным за счет использования катализаторов (обычно медных), способных работать при более низких давлениях. Современный процесс метанола низкого давления (LPM) был разработан ICI в конце 1960-х US 3326956 с давно истекшим сроком действия патента на технологию.
Во время Второй мировой войны метанол использовался в качестве топлива в нескольких конструкциях немецких военных ракет под названием M-Stoff и в смеси примерно 50/50 с гидразином., известный как C-Stoff.
Использование метанола в качестве моторного топлива привлекло внимание во время нефтяных кризисов 1970-х. К середине 1990-х в США было введено более 20 000 метанольных «транспортных средств с гибким топливом » (FFV), способных работать на метаноле или бензине. Кроме того, низкие уровни метанола были добавлены в бензиновые топлива, продаваемые в Европе. в течение большей части 1980-х и начала 1990-х годов. К концу 1990-х автопроизводители прекратили производство метанольных FFV, переключив свое внимание на автомобили, работающие на этаноле. Хотя программа метанола FFV имела технический успех, рост цен на метанол в середине-конце 1990-х годов в период падения цен на бензиновые насосы снизил интерес к метанольному топливу.
В начале 1970-х был разработан процесс. от Mobil для производства бензина топлива из метанола.
В период с 1960-х по 1980-е годы метанол появился в качестве прекурсора исходных химических веществ уксусной кислоты и уксусный ангидрид. Эти процессы включают синтез уксусной кислоты Monsanto, процесс Cativa и процесс уксусного ангидрида Теннесси Истмана.
См. Также
- Спирт
- Аминометанол
- Метанол (страница данных)
- Триметилкарбинол
Ссылки
Дополнительная литература
- Роберт Бойл, The Skeptical Chymist (1661) — содержит отчет о перегонке древесного спирта.
Внешние ссылки
- Международная карта химической безопасности 0057
- Метиловый спирт (метанол) CDC / NIOSH, ссылки на информацию по безопасности
- CDC — Карманное руководство NIOSH по химической опасности — Метиловый спирт
- Информационный бюллетень по метанолу — Национальный реестр загрязнителей
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
метиловый спирт
Брутто-формула:
CH4O
CAS# 67-56-1
Категории:
Спирты
PubChem CID: 887
| ChemSpider ID: 864
| CHEBI:17790
| CHEMBL14688
| CB7854099
Названия
Русский:
- Метанол(IUPAC) [Wiki]
- гидроксид метила
- древесный спирт
- карбинол
- метилгидрат
- метиловый спирт
English:
- Colonial Spirit
- EINECS:212-378-6
- Hydroxymethane
- Methanol(IUPAC)(CAS) [Wiki]
- Methyl hydrate
- Methyl hydroxide
- Methylic alcohol
- Methylol
- Pyroxylic spirit
- Wood alcohol
- Wood naphtha
- Wood spirit
- carbinol
- methyl alcohol
German:
- Carbinol
- Holzgeist
- Methanol(IUPAC) [Wiki]
- Methylalkohol
العربية:
- ميثانول [Wiki]
Ελληνικά:
- Καρβινόλη
- Μεθανόλη(IUPAC) [Wiki]
- Μεθυλική αλκοόλη
- Ξυλόπνευμα
- Οξαιθάνιο
- Υδροξυμεθάνιο
Latina:
- Karbinol
- Methanol [Wiki]
- Methylalkohol
- Spiritus acidi formici
- Spiritus formicarum
Español:
- Alcohol de madera
- Alcohol metílico
- Carbinol
- Espíritu de madera
- Metanol(IUPAC) [Wiki]
French:
- Méthanol(IUPAC) [Wiki]
- alcool méthylique
Italiano:
- Metanolo(IUPAC) [Wiki]
- alcol metilico
- carbinolo
- spirito di legno
日本語:
- カルビノール
- ヒドロキシメタン
- メタノール [Wiki]
- メチルアルコール
- 木精
中文:
- 木精
- 木醇
- 甲醇 [Wiki]
- 羟基甲烷
Варианты формулы:
CH3OH
CH3-OH
H-C-O-H; H|#C|H
$slope(55)H/C<_(A-160,w+)H><_(A-100,d+)H>-O/H
HO/
HO/CH3
{Me}OH
H3C-OH
H3C/OH
Вещества, имеющие отношение…
Альдегид:
Формальдегид
Следущий гомолог:
Этиловый спирт
Химический состав
Реакции, в которых участвует метиловый спирт
-
2CH3OH + O2 -> 2HCHO + 2H2O
-
{R}-OH + SOCl2 -> {R}-Cl + SO2 + HCl
, где R =
H3C H3C-CH2 CH3-CH2-CH2 `/`=`//-\ -
HCOOCH3 + KOH -> HCOOK + CH3OH
-
CH3OH + NH3 -> CH3NH2 + H2O
-
CH3NH2 + CH3OH -> (CH3)2NH + H2O
И ещё 28 реакций…
| Метанол | |
 | |
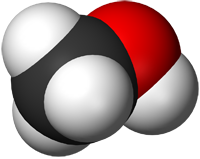 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метанол |
| Традиционные названия | Метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила |
| Химическая формула | СН3OH |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 32,04 г/моль |
| Плотность | 0,7918 г/см³ |
| Динамическая вязкость | 5.9×10−4 Па·с |
| Термические свойства | |
| Т. плав. | -97 °C |
| Т. кип. | 64,7 °C |
| Т. разл. | 320-380 °C |
| Т. всп. | 6 °C |
| Т. воспл. | 13 °C |
| Т. свспл. | 440 °C |
| Пр. взрв. | 6,98-35,5 % |
| Тройная точка | 175,45 K (−97,7°C) |
| Кр. точка | 513,15 K (240 °C), 7,85 МПа |
| Энтальпия образования | -238 кДж/моль |
| Удельная теплота испарения | 37,4 кДж/моль |
| Давление пара | 11,8 кПа (при 20 °С) |
| Химические свойства | |
| pKa | ~15,5 |
| Структура | |
| Дипольный момент | 1,65 Д |
| Классификация | |
| Рег. номер CAS | 67-56-1 |
| SMILES | CO |
| Безопасность | |
| Токсичность |    |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |

Метанол, метиловый спирт, карбинол[1], древесный спирт — простой представитель алифатических насыщенных одноатомных спиртов, CH3OH. Впервые получены Жаном Дюма и Эженом Пелиго.
Бесцветная жидкость с характерным запахом, похожим на запах этилового спирта[2]. Молекулярная масса 32,04 а. а. м. Смешивается с водой и органическими растворителями, растворяется в хлороформе. Температура плавления −97,88 °C. Температура кипения 64,509 °C. Плотность 0,7928 г/см³ (при 20 °C). В природе почти не встречается в свободном состоянии.
Метанол — важный исходный материал в химической промышленности. Кроме того, он используется, помимо прочего, как растворитель, антифриз и топливо. Соединение также присутствует в цветочных ароматах и в качестве полухимического вещества в общении организмов.
Получение[править]
Ранее метиловый спирт получали методом сухой перегонки древесины. В настоящее время его получают нескольким химическими методами. Основным является синтез из смеси оксида углерода(II) (CO) и водорода в присутствии катализаторов ZnO, Cr2O3 при температуре 400 °C и давлении 2·107—3·107 Па.
Использование[править]
Метанол используется в промышленности в составе антифризов, растворителей лаков и красок, в качестве топлива и исходного сырья в процессах получения формальдегида, хлористого метила и др.
Вредное воздействие[править]
Метанол является очень ядовитым веществом. Повреждает нервную и сосудистую систему. В дозах 4-15[2] мл вызывает слепоту и тяжелое отравление организма человека. Смертельная доза для человека составляет 30-100[2] мл.
Источники[править]
- ↑ Статья на сайте ХиМиК.ру (рус.)
- ↑ 2,0 2,1 2,2 Крамаренко В. Ф. Токсикологическая химия на сайце ХиМиК.ру (рус.)
Ссылки[править]
- Статья на сайте ХиМиК.ру
- Крамаренко В. Ф. Токсикологическая химия на сайте ХиМиК.ру
- Мини-справочник по химическим веществам на сайте ХиМиК.ру
|
[+] Спирты | |
|---|---|
| (0°) | Метанол |
| Первичные спирты (1°) | Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метилбутан-2-ол |
|
[+] Основные виды органического топлива | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
| ||||||||
| Возобновляемое и биологическое | Валежник • Дрова • Кизяк • Навоз • Древесный уголь • Этанол • Биодизель • Биоэтанол • Бутанол-1 • Метанол • Свалочный газ • Болотный газ • Биогаз • Биоводород | ||||||||
| Искусственное | Доменный газ • Светильный газ • Коксовый газ • Трет-бутилметиловый эфир • Синтез-газ • Синтетическое топливо • Генераторный газ • Водород • Водоугольное топливо • Пековый кокс | ||||||||
| Разное | Газификация угля |