8 класс. Контрольная работа №1 по
теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант
1.
Задание №1. (5
баллов)
Даны вещества: К, F2, Ca(OH)2,
Cu, C, MgO, Na2SO4
Выберите из предложенных веществ:
— простые вещества
(неметаллы)
— сложные вещества
Задание №2. (8
баллов)
Запишите произношение названий формул и
формулы по названию веществ: 3AlCl3, Cu(OH)2, LiF, 2FeO, магний-эс, цэ-о-два, аргентум-фтор,
силициум-о-два
Задание №3. (4
балла)
Охарактеризуйте качественный и количественный
состав веществ: 2Cu2O, Na2SiO4
Задание №4. (4
балла)
Рассчитайте молекулярную массу веществ: Al(OH)3, Ca2SO4
Задание №5. (4
балла)
Дайте полную характеристику элементов
(положение в ПСХЭ, строение атома, строение электронных оболочек) под № 5
Задание №6 (6
баллов)
Укажите тип химической связи в простых
веществах и сложных веществах: Na, O2, Cl2, K2О, CuS, Be
Задание №7. (6
баллов)
Рассчитайте массовую долю всех элементов
в веществах: CuCl2, K2SO4
Задание №8. (5
баллов)
Укажите электронные формулы и конфигурации
элементов с порядковыми номерами: 12, 8. Какой тип химической связи
между данными элементами?
Задание №9. (8
баллов)
Сравните металлические свойства
элементов поставив знак ˃ или <
А) натрия и калия Б) алюминия и натрия
В) галлия и алюминия Г) лития и калия
Сравните неметаллические свойства
элементов поставив знак ˃ или <
А) азота и фтора Б) кислорода
и серы
В) серы и кремния Г) фтора и
брома
Максимальный балл — 50
8 класс. Контрольная работа №1 по
теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант
2.
Задание №1. (7
баллов)
Даны вещества: Li, H2,
Cu(OH)2, Ca, S, Н2О, NaCl
Выберите из предложенных веществ:
— простые вещества
(металлы)
— сложные вещества
Задание №2. (8
баллов)
Запишите произношение названий формул и
формулы по названию веществ: 2MgF2, KOH, Na2S, 5Br2,
кальций-три-эн-два, эс-о-два, феррум-хлор-три, аш-два-о
Задание №3. (4
балла)
Охарактеризуйте качественный и количественный
состав веществ: 3MgO, Na2CO3
Задание №4. (4
балла)
Рассчитайте молекулярную массу веществ: Fe(OH)3, K2CO3
Задание №5. (4
балла)
Дайте полную характеристику элементов
(положение в ПСХЭ, строение атома, строение электронных оболочек) под № 14
Задание №6 (6
баллов)
Укажите тип химической связи в простых
веществах и сложных веществах: Li, N2, Mg, Na2О, K2S, O3
Задание №7. (6
баллов)
Рассчитайте массовую долю всех элементов
в веществах: Na3 P, Na2CO3
Задание №8. (5
баллов)
Укажите электронные формулы и конфигурации
элементов с порядковыми номерами: 11, 9. Какой тип химической связи
между данными элементами?
Задание №9. (8
баллов)
Сравните металлические свойства
элементов поставив знак ˃ или <
А) натрия и лития Б) лития и бериллия
В) магния и алюминия Г) калия и рубидия
Сравните неметаллические свойства
элементов поставив знак ˃ или <
А) углерода и фтора Б) азота и
фосфора
В) серы и кремния Г) хлора и
брома
Максимальный балл — 50
Контрольная работа № 1 по химии в 8 классе «Атомы химических элементов» с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 12. Контрольная работа по теме «Атомы химических элементов». Цитаты из пособия использованы в учебных целях. Химия 8 Габриелян Контрольная работа № 1.
Цели урока: проверка знаний и умений учащихся, степени усвоения ими учебного материала.
Тип урока: урок развивающего контроля.
Оборудование: карточки с заданиями, справочные таблицы.
ХОД УРОКА
1. Организационный момент
Мотивация к учебной деятельности. Учитель сообщает тему урока, формулирует цели урока.
2. Выполнение контрольной работы
Контрольная работа по химии. Вариант 1

- Строение какого атома отображает схема: +х)2)8)4 ?
- Какой атом имеет заряд ядра + 8?
- По два электронных слоя имеют атомы:
1) гелия и лития; 2) бериллия и магния;
3) бора и кислорода; 4) алюминия и натрия. - И азот, и фосфор имеют
- 1) одинаковое число электронов на внешнем электронном слое;
- 2) одинаковое число протонов в ядре;
- 3) одинаковое число нейтронов в ядре;
- 4) одинаковое число электронов в атоме.
- Чем отличается ион кислорода от атома кислорода? Ответ объясните.
- Определите ряд элементов, расположенных в порядке усиления их металлических свойств.
- 1) литий, натрий, калий;
- 2) натрий, магний, алюминий;
- 3) водород, литий, бериллий;
- 4) кальций, магний, бериллий.
- Ионная химическая связь образуется между:
- 1) кислородом и серой;
- 2) водородом и углеродом;
- 3) водородом и кислородом;
- 4) калием и фтором.
- Соотнесите вид химической связи и вид атомов.
| Вид связи | Атомы с данным видом связи |
| A. Ионная | 1. Атомы одного элемента – металла |
| Б. Ковалентная полярная | 2. Атомы одного элемента – неметалла |
| B. Ковалентная неполярная | 3. Атомы разных химических элементов – неметаллов |
| Г. Металлическая | 4. Атомы элементов–металлов и элементов – неметаллов |
- Определите валентность элементов в соединениях с формулами: Н2O; CuO; Аl2O3; SO3; Р2O5
- Подсчитайте по формуле Р2O3 относительную молекулярную массу оксида фосфора, вычислите массовые доли химических элементов Р и О.
- Какие из приведенных утверждений верны?
А. Физические явления сопровождаются изменением формы тела, агрегатного состояния вещества.
Б. Плавление олова относится к химическим явлениям.
- Химический элемент — это
- 1) определенный вид одинаковых молекул;
- 2) определенный вид атомов;
- 3) простое вещество;
- 4) названия видов атомов.
- Что является предметом изучения химии?
1) вещества; 2) тела; 3) тела и вещества;
4) вещества, их свойства, превращения и явления, сопровождающие эти превращения.
Контрольная работа по химии. Вариант 2

- Строение какого атома отображает схема: +х)2)6 ?
- Какой атом имеет заряд ядра +16 ?
- По два электрона на внешнем энергетическом уровне имеют атомы:
1) гелия и лития; 2) бериллия и магния;
3) бора и кислорода; 4) алюминия и натрия.
- Натрий и хлор имеют:
- 1) одинаковое число электронных слоев;
- 2) одинаковое число протонов в ядре;
- 3) одинаковое число нейтронов в ядре;
- 4) одинаковое число электронов в атоме.
- Какие ионы имеют электронные оболочки такие же, как у инертного газа неона?
1) Li+ и F–; 2) Сl– и Na+; 3) F– и Na+; 4) F– и Сl–.
- Определите ряд элементов, расположенных в порядке усиления их неметаллических свойств.
- 1) литий, натрий, калий;
- 2) сера, фосфор, кремний;
- 3) углерод, азот, кислород;
- 4) бор, алюминий, магний.
- При помощи ковалентной полярной связи образовано вещество
1) O2; 2) ВаСl2; 3) СО2, 4) К2O.
- Соотнесите вид химической связи и вещества.
| Вид связи | Вещества с данным видом связи |
| A. Ионная | 1. Хлорид фосфора |
| Б. Ковалентная полярная | 2. Оксид кальция |
| B. Ковалентная неполярная | 3. Цезий |
| Г. Металлическая | 4. Азот |
- Составьте формулы соединений следующих элементов: К, Ва, Al, P(V), Mg с хлором, зная, что он в этих соединениях одновалентен.
- Подсчитайте по формуле Р2O5 относительную молекулярную массу оксида фосфора, вычислите массовые доли химических элементов Р и О.
- Какие из приведенных утверждений верны?
А. Все химические явления сопровождаются изменением формы тела, агрегатного состояния вещества.
Б. Пригорание масла во время приготовления пищи относится к химическим явлениям.
- В каком ряду расположены только вещества?
- 1) поваренная соль, сахар, свеча;
- 2) вода, железо, сера;
- 3) медь, гвоздь, кислород;
- 4) кирпич, медная монета, стакан керамический.
- Определите формы существования химического элемента.
1) свободные атомы; 2) сложные вещества;
3) простые вещества; 4) верно все перечисленное.
3. Рефлексия учебной деятельности
В конце урока учитель раздает на каждую парту краткую запись с ответами на контрольную работу.
Ответы на контрольную работу. Вариант 1
- Кремния.
- Атом кислорода.
- 3) бора и кислорода.
- 1) одинаковое число электронов на внешнем электронном слое;
- Количеством электронов.
- 1) литий, натрий, калий;
- 4) калием и фтором.
- А — 4, Б —3, В — 2, Г — 1.
- …
- …
- А. — Верно.
- 2) определенный вид атомов.
- 4) вещества, их свойства, превращения и явления, сопровождающие эти превращения.
Ответы на контрольную работу. Вариант 2
- Кислорода.
- Атом серы.
- 2) бериллия и магния.
- 1) одинаковое число электронных слоев;
- 3) F– и Na+;
- 3) углерод, азот, кислород;
- 3) СО2
- А — 2, Б —1, В — 4, Г —3.
- КСl, ВаСl2, АlСl3, PCl5, MgCl2
- …
- Б — Верно.
- 2) вода, железо, сера.
- 4) верно все перечисленное.
4. Домашнее задание
- Подготовить сообщения на тему «Металлы в жизни человека».
- Пользуясь научно–популярной литературой, подготовьте сообщение по одной из тем: «Физические свойства металлов», «Роль металлов в технике», «Металлы в нашем доме».
Вы смотрели: Контрольная работа по химии в 8 классе с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 12. Контрольная работа по теме «Атомы химических элементов» + ОТВЕТЫ.
Смотреть Список всех контрольных по химии в 8 классе по УМК Габриелян.
Вернуться к Списку уроков Тематического планирования по химии в 8 классе.
8 класс. Контрольная работа №1 по теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант 1.
Задание №1.
Даны вещества: К, F2, Ca(OH)2, Cu, C, MgO, Na2SO4
Выберите из предложенных веществ:
— простые вещества
— сложные вещества
Задание №2.
Запишите произношение названий формул и формулы по названию веществ: 3AlCl3, Cu(OH)2, LiF, 2FeO, магний-эс, цэ-о-два, аргентум-фтор, силициум-о-два
Задание №3. (4 балла)
Рассчитайте молекулярную массу веществ: Al(OH)3, Ca2SO4
Задание №4. (6 баллов)
Рассчитайте массовую долю всех элементов в веществах: CuCl2, K2SO4
Задание №5
Определите валентность элементов в соединениях:
CaH2, I2O5, MnO2, N2O, BaO
Составьте химические формулы соединений:
а) цинк и бром (I)
б) железо (III) и кислород
в) кремний (IV) и водород
г) сера (VI) и кислород
8 класс. Контрольная работа №1 по теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант 1.
Задание №1.
Даны вещества: К, F2, Ca(OH)2, Cu, C, MgO, Na2SO4
Выберите из предложенных веществ:
— простые вещества
— сложные вещества
Задание №2.
Запишите произношение названий формул и формулы по названию веществ: 3AlCl3, Cu(OH)2, LiF, 2FeO, магний-эс, цэ-о-два, аргентум-фтор, силициум-о-два
Задание №3. (4 балла)
Рассчитайте молекулярную массу веществ: Al(OH)3, Ca2SO4
Задание №4. (6 баллов)
Рассчитайте массовую долю всех элементов в веществах: CuCl2, K2SO4
Задание №5
Определите валентность элементов в соединениях:
CaH2, I2O5, MnO2, N2O, BaO
Составьте химические формулы соединений:
а) цинк и бром (I)
б) железо (III) и кислород
в) кремний (IV) и водород
г) сера (VI) и кислород
8 класс. Контрольная работа №1 по теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант 2.
Задание №1.
Даны вещества: Li, H2, Cu(OH)2, Ca, S, Н2О, NaCl
Выберите из предложенных веществ:
— простые вещества (металлы)
— сложные вещества
Задание №2.
Запишите произношение названий формул и формулы по названию веществ: 2MgF2, KOH, Na2S, 5Br2, кальций-три-эн-два, эс-о-два, феррум-хлор-три, аш-два-о
Задание №3. (4 балла)
Рассчитайте молекулярную массу веществ: Fe(OH)3, K2CO3
Задание №4. (6 баллов)
Рассчитайте массовую долю всех элементов в веществах: Na3 P, Na2CO3
Задание №5
3. Определите валентность элементов в соединениях:
SiO2, PH3, MgO, Cu2O, Mn2O7
4. Составьте химические формулы соединений:
а) магний и хлор (I)
б) углерод (IV) и водород
в) алюминий и кислород
г) сера (IV) и кислород
8 класс. Контрольная работа №1 по теме «Первоначальные химические понятия. Атомы химических элементов»
Вариант 2.
Задание №1.
Даны вещества: Li, H2, Cu(OH)2, Ca, S, Н2О, NaCl
Выберите из предложенных веществ:
— простые вещества (металлы)
— сложные вещества
Задание №2.
Запишите произношение названий формул и формулы по названию веществ: 2MgF2, KOH, Na2S, 5Br2, кальций-три-эн-два, эс-о-два, феррум-хлор-три, аш-два-о
Задание №3. (4 балла)
Рассчитайте молекулярную массу веществ: Fe(OH)3, K2CO3
Задание №4. (6 баллов)
Рассчитайте массовую долю всех элементов в веществах: Na3 P, Na2CO3
Задание №5
3. Определите валентность элементов в соединениях:
SiO2, PH3, MgO, Cu2O, Mn2O7
4. Составьте химические формулы соединений:
а) магний и хлор (I)
б) углерод (IV) и водород
в) алюминий и кислород
г) сера (IV) и кислород
Контрольная работа №1 по разделу «Теоретические основы химии»
ВАРИАНТ 1
ЧАСТЬ А
При выполнении заданий этой части (А1— А13) выберите только один из четырёх
предложенных вариантов ответа.
А 1. Укажите номер периода и группы, в которых расположен кремний
1) II, IV 2)III, IV 3) V, II 4) II, III
А 2.Общее количество электронов в атоме хлора
1) 8 2) 7 3) 35 4) 17
А 3.Заряд ядра атома магния и его относительная атомная масса:
1) +39; 12 2) + 12; 24 3) 24; + 19 4) 2; + 24 + 12; 24
А4. Неметаллические свойства у элементов А групп усиливаются
слева направо и в группах сверху вниз 2) справа налево и в группах сверху вниз
справа налево и в группах снизу вверх 4) слева направо и в группах снизу вверх
А5. В каком ряду химические элементы расположены в порядке возрастания их атомного
радиуса?
Na, Mg, Al, Si 2) Li, Be, B, C 3) P, S, Cl, Ar 4) F, O, N, C
А6. Число нейтронов в ядре атома
39
K равно
А7. В каком ряду находятся только неметаллы:
1) S, O, N, Mg 2) N, O, F, Н 3) Fe, Cu, Na, H 4) Na, K, Cu, Ca
А8. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
Cl
2
, NH
3
, HCl 2) HBr, NO, Br
2
3) H
2
S, H
2
O, S
8
4) HI, H
2
O, PH
3
А9. Кристаллическую структуру, подобную структуре алмаза, имеет
кремнезем SiО
2
2) оксид натрия Na
2
O 3) оксид углерода (II) CO 4) белый фосфор Р
4
А10. Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или подобный им катион NH
4
+
) и
гидроксид анионы OH
–
.
Б. Никаких других анионов, кроме OH
–
, основания не образуют.
верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
А11. Какая из приведенных реакций не относится к реакциям ионного обмена?
Ba(NO
3
)
2
+ Na
2
SO
4
= BaSO
4
+ 2NaNO
3
2KMnO
4
= K
2
MnO
4
+ MnO
2
+ O
2
Li
2
SO
3
+ 2HNO
3
= 2LiNO
3
+ H
2
O + SO
2
А12. Только окислительные свойства проявляет
сульфид натрия 2) сера 3) серная кислота 4) сульфит калия
А13. На смещение химического равновесия в системе N
2
+ 3H
2
2NH
3
+ Q
не оказывает влияния
понижение температуры 2) повышение давления
удаление аммиака из зоны реакции 4) применение катализатора
Часть В
Ответом к заданиям части В является набор цифр или число
В заданиях В1—В4 на установление соответствия к каждой позиции первого столбца
подберите соответствующую позицию второго. (Цифры в ответе могут повторяться).
В1. Установите соответствие между названием химического соединения и видом
связи атомов в этом соединении.
В2. 50 г сахара растворили в 100 г воды. Массовая доля сахара в полученном растворе равна
_____________ %. (Ответ запишите с точностью до целых).
В3. Установите соответствие между уравнением реакции и веществом—
окислителем, участвующим в данной реакции.
Установите соответствие между солью и реакцией среды в ее водном растворе.
Часть С
( ответ запишите с полным объяснением)
Что такое скорость химической реакции, от каких факторов она зависит, приведите примеры из
жизни( ПРИРОДНЫХ ЯВЛЕНИЙ, БЫТА ЛЮДЕЙ, ПРОМЫШЛЕННОСТИ).
Оценивание:
Часть А – правильный ответ 1 балл
Часть В– В1,В3,В4 – 2 балла без ошибки. 1балл – 1ошибка
В2 – 1 балл
Часть С – 3 балла
Максимальное количество баллов: 23
23—22балла – «5»
21— 16 – «4»
15 —11—«3»
Менее 10 – «2»
Контрольная работа №1 по разделу «Теоретические основы химии»
ВАРИАНТ 2
ЧАСТЬ А
При выполнении заданий этой части (А1— А13) выберите только один из четырёх
предложенных вариантов ответа.
А 1. Укажите номер периода и группы, в которых расположен германий
1) II, IV 2)III, IV 3) IV, IV 4) IV, III
А 2.Общее количество электронов в атоме мышьяка
1) 33 2) 5 3) 75 4) 41
А 3.Заряд ядра атома фосфора и его относительная атомная масса:
1) +31; 15 2) + 15; 31 3) 30; + 15 4) 3; + 31 + 15; 31
А4 В ряду Mg → Ca → Sr → Ba способность металлов отдавать электроны
ослабевает 2) возрастает 3) не изменяется 4) изменяется периодически
А5. В каком ряду химические элементы расположены в порядке возрастания их атомного
радиуса?
Na, K, Rb, Cs 2) Li, Be, B, C 3) O, S, Cl, Ar 4) F, O, N, C
А6 Число нейтронов в ядре атома
16
S равно
1) 16 2) 32 3) 12 4) 24
А7. В каком ряду находятся только металлы:
1) S, O, N, Mg 2) N, O, F, Н 3) Fe, Cu, Na, Ni 4) Na, K, Cu, C
А8 Ковалентная неполярная связь реализуется в соединении
CrO
3
2) P
2
O
5
3) SO
2
4) F
2
А9 Молекулярную кристаллическую решетку имеет каждое из двух веществ:
графит и алмаз 2) кремний и иод
хлор и оксид углерода (IV) 4) хлорид бария и оксид бария
А10 Какие из утверждений о диссоциации кислот в водных растворах верны?
А. Кислоты в воде диссоциируют на катионы водорода Н
+
и гидроксид анионы OH
–
.
Б. Никаких других катионов, кроме Н
+
, кислоты не образуют.
верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
А11 Реакция, уравнение которой CaCO
3
+ CO
2
+ H
2
O = Ca(HCO
3
)
2
, является реакцией
обмена 2) соединения 3) разложения 4) замещения
А12 Как окислитель сера выступает в реакции с
хлором 2) кислородом 3) бромом 4) железом
А13 Равновесие реакции СаСО
3
СаО + СО
2
– Q смещается вправо при
уменьшении температуры и увеличении давления
увеличении температуры и уменьшении давления
увеличении температуры и увеличении давления
уменьшении температуры и уменьшении давления
Часть В
Ответом к заданиям части В является набор цифр или число
В заданиях В1—В4 на установление соответствия к каждой позиции первого столбца
подберите соответствующую позицию второго. (Цифры в ответе могут повторяться).
В1 В1. Установите соответствие между названием химического соединения и видом
связи атомов в этом соединении.
В2 12 г соли растворили в 100 г воды. Массовая доля соли в полученном растворе равна
_____________ %. (Ответ запишите с точностью до целых).
В3 Установите соответствие между уравнением реакции и формулой вещества, которое в
данной реакции является окислителем.
2SO
3
+ 2KI = I
2
+ SO
2
+ K
2
SO
4
В4. Установите соответствие между названием вещества и средой его водного раствора
Часть С
( ответ запишите с полным объяснением)
Что такое скорость химической реакции, от каких факторов она зависит, приведите примеры из
жизни( ПРИРОДНЫХ ЯВЛЕНИЙ, БЫТА ЛЮДЕЙ, ПРОМЫШЛЕННОСТИ).
Оценивание:
Часть А – правильный ответ 1 балл
Часть В– В1,В3,В4 – 2 балла без ошибки. 1балл – 1ошибка
В2 – 1 балл
Часть С – 3 балла
Максимальное количество баллов: 23
23—22балла – «5» 21— 16 – «4» 15 —11—«3» Менее 10 – «2»
1.Скорость химической реакции определяется изменением
количества реагирующих веществ или продуктов реакции за
единицу времени в единице объема.
2.Скорость зависит от:
Природы реагирующих веществ;
Концентрации реагирующих веществ
Температуры
Катализаторов/ингибиторов
3.Примеры
Контрольные работы по химии в 8 классе (УМК Габриелян)
Химия 8 Контрольные Габриелян (КиСР Павлова) — это контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О. С. Габриеляна «Химия 8 класс» / Н. С. Павлова. — М. : Издательство «Экзамен», 2015 (Серия «Учебно-методический комплект»).
Цитаты из вышеуказанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ): цитаты переработаны в удобный формат (каждая работа на 1-й странице), что дает экономию денежных средств учителю и образовательному учреждению я в использовании бумаги и ксерокопирующего оборудования.
При постоянном использовании контрольных работ по химии в 8 классе рекомендуем купить книгу:
«Наталья Павлова: Химия 8 класс. Контрольные и самостоятельные работы по химии. К учебнику О. С. Габриеляна. ФГОС», которая содержит 5 контрольных работ, 6 тестов по основным темам курса, 39 самостоятельных работ. Все работы представлены в 4 вариантах. Данное пособие полностью соответствует ФГОС (второго поколения). В пособии отражены новые требования к результатам освоения химии в виде совокупностей не только предметных, но и метапредметных и личностных результатов учащихся.
Контрольная К-1. Атомы химических элементов. Простые вещества
Контрольная работа № 1 + Ответы
Контрольная К-2. Соединения химических элементов
Контрольная работа № 2 + Ответы
Контрольная К-3. Изменения, происходящие с веществами
Контрольная работа № 3 + Ответы
Контрольная К-4. Растворение. Растворы. Свойства растворов электролитов
Контрольная работа № 4 + Ответы
Контрольная К-5. ИТОГОВАЯ за год
Контрольная работа № 5 + Ответы
Основные темы уроков по учебнику О.С. Габриелян «Химия 8 класс»
Предмет химии. Вещества. Превращение веществ. Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева. Химические формулы. Относительная атомная и молекулярная масса.
Тема № 1. Атомы химических элементов.
Основные сведения о строении атомов. Изменения в составе ядер атомов химических элементов. Изотопы. Строение электронных оболочек атомов. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Взаимодействие атомов элементов-неметаллов между собой. Ковалентная полярная связь. Обобщение и систематизация знаний о видах химической связи.
Тема № 2. Простые вещества.
Простые вещества — металлы. Простые вещества — неметаллы. Аллотропия. Количество вещества. Молярная масса вещества. Молярный объем газообразных веществ.
Тема № 3. Соединения химических элементов.
Степень окисления. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения. Основания. Кислоты. Соли как производные кислот и оснований. Основные классы соединений. Кристаллические решетки. Массовая и объемная доля компонента в смеси, в том числе и доля примесей.
Тема № 4. Изменения, происходящие с веществами.
Физические явления в химии. Химические реакции. Химические реакции. Закон сохранения массы веществ. Расчеты по химическим уравнениям. Химические уравнения. Реакции разложения. Реакции соединения. Реакции замещения. Реакции обмена. Типы химических реакций на примере свойств воды.
Тема № 5. Растворение. Растворы. Свойства растворов электролитов.
Растворение как физико-химический процесс. Растворимость. Типы растворов. Электролитическая диссоциация. Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Кислоты в свете ТЭД, их классификация и свойства. Основания в свете ТЭД, их классификация и свойства. Оксиды. Соли в свете ТЭД, их свойства. Генетическая связь между классами неорганических веществ. Окислительно-восстановительные реакции.
Вы смотрели Химия 8 Контрольные Габриелян (КиСР Павлова) контрольные работы (цитаты) в 4-х вариантах из пособия для учащихся Контрольные и самостоятельные работы по химии: 8 класс: к учебнику О.С. Габриеляна «Химия 8 класс» / Н. С. Павлова.
Контрольная работа № 1 по теме
«Первоначальные химические понятия»
Цель урока. Проконтролировать знания по теме. Планируемые результаты обучения
Предметные. Уметь применять полученные знания для решения учебных задач.
Метапредметные. Формировать умения соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований, корректировать свои действия в соответствии с изменяющейся ситуацией.
Личностные. Формировать ответственное отношение к учению.
Основные виды деятельности учащихся. Выполнять задание определённой сложности по пройденному материалу.
Вариант I
Тест:
-
В левом столбце под номерами 1—4 записаны известные вам понятия, в правом столбце буквами А—Г обозначены их характеристики. Выпишите номер, которым обозначено понятие, и букву, соответствующую его характеристике.
-
состоит из атомов одного вида, обладает постоянными физическими свойствами
-
химический элемент
-
простое вещество
-
сложное вещество
-
Б. состоит из атомов разных видов, имеет постоянные свойства
В. один вид атомов, физические свойства которого обычно не характеризуют!
| 1 | 2 | 3 |
-
Очистить железные опилки от порошка серы можно
-
фильтрованием 3) нагреванием
-
с помощью магнита 4) растиранием смеси в ступке
-
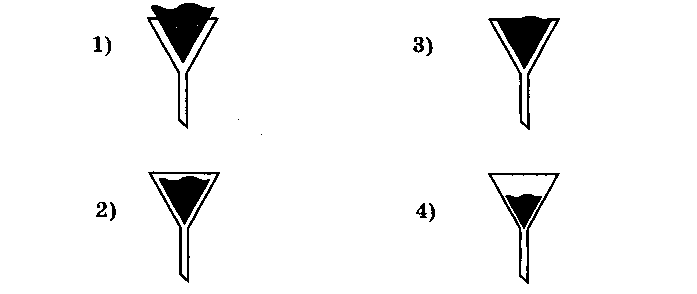
Правильно вложен фильтр в воронку для проведения опыта по разделению смеси на рисунке
-
Только сложные вещества перечислены в ряду
-
воздух, вода, кислород
-
серная кислота, водород, озон
-
кислород, азот, хлор
-
поваренная соль, вода, сероводород
-
Какая запись обозначает, что молекула азота состоит из двух атомов?
-
2N 2) N2 3) N2О 4) N2О3
-
В соединении с водородом валентность II всегда имеют химические элементы
-
S, N 2) О, S 3) О, С 4) S, С1
-
Среди приведённых схем химических реакций к реакциям соединения относится
-
Zn + HCI → H2↑ + ZnCl2
-
СН4 + О2 → CО2↑ + Н2О
-
H2SО4 + Na2О → Na2SО4 + H2О
-
K2О + H2О → КОН
Задания со свободным ответом:
-
Составьте формулы веществ: сульфида железа(II), хлорида кремния(IV), иодида меди(I), оксида натрия.
-
Вычислите массовую долю кислорода в железной окалине Fe 304.
-
Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции:
а) Н2О + Р2О5 — Н3РО4
ЭЛ. ток
б) Н2О → H2↑ + О2↑
t
в) СuО + Н2 → Н2О + Сu
Вариант II
Тест
-
Покажите стрелкой вертикальной (↑), горизонтальной (→) или диагональной () расположение в каждом из трёх квадратов названий: в первом квадрате — металлов, во втором — сложных веществ, в третьем — смесей.
I II
| Серебро | Сера | Кислород | Вода | Сера | Кислород | |
| Железо | Хлор | Кремний | Воздух | Углекислый газ | Азот | |
| Медь | Водород | Азот | Железо | Медь | Сульфид алюминия |
Ill
| Медь | Сера | Оксид магния |
| Азот | Вода дистиллированная | Углекислый газ |
| Воздух | Сахар, загрязнённый углём | Вода, загрязнённая нефтью |
-
Фильтрованием можно разделить смесь
-
воды и сахара 3) воды и угольной пыли
-
воды и поваренной соли 4) воды и уксусной эссенции
-
Правильно погасить пламя спиртовки нужно,
-
подув на пламя
-
надев на пламя колпачок
-
накрыв пламя руками
-
Только простые вещества перечислены в ряду
-
воздух, вода, кислород 3) кислород, азот, хлор
-
серная кислота, водород, озон 4) поваренная соль, вода, сероводород
-
Запись 2О2 обозначает
-
четыре атома кислорода
-
два атома кислорода
-
две молекулы кислорода
-
четыре молекулы кислорода
-
Валентность V и II азот имеет в каждом из веществ, указанных в ряду
-
N2О5, NO 3) N2O5, NО2,
-
NH3, N2O5 4) NH3, NO
-
Среди приведённых схем химических реакций к реакциям разложения относится
-
Сu + H2SО4(конц.) → CuSО4 + H2О + SО2
-
HgO → Hg + О2
-
H2 + О2 — H2О
-
FeO + HC1 — FeCl2 + H2О
2. Задания cо свободным ответом:
-
Вещества, обозначенные формулами Н2, СО2, СН4, СаС12, Р2О5, С, разделите на две группы: простые и сложные вещества. Определите значения валентности атомов химических элементов в формулах сложных веществ.
-
Вычислите массовую долю химических элементов в молекуле метана СН4.
-
Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции:
а) NH3 → N2 + H2↑
б) Na + Cl2 → NaCl
в) А1 + НС1 → А1С13 + Н2↑
Ответы Критерии оценивания.
1 вариант:
Первое задание:
-
1-в, 2а, 3б,
-
2
-
2
-
4
-
2
-
2
-
4
В первом вопросе за каждый правильный ответ 0,5 б (всего 1,5 балла), в последующих вопросах за каждый правильный ответ -1 балл. Всего – 7,5 баллов.
Второе задание:
-
формулы веществ: FeS , SiCl4, CuI, Na2O – за каждую правильную формулу 1 балл
Всего 4 балла;
-
Вычислите массовую долю кислорода в железной окалине Fe3O4
Мr (Fe3O4) = 56×3 + 16x 4 = 232 – 1 балл
W (Fe) = 168 : 232 x 100% = 72,4 % — 1 балл
W (O) = 64 : 232 x 100% = 27,6 % — 1 балл
Всего – 3 балла
3. Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции:
а) 3Н2О + Р2О5 = 2 Н3РО4 — реакция соединения
ЭЛ. ток
б) 2Н2О = 2 H2↑ + О2↑ — реакция разложения
в) СuО + Н2 = Н2О + Сu – реакция замещения
За правильно расставленные коэффициенты в каждом уравнении -1 балл, за определение типа реакции -1 балл. Всего – 6 баллов.
Всего за работу – 20,5 балла.
Критерии оценивания:
«2» — от 0 — 10 баллов, «3» — 10,5 до 15 баллов, «4» -от 15,5 до17 баллов, «5» от 17,5 баллов.
2 вариант:
Первое задание:
-
1-вертикальное, 2- диагональное, 3- горизонтальное;
-
3
-
2
-
3
-
3
-
1
-
2
В первом вопросе за каждый правильный ответ 0,5 б (всего 1,5 балла), в последующих вопросах за каждый правильный ответ -1 балл. Всего – 7,5 баллов.
2. Задания с развернутым ответом:
-
Простые вещества: Н2, С, — 1 балл за определение простых веществ;
IV II IV I II I V II
-
Сложные веществаСО2, СН4, СаС12, Р2О5 – 1балл за определение сложных веществ, 0,5 балла за определение валентности. Всего 4 балла
-
Вычислите массовую долю водорода в молекуле метана СН4.
Мr (CH4) = 12 + 1x 4 = 16 – 1 балл
W (C ) = 12 : 16 x 100% = 75 % — 1 балл
W (H) = 4 : 16 x 100% = 25 % — 1 балл
Всего – 3 балла
-
Расставьте коэффициенты в схемах химических реакций и укажите тип каждой реакции:
а) 2NH3 = N2 +3 H2↑ — реакция разложения
б) 2Na + Cl2 = 2 NaCl – реакция соединения
в) 2А1 + 6НС1 = 2А1С13 + 3Н2↑ — реакция замещения
За правильно расставленные коэффициенты в каждом уравнении -1 балл, за определение типа реакции -1 балл. Всего – 6 баллов.
Всего за работу – 20,5 балла.
Критерии оценивания:
«2» — от 0 — 10 баллов, «3» — 10,5 до 15 баллов, «4» -от 15,5 до17 баллов, «5» от 17,5 баллов.
Контрольная работа №1
по теме «Первоначальные химические понятия»
Вариант 1.
Часть 1
1.К чистым веществам относится:
1)почва; 2)алмаз; 3) кровь; 4) минеральная вода.
2.Водный раствор поваренной соли можно разделить на два чистых вещества:
1) отстаиванием; 2) выпариванием; 3) фильтрованием; 4) охлаждением.
3.Химическое явление происходит:
1) при плавлении олова; 2) при дистилляции воды; 3) при ржавлении железа; 4) при возгонке йода.
4. К сложным веществам относится каждое из двух веществ, формулы которых:
1) NO2 и S8; 2) NaOH и CaCO3 ; 3) СuO и Al; 4) N2 и H2SO4.
5. Распределите на группы следующие объекты:
— вещества (А) и тела (Б)
1)снежинка; 2)сера; 3)железный гвоздь; 4)медь; 5) медная скрепка; 6)вода
6.Вычислите относительную молекулярную массу для следующих веществ: а) Al2O3 б) N2O3 в) KNO2
Часть 2.
7. Что обозначает запись: 5О, 2Н2S, 3Al, 6H2
8. Предложите план разделения смеси, которая состоит из медных, железных и деревянных опилок.
Часть 3.
9.Вычислите массовые доли элементов в веществе CuO.
10.Выведите формулу вещества по известной массовой доли элементов входящих в состав данного вещества: элементный состав вещества следующий: массовая доля элемента железа 72,41%, массовая доля кислорода 27,59%.
Контрольная работа №1
по теме «Первоначальные химические понятия»
Вариант 2.
Часть 1
1.Только чистые вещества перечислены в группе:
1) морская вода; угарный газ; уксус.
2) питьевая сода, мрамор, нефть.
3) поваренная соль, графит, кислород.
4) речной песок, воздух, гранит.
2. Фильтрованием можно разделить смесь, состоящую:
1) из воды и сахара; 2) из бензина и воды; 3) из растительного масла и воды; 4) из глины и воды.
3.Физическое явление происходит:
1) при гниении древесины; 2) при перегонке воздуха; 3) при горении алюминия; 4) при гашении пищевой соды уксусом.
4. К простым веществам относится каждое из двух веществ, формулы которых:
1) Mg и H2S; 2)O3 и Al; 3)S8 и K2SiO3; 4)NH3 и Al2O3
5.Распределите на группы следующие объекты:
— вещества (А) и тела (Б)
1)железный нож; 2)сахар; 3)медный гвоздь; 4)медь; 5) железо; 6)ртуть
6. Вычислите относительную молекулярную массу для следующих веществ: а) HBr б) Na2O в) Са(OH)2
Часть 2.
7. Что обозначает запись: 5О2, 4Н, 2Fe, 3К2О
8. Предложите план разделения смеси, которая состоит из соли, песка, железных и деревянных опилок.
Часть 3.
9.Вычислите массовые доли элементов в веществе Ag2O.
10. Выведите формулу вещества по известной массовой доли элементов входящих в состав данного вещества: элементный состав вещества следующий: массовая доля w(Cu) = 88,9% и w(O) = 11,1%.
Правильные ответы.
І. Тест
В – І
| Вариант 1 | Вариант 2 |
| 2 | 1)3 |
| 2 | 2)4 |
| 3 | 3)2 |
| 2 | 4)2 |
| А) (вещества) — 2,4,6 Б) (тела) – 1,3,5 | 5) А) (вещества) – 2,4,5,6 Б) (тела) – 1,3 |
В-1
6.Mr(Al2O3)=102; Mr(N2O3)=76; Mr(KNO2)=85;
7. 5О – пять атомов кислорода
4Н – четыре атома водорода
2Fe – два атома железа
3К2О — три молекулы сложного вещества, в состав котрого входять два атома калия и один атом кислорода
Часть 3.
9. Решение задачи: w(Cu)=80%; w(O)=20%
10. Решение задачи: Fe3O4.
В-2
6. Mr(HBr)=81; Mr(Na2O)=62; Mr(Ca(OH)2)=74;
7. 5О2 – пять молекул кислорода
6Н2 – шесть атомов водорода
3Al – три атома алюминия
2Н2S — две молекулы сложного вещества, в состав котрого входять два атома водорода и один атом серы
Часть 3.
10.Решение задачи: w(Ag)=93,1%; w(O)=6,9%
11. Cu2O
Критерии оценивания.
Максимальное баллов – 29
Тест оценивается в 4 балла (1 балл за каждое правильно выполненное задание );
5. Оценивается в 3 баллов (1 балл за каждое правильно выполненное соответствое)
6. Оценивается в 3 балла (за каждое правильное определение относительной молекулярной массы)
7. Оценивается в 4 балла (за каждое правильное определение атомов и молекул в веществе)
8. Оценивается в 3 балла (за каждое правильное разделение смеси)
9. Оценивается в 5 баллов:
— составить молекулярную формулу;
— найти молекулярную массу;
— записать формулу для расчета массовой доли;
— рассчитать массовую долю элементов;
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| В ответе допущена ошибка в одном из названных выше элементов | 4 |
| В ответе допущена ошибка в двух из названных элементов | 3 |
| В ответе допущена ошибка в трех из названных элементов | 2 |
| В ответе допущена ошибка в четырех из названных элементов | 1 |
| Все элементы задачи записаны неверно | 0 |
10. Оценивается в 4 балла
— записать формулу для расчета массовой доли;
— составить молекулярную формулу;
| Ответ правильный и полный, включает все названные выше элементы | 4 |
| В ответе допущена ошибка в одном из названных выше элементов | 3 |
| В ответе допущена шибка в двух из названных элементов | 2 |
| В ответе допущена шибка в трех из названных элементов | 1 |
| Все элементы задачи записаны неверно | 0 |
— отметка «5» выставляется обучающемуся, если 11-22 баллов;
— отметка «4» выставляется обучающемуся, если 14– 17 баллов;
— отметка «3» выставляется обучающемуся, если 9 – 13 баллов;
— отметка «2» выставляется обучающемуся, если меньше 8 баллов
3. Разделите предложенные вещества на простые и сложные:
CuO; Fe, AlF3; O3, PbCl2; HNO2
Дайте названия бинарным соединениям и определите валентность элементов в следующих соединениях
4.Расставьте коэффициенты в следующих уравнениях, укажите тип химической реакции
-
CaO + HCl = CaCl2 + H2O
-
Cu(OH)2 →H2O + CuO
-
Na + H2O → NaOH + H2
-
Na2O + H2O = NaOH
В реакции обмена укажи реагенты .
5.Рассчитайте массовую долю химических элементов в соединении Na2SO4
-
класс КОНТРОЛЬНАЯ РАБОТА №1
Вариант № 3
-
Определите положение в ПС химического элемента с порядковым номером 47.
-
Разделите предложенные явления на физические и химические. Укажите признаки протекания химических реакций.
1) скисания молока
2) засахаривания варенья
3) обугливания древесины
4) варка яйца
-
Разделите предложенные вещества на простые и сложные:
FeCl3; PbO2; Br2; Li2S; Al; Na2SO4
Дайте названия бинарным соединениям и определите валентность элементов в следующих соединениях
-
Расставьте коэффициенты в следующих уравнениях, укажите тип химической реакции.
P2O3 + O2 → P2O5
KOH + SO2 → K2SO3+ H2O
Cr2O3 + Al → Cr + Al2O3
KNO3 → KNO2 + O2
В реакции замещения укажи продукты реакции.
-
Рассчитайте массовую долю химических элементов в соединении Mg(NO3)2
-
класс КОНТРОЛЬНАЯ РАБОТА №1
Вариант №4
-
Определите положение в ПС химического элемента с порядковым номером 30.
-
Разделите предложенные явления на физические и химические. Укажите признаки протекания химических реакций.
1) обугливания древесины
2) плавления парафина
3) гниение мяса
4) растворения сахара в воде
-
Разделите предложенные вещества на простые и сложные:
H2, CaO, Cl2, BaS, CuBr2, H2SO4
Дайте названия бинарным соединениям и определите валентность элементов в следующих соединениях
-
Расставьте коэффициенты в следующих уравнениях, укажите тип химической реакции.
Fe(OH)3 → Fe2O3 + H2O
NaOH + H3PO4 → Na3PO4 + H2O
NO2 + O2 + H2O → HNO3
CuO + H2 = Cu + H2O
В реакции соединения укажи реагенты.
-
Рассчитайте массовую долю химических элементов в соединении Al2(SO4)3
-
класс КОНТРОЛЬНАЯ РАБОТА №1
Вариант № 5
-
Определите положение в ПС химического элемента с порядковым номером 56.
-
Разделите предложенные явления на физические и химические. Укажите признаки протекания химических реакций.
1) ржавления гвоздя
2) скисания яблочного сока
3) перегонки нефти
4) прогоркание масла
-
Разделите предложенные вещества на простые и сложные.
FeCl2; Br2; H2, BaO, Cl2, CuBr2, H2SO3
Дайте названия бинарным соединениям и определите валентность элементов в следующих соединениях.
-
Расставьте коэффициенты в следующих уравнениях, укажите тип химической реакции.
SO2 + KOH = K2SO3 + H2O
H2 + N2 = NH3
CO2 + Mg = C + MgO
(NH4)2CO3 = NH3 + CO2 + H2O
В реакции разложения укажи продукты реакции.
-
Рассчитайте массовую долю химических элементов в соединении K2Cr2O7
-
класс КОНТРОЛЬНАЯ РАБОТА №1
Вариант № 6
-
Определите положение в ПС химического элемента с порядковым номером 44.
-
Разделите предложенные явления на физические и химические. Укажите признаки протекания химических реакций.
-
ржавления гвоздя
-
гниение листвы
-
измельчения сахара до состояния пудры
-
обугливания древесины
-
Разделите предложенные вещества на простые и сложные.
Cl2, BaS, H2SO4 CuO; O3, PbCl4;
Дайте названия бинарным соединениям и определите валентность элементов в следующих соединениях.
-
Расставьте коэффициенты в следующих уравнениях, укажите тип химической реакции.
Al + H2O = Al(OH)3 + H2
Fe(OH)3 = Fe2O3 + H2O
Al2O3 + HNO3 = Al(NO3)3 + H2O
Р + О2 → Р2О5
В реакции замещения укажи реагенты.
-
Рассчитайте массовую долю химических элементов в соединении (NH4)2SO4
Контрольная работа № 1 по химии в 8 классе «Атомы химических элементов» с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 12. Контрольная работа по теме «Атомы химических элементов». Цитаты из пособия использованы в учебных целях. Химия 8 Габриелян Контрольная работа № 1.
Цели урока: проверка знаний и умений учащихся, степени усвоения ими учебного материала.
Тип урока: урок развивающего контроля.
Оборудование: карточки с заданиями, справочные таблицы.
ХОД УРОКА
1. Организационный момент
Мотивация к учебной деятельности. Учитель сообщает тему урока, формулирует цели урока.
2. Выполнение контрольной работы
Контрольная работа по химии. Вариант 1

- Строение какого атома отображает схема: +х)2)8)4 ?
- Какой атом имеет заряд ядра + 8?
- По два электронных слоя имеют атомы:
1) гелия и лития; 2) бериллия и магния;
3) бора и кислорода; 4) алюминия и натрия. - И азот, и фосфор имеют
- 1) одинаковое число электронов на внешнем электронном слое;
- 2) одинаковое число протонов в ядре;
- 3) одинаковое число нейтронов в ядре;
- 4) одинаковое число электронов в атоме.
- Чем отличается ион кислорода от атома кислорода? Ответ объясните.
- Определите ряд элементов, расположенных в порядке усиления их металлических свойств.
- 1) литий, натрий, калий;
- 2) натрий, магний, алюминий;
- 3) водород, литий, бериллий;
- 4) кальций, магний, бериллий.
- Ионная химическая связь образуется между:
- 1) кислородом и серой;
- 2) водородом и углеродом;
- 3) водородом и кислородом;
- 4) калием и фтором.
- Соотнесите вид химической связи и вид атомов.
| Вид связи | Атомы с данным видом связи |
| A. Ионная | 1. Атомы одного элемента – металла |
| Б. Ковалентная полярная | 2. Атомы одного элемента – неметалла |
| B. Ковалентная неполярная | 3. Атомы разных химических элементов – неметаллов |
| Г. Металлическая | 4. Атомы элементов–металлов и элементов – неметаллов |
- Определите валентность элементов в соединениях с формулами: Н2O; CuO; Аl2O3; SO3; Р2O5
- Подсчитайте по формуле Р2O3 относительную молекулярную массу оксида фосфора, вычислите массовые доли химических элементов Р и О.
- Какие из приведенных утверждений верны?
А. Физические явления сопровождаются изменением формы тела, агрегатного состояния вещества.
Б. Плавление олова относится к химическим явлениям.
- Химический элемент — это
- 1) определенный вид одинаковых молекул;
- 2) определенный вид атомов;
- 3) простое вещество;
- 4) названия видов атомов.
- Что является предметом изучения химии?
1) вещества; 2) тела; 3) тела и вещества;
4) вещества, их свойства, превращения и явления, сопровождающие эти превращения.
Контрольная работа по химии. Вариант 2

- Строение какого атома отображает схема: +х)2)6 ?
- Какой атом имеет заряд ядра +16 ?
- По два электрона на внешнем энергетическом уровне имеют атомы:
1) гелия и лития; 2) бериллия и магния;
3) бора и кислорода; 4) алюминия и натрия.
- Натрий и хлор имеют:
- 1) одинаковое число электронных слоев;
- 2) одинаковое число протонов в ядре;
- 3) одинаковое число нейтронов в ядре;
- 4) одинаковое число электронов в атоме.
- Какие ионы имеют электронные оболочки такие же, как у инертного газа неона?
1) Li+ и F–; 2) Сl– и Na+; 3) F– и Na+; 4) F– и Сl–.
- Определите ряд элементов, расположенных в порядке усиления их неметаллических свойств.
- 1) литий, натрий, калий;
- 2) сера, фосфор, кремний;
- 3) углерод, азот, кислород;
- 4) бор, алюминий, магний.
- При помощи ковалентной полярной связи образовано вещество
1) O2; 2) ВаСl2; 3) СО2, 4) К2O.
- Соотнесите вид химической связи и вещества.
| Вид связи | Вещества с данным видом связи |
| A. Ионная | 1. Хлорид фосфора |
| Б. Ковалентная полярная | 2. Оксид кальция |
| B. Ковалентная неполярная | 3. Цезий |
| Г. Металлическая | 4. Азот |
- Составьте формулы соединений следующих элементов: К, Ва, Al, P(V), Mg с хлором, зная, что он в этих соединениях одновалентен.
- Подсчитайте по формуле Р2O5 относительную молекулярную массу оксида фосфора, вычислите массовые доли химических элементов Р и О.
- Какие из приведенных утверждений верны?
А. Все химические явления сопровождаются изменением формы тела, агрегатного состояния вещества.
Б. Пригорание масла во время приготовления пищи относится к химическим явлениям.
- В каком ряду расположены только вещества?
- 1) поваренная соль, сахар, свеча;
- 2) вода, железо, сера;
- 3) медь, гвоздь, кислород;
- 4) кирпич, медная монета, стакан керамический.
- Определите формы существования химического элемента.
1) свободные атомы; 2) сложные вещества;
3) простые вещества; 4) верно все перечисленное.
3. Рефлексия учебной деятельности
В конце урока учитель раздает на каждую парту краткую запись с ответами на контрольную работу.
Ответы на контрольную работу. Вариант 1
- Кремния.
- Атом кислорода.
- 3) бора и кислорода.
- 1) одинаковое число электронов на внешнем электронном слое;
- Количеством электронов.
- 1) литий, натрий, калий;
- 4) калием и фтором.
- А — 4, Б —3, В — 2, Г — 1.
- …
- …
- А. — Верно.
- 2) определенный вид атомов.
- 4) вещества, их свойства, превращения и явления, сопровождающие эти превращения.
Ответы на контрольную работу. Вариант 2
- Кислорода.
- Атом серы.
- 2) бериллия и магния.
- 1) одинаковое число электронных слоев;
- 3) F– и Na+;
- 3) углерод, азот, кислород;
- 3) СО2
- А — 2, Б —1, В — 4, Г —3.
- КСl, ВаСl2, АlСl3, PCl5, MgCl2
- …
- Б — Верно.
- 2) вода, железо, сера.
- 4) верно все перечисленное.
4. Домашнее задание
- Подготовить сообщения на тему «Металлы в жизни человека».
- Пользуясь научно–популярной литературой, подготовьте сообщение по одной из тем: «Физические свойства металлов», «Роль металлов в технике», «Металлы в нашем доме».
Вы смотрели: Контрольная работа по химии в 8 классе с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 12. Контрольная работа по теме «Атомы химических элементов» + ОТВЕТЫ.
Смотреть Список всех контрольных по химии в 8 классе по УМК Габриелян.
Вернуться к Списку уроков Тематического планирования по химии в 8 классе.
