11 класс
Контрольная работа №1 по теме «Химические реакции»
Вариант №1
Часть А
1. Характеристика реакции, уравнение которой 4Fe + 6H2O + 3O2 →4Fe(OH)3:
1) Соединения, ОВР 2) Замещения, ОВР 3) Обмена, не ОВР 4) Разложения ,ОВР
2. Окислитель в реакции синтеза аммиака, уравнение которой N2 + 3H2 = 2NH3 + Q
1) N0 2) H0 3) H+1 4) N–3
3. Наиболее сильной кислотой из перечисленных является:
1) H2CO3 2) H3PO4 3) H2SO4 4) H2SO3
4. Осадок образуется при взаимодействии хлорида калия с:
1) AgNO3 2) NaOH 3) H2SO4 4) NaCl
5. Укажите уравнение реакции обмена
-
2
 Н2О + 2 Na = 2NaOH + H2
Н2О + 2 Na = 2NaOH + H2 -
C
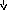 aCl2 + Na2CO3 = CaCO3 + 2NaCl
aCl2 + Na2CO3 = CaCO3 + 2NaCl -
2
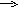
 KMnO4 t K2MnO4 + MnO2 + O2
KMnO4 t K2MnO4 + MnO2 + O2 -
2SO2 + O2 = 2 SO3
Часть В.
1.Дайте характеристику данной реакции по всем признакам классификации
t,Ni
C4H10 (г) ↔ С4H8 (г)+ H2(г)+Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции.
Mg + HCl = MgCl2 + H2
3.Написать реакции ионного обмена между:
а) сульфит натрия + соляная кислота;
б) гидроксид калия + бромоводородная кислота;
в) нитрат серебра + хлорид калия;
11 класс
Контрольная работа №1 по теме «Химические реакции»
Вариант №2
1. Характеристика реакции, уравнение которой 4KClO3 → 2KCl + 3O2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
2. Восстановитель в реакции, уравнение которой 2СО + О2 = 2СО2 + Q
1) С+2 2) С+4 3) О0 4) О–2
3. К неэлектролитам относится:
1) ZnO 2) Ba(OH)2 3) H2SO4 4) Na2SO3
4.Определите коэффициент перед восстановителем в уравнении реакции по схеме:
C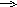 a + H2O Ca(OH)2 + H2
a + H2O Ca(OH)2 + H2
-
2
-
1
-
3
-
4
5. Верно утверждение, что реакция: Zn + 2 HCl → ZnCl2 + Н2
а) окислительно-восстановительная;
б) обмена;
в) обратимая;
г) каталитическая.
Часть В.
1.Дайте характеристику данной реакции по всем признакам классификации
t,Ni
2SO2 (г) + O2(г ) ↔ 2SO3 (г) + Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции.
N2 + H2 = NH3
3.Написать реакции ионного обмена между:
а) карбонат калия + азотная кислота;
б) гидроксид кальция + серная кислота;
в) хлорид бария + сульфат магния;
Вариант№3
1.Дайте характеристику данной реакции по всем признакам классификации
C(т) + O2 (г) = CO2 (г) + Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) гомогенная, гетерогенная;
Д) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель
и окислитель этой реакции. S + N2O = SO2 +N2
3.Кака нужно изменить температуру ,давление и концентрацию кислорода, чтобы химическое
равновесие сместить в сторону образования продуктов реакции:
N2 +O2 ↔ 2NO — Q
4.Написать реакции ионного обмена между: а) гидроксид натрия + серная кислота
б) сульфид калия + соляная кислота
в) сульфат натрия +нитрат бария
5.При сгорании 14 г этилена выделяется 700 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
Вариант №4
1.Дайте характеристику данной реакции по всем признакам классификации
CaCO3 (т) = CaO( т) + CO2 (г) — Q
А) реакция соединения, разложения, обмена, замещения;
Б) ОВР, не ОВР;
В) обратимая, необратимая;
Г) гомогенная, гетерогенная;
Д) )экзотермическая, эндотермическая;
Е) каталитическая , некаталитическая;
2.Написать ОВР методом электронного баланса, определить восстановитель и
окислитель этой реакции. C + O2 = CO2
3.Кака нужно изменить температуру ,давление и концентрацию кислорода, чтобы химическое
равновесие сместить в сторону образования продуктов реакции:
2SO2 + O2 ↔ 2SO3 +Q
4.Написать реакции ионного обмена между: а) уксусная кислота + гидроксид натрия
б) хлорид меди (II) +гидроксид калия
в) хлорид бария + сульфат натрия
5.При сжигании 15г кальция до оксида кальция выделилось 238,5 кДж энергии.
Составьте термохимическое уравнение этой реакции.
Контрольная работа № 1 по химии в 9 классе «Классификация химических реакций» с ответами (3 варианта) для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 1.
КР-1. Вариант 1
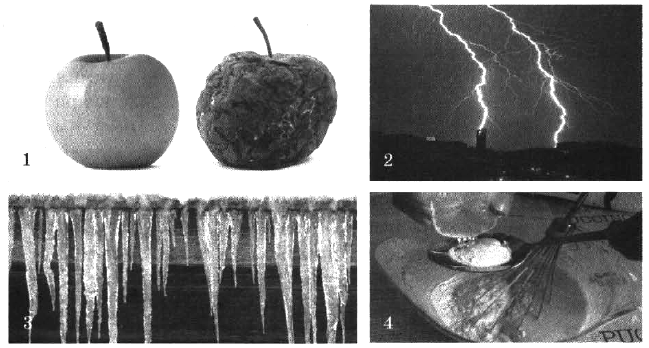
- Дайте определение окислительно-восстановительным реакциям. На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.
- Определите степени окисления элементов и роль (окислитель/ восстановитель) частицы в ОВР, название процесса (окисление/ восстановление) и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенных соединений определите, окислителем или восстановителем оно является в ОВР
NaH, PbO, SiO2, SO3, Р2O3, Li3N, PbO2, N2O5, КСlO3, K2MnO4.
б) по следующим схемам:
1) 2Вг– – 2е → Вг2х= ______; 4) Сl+5 + 6е → Сlх= ______
2) Fe0 – 3e → Fex= _______; 5) S+6 ______ → S+4 ______
3) O20 + 4е → 2Oх= ______; 6) S0 ______ → S+6 ______ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _КСlO3 + _S → _КСl + _SO2
2) _KMnO4 + _H2S + ______ = _MnSO4 + _S + ___ + ____ - Дан ряд веществ: оксид меди(II), соляная кислота, гидроксид калия, водород, карбонат натрия. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Определите количество теплоты, которое выделится при обжиге 720 г FeS2 согласно термохимическому уравнению реакции 4FeS2 (TB.) + 11О2(Г) = 8SО2(Г) + 2Fe2О3(TB) + 3310 кДж.
2) При соединении 2,3 г натрия с хлором выделяется 20,57 кДж теплоты. Составьте термохимическое уравнение реакции. - Химическая реакция протекает по уравнению 3А + В = С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л • ч). Какова будет скорость этой реакции при 30 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - Проанализируйте возможность изменения скорости реакции:
1) Приведите все факторы, способствующие увеличению скорости химической реакции FeO(TB.) + СО (Г) → Fe (TB.) + СО2 (Г).
2) Перечислите факторы, которые не влияют на скорость реакции 2С(TB.) + СО2(Г) = 2СО(Г) - 1) Рассмотрите факторы, влияющие на состояние равновесия реакции N2(Г)+ О2(Г) ⇔ 2NO(Г) – Q.
2) Какие факторы позволят сместить равновесие в системе в сторону продуктов реакции I2(Г) + Сl2(Г) ⇔ 2IСl(Г) + Q?
Ответы на задания Варианта 1
Открыть ОТВЕТЫ на Вариант 1
Химия 9 Рудзитис Контрольная работа 1. Вариант 2
- Дайте определение окислительно-восстановительным реакциям.
На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.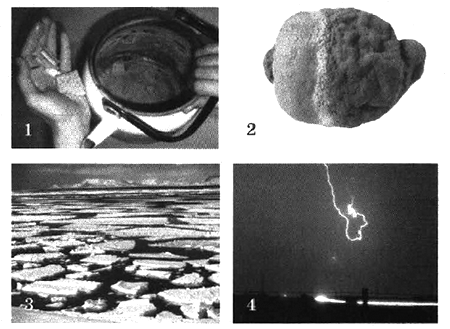
- Определите степени окисления элементов и роль (окислитель и восстановитель) частицы в ОВР, название процесса и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенного соединения определите, окислителем или восстановителем оно является в ОВР
SiF4, HBr, СuСl2, РСl3, NaBr, Na3N, Mg2Si, NaNO3, K3PO4, Al2(SO4)3
б) по следующим схемам:
1) 2Сl– – 2е → Сl2x= ______; 4) N+5 + 8e → Nx= _______
2) Аl0 – 3е → Аlx= ______; 5) Mn+7 ______ → Mn+4 _______
3) N20 + 6е → 2Nx= _______; 6) N+2 _____ → N+4 _______ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _КМnO4 + _KBr + _H2SO4 = _MnSO4 + Br2 + K2SO4 + H2O
2) _FeSO4 + _KMnO4 + ______ = _Fe2(SO4)3 + _MnSO4 + _____ + _____ - Дан ряд веществ: оксид железа(II), гидроксид натрия, оксид углерода(II), серная кислота, карбонат кальция. Из предложенного перечня выберите вещества, между которыми возможна окислительно–восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Термохимическое уравнение сгорания железа:
4Fe + 3O2 = 2Fe2O3 + 1646 кДж.
В результате реакции выделилось 2057,5 кДж. Определите массу образовавшегося при этом оксида железа(III).
2) При сгорании 1,3 г цинка выделяется теплота количеством 6,96 кДж. Составьте термохимическое уравнение этой реакции. - Химическая реакция протекает по уравнению А + В = 2С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л • ч). Какова будет скорость этой реакции при 40 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - 1) Рассмотрите факторы, способствующие увеличению скорости реакции 2NO2(Г) = 2NO(Г) + О2(Г).
2) Перечислите факторы, которые не влияют на скорость реакции Zn + CuCl2 = ZnCl2 + Сu. - 1) Рассмотрите факторы, влияющие на состояние равновесия на примере системы 2SO2 + O2 ⇔ 2SO3 + Q.
2) Определите, какие факторы позволят сместить равновесие в сторону продуктов реакции на примере системы Fe2O3(ТВ) + 3СО(Г) ⇔ 2Fe(TB.) + 3СO2(Г) + Q.
Ответы на задания Варианта 2
Открыть ОТВЕТЫ на Вариант 2
Химия 9 Рудзитис Контрольная работа 1. Вариант 3
- Дайте определение окислительно-восстановительным реакциям.
На каких рисунках изображены окислительно-восстановительные реакции? Ответ обоснуйте.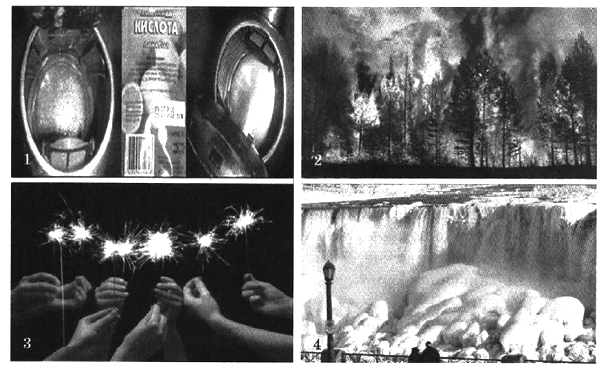
- Определите степени окисления элементов и роль (окислитель и восстановитель) частицы в ОВР, название процесса и число электронов, принимающих в них участие:
а) по формуле соединения (полученные значения запишите над символами элементов) для выделенного соединения определите, окислителем или восстановителем оно является в ОВР
CuCl, SbCl3, P2O5, N2O3, MnO, CrO3, Na2S, Al4C3, Zn(NO3)2, HNO3
б) по следующим схемам:
1) 2N–3 – 6е —> N2x= _____; 4) N+5 + 3е —> Nx= ______
2) Са0 – 2е —> Сах= _____; 5) Сг+6 ______ —> Сг+3 ______
3) Сl20 + 2е —> 2Сlх= ______; 6) N–3 _____ —> N+2 _____ - Расставьте коэффициенты в схемах ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
1) _KNO2 + _КМnO4 + _Н2O = _KNO3 + _МnO2 +_КОН
2) _KMnO4 + _KBr + ____ = _MnSO4 + Вг2 + ___ + ____ - Дан ряд веществ: оксид хрома(III), серная кислота, гидроксид натрия, алюминий, сульфит натрия. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
- Проведите вычисления, связанные с тепловым эффектом химической реакции:
1) Дано термохимическое уравнение: 2С(ТВ.) + Н2(Г) = С2Н2(Г) – 228 кДж. В реакции поглотилось 95 кДж теплоты. Определите массу углерода, вступившего в реакцию.
2) При полном восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж теплоты. Составьте термохимическое уравнение этой реакции. - Химическая реакция протекает по уравнению А + 2В = С. По приведённым в таблице экспериментальным данным рассчитайте концентрации веществ через 30 минут после начала реакции и среднюю скорость реакции в данном промежутке времени.

- При повышении температуры на 10 °С скорость некоторой реакции возрастает в 2 раза. При 20 °С скорость реакции равна 0,04 моль/(л•ч). Какова будет скорость этой реакции при 10 °С?
Постройте график зависимости скорости реакции от температуры для данных условий. - Рассмотрите факторы, которые влияют или нет на скорость химической реакции.
1) Приведите все факторы, способствующие увеличению скорости химической реакции 2CuS(ТВ.) + 3О2(Г) = 2CuO(ТВ.) + 2SО2(Г).
2) Перечислите факторы, которые не влияют на скорость реакции СаО(TB.) + 3С(ТВ.) = СаС2(ТВ.) + СО(Г). - 1) Рассмотрите все факторы, влияющие на состояние равновесия на примере системы СО2(Г) + С(ТВ.) ⇔ 2СО(Г) – Q.
2) Определите, какие факторы позволят сместить равновесие в сторону продуктов реакции на примере системы 3O2(Г) ⇔ 2O3(Г) – Q.
Ответы на задания Варианта 3
Открыть ОТВЕТЫ на Вариант 3
Вы смотрели: Контрольная работа по химии 9 класс «Классификация химических реакций» с решениями и ответами (3 варианта). Автор работы: Т.А.Боровских. Используется в комплекте с учебником Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 9 класс». Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 1.
Смотреть Список всех контрольных по химии в 9 классе УМК Рудзитис, Фельдман.
Контрольная работа
«Типы химической реакции»
Вариант 1
1. Расставьте коэффициенты, определите тип реакции:
а) H2 + N2 →NH3
б) CO +O2 → CO2
в) HNO3 → NO2+H2O+O2↑
г ) Ca3N2 + H2O → Ca(OH)2 + NH3↑
д) Ba + H2O → Ba(OH)2 + H2↑
2. Рассчитать степени окисления для каждого элемента в веществе
Al2(SO4)3
3. записать формулы веществ:
А) хлорид магния
Б) сульфат железа (III)
В) соляная кислота
4. В реакции меди с кислородом (О2) образовалось 800 г оксида меди (II). Рассчитать, какая масса меди вступила в реакцию с кислородом?
5. Составить уравнения и определить тип реакции:
А) хлорид железа (II) + гидроксид натрия
Б) цинк + серная кислота
Контрольная работа
«Типы химической реакции»
Вариант 2
1. Расставьте коэффициенты, определите тип реакции:
а) Mg + N2 →Mg3N2
б) C +Cr2 O3→ CO2 +Cr
в) HNO3 + CaO→ Ca(NO3)2+H2O
г ) Na + H2O → NaOH+ H2↑
д) Ba O+ H2SO4 → BaSO4 ↓+ H2O
2. Рассчитать степени окисления для каждого элемента в веществе
Fe(NO3)3
3. Записать формулы веществ:
А) сульфид железа (III)
Б) серная кислота
В) гидроксид меди (II)
4. По уравнению реакции CuCl2 +Mg →MgCl2 +Cu, вычислите количество вещества меди , если в реакцию с хлоридом меди (II) вступило 480 г магния.
5. Составить уравнение и определить тип реакции
А) сульфат бария + серная кислота
Б) соляная кислота + карбонат кальция
Контрольная работа
«Типы химической реакции»
Вариант 3
1. Расставьте коэффициенты, определите тип реакции:
а) P + S →P2S3
б) CuO +Al → Al2O3 +Cu
в) HNO3 + CaCO3→ Ca (NO3)2+H2O +CO2↑
г ) KClO3 → KCl+ O2↑
д) KOH+ H3PO4 → K3PO4 + H2O
2. Рассчитать степени окисления для каждого элемента для вещества
Na2SiO3
3. Записать формулы веществ:
А) сульфат натрия
Б) нитрат железа (II)
В) гидроксид магния
4. По уравнению реакции O2 +K →K2O, вычислите объём кислорода (н.у) , если в реакцию с кислородом вступило 390 г калия.
5. Составить уравнение и определить тип реакции
А) силикат натрия + соляная кислота
Б) фосфорная кислота + гидроксид алюминия
Контрольная работа
«Типы химической реакции»
Вариант 4
1. Расставьте коэффициенты, определите тип реакции:
а) P2О5 + Н2О →Н3РО4
б) Cl2+Al → AlCl3
в) NaNO3 → NaNO2+O2↑
г ) KBr +Cl2 → KCl+ Br2↑
д) K2O+ H3PO4 → K3PO4 + H2O
2.Раставить степени окисления для каждого элемента в веществе
K2CO3
3. Записать формулы веществ:
А) нитрат натрия
Б) сульфат железа (II)
В) кремневая кислота
4. По уравнению реакции Al + O2 →Al2O3, вычислите количество молекул кислорода, если в реакцию вступило 270 г алюминия.
5. Составить уравнение и определить тип реакции
А) алюминий + серная кислота
Б) карбонат калия + соляная кислота
Контрольная работа «Типы химических реакций» (Костя)
Какие реакции называются реакциями горения?
Какие реакции называются экзотермическими и эндотермическими реакциями?
Что называется веществом? Какие вещества называются простыми и сложными?
Какими признаками сопровождаются химические реакции?
Какие явления называются химическими и чем они отличаются от физических явлений?
Какими признаками сопровождаются химические реакции?
Перечислите, в каких случаях реакции обмена идут до конца.
Тематическая контрольная работа №1 по химии в 9 классе с использованием технологии уровневой дифференциации.
Тема: Контрольная работа №1 по теме «Химические реакции».
Цель: определение уровня овладения знаниями по теме «Химические реакции в водных растворах»»
Тип урока: Урок контроля и коррекции
Ход урока.
1. Орг. момент.
2. Постановка цели и задач урока. Мотивация учебной деятельности учащихся. Предъявление критериев выставления оценки.
3. Выявление знаний, умений и навыков, проверка уровня сформированности у обучающихся общеучебных умений. Задания по объему или степени трудности должны соответствовать программе и быть посильными для каждого ученика.
I вариант (1 уровневая группа)
-
Составьте уравнения химических реакций в молекулярной и ионной формах, в результате которых:
а) образуется вода; б) выпадает осадок; в) выделяется газ
при условии, что одним из исходных веществ является серная кислота.
-
При гидролизе каких из нижеприведенных солей:
а) хлорид натрия; б) нитрат алюминия;
в) сульфат калия; г) хлорид железа
среда будет кислая? Напишите уравнения первой стадии реакций гидролиза этих солей.
-
В трех пробирках даны растворы:
а) гидроксида калия; б) сульфата калия; в) фосфата калия.
Как определить, какое вещество находится в каждой из пробирок? Оформите план работы и объясните. Запишите соответствующие химические реакции в молекулярном и ионном виде.
-
Как практически осуществить процессы, схематически изображенные следующими ионными уравнениями?
а) Zn2++2OH-→Zn(OH)2↓ б) Fe+Cu2+→Fe2++Cu
Приведите примеры и напишите уравнения реакций.
II вариант (2 уровневая группа)
-
Напишите уравнения возможных реакций между веществами:
а) нитратом бария и сульфатом калия;
б) сульфатом меди (II) и сульфидом натрия;
в) сульфидом натрия и соляной кислотой;
г) оксидом углерода (IV) и гидроксидом натрия;
д) гидроксидом натрия и карбонатом калия;
Для реакций ионного обмена запишите ионные полные и сокращенные уравнения.
-
Напишите уравнения реакций в молекулярной и полной ионной формах, удовлетворяющие сокращенным ионным уравнениям:
а) AL3+ + 3OH- → AL(OH)3
б) 2H+ + CO32- → H2O + CO2
-
Напишите уравнения реакций гидролиза карбоната аммония, хлорида цинка. Определите среду растворов.
-
Объясните, как можно определить качественный состав хлорида калия.
III вариант (3 уровневая группа)
-
Какие ионы содержатся в водных растворах следующих веществ:
AlCl3 NaBr K2SO4 HNO3
Напишите уравнения электролитической диссоциации.
-
Напишите полные и сокращенные ионные уравнения следующих реакций:
а) HCl + Na2CO3 →
б) CuSO4 + NaOH →
-
Каково значение гидролиза солей для биосферы?
-
Из приведенных ниже названий веществ выберите только названия электролитов.
а) Глюкоза (водный раствор) б) Соляная кислота
в) Поваренная соль (водный раствор) г) Гидроксид калия (водный
раствор)
IV вариант ( 4 уровневая группа)
-
Составьте уравнения электролитической диссоциации электролитов:
K2SO4, MgNO3 , H2SO4
-
Напишите полные и сокращенные ионные уравнения следующих
реакций:
а) 2KOH + Zn(NO3)2 → 2KNO3 + Zn(OH)2
б) NaOH + HCl → NaCl + H2O
-
Какие вещества называются электролитами, а какие неэлектролитами, приведите примеры веществ.
-
Напишите формулы веществ, при растворении которых в воде образуются следующие ионы:
а) Ca2+ и Cl- б) Fe3+ и NO3- в) K+ и OH-
4. Рефлексия. Оценить полученные результаты собственной деятельности. При необходимости определить задание для самоподготовки (домашние задание с элементами выбора, творчества)
Первая группа. Учащиеся обладают высшими учебными возможностями, усваивают новый материал быстро, они свободно выполняют упражнения, решают задачи. У этих учащихся проявляется высокая самостоятельность. Владея навыками самостоятельной работы лучше своих одноклассников, они могут свободно работать без постоянного надзора учителя. Эти учащиеся нуждаются в заданиях повышенной степени трудности.
Вторая группа. Ученики с высокими учебными возможностями имеют прочные знания. Они обладают несколько меньшим потенциалом, чем ученики первой группы, но усваивают материал почти на том же уровне. Эти учащиеся хорошо учатся, работают в быстром темпе. Однако нуждаются в некотором корректировании их деятельности, периодическом контроле за их учебными действиями.
Третью группа. Учащиеся со средними учебными возможностями. Отдельные из них, обладая высокой обучаемостью, характеризуются низкой учебной работоспособностью. У них нет прилежания, высокой целеустремленности в учебной деятельности. Эти ученики нуждаются в том, чтобы их деятельность тщательно направлялась, осуществлялся оперативный контроль за их работой. В этой же группе ученики с типичными средними показателями в обучаемости. Эти учащиеся медленнее, чем их одноклассники из первой группы, усваивают понятия и всю систему знаний. В процессе учебной деятельности они не всегда могут напряженно работать, тщательно выполняют задание учителя только некоторые из них. При организации учебной деятельности учащихся этой группы необходимо строго соблюдать постепенность перехода от простых к сложным. Причем им необходимо выполнить большее число стандартных упражнений, т.е. приобрести определеннее навыки.
Четвертая группа. Ученики с низкими учебными возможностями. Они отличаются тем, что имеют низкий уровень обучаемости. Эти ученики без помощи учителя работать не могут, они не проявляют умственной самостоятельности, отличаются низким темпом усвоения знаний.
В связи с этим на своих уроках использую индивидуальные самостоятельные, контрольные и практические работы, которые предназначаются для всех учащихся класса, но в них учитывается разный уровень.
