| ||
 | ||
| Names | ||
|---|---|---|
| IUPAC name Calcium carbonate | ||
| Other names Aragonite; calcite; chalk; lime; limestone; marble; oyster; pearl | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| DrugBank |
| |
| ECHA InfoCard | 100.006.765 | |
| EC Number |
| |
| E number | E170 (colours) | |
| KEGG |
| |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | CaCO3 | |
| Molar mass | 100.0869 g/mol | |
| Appearance | Fine white powder; chalky taste | |
| Odor | odorless | |
| Density | 2.711 g/cm3 (calcite) 2.83 g/cm3 (aragonite) | |
| Melting point | 1,339 °C (2,442 °F; 1,612 K) (calcite) 825 °C (1,517 °F; 1,098 K) (aragonite)[4][5] | |
| Boiling point | decomposes | |
| Solubility in water | 0.013 g/L (25 °C)[1][2] | |
| Solubility product (Ksp) | 3.3×10−9[3] | |
| Solubility in dilute acids | soluble | |
| Acidity (pKa) | 9.0 | |
| Magnetic susceptibility (χ) | −3.82×10−5 cm3/mol | |
| Refractive index (nD) | 1.59 | |
| Structure | ||
| Crystal structure | Trigonal | |
| Space group | 32/m | |
| Thermochemistry | ||
| Std molar | 93 J·mol−1·K−1[6] | |
| Std enthalpy of | −1207 kJ·mol−1[6] | |
| Pharmacology | ||
| ATC code | A02AC01 (WHO) A12AA04 (WHO) | |
| Hazards | ||
| NFPA 704 (fire diamond) |
0 0 0 | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) | 6450 mg/kg (oral, rat) | |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[7] | |
| Safety data sheet (SDS) | ICSC 1193 | |
| Related compounds | ||
| Other anions | Calcium bicarbonate | |
| Other cations | Beryllium carbonate Magnesium carbonate Strontium carbonate Barium carbonate Radium carbonate | |
| Related compounds | Calcium sulfate | |
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |

Crystal structure of calcite
Calcium carbonate is a chemical compound with the formula CaCO3. It is a common substance found in rocks as the minerals calcite and aragonite (most notably as limestone, which is a type of sedimentary rock consisting mainly of calcite) and is the main component of eggshells, gastropod shells, shellfish skeletons and pearls. Things containing much calcium carbonate or resembling it are described as calcareous. Calcium carbonate is the active ingredient in agricultural lime and is created when calcium ions in hard water react with carbonate ions to create limescale. It has medical use as a calcium supplement or as an antacid, but excessive consumption can be hazardous and cause hypercalcemia and digestive issues.[8]
Chemistry[edit]
Calcium carbonate shares the typical properties of other carbonates. Notably it
- reacts with acids, releasing carbon dioxide (technically speaking, carbonic acid, but that disintegrates quickly to CO2 and H2O):
- releases carbon dioxide upon heating, called a thermal decomposition reaction, or calcination (to above 840 °C in the case of CaCO3), to form calcium oxide, CaO, commonly called quicklime, with reaction enthalpy 178 kJ/mol:
Calcium carbonate reacts with water that is saturated with carbon dioxide to form the soluble calcium bicarbonate.
This reaction is important in the erosion of carbonate rock, forming caverns, and leads to hard water in many regions.
An unusual form of calcium carbonate is the hexahydrate ikaite, CaCO3·6H2O. Ikaite is stable only below 8 °C.
Preparation[edit]
The vast majority of calcium carbonate used in industry is extracted by mining or quarrying. Pure calcium carbonate (such as for food or pharmaceutical use), can be produced from a pure quarried source (usually marble).
Alternatively, calcium carbonate is prepared from calcium oxide. Water is added to give calcium hydroxide then carbon dioxide is passed through this solution to precipitate the desired calcium carbonate, referred to in the industry as precipitated calcium carbonate (PCC) This process is called carbonatation:[9]
In a laboratory, calcium carbonate can easily be crystallized from calcium chloride (CaCl2), by placing an aqueous solution of CaCl2 in a desiccator alongside ammonium carbonate (NH4)2CO3.[10] In the desiccator, ammonium carbonate is exposed to air and decomposes into ammonia, carbon dioxide, and water. The carbon dioxide then diffuses into the aqueous solution of calcium chloride, reacts with the calcium ions and the water, and forms calcium carbonate.
Structure[edit]
The thermodynamically stable form of CaCO3 under normal conditions is hexagonal β-CaCO3 (the mineral calcite).[11] Other forms can be prepared, the denser (2.83 g/cm3) orthorhombic λ-CaCO3 (the mineral aragonite) and hexagonal μ-CaCO3, occurring as the mineral vaterite.[11] The aragonite form can be prepared by precipitation at temperatures above 85 °C; the vaterite form can be prepared by precipitation at 60 °C.[11] Calcite contains calcium atoms coordinated by six oxygen atoms; in aragonite they are coordinated by nine oxygen atoms.[11] The vaterite structure is not fully understood.[12] Magnesium carbonate (MgCO3) has the calcite structure, whereas strontium carbonate (SrCO3) and barium carbonate (BaCO3) adopt the aragonite structure, reflecting their larger ionic radii.[11]
Polymorphs[edit]
Calcium carbonate crystallizes in three anhydrous polymorphs,[13][14] of which calcite is the thermodynamically most stable at room temperature, aragonite is only slightly less so, and vaterite is the least stable.[15]
Crystal Structure[edit]
The calcite crystal structure is trigonal, with space group 




Crystallization[edit]

Crystal Structure of Calcite and Aragonite
All three polymorphs crystallize simultaneously from aqueous solutions under ambient conditions.[15] In additive-free aqueous solutions, calcite forms easily as the major product, while aragonite appears only as a minor product.
At high saturation, vaterite is typically the first phase precipitated, which is followed by a transformation of the vaterite to calcite.[20] This behavior seems to follow Ostwald’s step rule, in which the least stable polymorph crystallizes first, followed by the crystallization of different polymorphs via a sequence of increasingly stable phases.[21] However, aragonite, whose stability lies between those of vaterite and calcite, seems to be the exception to this rule, as aragonite does not form as a precursor to calcite under ambient conditions.[15]

Microscopic Calcite and Vaterite
Aragonite occurs in majority when the reaction conditions inhibit the formation of calcite and/or promote the nucleation of aragonite. For example, the formation of aragonite is promoted by the presence of magnesium ions,[22] or by using proteins and peptides derived from biological calcium carbonate.[23] Some polyamines such as Cadaverine and Poly(ethylene imine) have been shown to facilitate the formation of aragonite over calcite.[15]
Selection by organisms[edit]
Organisms, such as molluscs and arthropods, have shown the ability to grow all three crystal polymorphs of calcium carbonate, mainly as protection (shells) and muscle attachments.[24] Moreover, they exhibit a remarkable capability of phase selection over calcite and aragonite, and some organisms can switch between the two polymorphs. The ability of phase selection is usually attributed to the use of specific macromolecules or combinations of macromolecules by such organisms.[25][26][27]
Occurrence[edit]

Geological sources[edit]
Calcite, aragonite and vaterite are pure calcium carbonate minerals. Industrially important source rocks which are predominantly calcium carbonate include limestone, chalk, marble and travertine.
Biological sources[edit]
Eggshells, snail shells and most seashells are predominantly calcium carbonate and can be used as industrial sources of that chemical.[29] Oyster shells have enjoyed recent recognition as a source of dietary calcium, but are also a practical industrial source.[30][31] Dark green vegetables such as broccoli and kale contain dietarily significant amounts of calcium carbonate, but they are not practical as an industrial source.[32]
[edit]
Beyond Earth, strong evidence suggests the presence of calcium carbonate on Mars. Signs of calcium carbonate have been detected at more than one location (notably at Gusev and Huygens craters). This provides some evidence for the past presence of liquid water.[33][34]
Geology[edit]

Surface precipitation of
CaCO3 as tufa in Rubaksa, Ethiopia
Carbonate is found frequently in geologic settings and constitutes an enormous carbon reservoir. Calcium carbonate occurs as aragonite, calcite and dolomite as significant constituents of the calcium cycle. The carbonate minerals form the rock types: limestone, chalk, marble, travertine, tufa, and others.

In warm, clear tropical waters corals are more abundant than towards the poles where the waters are cold. Calcium carbonate contributors, including plankton (such as coccoliths and planktic foraminifera), coralline algae, sponges, brachiopods, echinoderms, bryozoa and mollusks, are typically found in shallow water environments where sunlight and filterable food are more abundant. Cold-water carbonates do exist at higher latitudes but have a very slow growth rate. The calcification processes are changed by ocean acidification.
Where the oceanic crust is subducted under a continental plate sediments will be carried down to warmer zones in the asthenosphere and lithosphere. Under these conditions calcium carbonate decomposes to produce carbon dioxide which, along with other gases, give rise to explosive volcanic eruptions.
Carbonate compensation depth[edit]
The carbonate compensation depth (CCD) is the point in the ocean where the rate of precipitation of calcium carbonate is balanced by the rate of dissolution due to the conditions present. Deep in the ocean, the temperature drops and pressure increases. Calcium carbonate is unusual in that its solubility increases with decreasing temperature.[35] Increasing pressure also increases the solubility of calcium carbonate. The carbonate compensation depth can range from 4,000 to 6,000 meters below sea level.
Role in taphonomy[edit]
Calcium carbonate can preserve fossils through permineralization. Most of the vertebrate fossils of the Two Medicine Formation—a geologic formation known for its duck-billed dinosaur eggs—are preserved by CaCO3 permineralization.[36] This type of preservation conserves high levels of detail, even down to the microscopic level. However, it also leaves specimens vulnerable to weathering when exposed to the surface.[36]
Trilobite populations were once thought to have composed the majority of aquatic life during the Cambrian, due to the fact that their calcium carbonate-rich shells were more easily preserved than those of other species,[37] which had purely chitinous shells.
Uses[edit]
Construction[edit]
The main use of calcium carbonate is in the construction industry, either as a building material, or limestone aggregate for road building, as an ingredient of cement, or as the starting material for the preparation of builders’ lime by burning in a kiln. However, because of weathering mainly caused by acid rain,[38] calcium carbonate (in limestone form) is no longer used for building purposes on its own, but only as a raw primary substance for building materials.
Calcium carbonate is also used in the purification of iron from iron ore in a blast furnace. The carbonate is calcined in situ to give calcium oxide, which forms a slag with various impurities present, and separates from the purified iron.[39]
In the oil industry, calcium carbonate is added to drilling fluids as a formation-bridging and filtercake-sealing agent; it is also a weighting material which increases the density of drilling fluids to control the downhole pressure. Calcium carbonate is added to swimming pools, as a pH corrector for maintaining alkalinity and offsetting the acidic properties of the disinfectant agent.[40]
It is also used as a raw material in the refining of sugar from sugar beet; it is calcined in a kiln with anthracite to produce calcium oxide and carbon dioxide. This burnt lime is then slaked in fresh water to produce a calcium hydroxide suspension for the precipitation of impurities in raw juice during carbonatation.[41]
Calcium carbonate in the form of chalk has traditionally been a major component of blackboard chalk. However, modern manufactured chalk is mostly gypsum, hydrated calcium sulfate CaSO4·2H2O. Calcium carbonate is a main source for growing biorock. Precipitated calcium carbonate (PCC), pre-dispersed in slurry form, is a common filler material for latex gloves with the aim of achieving maximum saving in material and production costs.[42]
Fine ground calcium carbonate (GCC) is an essential ingredient in the microporous film used in diapers and some building films, as the pores are nucleated around the calcium carbonate particles during the manufacture of the film by biaxial stretching. GCC and PCC are used as a filler in paper because they are cheaper than wood fiber. In terms of market volume, GCC are the most important types of fillers currently used.[43] Printing and writing paper can contain 10–20% calcium carbonate. In North America, calcium carbonate has begun to replace kaolin in the production of glossy paper. Europe has been practicing this as alkaline papermaking or acid-free papermaking for some decades. PCC used for paper filling and paper coatings is precipitated and prepared in a variety of shapes and sizes having characteristic narrow particle size distributions and equivalent spherical diameters of 0.4 to 3 micrometers.[citation needed]
Calcium carbonate is widely used as an extender in paints,[44] in particular matte emulsion paint where typically 30% by weight of the paint is either chalk or marble. It is also a popular filler in plastics.[44] Some typical examples include around 15 to 20% loading of chalk in unplasticized polyvinyl chloride (uPVC) drainpipes, 5% to 15% loading of stearate-coated chalk or marble in uPVC window profile. PVC cables can use calcium carbonate at loadings of up to 70 phr (parts per hundred parts of resin) to improve mechanical properties (tensile strength and elongation) and electrical properties (volume resistivity).[citation needed] Polypropylene compounds are often filled with calcium carbonate to increase rigidity, a requirement that becomes important at high usage temperatures.[45] Here the percentage is often 20–40%. It also routinely used as a filler in thermosetting resins (sheet and bulk molding compounds)[45] and has also been mixed with ABS, and other ingredients, to form some types of compression molded «clay» poker chips.[46] Precipitated calcium carbonate, made by dropping calcium oxide into water, is used by itself or with additives as a white paint, known as whitewashing.[47][48]
Calcium carbonate is added to a wide range of trade and do it yourself adhesives, sealants, and decorating fillers.[44] Ceramic tile adhesives typically contain 70% to 80% limestone. Decorating crack fillers contain similar levels of marble or dolomite. It is also mixed with putty in setting stained glass windows, and as a resist to prevent glass from sticking to kiln shelves when firing glazes and paints at high temperature.[49][50][51][52]
In ceramic glaze applications, calcium carbonate is known as whiting,[44] and is a common ingredient for many glazes in its white powdered form. When a glaze containing this material is fired in a kiln, the whiting acts as a flux material in the glaze. Ground calcium carbonate is an abrasive (both as scouring powder and as an ingredient of household scouring creams), in particular in its calcite form, which has the relatively low hardness level of 3 on the Mohs scale, and will therefore not scratch glass and most other ceramics, enamel, bronze, iron, and steel, and have a moderate effect on softer metals like aluminium and copper. A paste made from calcium carbonate and deionized water can be used to clean tarnish on silver.[53]
Health and diet[edit]

500-milligram calcium supplements made from calcium carbonate
Calcium carbonate is widely used medicinally as an inexpensive dietary calcium supplement for gastric antacid[54] (such as Tums and Eno). It may be used as a phosphate binder for the treatment of hyperphosphatemia (primarily in patients with chronic kidney failure). It is used in the pharmaceutical industry as an inert filler for tablets and other pharmaceuticals.[55]
Calcium carbonate is used in the production of calcium oxide as well as toothpaste and has seen a resurgence as a food preservative and color retainer, when used in or with products such as organic apples.[56]
Calcium carbonate is used therapeutically as phosphate binder in patients on maintenance haemodialysis. It is the most common form of phosphate binder prescribed, particularly in non-dialysis chronic kidney disease. Calcium carbonate is the most commonly used phosphate binder, but clinicians are increasingly prescribing the more expensive, non-calcium-based phosphate binders, particularly sevelamer.
Excess calcium from supplements, fortified food, and high-calcium diets can cause milk-alkali syndrome, which has serious toxicity and can be fatal. In 1915, Bertram Sippy introduced the «Sippy regimen» of hourly ingestion of milk and cream, and the gradual addition of eggs and cooked cereal, for 10 days, combined with alkaline powders, which provided symptomatic relief for peptic ulcer disease. Over the next several decades, the Sippy regimen resulted in kidney failure, alkalosis, and hypercalcaemia, mostly in men with peptic ulcer disease. These adverse effects were reversed when the regimen stopped, but it was fatal in some patients with protracted vomiting. Milk-alkali syndrome declined in men after effective treatments for peptic ulcer disease arose. Since the 1990s it has been most frequently reported in women taking calcium supplements above the recommended range of 1.2 to 1.5 grams daily, for prevention and treatment of osteoporosis,[57][58] and is exacerbated by dehydration. Calcium has been added to over-the-counter products, which contributes to inadvertent excessive intake. Excessive calcium intake can lead to hypercalcemia, complications of which include vomiting, abdominal pain and altered mental status.[59]
As a food additive it is designated E170,[60] and it has an INS number of 170. Used as an acidity regulator, anticaking agent, stabilizer or color it is approved for usage in the EU,[61] US[62] and Australia and New Zealand.[63] It is «added by law to all UK milled bread flour except wholemeal».[64][65] It is used in some soy milk and almond milk products as a source of dietary calcium; at least one study suggests that calcium carbonate might be as bioavailable as the calcium in cow’s milk.[66] Calcium carbonate is also used as a firming agent in many canned and bottled vegetable products.
Several calcium supplement formulations have been documented to contain the chemical element lead,[67] posing a public health concern.[68] Lead is commonly found in natural sources of calcium.[67]
Agriculture and aquaculture[edit]
Agricultural lime, powdered chalk or limestone, is used as a cheap method for neutralising acidic soil, making it suitable for planting, also used in aquaculture industry for pH regulation of pond soil before initiating culture.[69]
Household cleaning[edit]
Calcium carbonate is a key ingredient in many household cleaning powders like Comet and is used as a scrubbing agent.
Pollution mitigation[edit]
In 1989, a researcher, Ken Simmons, introduced CaCO3 into the Whetstone Brook in Massachusetts.[70] His hope was that the calcium carbonate would counter the acid in the stream from acid rain and save the trout that had ceased to spawn. Although his experiment was a success, it did increase the amount of aluminium ions in the area of the brook that was not treated with the limestone. This shows that CaCO3 can be added to neutralize the effects of acid rain in river ecosystems. Currently calcium carbonate is used to neutralize acidic conditions in both soil and water.[71][72][73] Since the 1970s, such liming has been practiced on a large scale in Sweden to mitigate acidification and several thousand lakes and streams are limed repeatedly.[74]
Calcium carbonate is also used in flue gas desulfurisation applications eliminating harmful SO2 and NO2 emissions from coal and other fossil fuels burnt in large fossil fuel power stations.[71]
Calcination equilibrium[edit]
Calcination of limestone using charcoal fires to produce quicklime has been practiced since antiquity by cultures all over the world. The temperature at which limestone yields calcium oxide is usually given as 825 °C, but stating an absolute threshold is misleading. Calcium carbonate exists in equilibrium with calcium oxide and carbon dioxide at any temperature. At each temperature there is a partial pressure of carbon dioxide that is in equilibrium with calcium carbonate. At room temperature the equilibrium overwhelmingly favors calcium carbonate, because the equilibrium CO2 pressure is only a tiny fraction of the partial CO2 pressure in air, which is about 0.035 kPa.
At temperatures above 550 °C the equilibrium CO2 pressure begins to exceed the CO2 pressure in air. So above 550 °C, calcium carbonate begins to outgas CO2 into air. However, in a charcoal fired kiln, the concentration of CO2 will be much higher than it is in air. Indeed, if all the oxygen in the kiln is consumed in the fire, then the partial pressure of CO2 in the kiln can be as high as 20 kPa.[75]
The table shows that this partial pressure is not achieved until the temperature is nearly 800 °C. For the outgassing of CO2 from calcium carbonate to happen at an economically useful rate, the equilibrium pressure must significantly exceed the ambient pressure of CO2. And for it to happen rapidly, the equilibrium pressure must exceed total atmospheric pressure of 101 kPa, which happens at 898 °C.
-
Equilibrium pressure of CO2 over CaCO3 (P) versus temperature (T).[76]
P (kPa) 0.055 0.13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 T (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Solubility[edit]
With varying CO2 pressure[edit]

Calcium carbonate is poorly soluble in pure water (47 mg/L at normal atmospheric CO2 partial pressure as shown below).
The equilibrium of its solution is given by the equation (with dissolved calcium carbonate on the right):
-
CaCO3 ⇌ Ca2+ + CO2−3 Ksp = 3.7×10−9 to 8.7×10−9 at 25 °C
where the solubility product for [Ca2+][CO2−3] is given as anywhere from Ksp = 3.7×10−9 to Ksp = 8.7×10−9 at 25 °C, depending upon the data source.[76][77] What the equation means is that the product of molar concentration of calcium ions (moles of dissolved Ca2+ per liter of solution) with the molar concentration of dissolved CO2−3 cannot exceed the value of Ksp. This seemingly simple solubility equation, however, must be taken along with the more complicated equilibrium of carbon dioxide with water (see carbonic acid). Some of the CO2−3 combines with H+ in the solution according to
-
HCO−3 ⇌ H+ + CO2−3 Ka2 = 5.61×10−11 at 25 °C
HCO−3 is known as the bicarbonate ion. Calcium bicarbonate is many times more soluble in water than calcium carbonate—indeed it exists only in solution.
Some of the HCO−3 combines with H+ in solution according to
-
H2CO3 ⇌ H+ + HCO−3 Ka1 = 2.5×10−4 at 25 °C
Some of the H2CO3 breaks up into water and dissolved carbon dioxide according to
-
H2O + CO2(aq) ⇌ H2CO3 Kh = 1.70×10−3 at 25 °C
And dissolved carbon dioxide is in equilibrium with atmospheric carbon dioxide according to
-
PCO2/[CO2] = kH where kH = 29.76 atm/(mol/L) at 25 °C (Henry constant), PCO2 being the CO2 partial pressure.
For ambient air, PCO2 is around 3.5×10−4 atmospheres (or equivalently 35 Pa). The last equation above fixes the concentration of dissolved CO2 as a function of PCO2, independent of the concentration of dissolved CaCO3. At atmospheric partial pressure of CO2, dissolved CO2 concentration is 1.2×10−5 moles per liter. The equation before that fixes the concentration of H2CO3 as a function of CO2 concentration. For [CO2] = 1.2×10−5, it results in [H2CO3] = 2.0×10−8 moles per liter. When [H2CO3] is known, the remaining three equations together with
| PCO2 (atm) | pH | [Ca2+] (mol/L) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
-
H2O ⇌ H+ + OH− K = 10−14 at 25 °C
(which is true for all aqueous solutions), and the fact that the solution must be electrically neutral, i.e., the overall charge of dissolved positive ions [Ca2+] + 2 [H+] must be cancelled out by the overall charge of dissolved negative ions [HCO−3] + [CO2−3] + [OH−], make it possible to solve simultaneously for the remaining five unknown concentrations (note that the previously mentioned form of the neutrality is valid only if calcium carbonate has been put in contact with pure water or with a neutral pH solution; in the case where the initial water solvent pH is not neutral, the balance is not neutral).
The adjacent table shows the result for [Ca2+] and [H+] (in the form of pH) as a function of ambient partial pressure of CO2 (Ksp = 4.47×10−9 has been taken for the calculation).
- At atmospheric levels of ambient CO2 the table indicates that the solution will be slightly alkaline with a maximum CaCO3 solubility of 47 mg/L.
- As ambient CO2 partial pressure is reduced below atmospheric levels, the solution becomes more and more alkaline. At extremely low PCO2, dissolved CO2, bicarbonate ion, and carbonate ion largely evaporate from the solution, leaving a highly alkaline solution of calcium hydroxide, which is more soluble than CaCO3. Note that for PCO2 = 10−12 atm, the [Ca2+][OH−]2 product is still below the solubility product of Ca(OH)2 (8×10−6). For still lower CO2 pressure, Ca(OH)2 precipitation will occur before CaCO3 precipitation.
- As ambient CO2 partial pressure increases to levels above atmospheric, pH drops, and much of the carbonate ion is converted to bicarbonate ion, which results in higher solubility of Ca2+.
The effect of the latter is especially evident in day-to-day life of people who have hard water. Water in aquifers underground can be exposed to levels of CO2 much higher than atmospheric. As such water percolates through calcium carbonate rock, the CaCO3 dissolves according to the second trend. When that same water then emerges from the tap, in time it comes into equilibrium with CO2 levels in the air by outgassing its excess CO2. The calcium carbonate becomes less soluble as a result, and the excess precipitates as lime scale. This same process is responsible for the formation of stalactites and stalagmites in limestone caves.
Two hydrated phases of calcium carbonate, monohydrocalcite CaCO3·H2O and ikaite CaCO3·6H2O, may precipitate from water at ambient conditions and persist as metastable phases.
With varying pH, temperature and salinity: CaCO3 scaling in swimming pools[edit]


In contrast to the open equilibrium scenario above, many swimming pools are managed by addition of sodium bicarbonate (NaHCO3) to about 2 mM as a buffer, then control of pH through use of HCl, NaHSO4, Na2CO3, NaOH or chlorine formulations that are acidic or basic. In this situation, dissolved inorganic carbon (total inorganic carbon) is far from equilibrium with atmospheric CO2. Progress towards equilibrium through outgassing of CO2 is slowed by
- the slow reaction
- H2CO3 ⇌ CO2(aq) + H2O;[78]
- limited aeration in a deep water column; and
- periodic replenishment of bicarbonate to maintain buffer capacity (often estimated through measurement of total alkalinity).
In this situation, the dissociation constants for the much faster reactions
- H2CO3 ⇌ H+ + HCO−3 ⇌ 2 H+ + CO2−3
allow the prediction of concentrations of each dissolved inorganic carbon species in solution, from the added concentration of HCO−3 (which constitutes more than 90% of Bjerrum plot species from pH 7 to pH 8 at 25 °C in fresh water).[79] Addition of HCO−3 will increase CO2−3 concentration at any pH. Rearranging the equations given above, we can see that [Ca2+] = Ksp/[CO2−3], and [CO2−3] = Ka2 [HCO−3]/[H+]. Therefore, when HCO−3 concentration is known, the maximum concentration of Ca2+ ions before scaling through CaCO3 precipitation can be predicted from the formula:
- [Ca2+]max = Ksp/Ka2 × [H+]/[HCO−3]
The solubility product for CaCO3 (Ksp) and the dissociation constants for the dissolved inorganic carbon species (including Ka2) are all substantially affected by temperature and salinity,[79] with the overall effect that [Ca2+]max increases from freshwater to saltwater, and decreases with rising temperature, pH, or added bicarbonate level, as illustrated in the accompanying graphs.
The trends are illustrative for pool management, but whether scaling occurs also depends on other factors including interactions with Mg2+, [B(OH)4]− and other ions in the pool, as well as supersaturation effects.[80][81] Scaling is commonly observed in electrolytic chlorine generators, where there is a high pH near the cathode surface and scale deposition further increases temperature. This is one reason that some pool operators prefer borate over bicarbonate as the primary pH buffer, and avoid the use of pool chemicals containing calcium.[82]
Solubility in a strong or weak acid solution[edit]
Solutions of strong (HCl), moderately strong (sulfamic) or weak (acetic, citric, sorbic, lactic, phosphoric) acids are commercially available. They are commonly used as descaling agents to remove limescale deposits. The maximum amount of CaCO3 that can be «dissolved» by one liter of an acid solution can be calculated using the above equilibrium equations.
- In the case of a strong monoacid with decreasing acid concentration [A] = [A−], we obtain (with CaCO3 molar mass = 100 g/mol):
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)50.0 5.00 0.514 0.0849 0.0504 0.0474 0.0471 0.0470 0.0470
-
- where the initial state is the acid solution with no Ca2+ (not taking into account possible CO2 dissolution) and the final state is the solution with saturated Ca2+. For strong acid concentrations, all species have a negligible concentration in the final state with respect to Ca2+ and A− so that the neutrality equation reduces approximately to 2[Ca2+] = [A−] yielding [Ca2+] ≈ 0.5 [A−]. When the concentration decreases, [HCO−3] becomes non-negligible so that the preceding expression is no longer valid. For vanishing acid concentrations, one can recover the final pH and the solubility of CaCO3 in pure water.
- In the case of a weak monoacid (here we take acetic acid with pKa = 4.76) with decreasing total acid concentration [A] = [A−] + [AH], we obtain:
-
-
[A] (mol/L) [Ca2+] ≈ 0.5 [A−] 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)49.5 4.99 0.513 0.0848 0.0504 0.0474 0.0471 0.0470 0.0470
-
- For the same total acid concentration, the initial pH of the weak acid is less acid than the one of the strong acid; however, the maximum amount of CaCO3 which can be dissolved is approximately the same. This is because in the final state, the pH is larger than the pKa, so that the weak acid is almost completely dissociated, yielding in the end as many H+ ions as the strong acid to «dissolve» the calcium carbonate.
- The calculation in the case of phosphoric acid (which is the most widely used for domestic applications) is more complicated since the concentrations of the four dissociation states corresponding to this acid must be calculated together with [HCO−3], [CO2−3], [Ca2+], [H+] and [OH−]. The system may be reduced to a seventh degree equation for [H+] the numerical solution of which gives
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Final pH 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)62.0 7.39 0.874 0.123 0.0536 0.0477 0.0471 0.0471 0.0470
-
- where [A] = [H3PO4] + [H2PO−4] + [HPO2−4] + [PO3−4] is the total acid concentration. Thus phosphoric acid is more efficient than a monoacid since at the final almost neutral pH, the second dissociated state concentration [HPO2−4] is not negligible (see phosphoric acid).
See also[edit]

Electron micrograph of needle-like calcium carbonate crystals formed as limescale in a kettle

Around 2 g of calcium-48 carbonate
- Cuttlebone
- Cuttlefish
- Gesso
- Limescale
- Marble
- Ocean acidification
- Whiting event
- List of climate engineering topics
- Lysocline
References[edit]
- ^ Aylward, Gordon; Findlay, Tristan (2008). SI Chemical Data Book (4th ed.). John Wiley & Sons Australia. ISBN 978-0-470-81638-7.
- ^ Rohleder, J.; Kroker, E. (2001). Calcium Carbonate: From the Cretaceous Period Into the 21st Century. Springer Science & Business Media. ISBN 978-3-7643-6425-0.
- ^ Benjamin, Mark M. (2002). Water Chemistry. McGraw-Hill. ISBN 978-0-07-238390-4.
- ^ «Occupational safety and health guideline for calcium carbonate» (PDF). US Dept. of Health and Human Services. Retrieved 31 March 2011.
- ^ «Archived copy» (PDF). Archived from the original (PDF) on 29 October 2018. Retrieved 29 October 2018.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0090». National Institute for Occupational Safety and Health (NIOSH).
- ^ Strumińska-Parulska, DI (2015). «Determination of 210Po in calcium supplements and the possible related dose assessment to the consumers». Journal of Environmental Radioactivity. 150: 121–125. doi:10.1016/j.jenvrad.2015.08.006. PMID 26318774.
- ^ «Precipitated Calcium Carbonate». Archived from the original on 11 January 2014. Retrieved 11 January 2014.
- ^ Kim, Yi-Yeoun; Schenk, Anna S.; Ihli, Johannes; Kulak, Alex N.; Hetherington, Nicola B. J.; Tang, Chiu C.; Schmahl, Wolfgang W.; Griesshaber, Erika; Hyett, Geoffrey; Meldrum, Fiona C. (September 2014). «A critical analysis of calcium carbonate mesocrystals». Nature Communications. 5 (1): 4341. Bibcode:2014NatCo…5.4341K. doi:10.1038/ncomms5341. ISSN 2041-1723. PMC 4104461. PMID 25014563.
- ^ a b c d e Ropp, R. C. (6 March 2013). Encyclopedia of the Alkaline Earth Compounds. Elsevier. pp. 359–370. ISBN 9780444595508.
- ^ Demichelis, Raffaella; Raiteri, Paolo; Gale, Julian D.; Dovesi, Roberto (2013). «The Multiple Structures of Vaterite». Crystal Growth & Design. 13 (6): 2247–2251. doi:10.1021/cg4002972. ISSN 1528-7483.
- ^ Morse, John W.; Arvidson, Rolf S.; Lüttge, Andreas (1 February 2007). «Calcium Carbonate Formation and Dissolution». Chemical Reviews. 107 (2): 342–381. doi:10.1021/cr050358j. ISSN 0009-2665. PMID 17261071.
- ^ Géologue., Lippmann, Friedrich (1973). Sedimentary carbonate minerals. Springer. ISBN 3-540-06011-1. OCLC 715109304.
- ^ a b c d Nahi, Ouassef; Kulak, Alexander N.; Zhang, Shuheng; He, Xuefeng; Aslam, Zabeada; Ilett, Martha A.; Ford, Ian J.; Darkins, Robert; Meldrum, Fiona C. (20 November 2022). «Polyamines Promote Aragonite Nucleation and Generate Biomimetic Structures». Advanced Science: 2203759. doi:10.1002/advs.202203759. ISSN 2198-3844. PMID 36403251. S2CID 253707446.
- ^ International tables for crystallography. Chester, England: International Union of Crystallography. 2006. doi:10.1107/97809553602060000001. ISBN 978-0-7923-6590-7. OCLC 166325528.
- ^ Chessin, H.; Hamilton, W. C.; Post, B. (1 April 1965). «Position and thermal parameters of oxygen atoms in calcite». Acta Crystallographica. 18 (4): 689–693. doi:10.1107/S0365110X65001585. ISSN 0365-110X.
- ^ Negro, AD (1971). «Refinement of the crystal structure of aragonite» (PDF). American Mineralogist: Journal of Earth and Planetary Materials. 56: 768–772 – via GeoScienceWorld.
- ^ Kabalah-Amitai, Lee; Mayzel, Boaz; Kauffmann, Yaron; Fitch, Andrew N.; Bloch, Leonid; Gilbert, Pupa U. P. A.; Pokroy, Boaz (26 April 2013). «Vaterite Crystals Contain Two Interspersed Crystal Structures». Science. 340 (6131): 454–457. Bibcode:2013Sci…340..454K. doi:10.1126/science.1232139. ISSN 0036-8075. PMID 23620047. S2CID 206546317.
- ^ Bots, Pieter; Benning, Liane G.; Rodriguez-Blanco, Juan-Diego; Roncal-Herrero, Teresa; Shaw, Samuel (3 July 2012). «Mechanistic Insights into the Crystallization of Amorphous Calcium Carbonate (ACC)». Crystal Growth & Design. 12 (7): 3806–3814. doi:10.1021/cg300676b. ISSN 1528-7483.
- ^ Cardew, Peter T.; Davey, Roger J. (2 October 2019). «The Ostwald Ratio, Kinetic Phase Diagrams, and Polymorph Maps». Crystal Growth & Design. 19 (10): 5798–5810. doi:10.1021/acs.cgd.9b00815. ISSN 1528-7483. S2CID 202885778.
- ^ Zhang, Shuheng; Nahi, Ouassef; Chen, Li; Aslam, Zabeada; Kapur, Nikil; Kim, Yi‐Yeoun; Meldrum, Fiona C. (June 2022). «Magnesium Ions Direct the Solid‐State Transformation of Amorphous Calcium Carbonate Thin Films to Aragonite, Magnesium‐Calcite, or Dolomite». Advanced Functional Materials. 32 (25): 2201394. doi:10.1002/adfm.202201394. ISSN 1616-301X. S2CID 247587883.
- ^ Metzler, Rebecca A.; Evans, John Spencer; Killian, Christopher E.; Zhou, Dong; Churchill, Tyler H.; Appathurai, Narayana P.; Coppersmith, Susan N.; Gilbert, P. U. P. A. (12 May 2010). «Nacre Protein Fragment Templates Lamellar Aragonite Growth». Journal of the American Chemical Society. 132 (18): 6329–6334. doi:10.1021/ja909735y. ISSN 0002-7863. PMID 20397648.
- ^ Lowenstam, H.A.; Weiner, S. (1989). On Biomineralization. Oxford University Press. ISBN 9780195049770.
- ^ Belcher, A. M.; Wu, X. H.; Christensen, R. J.; Hansma, P. K.; Stucky, G. D.; Morse, D. E. (May 1996). «Control of crystal phase switching and orientation by soluble mollusc-shell proteins». Nature. 381 (6577): 56–58. Bibcode:1996Natur.381…56B. doi:10.1038/381056a0. ISSN 1476-4687. S2CID 4285912.
- ^ Falini, Giuseppe; Albeck, Shira; Weiner, Steve; Addadi, Lia (5 January 1996). «Control of Aragonite or Calcite Polymorphism by Mollusk Shell Macromolecules». Science. 271 (5245): 67–69. Bibcode:1996Sci…271…67F. doi:10.1126/science.271.5245.67. ISSN 0036-8075. S2CID 95357556.
- ^ Marin, Frédéric (October 2020). «Mollusc shellomes: Past, present and future». Journal of Structural Biology. 212 (1): 107583. doi:10.1016/j.jsb.2020.107583. PMID 32721585. S2CID 220850117.
- ^ Russell, Daniel E . 17 February 2008. Retrieved December 31, 2010. «Helgustadir Iceland Spar Mine» mindat.org
- ^ Horne, Francis (23 October 2006). «How are seashells created?». Scientific American. Retrieved 25 April 2012.
- ^ «Oyster shell calcium». WebMD. Retrieved 25 April 2012.
- ^ «Oyster Shell Calcium Carbonate». Caltron Clays & Chemicals. Archived from the original on 10 September 2013. Retrieved 25 April 2012.
- ^ Mangels, Ann Reed (4 June 2014). «Bone nutrients for vegetarians». The American Journal of Clinical Nutrition. 100 (1): 469S–475S. doi:10.3945/ajcn.113.071423. PMID 24898231.
- ^ Boynton, W. V.; Ming, D. W.; Kounaves, S. P.; et al. (2009). «Evidence for Calcium Carbonate at the Mars Phoenix Landing Site» (PDF). Science. 325 (5936): 61–64. Bibcode:2009Sci…325…61B. doi:10.1126/science.1172768. PMID 19574384. S2CID 26740165.
- ^
Clark, B. C., III; Arvidson, R. E.; Gellert, R.; et al. (2007). «Evidence for montmorillonite or its compositional equivalent in Columbia Hills, Mars» (PDF). Journal of Geophysical Research. 112 (E6): E06S01. Bibcode:2007JGRE..112.6S01C. doi:10.1029/2006JE002756. hdl:1893/17119. - ^ Weyl, P.K. (1959). «The change in solubility of calcium carbonate with temperature and carbon dioxide content». Geochimica et Cosmochimica Acta. 17 (3–4): 214–225. Bibcode:1959GeCoA..17..214W. doi:10.1016/0016-7037(59)90096-1.
- ^ a b Trexler, D. (2001). «Two Medicine Formation, Montana: geology and fauna». In Tanke, D. H.; Carpenter, K. (eds.). Mesozoic Vertebrate Life. Indiana University Press. pp. 298–309. ISBN 978-0-253-33907-2.
- ^ Ward, Peter (2006). Out of Thin Air: Dinosaurs, Birds, and Earth’s Ancient Atmosphere. doi:10.17226/11630. ISBN 9780309666121.
- ^ «Effects of Acid Rain». US Environmental Protection Agency. Retrieved 14 March 2015.
- ^ «Blast Furnace». Science Aid. Archived from the original on 17 December 2007. Retrieved 30 December 2007.
- ^ Sfetcu, Nicolae (2 May 2014). Health & Drugs: Disease, Prescription & Medication. Nicolae Sfetcu.
- ^ McGinnis, R. A. Beet-Sugar Technology (2nd ed.). Beet Sugar Development Foundation. p. 178.
- ^ «Precipitated Calcium Carbonate uses». Archived from the original on 25 July 2014.
- ^ «Market Study Fillers, 2nd ed». Ceresana. September 2011.
- ^ a b c d «Calcium Carbonate Powder». Reade Advanced Materials. 4 February 2006. Archived from the original on 22 February 2008. Retrieved 30 December 2007.
- ^ a b «Calcium carbonate in plastic applications». Imerys Performance Minerals. Archived from the original on 4 August 2008. Retrieved 1 August 2008.
- ^ «Why do calcium carbonate play an important part in Industrial». www.xintuchemical.com. Retrieved 7 October 2018.
- ^ «precipitated calcium carbonate commodity price». www.dgci.be. Archived from the original on 7 October 2018. Retrieved 7 October 2018.
- ^ Jimoh, O.A.; et al. (2017). «Understanding the Precipitated Calcium Carbonate (PCC) Production Mechanism and Its Characteristics in the Liquid–Gas System Using Milk of Lime (MOL) Suspension» (PDF). South African Journal of Chemistry. 70: 1–7. doi:10.17159/0379-4350/2017/v70a1.
- ^ «Topic: Re: Can our calcium carbonate «waste» be utilized in other industries so we can divert it from landfills?». www.chemicalprocessing.com. 4 March 2010. Archived from the original on 23 March 2017. Retrieved 3 February 2021.
- ^ «Why do calcium carbonate play an important part in Industry?». www.xintuchemical.com. Retrieved 3 February 2021.
- ^ «Calcium Carbonates / Calcite/ Limestone. CaCO3 | Rajasthan Minerals & Chemicals». www.rmcl.co.in. Archived from the original on 15 April 2021. Retrieved 3 February 2021.
- ^ «Calcium Carbonate». kamceramics.com. Retrieved 3 February 2021.
- ^ «Ohio Historical Society Blog: Make It Shine». Ohio Historical Society. Archived from the original on 23 March 2012. Retrieved 2 June 2011.
- ^ «Calcium Carbonate». Medline Plus. National Institutes of Health. 1 October 2005. Archived from the original on 17 October 2007. Retrieved 30 December 2007.
- ^ Lieberman, Herbert A.; Lachman, Leon; Schwartz, Joseph B. (1990). Pharmaceutical Dosage Forms: Tablets. New York: Dekker. p. 153. ISBN 978-0-8247-8044-9.
- ^ «Food Additives – Names Starting with C». Chemistry.about.com. 10 April 2012. Archived from the original on 16 October 2006. Retrieved 24 May 2012.
- ^ Caruso JB, Patel RM, Julka K, Parish DC (July 2007). «Health-behavior induced disease: return of the milk-alkali syndrome». J Gen Intern Med. 22 (7): 1053–5. doi:10.1007/s11606-007-0226-0. PMC 2219730. PMID 17483976.
- ^ Beall DP, Henslee HB, Webb HR, Scofield RH (May 2006). «Milk-alkali syndrome: a historical review and description of the modern version of the syndrome». Am. J. Med. Sci. 331 (5): 233–42. doi:10.1097/00000441-200605000-00001. PMID 16702792. S2CID 45802184.
- ^ Gabriely, Ilan; Leu, James P.; Barzel, Uriel S. (2008). «Clinical problem-solving, back to basics». New England Journal of Medicine. 358 (18): 1952–6. doi:10.1056/NEJMcps0706188. PMID 18450607.
- ^ «E-numbers: E170 Calcium carbonate». Food-Info.net. 080419 food-info.net
- ^ «Current EU approved additives and their E Numbers». UK Food Standards Agency. Retrieved 27 October 2011.
- ^ «Listing of Food Additives Status Part I». US Food and Drug Administration. Archived from the original on 14 March 2013. Retrieved 27 October 2011.
- ^ «Standard 1.2.4 – Labelling of ingredients». Australia New Zealand Food Standards Code. Retrieved 27 October 2011.
- ^ Holdstock, Lee. «Why go organic?». Real Bread Campaign. Soil Association Certification Limited. Retrieved 3 April 2021.
- ^ «Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply» (PDF). Department for Environment, Food and Rural Affairs. August 2013.
- ^ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). «Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women». The Journal of Nutrition. 135 (10): 2379–2382. doi:10.1093/jn/135.10.2379. PMID 16177199.
- ^ a b Kauffman, John F.; Westenberger, Benjamin J.; Robertson, J. David; Guthrie, James; Jacobs, Abigail; Cummins, Susan K. (1 July 2007). «Lead in pharmaceutical products and dietary supplements». Regulatory Toxicology and Pharmacology. 48 (2): 128–134. doi:10.1016/j.yrtph.2007.03.001. ISSN 0273-2300. PMID 17467129.
- ^ Ross, Edward A.; Szabo, N. J.; Tebbett, I. R. (2000). «Lead Content of Calcium Supplements». JAMA. 284 (11): 1425–1429. doi:10.1001/jama.284.11.1425. PMID 10989406.
- ^ Oates, J. A. H. (11 July 2008). Lime and Limestone: Chemistry and Technology, Production and Uses. John Wiley & Sons. pp. 111–113. ISBN 978-3-527-61201-7.
- ^ «Limestone Dispenser Fights Acid Rain in Stream». The New York Times. Associated Press. 13 June 1989.
- ^ a b «Environmental Uses for Calcium Carbonate». Congcal. 6 September 2012. Retrieved 5 August 2013.
- ^ Schreiber, R. K. (1988). «Cooperative federal-state liming research on surface waters impacted by acidic deposition». Water, Air, & Soil Pollution. 41 (1): 53–73. Bibcode:1988WASP…41…53S. doi:10.1007/BF00160344. S2CID 98404326.
- ^ Kircheis, Dan; Dill, Richard (2006). «Effects of low pH and high aluminum on Atlantic salmon smolts in Eastern Maine and liming project feasibility analysis» (reprinted at Downeast Salmon Federation). National Marine Fisheries Service and Maine Atlantic Salmon Commission.[permanent dead link]
- ^ Guhrén, M.; Bigler, C.; Renberg, I. (2006). «Liming placed in a long-term perspective: A paleolimnological study of 12 lakes in the Swedish liming program». Journal of Paleolimnology. 37 (2): 247–258. Bibcode:2007JPall..37..247G. doi:10.1007/s10933-006-9014-9. S2CID 129439066.
- ^ «Solvay Precipitated Calcium Carbonate: Production». Solvay. 9 March 2007. Retrieved 30 December 2007.
- ^ a b Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ «Selected Solubility Products and Formation Constants at 25 °C». California State University, Dominguez Hills. Archived from the original on 25 May 2006. Retrieved 7 June 2007.
- ^ Wang, X.; Conway, W.; Burns, R.; McCann, N.; Maeder, M. (2010). «Comprehensive Study of the Hydration and Dehydration Reactions of Carbon Dioxide in Aqueous Solution». The Journal of Physical Chemistry A. 114 (4): 1734–40. Bibcode:2010JPCA..114.1734W. doi:10.1021/jp909019u. PMID 20039712.
- ^ a b Mook, W. (2000). «Chemistry of carbonic acid in water». Environmental Isotopes in the Hydrological Cycle: Principles and Applications (PDF). Paris: INEA/UNESCO. pp. 143–165. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). «Factors affecting precipitation of calcium carbonate» (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 18–23. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). «Corrections, potential errors, and significance of the saturation index» (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 37–40. Archived from the original (PDF) on 24 August 2012. Retrieved 18 March 2014.
- ^ Birch, R. G. (2013). «BABES: a better method than «BBB» for pools with a salt-water chlorine generator» (PDF). scithings.id.au.
External links[edit]
- International Chemical Safety Card 1193
- CID 516889 from PubChem
- ATC codes: A02AC01 (WHO) and A12AA04 (WHO)
- The British Calcium Carbonate Association – What is calcium carbonate Archived 24 May 2008 at the Wayback Machine
- CDC – NIOSH Pocket Guide to Chemical Hazards – Calcium Carbonate
| ||
 | ||
| Names | ||
|---|---|---|
| IUPAC name Calcium carbonate | ||
| Other names Aragonite; calcite; chalk; lime; limestone; marble; oyster; pearl | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| DrugBank |
| |
| ECHA InfoCard | 100.006.765 | |
| EC Number |
| |
| E number | E170 (colours) | |
| KEGG |
| |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | CaCO3 | |
| Molar mass | 100.0869 g/mol | |
| Appearance | Fine white powder; chalky taste | |
| Odor | odorless | |
| Density | 2.711 g/cm3 (calcite) 2.83 g/cm3 (aragonite) | |
| Melting point | 1,339 °C (2,442 °F; 1,612 K) (calcite) 825 °C (1,517 °F; 1,098 K) (aragonite)[4][5] | |
| Boiling point | decomposes | |
| Solubility in water | 0.013 g/L (25 °C)[1][2] | |
| Solubility product (Ksp) | 3.3×10−9[3] | |
| Solubility in dilute acids | soluble | |
| Acidity (pKa) | 9.0 | |
| Magnetic susceptibility (χ) | −3.82×10−5 cm3/mol | |
| Refractive index (nD) | 1.59 | |
| Structure | ||
| Crystal structure | Trigonal | |
| Space group | 32/m | |
| Thermochemistry | ||
| Std molar | 93 J·mol−1·K−1[6] | |
| Std enthalpy of | −1207 kJ·mol−1[6] | |
| Pharmacology | ||
| ATC code | A02AC01 (WHO) A12AA04 (WHO) | |
| Hazards | ||
| NFPA 704 (fire diamond) |
0 0 0 | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) | 6450 mg/kg (oral, rat) | |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[7] | |
| Safety data sheet (SDS) | ICSC 1193 | |
| Related compounds | ||
| Other anions | Calcium bicarbonate | |
| Other cations | Beryllium carbonate Magnesium carbonate Strontium carbonate Barium carbonate Radium carbonate | |
| Related compounds | Calcium sulfate | |
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |

Crystal structure of calcite
Calcium carbonate is a chemical compound with the formula CaCO3. It is a common substance found in rocks as the minerals calcite and aragonite (most notably as limestone, which is a type of sedimentary rock consisting mainly of calcite) and is the main component of eggshells, gastropod shells, shellfish skeletons and pearls. Things containing much calcium carbonate or resembling it are described as calcareous. Calcium carbonate is the active ingredient in agricultural lime and is created when calcium ions in hard water react with carbonate ions to create limescale. It has medical use as a calcium supplement or as an antacid, but excessive consumption can be hazardous and cause hypercalcemia and digestive issues.[8]
Chemistry[edit]
Calcium carbonate shares the typical properties of other carbonates. Notably it
- reacts with acids, releasing carbon dioxide (technically speaking, carbonic acid, but that disintegrates quickly to CO2 and H2O):
- releases carbon dioxide upon heating, called a thermal decomposition reaction, or calcination (to above 840 °C in the case of CaCO3), to form calcium oxide, CaO, commonly called quicklime, with reaction enthalpy 178 kJ/mol:
Calcium carbonate reacts with water that is saturated with carbon dioxide to form the soluble calcium bicarbonate.
This reaction is important in the erosion of carbonate rock, forming caverns, and leads to hard water in many regions.
An unusual form of calcium carbonate is the hexahydrate ikaite, CaCO3·6H2O. Ikaite is stable only below 8 °C.
Preparation[edit]
The vast majority of calcium carbonate used in industry is extracted by mining or quarrying. Pure calcium carbonate (such as for food or pharmaceutical use), can be produced from a pure quarried source (usually marble).
Alternatively, calcium carbonate is prepared from calcium oxide. Water is added to give calcium hydroxide then carbon dioxide is passed through this solution to precipitate the desired calcium carbonate, referred to in the industry as precipitated calcium carbonate (PCC) This process is called carbonatation:[9]
In a laboratory, calcium carbonate can easily be crystallized from calcium chloride (CaCl2), by placing an aqueous solution of CaCl2 in a desiccator alongside ammonium carbonate (NH4)2CO3.[10] In the desiccator, ammonium carbonate is exposed to air and decomposes into ammonia, carbon dioxide, and water. The carbon dioxide then diffuses into the aqueous solution of calcium chloride, reacts with the calcium ions and the water, and forms calcium carbonate.
Structure[edit]
The thermodynamically stable form of CaCO3 under normal conditions is hexagonal β-CaCO3 (the mineral calcite).[11] Other forms can be prepared, the denser (2.83 g/cm3) orthorhombic λ-CaCO3 (the mineral aragonite) and hexagonal μ-CaCO3, occurring as the mineral vaterite.[11] The aragonite form can be prepared by precipitation at temperatures above 85 °C; the vaterite form can be prepared by precipitation at 60 °C.[11] Calcite contains calcium atoms coordinated by six oxygen atoms; in aragonite they are coordinated by nine oxygen atoms.[11] The vaterite structure is not fully understood.[12] Magnesium carbonate (MgCO3) has the calcite structure, whereas strontium carbonate (SrCO3) and barium carbonate (BaCO3) adopt the aragonite structure, reflecting their larger ionic radii.[11]
Polymorphs[edit]
Calcium carbonate crystallizes in three anhydrous polymorphs,[13][14] of which calcite is the thermodynamically most stable at room temperature, aragonite is only slightly less so, and vaterite is the least stable.[15]
Crystal Structure[edit]
The calcite crystal structure is trigonal, with space group 




Crystallization[edit]

Crystal Structure of Calcite and Aragonite
All three polymorphs crystallize simultaneously from aqueous solutions under ambient conditions.[15] In additive-free aqueous solutions, calcite forms easily as the major product, while aragonite appears only as a minor product.
At high saturation, vaterite is typically the first phase precipitated, which is followed by a transformation of the vaterite to calcite.[20] This behavior seems to follow Ostwald’s step rule, in which the least stable polymorph crystallizes first, followed by the crystallization of different polymorphs via a sequence of increasingly stable phases.[21] However, aragonite, whose stability lies between those of vaterite and calcite, seems to be the exception to this rule, as aragonite does not form as a precursor to calcite under ambient conditions.[15]

Microscopic Calcite and Vaterite
Aragonite occurs in majority when the reaction conditions inhibit the formation of calcite and/or promote the nucleation of aragonite. For example, the formation of aragonite is promoted by the presence of magnesium ions,[22] or by using proteins and peptides derived from biological calcium carbonate.[23] Some polyamines such as Cadaverine and Poly(ethylene imine) have been shown to facilitate the formation of aragonite over calcite.[15]
Selection by organisms[edit]
Organisms, such as molluscs and arthropods, have shown the ability to grow all three crystal polymorphs of calcium carbonate, mainly as protection (shells) and muscle attachments.[24] Moreover, they exhibit a remarkable capability of phase selection over calcite and aragonite, and some organisms can switch between the two polymorphs. The ability of phase selection is usually attributed to the use of specific macromolecules or combinations of macromolecules by such organisms.[25][26][27]
Occurrence[edit]

Geological sources[edit]
Calcite, aragonite and vaterite are pure calcium carbonate minerals. Industrially important source rocks which are predominantly calcium carbonate include limestone, chalk, marble and travertine.
Biological sources[edit]
Eggshells, snail shells and most seashells are predominantly calcium carbonate and can be used as industrial sources of that chemical.[29] Oyster shells have enjoyed recent recognition as a source of dietary calcium, but are also a practical industrial source.[30][31] Dark green vegetables such as broccoli and kale contain dietarily significant amounts of calcium carbonate, but they are not practical as an industrial source.[32]
[edit]
Beyond Earth, strong evidence suggests the presence of calcium carbonate on Mars. Signs of calcium carbonate have been detected at more than one location (notably at Gusev and Huygens craters). This provides some evidence for the past presence of liquid water.[33][34]
Geology[edit]

Surface precipitation of
CaCO3 as tufa in Rubaksa, Ethiopia
Carbonate is found frequently in geologic settings and constitutes an enormous carbon reservoir. Calcium carbonate occurs as aragonite, calcite and dolomite as significant constituents of the calcium cycle. The carbonate minerals form the rock types: limestone, chalk, marble, travertine, tufa, and others.

In warm, clear tropical waters corals are more abundant than towards the poles where the waters are cold. Calcium carbonate contributors, including plankton (such as coccoliths and planktic foraminifera), coralline algae, sponges, brachiopods, echinoderms, bryozoa and mollusks, are typically found in shallow water environments where sunlight and filterable food are more abundant. Cold-water carbonates do exist at higher latitudes but have a very slow growth rate. The calcification processes are changed by ocean acidification.
Where the oceanic crust is subducted under a continental plate sediments will be carried down to warmer zones in the asthenosphere and lithosphere. Under these conditions calcium carbonate decomposes to produce carbon dioxide which, along with other gases, give rise to explosive volcanic eruptions.
Carbonate compensation depth[edit]
The carbonate compensation depth (CCD) is the point in the ocean where the rate of precipitation of calcium carbonate is balanced by the rate of dissolution due to the conditions present. Deep in the ocean, the temperature drops and pressure increases. Calcium carbonate is unusual in that its solubility increases with decreasing temperature.[35] Increasing pressure also increases the solubility of calcium carbonate. The carbonate compensation depth can range from 4,000 to 6,000 meters below sea level.
Role in taphonomy[edit]
Calcium carbonate can preserve fossils through permineralization. Most of the vertebrate fossils of the Two Medicine Formation—a geologic formation known for its duck-billed dinosaur eggs—are preserved by CaCO3 permineralization.[36] This type of preservation conserves high levels of detail, even down to the microscopic level. However, it also leaves specimens vulnerable to weathering when exposed to the surface.[36]
Trilobite populations were once thought to have composed the majority of aquatic life during the Cambrian, due to the fact that their calcium carbonate-rich shells were more easily preserved than those of other species,[37] which had purely chitinous shells.
Uses[edit]
Construction[edit]
The main use of calcium carbonate is in the construction industry, either as a building material, or limestone aggregate for road building, as an ingredient of cement, or as the starting material for the preparation of builders’ lime by burning in a kiln. However, because of weathering mainly caused by acid rain,[38] calcium carbonate (in limestone form) is no longer used for building purposes on its own, but only as a raw primary substance for building materials.
Calcium carbonate is also used in the purification of iron from iron ore in a blast furnace. The carbonate is calcined in situ to give calcium oxide, which forms a slag with various impurities present, and separates from the purified iron.[39]
In the oil industry, calcium carbonate is added to drilling fluids as a formation-bridging and filtercake-sealing agent; it is also a weighting material which increases the density of drilling fluids to control the downhole pressure. Calcium carbonate is added to swimming pools, as a pH corrector for maintaining alkalinity and offsetting the acidic properties of the disinfectant agent.[40]
It is also used as a raw material in the refining of sugar from sugar beet; it is calcined in a kiln with anthracite to produce calcium oxide and carbon dioxide. This burnt lime is then slaked in fresh water to produce a calcium hydroxide suspension for the precipitation of impurities in raw juice during carbonatation.[41]
Calcium carbonate in the form of chalk has traditionally been a major component of blackboard chalk. However, modern manufactured chalk is mostly gypsum, hydrated calcium sulfate CaSO4·2H2O. Calcium carbonate is a main source for growing biorock. Precipitated calcium carbonate (PCC), pre-dispersed in slurry form, is a common filler material for latex gloves with the aim of achieving maximum saving in material and production costs.[42]
Fine ground calcium carbonate (GCC) is an essential ingredient in the microporous film used in diapers and some building films, as the pores are nucleated around the calcium carbonate particles during the manufacture of the film by biaxial stretching. GCC and PCC are used as a filler in paper because they are cheaper than wood fiber. In terms of market volume, GCC are the most important types of fillers currently used.[43] Printing and writing paper can contain 10–20% calcium carbonate. In North America, calcium carbonate has begun to replace kaolin in the production of glossy paper. Europe has been practicing this as alkaline papermaking or acid-free papermaking for some decades. PCC used for paper filling and paper coatings is precipitated and prepared in a variety of shapes and sizes having characteristic narrow particle size distributions and equivalent spherical diameters of 0.4 to 3 micrometers.[citation needed]
Calcium carbonate is widely used as an extender in paints,[44] in particular matte emulsion paint where typically 30% by weight of the paint is either chalk or marble. It is also a popular filler in plastics.[44] Some typical examples include around 15 to 20% loading of chalk in unplasticized polyvinyl chloride (uPVC) drainpipes, 5% to 15% loading of stearate-coated chalk or marble in uPVC window profile. PVC cables can use calcium carbonate at loadings of up to 70 phr (parts per hundred parts of resin) to improve mechanical properties (tensile strength and elongation) and electrical properties (volume resistivity).[citation needed] Polypropylene compounds are often filled with calcium carbonate to increase rigidity, a requirement that becomes important at high usage temperatures.[45] Here the percentage is often 20–40%. It also routinely used as a filler in thermosetting resins (sheet and bulk molding compounds)[45] and has also been mixed with ABS, and other ingredients, to form some types of compression molded «clay» poker chips.[46] Precipitated calcium carbonate, made by dropping calcium oxide into water, is used by itself or with additives as a white paint, known as whitewashing.[47][48]
Calcium carbonate is added to a wide range of trade and do it yourself adhesives, sealants, and decorating fillers.[44] Ceramic tile adhesives typically contain 70% to 80% limestone. Decorating crack fillers contain similar levels of marble or dolomite. It is also mixed with putty in setting stained glass windows, and as a resist to prevent glass from sticking to kiln shelves when firing glazes and paints at high temperature.[49][50][51][52]
In ceramic glaze applications, calcium carbonate is known as whiting,[44] and is a common ingredient for many glazes in its white powdered form. When a glaze containing this material is fired in a kiln, the whiting acts as a flux material in the glaze. Ground calcium carbonate is an abrasive (both as scouring powder and as an ingredient of household scouring creams), in particular in its calcite form, which has the relatively low hardness level of 3 on the Mohs scale, and will therefore not scratch glass and most other ceramics, enamel, bronze, iron, and steel, and have a moderate effect on softer metals like aluminium and copper. A paste made from calcium carbonate and deionized water can be used to clean tarnish on silver.[53]
Health and diet[edit]

500-milligram calcium supplements made from calcium carbonate
Calcium carbonate is widely used medicinally as an inexpensive dietary calcium supplement for gastric antacid[54] (such as Tums and Eno). It may be used as a phosphate binder for the treatment of hyperphosphatemia (primarily in patients with chronic kidney failure). It is used in the pharmaceutical industry as an inert filler for tablets and other pharmaceuticals.[55]
Calcium carbonate is used in the production of calcium oxide as well as toothpaste and has seen a resurgence as a food preservative and color retainer, when used in or with products such as organic apples.[56]
Calcium carbonate is used therapeutically as phosphate binder in patients on maintenance haemodialysis. It is the most common form of phosphate binder prescribed, particularly in non-dialysis chronic kidney disease. Calcium carbonate is the most commonly used phosphate binder, but clinicians are increasingly prescribing the more expensive, non-calcium-based phosphate binders, particularly sevelamer.
Excess calcium from supplements, fortified food, and high-calcium diets can cause milk-alkali syndrome, which has serious toxicity and can be fatal. In 1915, Bertram Sippy introduced the «Sippy regimen» of hourly ingestion of milk and cream, and the gradual addition of eggs and cooked cereal, for 10 days, combined with alkaline powders, which provided symptomatic relief for peptic ulcer disease. Over the next several decades, the Sippy regimen resulted in kidney failure, alkalosis, and hypercalcaemia, mostly in men with peptic ulcer disease. These adverse effects were reversed when the regimen stopped, but it was fatal in some patients with protracted vomiting. Milk-alkali syndrome declined in men after effective treatments for peptic ulcer disease arose. Since the 1990s it has been most frequently reported in women taking calcium supplements above the recommended range of 1.2 to 1.5 grams daily, for prevention and treatment of osteoporosis,[57][58] and is exacerbated by dehydration. Calcium has been added to over-the-counter products, which contributes to inadvertent excessive intake. Excessive calcium intake can lead to hypercalcemia, complications of which include vomiting, abdominal pain and altered mental status.[59]
As a food additive it is designated E170,[60] and it has an INS number of 170. Used as an acidity regulator, anticaking agent, stabilizer or color it is approved for usage in the EU,[61] US[62] and Australia and New Zealand.[63] It is «added by law to all UK milled bread flour except wholemeal».[64][65] It is used in some soy milk and almond milk products as a source of dietary calcium; at least one study suggests that calcium carbonate might be as bioavailable as the calcium in cow’s milk.[66] Calcium carbonate is also used as a firming agent in many canned and bottled vegetable products.
Several calcium supplement formulations have been documented to contain the chemical element lead,[67] posing a public health concern.[68] Lead is commonly found in natural sources of calcium.[67]
Agriculture and aquaculture[edit]
Agricultural lime, powdered chalk or limestone, is used as a cheap method for neutralising acidic soil, making it suitable for planting, also used in aquaculture industry for pH regulation of pond soil before initiating culture.[69]
Household cleaning[edit]
Calcium carbonate is a key ingredient in many household cleaning powders like Comet and is used as a scrubbing agent.
Pollution mitigation[edit]
In 1989, a researcher, Ken Simmons, introduced CaCO3 into the Whetstone Brook in Massachusetts.[70] His hope was that the calcium carbonate would counter the acid in the stream from acid rain and save the trout that had ceased to spawn. Although his experiment was a success, it did increase the amount of aluminium ions in the area of the brook that was not treated with the limestone. This shows that CaCO3 can be added to neutralize the effects of acid rain in river ecosystems. Currently calcium carbonate is used to neutralize acidic conditions in both soil and water.[71][72][73] Since the 1970s, such liming has been practiced on a large scale in Sweden to mitigate acidification and several thousand lakes and streams are limed repeatedly.[74]
Calcium carbonate is also used in flue gas desulfurisation applications eliminating harmful SO2 and NO2 emissions from coal and other fossil fuels burnt in large fossil fuel power stations.[71]
Calcination equilibrium[edit]
Calcination of limestone using charcoal fires to produce quicklime has been practiced since antiquity by cultures all over the world. The temperature at which limestone yields calcium oxide is usually given as 825 °C, but stating an absolute threshold is misleading. Calcium carbonate exists in equilibrium with calcium oxide and carbon dioxide at any temperature. At each temperature there is a partial pressure of carbon dioxide that is in equilibrium with calcium carbonate. At room temperature the equilibrium overwhelmingly favors calcium carbonate, because the equilibrium CO2 pressure is only a tiny fraction of the partial CO2 pressure in air, which is about 0.035 kPa.
At temperatures above 550 °C the equilibrium CO2 pressure begins to exceed the CO2 pressure in air. So above 550 °C, calcium carbonate begins to outgas CO2 into air. However, in a charcoal fired kiln, the concentration of CO2 will be much higher than it is in air. Indeed, if all the oxygen in the kiln is consumed in the fire, then the partial pressure of CO2 in the kiln can be as high as 20 kPa.[75]
The table shows that this partial pressure is not achieved until the temperature is nearly 800 °C. For the outgassing of CO2 from calcium carbonate to happen at an economically useful rate, the equilibrium pressure must significantly exceed the ambient pressure of CO2. And for it to happen rapidly, the equilibrium pressure must exceed total atmospheric pressure of 101 kPa, which happens at 898 °C.
-
Equilibrium pressure of CO2 over CaCO3 (P) versus temperature (T).[76]
P (kPa) 0.055 0.13 0.31 1.80 5.9 9.3 14 24 34 51 72 80 91 101 179 901 3961 T (°C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Solubility[edit]
With varying CO2 pressure[edit]

Calcium carbonate is poorly soluble in pure water (47 mg/L at normal atmospheric CO2 partial pressure as shown below).
The equilibrium of its solution is given by the equation (with dissolved calcium carbonate on the right):
-
CaCO3 ⇌ Ca2+ + CO2−3 Ksp = 3.7×10−9 to 8.7×10−9 at 25 °C
where the solubility product for [Ca2+][CO2−3] is given as anywhere from Ksp = 3.7×10−9 to Ksp = 8.7×10−9 at 25 °C, depending upon the data source.[76][77] What the equation means is that the product of molar concentration of calcium ions (moles of dissolved Ca2+ per liter of solution) with the molar concentration of dissolved CO2−3 cannot exceed the value of Ksp. This seemingly simple solubility equation, however, must be taken along with the more complicated equilibrium of carbon dioxide with water (see carbonic acid). Some of the CO2−3 combines with H+ in the solution according to
-
HCO−3 ⇌ H+ + CO2−3 Ka2 = 5.61×10−11 at 25 °C
HCO−3 is known as the bicarbonate ion. Calcium bicarbonate is many times more soluble in water than calcium carbonate—indeed it exists only in solution.
Some of the HCO−3 combines with H+ in solution according to
-
H2CO3 ⇌ H+ + HCO−3 Ka1 = 2.5×10−4 at 25 °C
Some of the H2CO3 breaks up into water and dissolved carbon dioxide according to
-
H2O + CO2(aq) ⇌ H2CO3 Kh = 1.70×10−3 at 25 °C
And dissolved carbon dioxide is in equilibrium with atmospheric carbon dioxide according to
-
PCO2/[CO2] = kH where kH = 29.76 atm/(mol/L) at 25 °C (Henry constant), PCO2 being the CO2 partial pressure.
For ambient air, PCO2 is around 3.5×10−4 atmospheres (or equivalently 35 Pa). The last equation above fixes the concentration of dissolved CO2 as a function of PCO2, independent of the concentration of dissolved CaCO3. At atmospheric partial pressure of CO2, dissolved CO2 concentration is 1.2×10−5 moles per liter. The equation before that fixes the concentration of H2CO3 as a function of CO2 concentration. For [CO2] = 1.2×10−5, it results in [H2CO3] = 2.0×10−8 moles per liter. When [H2CO3] is known, the remaining three equations together with
| PCO2 (atm) | pH | [Ca2+] (mol/L) |
|---|---|---|
| 10−12 | 12.0 | 5.19×10−3 |
| 10−10 | 11.3 | 1.12×10−3 |
| 10−8 | 10.7 | 2.55×10−4 |
| 10−6 | 9.83 | 1.20×10−4 |
| 10−4 | 8.62 | 3.16×10−4 |
| 3.5×10−4 | 8.27 | 4.70×10−4 |
| 10−3 | 7.96 | 6.62×10−4 |
| 10−2 | 7.30 | 1.42×10−3 |
| 10−1 | 6.63 | 3.05×10−3 |
| 1 | 5.96 | 6.58×10−3 |
| 10 | 5.30 | 1.42×10−2 |
-
H2O ⇌ H+ + OH− K = 10−14 at 25 °C
(which is true for all aqueous solutions), and the fact that the solution must be electrically neutral, i.e., the overall charge of dissolved positive ions [Ca2+] + 2 [H+] must be cancelled out by the overall charge of dissolved negative ions [HCO−3] + [CO2−3] + [OH−], make it possible to solve simultaneously for the remaining five unknown concentrations (note that the previously mentioned form of the neutrality is valid only if calcium carbonate has been put in contact with pure water or with a neutral pH solution; in the case where the initial water solvent pH is not neutral, the balance is not neutral).
The adjacent table shows the result for [Ca2+] and [H+] (in the form of pH) as a function of ambient partial pressure of CO2 (Ksp = 4.47×10−9 has been taken for the calculation).
- At atmospheric levels of ambient CO2 the table indicates that the solution will be slightly alkaline with a maximum CaCO3 solubility of 47 mg/L.
- As ambient CO2 partial pressure is reduced below atmospheric levels, the solution becomes more and more alkaline. At extremely low PCO2, dissolved CO2, bicarbonate ion, and carbonate ion largely evaporate from the solution, leaving a highly alkaline solution of calcium hydroxide, which is more soluble than CaCO3. Note that for PCO2 = 10−12 atm, the [Ca2+][OH−]2 product is still below the solubility product of Ca(OH)2 (8×10−6). For still lower CO2 pressure, Ca(OH)2 precipitation will occur before CaCO3 precipitation.
- As ambient CO2 partial pressure increases to levels above atmospheric, pH drops, and much of the carbonate ion is converted to bicarbonate ion, which results in higher solubility of Ca2+.
The effect of the latter is especially evident in day-to-day life of people who have hard water. Water in aquifers underground can be exposed to levels of CO2 much higher than atmospheric. As such water percolates through calcium carbonate rock, the CaCO3 dissolves according to the second trend. When that same water then emerges from the tap, in time it comes into equilibrium with CO2 levels in the air by outgassing its excess CO2. The calcium carbonate becomes less soluble as a result, and the excess precipitates as lime scale. This same process is responsible for the formation of stalactites and stalagmites in limestone caves.
Two hydrated phases of calcium carbonate, monohydrocalcite CaCO3·H2O and ikaite CaCO3·6H2O, may precipitate from water at ambient conditions and persist as metastable phases.
With varying pH, temperature and salinity: CaCO3 scaling in swimming pools[edit]


In contrast to the open equilibrium scenario above, many swimming pools are managed by addition of sodium bicarbonate (NaHCO3) to about 2 mM as a buffer, then control of pH through use of HCl, NaHSO4, Na2CO3, NaOH or chlorine formulations that are acidic or basic. In this situation, dissolved inorganic carbon (total inorganic carbon) is far from equilibrium with atmospheric CO2. Progress towards equilibrium through outgassing of CO2 is slowed by
- the slow reaction
- H2CO3 ⇌ CO2(aq) + H2O;[78]
- limited aeration in a deep water column; and
- periodic replenishment of bicarbonate to maintain buffer capacity (often estimated through measurement of total alkalinity).
In this situation, the dissociation constants for the much faster reactions
- H2CO3 ⇌ H+ + HCO−3 ⇌ 2 H+ + CO2−3
allow the prediction of concentrations of each dissolved inorganic carbon species in solution, from the added concentration of HCO−3 (which constitutes more than 90% of Bjerrum plot species from pH 7 to pH 8 at 25 °C in fresh water).[79] Addition of HCO−3 will increase CO2−3 concentration at any pH. Rearranging the equations given above, we can see that [Ca2+] = Ksp/[CO2−3], and [CO2−3] = Ka2 [HCO−3]/[H+]. Therefore, when HCO−3 concentration is known, the maximum concentration of Ca2+ ions before scaling through CaCO3 precipitation can be predicted from the formula:
- [Ca2+]max = Ksp/Ka2 × [H+]/[HCO−3]
The solubility product for CaCO3 (Ksp) and the dissociation constants for the dissolved inorganic carbon species (including Ka2) are all substantially affected by temperature and salinity,[79] with the overall effect that [Ca2+]max increases from freshwater to saltwater, and decreases with rising temperature, pH, or added bicarbonate level, as illustrated in the accompanying graphs.
The trends are illustrative for pool management, but whether scaling occurs also depends on other factors including interactions with Mg2+, [B(OH)4]− and other ions in the pool, as well as supersaturation effects.[80][81] Scaling is commonly observed in electrolytic chlorine generators, where there is a high pH near the cathode surface and scale deposition further increases temperature. This is one reason that some pool operators prefer borate over bicarbonate as the primary pH buffer, and avoid the use of pool chemicals containing calcium.[82]
Solubility in a strong or weak acid solution[edit]
Solutions of strong (HCl), moderately strong (sulfamic) or weak (acetic, citric, sorbic, lactic, phosphoric) acids are commercially available. They are commonly used as descaling agents to remove limescale deposits. The maximum amount of CaCO3 that can be «dissolved» by one liter of an acid solution can be calculated using the above equilibrium equations.
- In the case of a strong monoacid with decreasing acid concentration [A] = [A−], we obtain (with CaCO3 molar mass = 100 g/mol):
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 0.00 1.00 2.00 3.00 4.00 5.00 6.00 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)50.0 5.00 0.514 0.0849 0.0504 0.0474 0.0471 0.0470 0.0470
-
- where the initial state is the acid solution with no Ca2+ (not taking into account possible CO2 dissolution) and the final state is the solution with saturated Ca2+. For strong acid concentrations, all species have a negligible concentration in the final state with respect to Ca2+ and A− so that the neutrality equation reduces approximately to 2[Ca2+] = [A−] yielding [Ca2+] ≈ 0.5 [A−]. When the concentration decreases, [HCO−3] becomes non-negligible so that the preceding expression is no longer valid. For vanishing acid concentrations, one can recover the final pH and the solubility of CaCO3 in pure water.
- In the case of a weak monoacid (here we take acetic acid with pKa = 4.76) with decreasing total acid concentration [A] = [A−] + [AH], we obtain:
-
-
[A] (mol/L) [Ca2+] ≈ 0.5 [A−] 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 2.38 2.88 3.39 3.91 4.47 5.15 6.02 6.79 7.00 Final pH 6.75 7.25 7.75 8.14 8.25 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)49.5 4.99 0.513 0.0848 0.0504 0.0474 0.0471 0.0470 0.0470
-
- For the same total acid concentration, the initial pH of the weak acid is less acid than the one of the strong acid; however, the maximum amount of CaCO3 which can be dissolved is approximately the same. This is because in the final state, the pH is larger than the pKa, so that the weak acid is almost completely dissociated, yielding in the end as many H+ ions as the strong acid to «dissolve» the calcium carbonate.
- The calculation in the case of phosphoric acid (which is the most widely used for domestic applications) is more complicated since the concentrations of the four dissociation states corresponding to this acid must be calculated together with [HCO−3], [CO2−3], [Ca2+], [H+] and [OH−]. The system may be reduced to a seventh degree equation for [H+] the numerical solution of which gives
-
-
[A] (mol/L) 1 10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−10 Initial pH 1.08 1.62 2.25 3.05 4.01 5.00 5.97 6.74 7.00 Final pH 6.71 7.17 7.63 8.06 8.24 8.26 8.26 8.26 8.27 Dissolved CaCO3
(g/L of acid)62.0 7.39 0.874 0.123 0.0536 0.0477 0.0471 0.0471 0.0470
-
- where [A] = [H3PO4] + [H2PO−4] + [HPO2−4] + [PO3−4] is the total acid concentration. Thus phosphoric acid is more efficient than a monoacid since at the final almost neutral pH, the second dissociated state concentration [HPO2−4] is not negligible (see phosphoric acid).
See also[edit]

Electron micrograph of needle-like calcium carbonate crystals formed as limescale in a kettle

Around 2 g of calcium-48 carbonate
- Cuttlebone
- Cuttlefish
- Gesso
- Limescale
- Marble
- Ocean acidification
- Whiting event
- List of climate engineering topics
- Lysocline
References[edit]
- ^ Aylward, Gordon; Findlay, Tristan (2008). SI Chemical Data Book (4th ed.). John Wiley & Sons Australia. ISBN 978-0-470-81638-7.
- ^ Rohleder, J.; Kroker, E. (2001). Calcium Carbonate: From the Cretaceous Period Into the 21st Century. Springer Science & Business Media. ISBN 978-3-7643-6425-0.
- ^ Benjamin, Mark M. (2002). Water Chemistry. McGraw-Hill. ISBN 978-0-07-238390-4.
- ^ «Occupational safety and health guideline for calcium carbonate» (PDF). US Dept. of Health and Human Services. Retrieved 31 March 2011.
- ^ «Archived copy» (PDF). Archived from the original (PDF) on 29 October 2018. Retrieved 29 October 2018.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0090». National Institute for Occupational Safety and Health (NIOSH).
- ^ Strumińska-Parulska, DI (2015). «Determination of 210Po in calcium supplements and the possible related dose assessment to the consumers». Journal of Environmental Radioactivity. 150: 121–125. doi:10.1016/j.jenvrad.2015.08.006. PMID 26318774.
- ^ «Precipitated Calcium Carbonate». Archived from the original on 11 January 2014. Retrieved 11 January 2014.
- ^ Kim, Yi-Yeoun; Schenk, Anna S.; Ihli, Johannes; Kulak, Alex N.; Hetherington, Nicola B. J.; Tang, Chiu C.; Schmahl, Wolfgang W.; Griesshaber, Erika; Hyett, Geoffrey; Meldrum, Fiona C. (September 2014). «A critical analysis of calcium carbonate mesocrystals». Nature Communications. 5 (1): 4341. Bibcode:2014NatCo…5.4341K. doi:10.1038/ncomms5341. ISSN 2041-1723. PMC 4104461. PMID 25014563.
- ^ a b c d e Ropp, R. C. (6 March 2013). Encyclopedia of the Alkaline Earth Compounds. Elsevier. pp. 359–370. ISBN 9780444595508.
- ^ Demichelis, Raffaella; Raiteri, Paolo; Gale, Julian D.; Dovesi, Roberto (2013). «The Multiple Structures of Vaterite». Crystal Growth & Design. 13 (6): 2247–2251. doi:10.1021/cg4002972. ISSN 1528-7483.
- ^ Morse, John W.; Arvidson, Rolf S.; Lüttge, Andreas (1 February 2007). «Calcium Carbonate Formation and Dissolution». Chemical Reviews. 107 (2): 342–381. doi:10.1021/cr050358j. ISSN 0009-2665. PMID 17261071.
- ^ Géologue., Lippmann, Friedrich (1973). Sedimentary carbonate minerals. Springer. ISBN 3-540-06011-1. OCLC 715109304.
- ^ a b c d Nahi, Ouassef; Kulak, Alexander N.; Zhang, Shuheng; He, Xuefeng; Aslam, Zabeada; Ilett, Martha A.; Ford, Ian J.; Darkins, Robert; Meldrum, Fiona C. (20 November 2022). «Polyamines Promote Aragonite Nucleation and Generate Biomimetic Structures». Advanced Science: 2203759. doi:10.1002/advs.202203759. ISSN 2198-3844. PMID 36403251. S2CID 253707446.
- ^ International tables for crystallography. Chester, England: International Union of Crystallography. 2006. doi:10.1107/97809553602060000001. ISBN 978-0-7923-6590-7. OCLC 166325528.
- ^ Chessin, H.; Hamilton, W. C.; Post, B. (1 April 1965). «Position and thermal parameters of oxygen atoms in calcite». Acta Crystallographica. 18 (4): 689–693. doi:10.1107/S0365110X65001585. ISSN 0365-110X.
- ^ Negro, AD (1971). «Refinement of the crystal structure of aragonite» (PDF). American Mineralogist: Journal of Earth and Planetary Materials. 56: 768–772 – via GeoScienceWorld.
- ^ Kabalah-Amitai, Lee; Mayzel, Boaz; Kauffmann, Yaron; Fitch, Andrew N.; Bloch, Leonid; Gilbert, Pupa U. P. A.; Pokroy, Boaz (26 April 2013). «Vaterite Crystals Contain Two Interspersed Crystal Structures». Science. 340 (6131): 454–457. Bibcode:2013Sci…340..454K. doi:10.1126/science.1232139. ISSN 0036-8075. PMID 23620047. S2CID 206546317.
- ^ Bots, Pieter; Benning, Liane G.; Rodriguez-Blanco, Juan-Diego; Roncal-Herrero, Teresa; Shaw, Samuel (3 July 2012). «Mechanistic Insights into the Crystallization of Amorphous Calcium Carbonate (ACC)». Crystal Growth & Design. 12 (7): 3806–3814. doi:10.1021/cg300676b. ISSN 1528-7483.
- ^ Cardew, Peter T.; Davey, Roger J. (2 October 2019). «The Ostwald Ratio, Kinetic Phase Diagrams, and Polymorph Maps». Crystal Growth & Design. 19 (10): 5798–5810. doi:10.1021/acs.cgd.9b00815. ISSN 1528-7483. S2CID 202885778.
- ^ Zhang, Shuheng; Nahi, Ouassef; Chen, Li; Aslam, Zabeada; Kapur, Nikil; Kim, Yi‐Yeoun; Meldrum, Fiona C. (June 2022). «Magnesium Ions Direct the Solid‐State Transformation of Amorphous Calcium Carbonate Thin Films to Aragonite, Magnesium‐Calcite, or Dolomite». Advanced Functional Materials. 32 (25): 2201394. doi:10.1002/adfm.202201394. ISSN 1616-301X. S2CID 247587883.
- ^ Metzler, Rebecca A.; Evans, John Spencer; Killian, Christopher E.; Zhou, Dong; Churchill, Tyler H.; Appathurai, Narayana P.; Coppersmith, Susan N.; Gilbert, P. U. P. A. (12 May 2010). «Nacre Protein Fragment Templates Lamellar Aragonite Growth». Journal of the American Chemical Society. 132 (18): 6329–6334. doi:10.1021/ja909735y. ISSN 0002-7863. PMID 20397648.
- ^ Lowenstam, H.A.; Weiner, S. (1989). On Biomineralization. Oxford University Press. ISBN 9780195049770.
- ^ Belcher, A. M.; Wu, X. H.; Christensen, R. J.; Hansma, P. K.; Stucky, G. D.; Morse, D. E. (May 1996). «Control of crystal phase switching and orientation by soluble mollusc-shell proteins». Nature. 381 (6577): 56–58. Bibcode:1996Natur.381…56B. doi:10.1038/381056a0. ISSN 1476-4687. S2CID 4285912.
- ^ Falini, Giuseppe; Albeck, Shira; Weiner, Steve; Addadi, Lia (5 January 1996). «Control of Aragonite or Calcite Polymorphism by Mollusk Shell Macromolecules». Science. 271 (5245): 67–69. Bibcode:1996Sci…271…67F. doi:10.1126/science.271.5245.67. ISSN 0036-8075. S2CID 95357556.
- ^ Marin, Frédéric (October 2020). «Mollusc shellomes: Past, present and future». Journal of Structural Biology. 212 (1): 107583. doi:10.1016/j.jsb.2020.107583. PMID 32721585. S2CID 220850117.
- ^ Russell, Daniel E . 17 February 2008. Retrieved December 31, 2010. «Helgustadir Iceland Spar Mine» mindat.org
- ^ Horne, Francis (23 October 2006). «How are seashells created?». Scientific American. Retrieved 25 April 2012.
- ^ «Oyster shell calcium». WebMD. Retrieved 25 April 2012.
- ^ «Oyster Shell Calcium Carbonate». Caltron Clays & Chemicals. Archived from the original on 10 September 2013. Retrieved 25 April 2012.
- ^ Mangels, Ann Reed (4 June 2014). «Bone nutrients for vegetarians». The American Journal of Clinical Nutrition. 100 (1): 469S–475S. doi:10.3945/ajcn.113.071423. PMID 24898231.
- ^ Boynton, W. V.; Ming, D. W.; Kounaves, S. P.; et al. (2009). «Evidence for Calcium Carbonate at the Mars Phoenix Landing Site» (PDF). Science. 325 (5936): 61–64. Bibcode:2009Sci…325…61B. doi:10.1126/science.1172768. PMID 19574384. S2CID 26740165.
- ^
Clark, B. C., III; Arvidson, R. E.; Gellert, R.; et al. (2007). «Evidence for montmorillonite or its compositional equivalent in Columbia Hills, Mars» (PDF). Journal of Geophysical Research. 112 (E6): E06S01. Bibcode:2007JGRE..112.6S01C. doi:10.1029/2006JE002756. hdl:1893/17119. - ^ Weyl, P.K. (1959). «The change in solubility of calcium carbonate with temperature and carbon dioxide content». Geochimica et Cosmochimica Acta. 17 (3–4): 214–225. Bibcode:1959GeCoA..17..214W. doi:10.1016/0016-7037(59)90096-1.
- ^ a b Trexler, D. (2001). «Two Medicine Formation, Montana: geology and fauna». In Tanke, D. H.; Carpenter, K. (eds.). Mesozoic Vertebrate Life. Indiana University Press. pp. 298–309. ISBN 978-0-253-33907-2.
- ^ Ward, Peter (2006). Out of Thin Air: Dinosaurs, Birds, and Earth’s Ancient Atmosphere. doi:10.17226/11630. ISBN 9780309666121.
- ^ «Effects of Acid Rain». US Environmental Protection Agency. Retrieved 14 March 2015.
- ^ «Blast Furnace». Science Aid. Archived from the original on 17 December 2007. Retrieved 30 December 2007.
- ^ Sfetcu, Nicolae (2 May 2014). Health & Drugs: Disease, Prescription & Medication. Nicolae Sfetcu.
- ^ McGinnis, R. A. Beet-Sugar Technology (2nd ed.). Beet Sugar Development Foundation. p. 178.
- ^ «Precipitated Calcium Carbonate uses». Archived from the original on 25 July 2014.
- ^ «Market Study Fillers, 2nd ed». Ceresana. September 2011.
- ^ a b c d «Calcium Carbonate Powder». Reade Advanced Materials. 4 February 2006. Archived from the original on 22 February 2008. Retrieved 30 December 2007.
- ^ a b «Calcium carbonate in plastic applications». Imerys Performance Minerals. Archived from the original on 4 August 2008. Retrieved 1 August 2008.
- ^ «Why do calcium carbonate play an important part in Industrial». www.xintuchemical.com. Retrieved 7 October 2018.
- ^ «precipitated calcium carbonate commodity price». www.dgci.be. Archived from the original on 7 October 2018. Retrieved 7 October 2018.
- ^ Jimoh, O.A.; et al. (2017). «Understanding the Precipitated Calcium Carbonate (PCC) Production Mechanism and Its Characteristics in the Liquid–Gas System Using Milk of Lime (MOL) Suspension» (PDF). South African Journal of Chemistry. 70: 1–7. doi:10.17159/0379-4350/2017/v70a1.
- ^ «Topic: Re: Can our calcium carbonate «waste» be utilized in other industries so we can divert it from landfills?». www.chemicalprocessing.com. 4 March 2010. Archived from the original on 23 March 2017. Retrieved 3 February 2021.
- ^ «Why do calcium carbonate play an important part in Industry?». www.xintuchemical.com. Retrieved 3 February 2021.
- ^ «Calcium Carbonates / Calcite/ Limestone. CaCO3 | Rajasthan Minerals & Chemicals». www.rmcl.co.in. Archived from the original on 15 April 2021. Retrieved 3 February 2021.
- ^ «Calcium Carbonate». kamceramics.com. Retrieved 3 February 2021.
- ^ «Ohio Historical Society Blog: Make It Shine». Ohio Historical Society. Archived from the original on 23 March 2012. Retrieved 2 June 2011.
- ^ «Calcium Carbonate». Medline Plus. National Institutes of Health. 1 October 2005. Archived from the original on 17 October 2007. Retrieved 30 December 2007.
- ^ Lieberman, Herbert A.; Lachman, Leon; Schwartz, Joseph B. (1990). Pharmaceutical Dosage Forms: Tablets. New York: Dekker. p. 153. ISBN 978-0-8247-8044-9.
- ^ «Food Additives – Names Starting with C». Chemistry.about.com. 10 April 2012. Archived from the original on 16 October 2006. Retrieved 24 May 2012.
- ^ Caruso JB, Patel RM, Julka K, Parish DC (July 2007). «Health-behavior induced disease: return of the milk-alkali syndrome». J Gen Intern Med. 22 (7): 1053–5. doi:10.1007/s11606-007-0226-0. PMC 2219730. PMID 17483976.
- ^ Beall DP, Henslee HB, Webb HR, Scofield RH (May 2006). «Milk-alkali syndrome: a historical review and description of the modern version of the syndrome». Am. J. Med. Sci. 331 (5): 233–42. doi:10.1097/00000441-200605000-00001. PMID 16702792. S2CID 45802184.
- ^ Gabriely, Ilan; Leu, James P.; Barzel, Uriel S. (2008). «Clinical problem-solving, back to basics». New England Journal of Medicine. 358 (18): 1952–6. doi:10.1056/NEJMcps0706188. PMID 18450607.
- ^ «E-numbers: E170 Calcium carbonate». Food-Info.net. 080419 food-info.net
- ^ «Current EU approved additives and their E Numbers». UK Food Standards Agency. Retrieved 27 October 2011.
- ^ «Listing of Food Additives Status Part I». US Food and Drug Administration. Archived from the original on 14 March 2013. Retrieved 27 October 2011.
- ^ «Standard 1.2.4 – Labelling of ingredients». Australia New Zealand Food Standards Code. Retrieved 27 October 2011.
- ^ Holdstock, Lee. «Why go organic?». Real Bread Campaign. Soil Association Certification Limited. Retrieved 3 April 2021.
- ^ «Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply» (PDF). Department for Environment, Food and Rural Affairs. August 2013.
- ^ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). «Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women». The Journal of Nutrition. 135 (10): 2379–2382. doi:10.1093/jn/135.10.2379. PMID 16177199.
- ^ a b Kauffman, John F.; Westenberger, Benjamin J.; Robertson, J. David; Guthrie, James; Jacobs, Abigail; Cummins, Susan K. (1 July 2007). «Lead in pharmaceutical products and dietary supplements». Regulatory Toxicology and Pharmacology. 48 (2): 128–134. doi:10.1016/j.yrtph.2007.03.001. ISSN 0273-2300. PMID 17467129.
- ^ Ross, Edward A.; Szabo, N. J.; Tebbett, I. R. (2000). «Lead Content of Calcium Supplements». JAMA. 284 (11): 1425–1429. doi:10.1001/jama.284.11.1425. PMID 10989406.
- ^ Oates, J. A. H. (11 July 2008). Lime and Limestone: Chemistry and Technology, Production and Uses. John Wiley & Sons. pp. 111–113. ISBN 978-3-527-61201-7.
- ^ «Limestone Dispenser Fights Acid Rain in Stream». The New York Times. Associated Press. 13 June 1989.
- ^ a b «Environmental Uses for Calcium Carbonate». Congcal. 6 September 2012. Retrieved 5 August 2013.
- ^ Schreiber, R. K. (1988). «Cooperative federal-state liming research on surface waters impacted by acidic deposition». Water, Air, & Soil Pollution. 41 (1): 53–73. Bibcode:1988WASP…41…53S. doi:10.1007/BF00160344. S2CID 98404326.
- ^ Kircheis, Dan; Dill, Richard (2006). «Effects of low pH and high aluminum on Atlantic salmon smolts in Eastern Maine and liming project feasibility analysis» (reprinted at Downeast Salmon Federation). National Marine Fisheries Service and Maine Atlantic Salmon Commission.[permanent dead link]
- ^ Guhrén, M.; Bigler, C.; Renberg, I. (2006). «Liming placed in a long-term perspective: A paleolimnological study of 12 lakes in the Swedish liming program». Journal of Paleolimnology. 37 (2): 247–258. Bibcode:2007JPall..37..247G. doi:10.1007/s10933-006-9014-9. S2CID 129439066.
- ^ «Solvay Precipitated Calcium Carbonate: Production». Solvay. 9 March 2007. Retrieved 30 December 2007.
- ^ a b Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ «Selected Solubility Products and Formation Constants at 25 °C». California State University, Dominguez Hills. Archived from the original on 25 May 2006. Retrieved 7 June 2007.
- ^ Wang, X.; Conway, W.; Burns, R.; McCann, N.; Maeder, M. (2010). «Comprehensive Study of the Hydration and Dehydration Reactions of Carbon Dioxide in Aqueous Solution». The Journal of Physical Chemistry A. 114 (4): 1734–40. Bibcode:2010JPCA..114.1734W. doi:10.1021/jp909019u. PMID 20039712.
- ^ a b Mook, W. (2000). «Chemistry of carbonic acid in water». Environmental Isotopes in the Hydrological Cycle: Principles and Applications (PDF). Paris: INEA/UNESCO. pp. 143–165. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). «Factors affecting precipitation of calcium carbonate» (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 18–23. Archived from the original (PDF) on 18 March 2014. Retrieved 18 March 2014.
- ^ Wojtowicz, J. A. (1998). «Corrections, potential errors, and significance of the saturation index» (PDF). Journal of the Swimming Pool and Spa Industry. 3 (1): 37–40. Archived from the original (PDF) on 24 August 2012. Retrieved 18 March 2014.
- ^ Birch, R. G. (2013). «BABES: a better method than «BBB» for pools with a salt-water chlorine generator» (PDF). scithings.id.au.
External links[edit]
- International Chemical Safety Card 1193
- CID 516889 from PubChem
- ATC codes: A02AC01 (WHO) and A12AA04 (WHO)
- The British Calcium Carbonate Association – What is calcium carbonate Archived 24 May 2008 at the Wayback Machine
- CDC – NIOSH Pocket Guide to Chemical Hazards – Calcium Carbonate
| Карбонат кальция | ||
|---|---|---|
| ||
 | ||
| Общие | ||
| Систематическое наименование | карбонат кальция | |
| Традиционные названия | карбонат кальция, углекислый кальций, арагонит, кальцит, известняк, мел, мрамор, фатерит | |
| Хим. формула | CaCO3 | |
| Рац. формула | CaCO3 | |
| Физические свойства | ||
| Состояние | твёрдые белые кристаллы | |
| Молярная масса | 100.0869 г/моль | |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | |
| • разложения | 900−1000 °C | |
| Энтальпия | ||
| • образования | -1206,9 кДж/моль | |
| Давление пара | 0 ± 1 мм рт.ст.[1] | |
| Химические свойства | ||
Константа диссоциации кислоты  | 9.0 | |
| Растворимость | ||
| • в воде | (25 °C) 0,0014 г/100мл | |
| Оптические свойства | ||
| Показатель преломления | 1,60 | |
| Структура | ||
| Кристаллическая структура | тригональная, пространств. гр. 2/m | |
| Классификация | ||
| Рег. номер CAS | 471-34-1 | |
| PubChem | 10112 | |
| Рег. номер EINECS | 207-439-9 | |
| SMILES | C(=O)([O-])[O-].[Ca+2] | |
| InChI | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 VTYYLEPIZMXCLO-UHFFFAOYSA-L | |
| Кодекс Алиментариус | E170 | |
| RTECS | FF9335000 | |
| ChEBI | 3311 | |
| ChemSpider | 9708 | |
| Безопасность | ||
| Предельная концентрация | 6 мг/дм3 | |
| ЛД50 | 6400 мг/кг | |
| Токсичность | Класс опасности 4 | |
| NFPA 704 |
0 0 0 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Карбона́т ка́льция (углеки́слый кальций, кальцит, арагонит, известняк, мел, мрамор) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула 
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц и пресмыкающихся, а также в состав раковин моллюсков и некоторых других беспозвоночных.
Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование

Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слёживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 1535 дней].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и пигмента, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 1535 дней].
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе

Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространённой.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
- Доломит
-

Кальцит
-

Арагонит
-

Мрамор
-

Травертин
Геология
Залежи карбоната кальция в виде известняковых и меловых пластов — распространённое явление в земной коре. Они имеют органическое, реже хемогенное происхождение.
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона, моллюсков, кораллов и др., в основном, в меловой период.
Такие горные породы как известняк, мел, мрамор, травертин и другие известковые туфы практически полностью состоят из карбоната кальция с различными примесями.
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашёной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
.
Реагирует с сильными кислотами с вытеснением угольной кислоты, которая тут же разлагается на воду и углекислый газ:
Данная реакция используется для лабораторного получения углекислого газа в аппарате Киппа.
Безопасность
Карбонат кальция считается нетоксичным веществом. ПДК 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция).
ЛД50 на крысах около 6400 мг/кг.
Одобрен Объединённым экспертным комитетом ФАО/ВОЗ по пищевым добавкам (JECFA) в качестве пищевой добавки в 1965 году[3]. Имеет номер E170[4] и номер INS 170. Используется в качестве регулятора кислотности, антислеживателя, стабилизатора или пищевого красителя и одобрен для использования в Европейском союзе[5], США[6], Австралии и Новой Зеландии[7]. Он «по закону добавляется ко всей муке грубого помола в Великобритании, кроме цельнозерновой»[8][9]. Он используется в некоторых продуктах из соевого молока и миндального молока в качестве источника диетического кальция; по крайней мере, одно исследование предполагает, что карбонат кальция может быть таким же биодоступным, как кальций в коровьем молоке[10]. Карбонат кальция также используется в качестве укрепляющего агента во многих консервированных и бутилированных овощных продуктах.
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0090.html
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано 9 февраля 2012 года.
- ↑ World Health Organization. CALCIUM CARBONATE // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 26 июня 2022 года.
- ↑ E-numbers: E170 Calcium carbonate. Food-Info.net. Дата обращения: 14 октября 2022. Архивировано 14 октября 2022 года. 080419 food-info.net
- ↑ Current EU approved additives and their E Numbers. UK Food Standards Agency. Дата обращения: 27 октября 2011. Архивировано 7 октября 2010 года.
- ↑ Listing of Food Additives Status Part I. US Food and Drug Administration. Дата обращения: 27 октября 2011. Архивировано 14 марта 2013 года.
- ↑ Standard 1.2.4 – Labelling of ingredients. Australia New Zealand Food Standards Code. Дата обращения: 27 октября 2011. Архивировано 2 сентября 2013 года.
- ↑ Why go organic?, Real Bread Campaign. Архивировано 14 октября 2022 года. Дата обращения: 14 октября 2022.
- ↑ Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply, Department for Environment, Food and Rural Affairs (August 2013). Архивировано 19 сентября 2021 года. Дата обращения: 14 октября 2022.
- ↑ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). “Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women”. The Journal of Nutrition. 135 (10): 2379—2382. DOI:10.1093/jn/135.10.2379. PMID 16177199.
Литература
- Calcium Carbonate : [англ.] : [арх. 17 октября 2007] / National Institutes of Health // Medline Plus. — 2005. — 1 October. — Revised: Sep 15, 2015.
- А.И. Врублевский Основы химии
Ссылки
- Краситель е170 – Карбонат кальция : [арх. 26 октября 2010] // Факты о здоровой пище. — 2009.
![]()
Эта страница в последний раз была отредактирована 11 января 2023 в 23:03.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Карбонат кальция
Характеристики и физические свойства карбоната кальция
Практически не растворяется в воде.

Рис. 1. Карбонат кальция. Внешний вид.
Основные характеристики карбоната кальция приведены в таблице ниже:
| Молекулярная формула | CaCO3 |
| Молярная масса, г/моль | 100 |
| Плотность, г/см3 | 2,74 – 2,83 |
| Температура плавления, oС | 825 |
| Температура разложения, oС | 900 – 1000 |
| Растворимость в воде (25oС), г/100 мл | 0,0015 |
Получение карбоната кальция
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
CaO + H2O = Ca(OH)2;
Ca(OH)2 + CO2 = CaCO3↓.
Химические свойства карбоната кальция
Карбонат кальция — это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная H2CO3). В водном растворе он гидролизуется. Гидролиз протекает по аниону. Наличие анионов OH— свидетельствует о щелочном характере среды.
CaCO3↔ Ca2+ +CO32-;
Ca2+ +CO32- + HOH ↔ HCO3— + Ca2+ + OH—;
CaCO3 + HOH ↔ Ca(HCO3)2 + Ca(OH)2↓.
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот:
CaCO3 + 2HClconc = CaCl2 + CO2↑ + H2O.
Он способен реагировать с щелочами в водных растворах:
CaCO3 + 2NaOHaq = Na2CO3 + Ca(OH)2↓.
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды:
CaCO3 + 2NH4Clcon = CaCl2 + 2NH3↑ + CO2↑ + H2O.
При нагревании данная соль разлагается:
CaCO3 = CaO + CO2↑ (t,oС = 900 — 1000).
Пропускание диоксида углерода через раствор карбоната кальция приводит к образованию кислой соли – гидрокарбоната кальция:
CaCO3 + CO2 + H2O ↔Ca(HCO3)2.
Применение карбоната кальция
Карбонат кальция нашел широкое применение в различных отраслях промышленности. Так, например, его используют в пищевой (добавка Е710 – белый краситель) и бумажной промышленности, при производстве полимеров, лакокрасочных материалов, бытовой химии и т.д.
Примеры решения задач
| Карбонат кальция | ||
|---|---|---|
| ||
 | ||
| Общие | ||
| Систематическое наименование (b) | карбонат кальция | |
| Традиционные названия | карбонат кальция, углекислый кальций, арагонит (b) , кальцит (b) , известняк (b) , мел (b) , мрамор (b) , фатерит (b) | |
| Хим. формула (b) | CaCO3 | |
| Рац. формула (b) | CaCO3 | |
| Физические свойства | ||
| Состояние (b) | твёрдые белые кристаллы | |
| Молярная масса (b) | 100.0869 г/моль (b) | |
| Плотность (b) | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления (b) | (кальцит) 825 °C, (арагонит) 1339 °C | |
| • разложения | 900−1000 °C | |
| Энтальпия | ||
| • образования | -1206,9 кДж/моль | |
| Давление пара | 0 ± 1 мм рт.ст.[1] | |
| Химические свойства | ||
| Константа диссоциации кислоты (b) | 9.0 | |
| Растворимость (b) | ||
| • в воде | (25 °C) 0,0014 г/100мл | |
| Оптические свойства | ||
| Показатель преломления (b) | 1,60 | |
| Структура | ||
| Кристаллическая структура (b) | тригональная, пространств. гр. (b) 2/m | |
| Классификация | ||
| Рег. номер CAS (b) | 471-34-1 | |
| PubChem (b) | 10112 | |
| Рег. номер EINECS (b) | 207-439-9 | |
| SMILES (b) | C(=O)([O-])[O-].[Ca+2] | |
| InChI (b) | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 VTYYLEPIZMXCLO-UHFFFAOYSA-L | |
| Кодекс Алиментариус (b) | E170 | |
| RTECS (b) | FF9335000 | |
| ChEBI | 3311 | |
| ChemSpider (b) | 9708 | |
| Безопасность | ||
| Предельная концентрация (b) | 6 мг/дм3 | |
| ЛД50 (b) | 6400 мг/кг | |
| Токсичность (b) | Класс опасности 4 | |
| NFPA 704 (b) |  0 0 0 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Карбона́т ка́льция (углеки́слый кальций, кальцит, арагонит, известняк, мел, мрамор) — неорганическое (b) химическое соединение (b) , соль (b) угольной кислоты (b) и кальция (b) . Химическая формула .
В природе встречается в виде многочисленных минералов, например, кальцита (b) , арагонита (b) и ватерита (b) , является главной составной частью известняка (b) , мрамора (b) , мела (b) , входит в состав скорлупы яиц птиц и пресмыкающихся, а также в состав раковин моллюсков и некоторых других беспозвоночных (b) .
Нерастворим в воде (b) и этаноле (b) . Зарегистрирован как белый пищевой краситель (b) (E170 (b) ).
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела (b) , используется для письма на досках (b) . Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование

Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности (b) , в качестве наполнителя при производстве пластмасс (b) , красок (b) , резины (b) , продукции бытовой химии (b) , в строительстве.
При производстве бумаги (b) карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла (b) , — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слёживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (b) (синдром Бернетта (b) ). Рекомендован при болезнях костных тканей[источник не указан 1535 дней].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и пигмента, карбонат кальция необходим при производстве поливинилхлорида (b) (PVC), полиэфирных волокон (кримплен (b) , лавсан (b) , и т. п.), полиолефинов (b) . Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок[источник не указан 1535 дней].
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок (b) и герметиков (b) .
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе

Карбонат кальция находится в минералах в виде полиморфов (b) :
- Арагонит (b)
- Кальцит (b)
- Фатерит (b) (или μ-CaCO3)
Тригональная (b) кристаллическая структура (b) кальцита является наиболее распространённой.
Минералы карбоната кальция находятся в следующих горных породах (b) :
- Мел (b)
- Известняк (b)
- Мрамор (b)
- Травертин (b)
- Доломит (b)
-

Кальцит
-

Арагонит
-

Мрамор
-

Травертин
Геология
Залежи карбоната кальция в виде известняковых (b) и меловых (b) пластов — распространённое явление в земной коре. Они имеют органическое, реже хемогенное происхождение (b) .
Органическое происхождение связано отложениями останков древних морских организмов: зоопланктона (b) , моллюсков (b) , кораллов и др., в основном, в меловой период (b) .
Такие горные породы как известняк, мел, мрамор, травертин (b) и другие известковые туфы (b) практически полностью состоят из карбоната кальция с различными примесями.
В природе встречаются три кристаллические модификации карбоната кальция (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Кальцит (b) является наиболее устойчивой и распространённой кристаллической модификацией карбоната кальция. Около 10 % всех осадочных пород составляют известняки, сложенные кальцитовыми останками раковин простейших морских организмов.
Арагонит (b) является второй по устойчивости и распространённости кристаллической модификацией CaCO3. В основном формируется в раковинах моллюсков и скелетах кораллов. Также арагонит может образовываться при неорганических процессах (хемогенное происхождение), например, в карстовых пещерах или гидротермальных источниках в результате химического осаждения из водных растворов или при испарении воды.
Фатерит (b) является наименее стабильной разновидностью карбоната кальция и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция (b) — негашёной извести. При этом образуется гидроксид кальция (b) , и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ (b) CO2 и основный оксид — негашёную известь (b) CaO:
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция (b) Ca(HCO3)2:
- .
Из-за этой реакции образуются сталактиты (b) , сталагмиты (b) . Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые (b) пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса (b) , образует карбид кальция (b) и угарный газ:
- .
Реагирует с сильными кислотами с вытеснением угольной кислоты (b) , которая тут же разлагается на воду и углекислый газ (b) :
Данная реакция используется для лабораторного получения углекислого газа (b) в аппарате Киппа (b) .
Безопасность
Карбонат кальция считается нетоксичным веществом. ПДК (b) 180 мг/дм³ (в воде, с обязательным контролем по ионам кальция (b) ). ЛД50 (b) на крысах около 6400 мг/кг.
Одобрен Объединённым экспертным комитетом ФАО/ВОЗ по пищевым добавкам (b) (JECFA) в качестве пищевой добавки (b) в 1965 году[3]. Имеет номер E170[4] и номер INS 170. Используется в качестве регулятора кислотности (b) , антислеживателя (b) , стабилизатора (b) или пищевого красителя (b) и одобрен для использования в Европейском союзе (b) [5], США (b) [6], Австралии (b) и Новой Зеландии (b) [7]. Он «по закону добавляется ко всей муке (b) грубого помола в Великобритании, кроме цельнозерновой»[8][9]. Он используется в некоторых продуктах из соевого молока (b) и миндального молока (b) в качестве источника диетического кальция; по крайней мере, одно исследование предполагает, что карбонат кальция может быть таким же биодоступным, как кальций в коровьем молоке (b) [10]. Карбонат кальция также используется в качестве укрепляющего агента во многих консервированных (b) и бутилированных овощных продуктах.
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0090.html
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано 9 февраля 2012 года.
- ↑ World Health Organization. CALCIUM CARBONATE // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 26 июня 2022 года.
- ↑ E-numbers: E170 Calcium carbonate. Food-Info.net. Дата обращения: 14 октября 2022. Архивировано 14 октября 2022 года. 080419 food-info.net
- ↑ Current EU approved additives and their E Numbers. UK Food Standards Agency. Дата обращения: 27 октября 2011. Архивировано 7 октября 2010 года.
- ↑ Listing of Food Additives Status Part I. US Food and Drug Administration (b) . Дата обращения: 27 октября 2011. Архивировано 14 марта 2013 года.
- ↑ Standard 1.2.4 – Labelling of ingredients. Australia New Zealand Food Standards Code. Дата обращения: 27 октября 2011. Архивировано 2 сентября 2013 года.
- ↑ Why go organic?, Real Bread Campaign. Архивировано 14 октября 2022 года. Дата обращения: 14 октября 2022.
- ↑ Bread and Flour Regulations 1998 A summary of responses to the consultation and Government Reply, Department for Environment, Food and Rural Affairs (August 2013). Архивировано 19 сентября 2021 года. Дата обращения: 14 октября 2022.
- ↑ Zhao, Y.; Martin, B. R.; Weaver, C. M. (2005). “Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow’s milk in young women”. The Journal of Nutrition. 135 (10): 2379—2382. DOI (b) :10.1093/jn/135.10.2379. PMID (b) 16177199.
Литература
- Calcium Carbonate : (b) [англ. (b) ] : [арх. 17 октября 2007] / National Institutes of Health (b) // Medline Plus. — 2005. — 1 October. — Revised: Sep 15, 2015.
- А.И. Врублевский Основы химии
Ссылки
- Краситель е170 – Карбонат кальция : [арх. 26 октября 2010] // Факты о здоровой пище. — 2009.
| Карбонат кальция | |
 | |
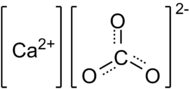  | |
| Общие | |
|---|---|
| Систематическое наименование | карбонат кальция |
| Традиционные названия | углекислый кальций |
| Химическая формула | CaCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдые белые кристаллы |
| Молярная масса | 100.0869 г/моль |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
| Термические свойства | |
| Температура плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
| Температура разложения | 900−1000 °C |
| Химические свойства | |
| pKa | 9.0 |
| Растворимость в воде | (25 °C) 0.00015 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,60 |
| Структура | |
| Кристаллическая структура | тригональная, пространств. гр. 32/m |
| Безопасность | |
| Токсичность |
0 0 0 |
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула —  . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
- 1 Применение
- 1.1 Массовое производство/использование
- 1.2 Строительство
- 2 Нахождение в природе
- 3 Геология
- 4 Изготовление
- 5 Химические свойства
- 6 Примечания
- 7 Ссылки
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование

![]()
Таблетки из карбоната кальция
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
- Арагонит
- Кальцит
- Фатерит (или μ-CaCO3)
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
- Мел
- Известняк
- Мрамор
- Травертин
-

Кальцит
-

Арагонит
-

Мрамор
-

Травертин
Геология
Карбонат часто встречается в геологической среде. Он находится как полиморф. Полиморфами являются минералы с той же химической формулой, но разной химической структуры. Арагонит, кальцит, известняк, мел, мрамор, травертин, туф и др. — все они имеют формулу CaCO3, но каждый из них имеет несколько иной химический состав. Кальцит, как карбонат кальция, геологи обычно находят в морских условиях. Также кальцит, как правило, находится около теплых тропических условий. Это связано с его химией и свойствами. Кальцит может выпадать чаще как осадок в теплой среде, чем в холодной, поскольку теплая среда не дает улетучиваться в больших объемах CO2. Это аналогично тому как CO2 растворяется в воде. Когда вы открываете крышку пластиковой бутылки происходит выделение CO2. Из-за того что сода нагревается, выделяется углекислый газ. Этот же принцип может быть применен к кальциту и в океане. Карбонаты данного вещества в холодной воде существуют в более высоких широтах, но имеют очень медленный темп роста.
В тропических условиях вода теплая и чистая. Таким образом, вы можете увидеть много кораллов в данной среде по сравнению с холодной, где вода холодная. Производители карбоната кальция, такие как кораллы, водоросли и микроорганизмы, которые обычно встречаются в мелководных водоемах, как фильтраторы, требуют солнечный свет для производства карбоната кальция.
Изготовление
Подавляющее большинство карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из чистого источника (как правило, мрамор).
В качестве альтернативы карбонат кальция может быть приготовлен кальцинацией оксида кальция. Вода добавляется к этому оксиду, давая гидроксид кальция, и затем проводится углекислый газ, который проходит через этот раствор для осаждения желаемого карбоната кальция[1]:
Химические свойства
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO по уравнению:
 .
.
В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
 .
.
Существование именно этой реакции дает возможность образовываться сталактитам, сталагмитам и прочим красивейшим формам, да и вообще развиваться карсту.
При 1500 °C вместе с углеродом образует карбид кальция и оксид углерода (II)
 .
.
Примечания
- ↑ Solvay Precipitated Calcium Carbonate: Production. Solvay S. A. (9 марта 2007). Архивировано из первоисточника 9 февраля 2012.
Ссылки
- Польза и возможный вред от карбоната кальция как пищевой добавки — е170
Шаблон:АТХ код A02
Химическое соединение
| ||
 | ||
| Имена | ||
|---|---|---|
| Название IUPAC Карбонат кальция | ||
| Другие названия кальцит ; арагонит ; мел ; Известь (материал) ; Известняк ; мрамор ; устрица ; жемчуг ; | ||
| Идентификаторы | ||
| Номер CAS |
| |
| 3D-модель (JSmol ) |
| |
| ЧЭБИ |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| DrugBank |
| |
| ECHA InfoCard | 100.006.765 | |
| Номер EC |
| |
| E номер | E170 (colours) | |
| KEGG |
| |
| PubChem CID |
| |
| номер RTECS |
| |
| UNII |
| |
| Панель управления CompTox (EPA ) |
| |
InChI
| ||
УЛЫБКА
| ||
| Свойства | ||
| Химическая формула | CaCO 3 | |
| Молярная масса | 100,0869 г / моль | |
| Внешний вид | Мелкий белый порошок; меловой вкус | |
| Запах | без запаха | |
| Плотность | 2,711 г / см (кальцит ). 2,83 г / см (арагонит ) | |
| Мелтин точка г | 1339 ° C (2442 ° F; 1612 K) (кальцит). 825 ° C (1517 ° F; 1098 K) (арагонит) | |
| Точка кипения | разлагается | |
| Растворимость в воде | 0,013 г / л (25 ° C) | |
| Произ растворимости (Ksp) | 3,3 × 10 | |
| Растворимость в разбавленных кислотах | растворимый | |
| Кислотность ( pK a) | 9,0 | |
| Магнитная восприимчивость (χ) | -3,82 × 10 см / моль | |
| Показатель преломления (nD) | 1,59 | |
| Структура | ||
| Кристаллическая структура | Тригональная | |
| Пространственная группа | 32 / м | |
| Термохимия | ||
| Стандартная молярная. энтропия (S 298) | 93 Дж · моль · K | |
| энтальпия образования. (ΔfH298) | -1207 кДж · моль | |
| Фармакология | ||
| Код АТС | A02AC01 (ВОЗ ) A12AA04 ( ВОЗ ) | |
| Опасности | ||
| Паспорт безопасности | ICSC 1193 | |
| NFPA 704 (огненный алмаз) |  0 0 0 0 0 0 | |
| Летальная доза или повышенный (LD, LC): | ||
| LD50(средняя доза ) | 6450 мг / кг (перорально, крыса) | |
| NIOSH (пределы воздействия на здоровье в США): | ||
| PEL (допустимое) | TWA 15 мг / м (всего) TWA 5 мг / м (соответственно) | |
| Родственные соединения | ||
| Другое анионы | кальций бик арбонат | |
| Другие катионы | Карбонат магния. Карбонат стронция. Карбонат бария | |
| Родственные соединения | Сульфат кальция | |
| Если не указаны данные, данные для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки на ink | ||
 Кристаллическая структура кальцита
Кристаллическая структура кальцита
Карбонат кальция представляет собой химическое соединение с формулой Ca CO3. Это обычное вещество, обнаруженное в породах в виде минералов кальцита и арагонита (в первую очередь как известняк, который представляет собой тип осадочной породы, состоящий в основном из кальцита) и является основным компонентом жемчуга и раковин морских организмов, улиток и яиц. Карбонат кальция является активным ингредиентом сельскохозяйственным извести и образует, когда ионы кальция в жесткой воде реагируют с ионами карбоната с образованием накипи. В медицине он используется в добавках кальция или в антацида, но чрезмерное употребление может быть опасным и вызвать плохое пищеварение.
Содержание
- 1 Химия
- 2 Подготовка
- 3 Структура
- 4 Происхождение
- 4.1 Геологические источники
- 4.2 Биологические источники
- 4.3 Внеземные
- 5 Геология
- 5.1 Глубина карбонатной компенсации
- 5.2 Роль в тафономии
- 6 Использование
- 6.1 Промышленное применение
- 6.2 Применение в здравоохранении и питании
- 6.3 Использование в сельском хозяйстве
- 6.4 Использование в домашних условиях
- 6.5 Экологические приложения
- 7 Равновесие при прокаливании
- 8 Растворимость
- 8.1 При изменении давления CO 2
- 8,2 При изменении pH, температуры и солености: CaCO 3 накипь в плавательных бассейнах
- 8.3 Растворимость в растворе сильной или слабой кислоты
- 9 См. Также
- 10 Ссылки
- 11 Внешние ссылки
Химия
Карбонат кальция обладает типичными свойствами других карбонатов. В частности, он
- реагирует с кислотами, выделяя двуокись углерода (технически говоря, угольную кислоту, но она быстро распадается до CO 2 и H 2 O):
-
- CaCO 3(s) + 2 H (вод. ) → Ca (вод. ) + CO 2(g) + H 2O(l)
- выделяется диоксид углерода при нагревании, что называется реакцией термического разложения или прокаливанием (до температуры выше 840 ° C в случае CaCO 3), с образованием оксида кальция, обычно называемого негашеной извести, с реакцией энтальпией 178 кДж / моль:
-
- CaCO 3(s) → CaO (s ) + CO 2(g)
Карбонат кальция будет реагировать с водой, насыщенной диоксидом углерода, с образованием растворимого бикарбоната кальция.
- CaCO 3(s) + CO 2(g) + H 2O(l) → Ca (HCO 3)2(aq)
Эта реакция важна в эрозии карбонатной породы, образуя каверны и приводя к жесткой водой во многих регионах.
Необычной формой карбоната кальция является гексагидрат, икаит, CaCO 3 · 6H 2 O. Икаите стабилен только при температуре ниже 8 ° C.
Получение
Подавляющее большинство карбоната кальция, используемого в промышленности, добывается при добыче полезных ископаемых или в карьере. Чистый карбонат кальция (например, для пищевого или фармацевтического использования) может быть получен из чистого источника (обычно мрамор ).
В качестве альтернативы карбоната кальция получают из оксида кальция. Добавляют воду, чтобы получить гидроксид кальция, затем диоксид углерода пропускают через этот раствор для осаждения желаемого карбоната кальция, называемого промышленностью осажденным карбонатом кальция (PCC):
- CaO + H 2 O → Ca (OH) 2
- Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2O
Структура
Термодинамически стабильная форма CaCO 3 при нормальных условиях — гексагональная β-CaCO 3 (минерал кальцит ). Могут быть получены другие формы, более плотные (2,83 г / см) ромбические λ-CaCO 3 (минерал арагонит ) и гексагональные μ-CaCO 3, встречающийся в виде минерала ватерит. Форма арагонита может быть получена осаждением при температуре выше 85 ° C, форма ватерита может быть получена осаждением при 60 ° C. Кальцит содержит атомы кальция, координированные шестью атомами кислорода, в арагоните они координированы девятью атомами кислорода. Структура ватерита до конца не изучена. Карбонат магния (MgCO 3) имеет устойчивый кальцита, тогда как карбонат стронция и бария (SrCO 3 и BaCO 3 являются) деформирует арагонита, отражая их большие ионные радиусы.
Возникновение
 Кальцит является наиболее стабильным полиморфом карбоната кальция. От прозрачного до непрозрачного. Прозрачная разновидность под названием исландский шпат (показана здесь) использовалась для создания поляризованного света в XIX веке.
Кальцит является наиболее стабильным полиморфом карбоната кальция. От прозрачного до непрозрачного. Прозрачная разновидность под названием исландский шпат (показана здесь) использовалась для создания поляризованного света в XIX веке.
Геологические источники
Кальцит, арагонит и фатерит представить собой чистые минералы карбоната кальция. Промышленно важные нефтематеринские породы, состоящие преимущественно из карбоната кальция, включая известняк, мел, мрамор и травертин.
Биологические источники

яичная скорлупа, раковина улитки и большинство ракушек преимущественно состоят из карбоната кальция и могут использоваться в качестве источника промышленного химического вещества. Oyster Раковины недавно получили признание как источник диетического кальция. Темные зеленые овощи, такие как брокколи и капуста, значительно увеличивают количество карбоната кальция с пищей, однако их использование в качестве промышленного источника нецелно.
Инопланетянин
За пределами Земли убедительные доказательства присутствия карбоната кальция на Марсе. Признаки карбоната кальция были обнаружены более чем в одном месте (особенно в кратерах Гусев и Гюйгенс ). Это дает некоторые присутствия жидкой воды в прошлом.
Геология
 Осаждение CaCO3 на поверхности в виде туфа в Рубакса, Эфиопия
Осаждение CaCO3 на поверхности в виде туфа в Рубакса, Эфиопия
Обнаружены карбонаты часто в геологических условиях и представляет собой огромный резервуар углерода. Карбонат кальция в виде арагонита, кальцита и доломита как важных составляющих кальциевого цикла. карбонатные минералы образуют типы горных пород: известняк, мел, мрамор, травертин, туф. и другие.
В теплых, прозрачных тропических водах кораллов больше, чем у полюсов, где вода холодная. Вклады карбоната кальция, включая планктон (например, кокколиты и планктон фораминиферы ), кораллиновые водоросли, губки, брахиоподы, иглокожие, мшанки и моллюски, как правило, встречаются на мелководье, где больше солнечного света и фильтруемой пищи. Карбонаты холодной воды существуют в более высоких широтах, но имеют очень медленную скорость роста. Процессы кальцификации заменены закислением океана.
Где океаническая кора погружена под континентальную плиту, осадки будут переносится в более теплые зоны зоны в астеносфере и литосфере. В этих условиях карбоната кальция разлагается с образованием углекислого газа, который вместе с другими газами вызывает взрывные вулканические извержения.
Глубина компенсации карбоната
Компенсация карбоната глубина (CCD) — это точка в океане, где скорость осаждения карбоната кальция уравновешивается скоростью растворения из-за своих условий. Глубоко в океане температура падает, а давление увеличивается. Карбонат кальция необычен тем, что его растворимость увеличивает с понижением температуры. Повышение давления также растворимость карбоната кальция. Глубина карбонатной компенсации может составлять от 4000 до 6000 метров ниже уровня моря.
Роль в тафономии
Карбонат кальция может вызвать ископаемые посредством перминерализации. Большинство окаменелостей позвоночных в формации Две Медицины — геологической формации, известные своими яйцами утконосых динозавров — сохранены CaCO 3 перминерализация. Этот тип сохранения позволяет сохранить высокий уровень детализации даже до микроскопического уровня. Однако он оставляет образцы уязвимыми для выветривания при воздействии на поверхность.
Популяции трилобитов когда-то считались составляющими большими частями водных организмов в кембрийском, из-за того, что их богатые карбонатом кальция раковины сохранялись легче, чем раковины других видов, которые имели чисто хитиновые раковины.
Использует
Промышленное применение
В основном карбонат кальция используется в строительной промышленности, либо в качестве строительного материала, либо в качестве известняка заполнителя для дорог. здания, качестве в ингредиента цемента или в качестве исходного материала для получения строительной извести путем обжига в печи. Из-за выветривания, вызванного главным образом, кислотными дождями, карбонат кальция (в известняка) больше не используется в строительных целях сам по себе, а только в качестве основного сырья для строительных материалов.
Карбонат кальция также используется при очистке железа из железной руды в доменной печи . Карбонат кальцинируют на месте с получением оксида кальция, который образует шлак с различными примесями и отделяется от очищенного железа.
В нефтяной промышленности карбонат кальция к буровым растворам в качестве агента, перекрывающего пласт и фильтрационной корки; это также утяжелитель, плотность буровых растворов для контроля забойного давления. Карбонат улучшения в бассейны в качестве корректора pH для поддержания щелочности и компенсации кислотных свойств дезинфицирующего агента.
Он также используется в качестве сырья при рафинировании сахара из сахарной свеклы ; его прокаливают в печи с антрацитом для получения оксида кальция и диоксида углерода. Получение суспензии гидроксида кальция для осаждения примесей в сыром соке во время карбонатации.
карбоната кальция в форме мела традиционно основным компонентом <152Эту негашеную известь известь гасят пресной водой.>доски мелом. Однако современный производимый мел — это в основном гипс, гидратированный сульфат кальция CaSO 4 · 2H 2 O. Карбонат кальция является средством выращивания Seacrete. Осажденный карбонат кальция (ОКК), промышленный диспергированный в форме суспензии, является обычным наполнителем для латексных перчаток с целью достижения максимальной экономии материалов и производства затрат.
Тонкоизмельченный карбонат кальция (GCC) является важным элементом микропористой пленки, используемой в подгузниках и некоторых других пленках, поры образуются вокруг частиц карбоната кальция во время производства пленки двухосным способом. растяжка. GCC и PCC используются в качестве наполнителя в бумаге, потому что они дешевле, чем древесное волокно. С точки зрения рынка GCC наиболее важными типами наполнителей, используемых в настоящее время. Бумага для печати и письма может содержать 10–20% карбоната кальция. В Северной карбонат кальция начал заменять каолин при производстве глянцевой бумаги. В Европе это практикуется как щелочное производство бумаги или бескислотное производство бумаги в течение нескольких десятилетий. PCC, используется для наполнения бумаги и бумажных покрытий, осаждается и готовится в различных формах и размерах с характерным узким распределением частиц по размерам и эквивалентными сферическими диаметрами от 0,4 до 3 мкм.
Карбонат кальция широко используется в качестве наполнитель в красках, в частности матовая эмульсионная краска, где обычно 30% по весу краски составляет мел или мрамор. Это также популярный наполнитель в пластмассах. Некоторые типичные примеры включают от 15 до 20% содержания в непластифицированном поливинилхлориде (uPVC) водосточные трубы, от 5 до 15% содержания мела с покрытием стеаратом. или мрамор в оконном профиле из ПВХ. В кабелях из ПВХ карбонат Нагрузка при нагрузках до 70 частей на сто смолы для улучшения механической прочности (прочность на разрыв и удлинение) и электрических свойств (удельное объемное сопротивление). Полипропилен составы часто наполнены карбонатом кальция для увеличения жесткости, что важно при высоких температурах использования. Здесь процент часто составляет 20–40%. Он также обычно используется в наполнителях термореактивных смолах (листовые и объемные формовочные смеси), а также смешивается с ABS и другими ингредиентами для формирования некоторых типов прессованной «глины». «фишки для покера. Осажденный карбонат кальция, полученный путем добавления оксида кальция в воду, используется сам по себе или с добавками в качестве белой краски, известной как побелка.
Карбонат кальция добавлен в широкий спектр торговых и своими руками клеи, герметики и отделочные наполнители. Клеи для керамической плитки обычно содержат от 70% до 80% известняка. Заполнители для отделки трещин содержат аналогичный уровень мрамора или доломита. Он также смешивается со шпатлевкой при установке витражей окон и в качестве резиста, предотвращающего прилипание стекла к полкам печи при обжиге глазури и красок при высокой температуре.
В керамике. Для глазури карбонат известен как белил и является обычным ингредиентом многих глазурей в виде белого порошка. Когда глазурь, содержащая этот материал, обжиг в печи, отбеливание действует как материал флюса в глазури. Молотый карбонат кальция — это абразив (как чистый порошок, так и компонент бытовых чистящих кремов), в частности, в его кальцитовой форме, который имеет относительно низкий уровень твердости 3 по шкале Мооса., и поэтому не поцарапает стекло и другие керамики, эмали, бронзы, железа, и сталь, и оказываем умеренное влияние на более мягкие металлы, такие как алюминий и медь. Паста из карбоната кальция и деионизированной воды может быть настроенной для очистки потускнения на серебре.
Здоровье и диета
 Добавки кальция на 500 миллиграммов, сделанные из кальция. карбонат
Добавки кальция на 500 миллиграммов, сделанные из кальция. карбонат
Карбонат кальция широко используется в медицине в качестве недорогой пищевой кальциевой добавки для желудочного антацида (например, Tums ). Его можно использовать в качестве связывающего фосфата для лечения гиперфосфатемии (в первую очередь у пациентов с хронической почечной недостаточностью ). Он используется в фармацевтической промышленности в качестве инертного наполнителя для таблеток и других фармацевтических препаратов.
Карбонат кальция используется в производстве оксида кальция, а также зубной пасты и имеет наблюдается возрождение в качестве пищевого консерванта и фиксатора цвета при использовании в таких продуктах, как органические яблоки или с ними.
Карбонат кальция используется в терапевтических целях в качестве связывающего фосфата у пациентов, находящихся на поддерживающем гемодиализе. Это наиболее часто назначаемая форма связывающего фосфата, особенно при недиализной хронической болезни почек. Карбонат кальция является наиболее часто используемым связывающим фосфатом, но клиницисты все чаще назначают более дорогие фосфатсвязывающие средства не на основе кальция, в частности севеламер.
Избыток кальция из добавок, обогащенных пищевых продуктов и диет с высоким содержанием кальция может вызвать молочно-щелочной синдром, который имеет серьезную токсичность и может привести к летальному исходу. В 1915 году Бертрам Сиппи ввел «режим сиппи» — ежечасное употребление молока и сливок и постепенное добавление яиц и вареных злаков в течение 10 дней в сочетании с щелочными порошками, что обеспечивало облегчение симптомов язвенной болезни. В течение следующих нескольких десятилетий режим Сиппи привел к почечной недостаточности, алкалозу и гиперкальциемии, в основном у мужчин с язвенной болезнью. Эти побочные эффекты былиобращены вспять после отмены режима, но у некоторых пациентов с длительной рвотой это было фатальным. Молочно-щелочной синдром снизился у мужчин после того, как возникло эффективное лечение язвенной болезни. С 1990-х годов чаще всего сообщается о женщинах, принимающих добавки кальция сверх рекомендуемого диапазона от 1,2 до 1,5 граммов в день для профилактики и лечения остеопороза, и усугубляется обезвоживанием. Кальций добавлен в безрецептурные продукты, что непреднамеренному чрезмерному потреблению. Чрезмерное потребление кальция может привести к гиперкальциемии, осложнениями, которые вызывают рвота, боли в животе и изменение психического состояния.
В качестве пищевых добавок она обозначается E170, и он имеет INS число 170. Используется в регулятора кислотности, агента против слеживания, стабилизатора или цвет одобрен для использования в ЕС, США и Австралии и Новой Зеландии. Он используется в некоторых продуктах соевого молока и миндального молока в качестве источника диетического кальция; одно исследование предполагает, что карбонат кальция может быть биодоступным, как кальций в коров молоке. Карбонат кальция также используется в качестве укрепляющего агента во многих овощных консервах и бутылках.
Использование в сельском хозяйстве
Известь в сельском хозяйстве, измельченный метод нейтрализации кислой почвы, что делает ее пригодной для посадки.
Использование в домашних условиях
Карбонат кальция является ключевым компонентом многих бытовых чистящих порошков, таких как Комета, и используется в качестве чистящего средства.
Экологические приложения
В 1989 году исследователь Кен Симмонс ввел CaCO 3 в Уэтстон-Брук в Массачусетсе. Он надеялся, что карбонат кальция противодействует кислоте в ручье от кислотных дождей и спасет форель, которая перестала нереститься. Хотя его эксперимент был успешным, он действительно увеличил количество алюминия в области ручья, не обработанной известняком. Это показывает, что CaCO 3 может быть добавлен для нейтрализации воздействия кислотных дождей в экосистемах реки. В настоящее время карбонат кальция используется для нейтрализации кислых условий как в почве, так и в воде. С 1970-х годов такое известкование широко практикуется в Швеции для уменьшения подкисления, и несколько тысяч озер и водотоков неоднократно замораживаются.
Карбонат кальция также используется в десульфуризации дымовых газов устранение вредных выбросов SO 2 и NO 2 от угля и других ископаемых видов топлива, сжигаемых на крупных электростанций, работающих на ископаемом топливе.
Расчетное равновесие
Прокаливание известняк с использованием древесного угля для производства негашеной извести применялся с древних времен культурми всего мира. Температура, при которой известняк дает оксид кальция, обычно составляет 825 ° C, но указание абсолютного порогового значения вводит в заблуждение. Карбонат кальция находится в равновесии с оксидом кальция и диоксидом углерода при любой температуре. При каждой температуре парциальное давление диоксида углерода, находится в равновесии с карбонатом кальция. При комнатной температуре равновесие в подавляющем большинстве случаев благоприятствует карбонату кальция, поскольку равновесное давление CO 2 составляет лишь небольшую часть парциального давления CO 2 в воздухе, которое составляет примерно 0,035 кПа.
При температуре выше 550 ° C равновесное давление CO 2 превышает давление CO 2 в воздухе. Таким образом, при температуре выше 550 ° C карбонат кальция начинает выделять CO 2 в воздухе. Однако в печи, работающей на древесном угле, с CO 2 будет намного выше, чем в воздухе. Действительно, если весь кислород в печи потребляется в огне, то парциальное давление CO 2 в печи может достигать 20 кПа.
Из таблицы видно, что это парциальное давление достигается только при температуре около 800 ° C. Для того, чтобы дегазация CO 2 из карбоната кальция происходила с экономически приемлемой скоростью, равновесное давление должно было превышать давление окружающей среды CO 2. И для того, чтобы это произошло быстро, равновесное давление превышает общее атмосферное давление в 101 кПа, что происходит при 898 ° C.
-
Равновесное давление CO 2 над CaCO 3 ( P) от температуры (T).
P (кПа) 0,055 0,13 0,31 1.80 5,9 9,3 14 24 34 51 72 80 91 101 179 901 3961 T (° C) 550 587 605 680 727 748 777 800 830 852 871 881 891 898 937 1082 1241
Растворимость
При переменном давлении CO 2
 Травертин отложения карбоната кальция из горячего источника
Травертин отложения карбоната кальция из горячего источника
Карбонат кальция плохо растворим в чистой воде (47 мг / л при нормальном парциальном давлении CO 2 атмосферный, как показано ниже).
Равновесие его уравненным уравнением (с растворенным карбонатом кальция справа):
-
CaCO 3 ⇌ Ca + CO. 3 Ksp= 3,7 × 10-8,7 × 10 при 25 ° C
, где произведение растворимости для [Ca] [CO. 3] дается как любое значение от K sp = 3,7 × 10 до K sp = 8,7 × 10 при 25 ° C, в зависимости от источника данных. Уравнение означает, что произведение молярной почвы соответствует калькуляту (моль растворенного Ca на литр раствор) на молярную концентрацию раствора CO. 3не может помочь значение K sp.. Однако это, казалось бы, простое уравнение растворимости следует рассматривать вместе с более сложным равновесием диоксида углерода с водой (см. угольная кислота ). Часть CO. 3соединяется с H в растворе согласно
-
HCO. 3⇌ H + CO. 3 Ka2= 5,61 × 10 при 25 ° C
HCO. 3известен как бикарбонат ион. Бикарбонат кальция во много раз более растворим в воде, чем карбонат кальция — действительно, он существует в растворе.
Часть HCO. 3соединяется с H в растворе согласно
-
H2CO3⇌ H + HCO. 3 Ka1= 2,5 × 10 при 25 ° C
Часть H 2CO3распадается. в растворенный диоксид углерода согласно
-
H2O + CO 2(aq) ⇌ H 2CO3 Kh= 1,70 × 10 при 25 ° C
И растворенный диоксид углерода находится в равновесии с атмосферным диоксидом углерода согласно
-
P CO 2 [CO 2] = К Ч { Displaystyle { frac {P _ {{ ce {CO2}}}} {[{ ce {CO2}}]}} = k _ {{ ce {H}}}} где k H = 29,76 атм / (моль / л) при 25 ° C (константа Генри ), P CO2- CO 2 парциальное давление.
Для окружающего воздуха P CO2составляет около 3,5 × 10 атмосфер (или эквивалентно 35 Па ). Последнее уравнение выше фиксирует концентрацию растворенного CO 2 как функцию от P CO2независимо от растворенного CaCO 3. При атмосферном парциальном давлении CO 2 раствор растворенного CO 2 составляет 1,2 × 10 моль на литр. Уравнение перед этим фиксирует концентрацию H 2CO3как концентрацию от CO 2. Для [CO 2 ] = 1,2 × 10 получается [H 2CO3] = 2,0 × 10 моль на литр. Когда [H 2CO3] известны оставшиеся три уравнения вместе с
| PCO2(атм) | pH | [Ca] (моль / л) |
|---|---|---|
| 10 | 12,0 | 5,19 × 10 |
| 10 | 11,3 | 1,12 × 10 |
| 10 | 10,7 | 2,55 × 10 |
| 10 | 9,83 | 1,20 × 10 |
| 10 | 8,62 | 3,16 × 10 |
| 3,5 × 10 | 8,27 | 4,70 × 10 |
| 10 | 7,96 | 6,62 × 10 |
| 10 | 7,30 | 1,42 × 10 |
| 10 | 6,63 | 3,05 × 10 |
| 1 | 5,96 | 6,58 × 10 |
| 10 | 5,30 | 1,42 × 10 |
-
H2O ⇌ H + OH K = 10 при 25 ° C
(что верно для всех водных растворов) и тот, что раствор должен быть электрически нейтральным,
- 2 [Ca] + [H] = [HCO. 3] + 2 [CO. 3] + [OH]
делает можно решить одновременно для оставшихся пяти неизвестных концентраций (обратите внимание, что приведенная выше форма уравнения нейтральности действительна только в том случае, если карбонат кальция контактировал с чистой водой или с раствором с нейтралами. ральным pH; в случае, если исходный водный растворитель pH не нейтральный трал, уравнение модифицировано).
В соседней таблице показаны результаты для [Ca] и [H] (в форме pH) в зависимости от парциального давления окружающей среды CO 2(Ksp= 4,47 × 10 было взято для расчета).
- При атмосферных уровнях СО 2 в таблице указано, что раствор будет слабощелочным с максимальной растворимостью в CaCO 3 47 мг / л.
- Парциальное давление окружающего CO 2 снижается ниже атмосферного уровня, раствор все становится более и более щелочным. При очень низком P CO2растворенный CO 2, бикарбонатно-ионный и карбонат-ионный раствор в степени испаряются из раствора, оставляя сильно щелочной раствор гидроксида кальция, который более растворим, чем CaCO 3. Обратите внимание, что для P CO2= 10 атм продукт [Ca] [OH] все еще ниже произведений продукции Ca (OH) 2 (8 × 10). При еще более низком давлении CO 2, осаждение Ca (OH) 2 произойдет до осаждения CaCO 3.
- Как окружающий CO 2 парциальное давление увеличивается до уровня выше атмосферного, pH падает, и большая часть карбонат-иона превращается в бикарбонат-ион, что приводит к более высокой растворимости Ca.
Эффект последнего особенно очевиден в повседневной жизни. -повседневная жизнь людей, у которых жесткая вода. Вода в подземных водоносных горизонтах может подвергаться воздействию CO 2, намного превышающего атмосферный. Такая вода просачивается через породу карбоната кальция кальция, CaCO 3 растворяется в соответствии со второй тенденцией. Когда та же самая вода выходит из крана, со временем она приходит в равновесие с уровнями CO 2 в воздухе, выделяя свой избыток CO 2. В результате карбонат кальция становится менее растворимым, а его избыток выпадает в виде известкового налета. Этот же процесс ответственен за образование сталактитов и сталагмитов в известняковых пещерах.
Две гидратированные фазы карбоната кальция, моногидрокальцит CaCO 3·H2O и икаит CaCO 3 · 6H 2 О, может выпадать в осадок из воды в условиях окружающей среды и сохраняться в виде метастабильных фаз.
При изменении pH, температуры и солености: CaCO 3 масштабирование в плавательных бассейнах


В отличие от описанного выше сценария открытого равновесия, многие бассейны управляются добавлением натрия бикарбонат (NaHCO 3) примерно до 2 мМ в качестве буфера, затем контроль pH с помощью HCl, NaHSO 4, Na 2CO3, NaOH или составов хлора, которые бывают кислыми или нарушенными. В этой ситуации растворенный неорганический углерод общий неорганический углерод ) далек от равновесия с атмосферным CO 2. Движение к равновесию посредством дегазации CO 2 замедляется
- медленной реакцией
- H2CO3 ⇌ CO 2(aq) + H 2O;
- ограниченной аэрацией в глубокой водной толще; и
- периодическое пополнение бикарбоната для поддержания буферной емкости (часто оценивается путем измерения «общей щелочности» ).
В ситуации намного более быстрых возможностей
- H2CO3⇌ H + HCO. 3⇌ 2 H + CO. 3
позволяет прогнозировать концентрацию каждого растворенного неорганического углерода в растворе, исходя из добавленной концентрации HCO. 3(которая составляет более 90% от графика Бьерма от pH 7 до pH 8 при 25 ° C в пресной воде). Добавление HCO. 3увеличит концентрацию CO. 3при любом pH. Изменив приведенные выше уравнения, мы видим, что [Ca] = K sp / [CO. 3] и [ CO. 3] = K a2 [HCO. 3] / [H]. Следовательно, если известна смесь HCO. 3, максимальная концентрация ионов Са перед масштабированием через CaCO 3 осадки можно предсказать по формуле:
- [Ca 2 +] max = K sp K a 2 × [H +] [HCO 3 -] { displaystyle [{ ce {Ca ^ 2 +}}] _ { max} = { frac {K _ { mathrm {sp}}} {K _ { ma thrm {a} 2}}} times { frac {[{ ce {H +}}]} {[{ ce {HCO3-}}]}}}
Произведение растворимости для CaCO 3(Ksp) и константы диссоциации для растворенных видов неорганического углерода (включая K a2) все в значительной степени зависят от температуры и солености, с общим эффектом, который [Ca] max увеличивается от пресной воды к морской и уменьшается с повышением температуры, pH или уровня добавленного бикарбоната, как показано на прилагаемых графиках.
Тенденции являются иллюстративными для управления пулом, но происходит ли масштабирование также зависит от других факторов, включая взаимодействия с Mg, B (OH). 4 и другими ионами в пуле, а также эффекты перенасыщения. Накипь обычно наблюдается в электролитических генераторах хлора, где у поверхности катода высокий pH, а отложение накипи еще больше увеличивает температуру. Это одна из причин, по которой некоторые операторы бассейнов предпочитают борат бикарбонату в качестве основного буфера pH и избегают использования химикатов, содержащих кальций. сильная (HCl ), умеренно сильная (сульфаминовая ) или слабая (уксусная, лимонная, сорбиновая, молочная, фосфорная ) кислоты коммерчески доступны. Они обычно используются в качестве средств для удаления накипи для удаления известковых отложений. Максимальное количество CaCO 3, которое может быть «растворено» одним литром кислотного раствора, можно рассчитать с использованием приведенных выше уравнений равновесия.
- В случае сильной одноосновной кислоты с уменьшающейся концентрацией кислоты [A] = [A], мы получаем (с молярной массой CaCO 3 = 100 г / моль):
-
-
[A] ( моль / л) 1 10 10 10 10 10 10 10 10 Начальный pH 0,00 1,00 2,00 3,00 4,00 5. 00 6,00 6,79 7,00 Конечное значение pH 6,75 7, 25 7,75 8,14 8,25 8,26 8,26 8,26 8,27 Растворенный CaCO 3. (г / Л кислоты) 50.0 5.00 0,514 0,0849 0,0504 0,0474 0,0471 0,0470 0, 0470
-
- где исходное состояние — раствор кислоты без Ca (без учета возможного растворения CO 2) и конечное состояние — раствор с насыщенным Ca. Для сильных концентрационных концентраций все частицы имеют малую концентрацию в конечном состоянии по отношению к Ca и A, так что уравнение нейтральности сокращается до 2 [Ca] = [A], что дает [Ca] ≈ 1/2 [A]. Когда уменьшается, [HCO. 3] становится значимым, так что предыдущее выражение больше не действует. Для концентраций концентраций можно восстановить конечный pH и растворимость CaCO 3 в чистой воде.
- В случае слабой одноосновной кислоты (здесь мы берем уксусную кислоту с pKa = 4,76) при уменьшении общей концентрации кислоты [A] = [A] + [AH], мы получаем:
-
-
[A] ( моль / л) 1 10 10 10 10 10 10 10 10 Начальный pH 2,38 2,88 3,39 3,91 4,47 5,15 6,02 6,79 7,00 Конечное значение pH 6,75 7,25 7,75 8,14 8,25 8,26 8,26 8,26 8,27 Растворенный CaCO 3. (г / л кислоты) 49,5 4,99 0,513 0,0848 0,0504 0,0474 0,0471 0,0470 0,0470
-
- При одинаковой общей концентрации кислоты начальный pHой кислоты меньше, чем pH сильной кислоты; однако максимальное количество CaCO 3, которое может быть растворено, примерно такое же. Это связано с тем, что в конечном состоянии pH больше, чем pK a, так что слабая кислота почти полностью диссоциирует, давая в конечном итоге столько же H, сколько сильной кислоты, чтобы «растворить» карбонат кальция.
- Расчет в случае фосфорной кислоты (которая наиболее широко используется в быту) более сложен, используя четыре состояния диссоциации, соответствующие кислоте, должны вычисляться вместе с [HCO. 3], [CO. 3], [Ca], [H] и [OH]. Система может быть сведено к уравнению седьмой степени для [H], численное решение которого дает
-
-
[A] (моль / л) 1 10 10 10 10 10 10 10 10 Начальный pH 1,08 1, 62 2,25 3,05 4,01 5,00 5,97 6,74 7,00 Конечный рН 6,71 7,17 7,63 8,06 8,24 8,26 8,26 8,26 8, 27 Растворенный CaCO 3. (г / л кислоты) 62,0 7,39 0,874 0,123 0,0536 0,0477 0,0471 0,0471 0,0470
-
- где [A] = [H 3PO4] + [H. 2PO. 4] + [HPO. 4] + [PO. 4] представляет собой общую концентрацию кислоты. Таким образом, фосфорная кислота более эффективна, чем одноосновная кислота, поскольку при конечном почти нейтральном pH второго диссоциированного состояния [HPO. 4] является не незначительной (см. фосфорная кислота ).
См. Также
 Электронная микрофотография иглы -подобные кристаллы карбоната кальция, образующиеся в видекового налета в котле
Электронная микрофотография иглы -подобные кристаллы карбоната кальция, образующиеся в видекового налета в котле
- Каракатица
- Каракатица
- Гессо
- Известковая чешуя
- Мрамор
- Закисление океана
- Событие Уайтинга
- Список темматической инженерии
- Лизоклин
Ссылки
Внешние ссылки
- Международная карта химической безопасности 1193
- CID 516889 из PubChem
- коды ATC : A02AC01 (WHO ) и A12AA04 (WHO )
- Британская ассоциация карбоната кальция — Что такое карбонат кальция
- CDC — Карманное руководство NIOSH по химическим опасностям — Кальций Карбонат
Карбонат кальция

Характеристика карбонат кальция
 Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой — широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой — широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Формула карбоната кальция
Химическая формула: CaCO3.
Получение карбоната кальция
Кальция карбонат получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2) с карбонатом натрия (Na2CO3) в водном растворе.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.;
- в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Наименование показателя | Норма |
|---|---|
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
Таблица 2.
| Диэлектрическая проницаемость (при 17-22°C) при 104 Гц: | |
|---|---|
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| Диэлектрическая проницаемость (при 17-22°C) при 108 Гц: | |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
Таблица 3.
| Удельное электрическое сопротивление мрамора при 20°C: | |
|---|---|
| объемное, Ом·см | 109-1011 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·109 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·107 |
| Удельное электрическое сопротивление дисперсии 5г CaCO3 в 100 мл воды при 23 °C, Ом: | |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·1014 |
Таблица 4. Физические свойства различных типов карбонатов.
| Показатели | Кальцит CaCO3 (наиболее устойчивая модификация) | Арагонит CaCO3 (метастабильная модификация, переходит в кальцит) | Доломит CaCO3-MgCO3 (45% масс. MgCO3) | Магнезит MgCO3 |
|---|---|---|---|---|
| Плотность, кг/м3 | 2600 — 2750 | 2920 — 2940 | 2800 — 2900 | 3000 — 3100 |
| Твердость по Мосу | 3,0 | 3,5 — 4,0 | 3,5 — 4,0 | 3,5 — 4,5 |
| Содержание растворимых фракций | 0,99·10-8 (при 15°C)0,87·10-8 (при 25°C) | — | — | 2,6·10-5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы.Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C | — | — |
Статьи по теме

Основные пигменты
Название элемента хрома происходит от греческого слова «хром», что означает «цвет», «краска». Оксид хрома — лишь одно из ярко окрашенных соединений элемента № 24.

Окрашивание пигментами
Пигменты полидисперсны; гранулометрии, (дисперсионный) состав их оказывает большое влияние на оптич. и технико-эко-номич. характеристики.

Красящие пигменты
Сегодня лакокрасочная продукция является достаточно распространенной. Она предназначена не только для нанесения декоративного слоя на различные виды поверхностей, но и для защиты отдельных видов материалов от появления ржавчины или коррозии.
 Карбонат кальция CaCO3 (кальций углекислый, calcium carbonate, углекислота, кальциевая соль, мел, известняк, регистрационный номер CAS 471-34-1, молекулярная масса 100.086)Белый кристаллический порошок плотн. 2.71-2.93 г/см3, Тплавл.1339 0С. Растворим в кислотах, очень мало растворим в воде
Карбонат кальция CaCO3 (кальций углекислый, calcium carbonate, углекислота, кальциевая соль, мел, известняк, регистрационный номер CAS 471-34-1, молекулярная масса 100.086)Белый кристаллический порошок плотн. 2.71-2.93 г/см3, Тплавл.1339 0С. Растворим в кислотах, очень мало растворим в воде
Получение:
Производство природного грунтового карбоната кальция начинается с разработки месторождения мела, известняка или мрамора. Лучшие отложения для большинства промышленных применений -это те, которые имеют высокую чистоту (>90% CaCO3).Руда поступает в первичную дробилку для уменьшения размера, а затем на перерабатывающий завод. Грубые продукты, не требующие высокой чистоты, 90-98% CaCO3, идут на вторичное дробление. В производстве карбоната кальция из природных месторождений так же применяют процессы флотации, которые позволяют уменьшить количество примесей в конечном продукте. Карбонат кальция получают так же как побочный продукт процесса Сольвея (который используется для получения карбоната натрия, известково-содовый процесс). Осажденный карбонат кальция чище, чем молотый карбонат кальция, и имеет различные свойства.
В лаборатории карбонат кальция можно получить действием углекислого аммония на азотнокислый кальций:
Ca(NO3)2+(NH4)2CO3→CaCO3+2NH4NO3
Химические реакции карбоната кальция:
Карбонат кальция практически нерастворим в воде и спирте. Растворяется с шипением в разбавленной уксусной кислоте, в разбавленной соляной кислоте и в разбавленной азотной кислоте, и полученные растворы, после кипячения, дают положительные пробы на кальций.
При нагревании карбонат кальция разлагается до CaO:
CaCO3→CaO+CO2
Карбонат кальция взаимодействует с кислотами:
CaCO3+2HCl→CaCl2+CO2+H2O
Растворением карбоната кальция во фтористоводородной кислоте получают фтористый кальций:
CaCO3+HF→CaF2+CO2+H2O
Растворением карбоната кальция в уксусной кислоте получают уксуснокислый кальций:
CaCO3+2CH3COOH→Ca(CH3COO)2+CO2+H2O
Сернистый кальций можно получить обработкой карбоната кальция сероводородом:
CaCO3+H2S→CaS+H2O+CO2
Применение карбоната кальция: Карбонат кальция используется терапевтически в качестве фосфатного буфера при гемодиализе, в качестве антацида* при повышенной кислотности желудка для временного облегчения расстройства желудка и изжоги, а также в качестве кальциевой добавки для профилактики и лечения остеопороза.
* Желудочно-язвенная болезнь возникает в результате дисбаланса между защитными факторами, такими как секреция слизи, бикарбонатаи простагландинов , и агрессивными факторами, такими как соляная кислота, пепсин и Helicobacter pylori (H. pylori). Антациды работают, восстанавливая кислотно-щелочной баланс, ослабляя активность пепсина и увеличивая секрецию бикарбоната и простагландина. Кислотно-нейтрализующая способность карбоната кальция составляет 58 мэкв/15 мл. При использовании в качестве пищевой добавки карбонат кальция действует непосредственно увеличивая запасы кальция в организме.
Карбонат кальция так же находит применение в производстве клеев, спичек, карандашей; мелков, линолеума, изоляционных составов, сварочных стержней, в качестве наполнителя для резин. В пищевых продуктах, косметике, антибиотиках; в фармацевтических препаратах в качестве разбавителя таблеток и капсул; удаление кислотности вин. В аналитической химии для обнаружения и определения галогенов в органических соединениях; с хлоридом аммония для разложения силикатов; приготовления раствора хлорида кальция для стандартизации мыльных растворов; для анализа воды; в качестве колориметрического стандарта .
ГОСТ 4530-76 Реактивы. Кальций углекислый. Технические условия.
ГОСТ 21138.5-78 Мел. Метод определения массовой доли углекислого кальция и углекислого магния.
ГОСТ 23260.1-78 Мрамор. Метод определения содержания углекислого кальция.




![{displaystyle {ce {CaCO3(s)->[Delta ]CaO(s){+}CO2uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/341d1776ae78128a432b06ec2f5b8968ecf3d50c)



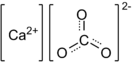








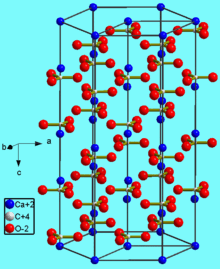



![{ displaystyle { frac {P _ { ce {CO2}}}} {[{ ce {CO2}}]}} = k _ { { ce {H}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ea24aea352cf487469aff16947f0df5355eba48)
![{ displaystyle [{ ce {Ca ^ 2 +}}] _ { max} = { frac {K _ { mathrm {sp}}} {K _ { mathrm { a} 2}}} times { frac {[{ ce {H +}}]} {[{ ce {HCO3-}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c29788e95a3ab2725c1dcf13bc21810814294dc)