Физический
смысл номера группы, номера периода.
Периодом называют
горизонтальный ряд элементов, расположенных
в порядке возрастания порядковых
(атомных) номеров.
В
периодической системе имеются семь
периодов: первый, второй и третий периоды
называют малыми,
в них содержится соответственно 2, 8 и 8
элементов; остальные периоды называют
большими:
в четвёртом и пятом периодах расположены
по 18 элементов, в шестом — 32, а в седьмом
(пока незавершенном) — 31 элемент. Каждый
период, кроме первого, начинается
щелочным металлом, а заканчивается
благородным газом.
В
пределах периода с увеличением порядкового
номера элемента:
-
электроотрицательность
возрастает; -
металлические
свойства убывают, неметаллические
возрастают; -
атомный радиус
падает.
Номер
периода показывает энергетический
уровень, на котором располагаются
электроны, в каком удалении от ядра, чем
больше номер, тем большим запасом энергии
должны обладать электроны.
Группами называют
вертикальные ряды в периодической
системе.
В
группах элементы объединены по признаку
высшей степени окисления в оксидах.
Каждая группа состоит из главной
и побочной подгрупп.
Главные
подгруппы включают в себя элементы
малых периодов и одинаковые с ним по
свойствам элементы больших периодов.
Побочные подгруппы состоят только из
элементов больших периодов. Химические
свойства элементов главных и побочных
подгрупп значительно различаются.
Свойства
элементов в подгруппах закономерно
изменяются сверху вниз:
-
усиливаются
металлические свойства и ослабевают
неметаллические; -
возрастает
атомный радиус; -
возрастает
сила образованных элементом оснований
и бескислородных кислот; -
электроотрицательность
падает.
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Физический смысл Периодического закона Дмитрия Ивановича Менделеева отражается в закономерных изменениях свойств химических элементов и их соединений по мере увеличения атомного заряда. Ученые во второй половине XIX века имели огромное количество знаний о различных элементах. Все знания для лучшего понимания и развития науки было необходимо упорядочить в понятном и наглядном виде. Исследователи стремились создать химическую классификацию, в которой все вещества должны объединяться по общему строению и схожим свойствам.
Упорядочить элементы удалось молодому русскому химику Дмитрию Ивановичу Менделееву. Путем экспериментов он определил свойства всех элементов и их соединений. Исследователь отразил сведения о каждом элементе на отдельных листах, которые он перемещал на столе огромное количество раз и старался определить логичную последовательность. Спустя несколько лет он определил, что свойства периодически изменяются по мере увеличения атомной массы.
Периодический закон отражается в Периодической таблице Д.И. Менделеева. Во время создания данного закона было известно 63 элемента. Менделеев предугадал существование новых веществ, поэтому оставил для них пустые ячейки. В современной таблице 118 элементов.
Каков физический смысл порядкового номера химического элемента?
Порядковый номер соответствует заряду атомного ядра. Количество электронов (отрицательных частиц) равно числу протонов (положительных частиц), поэтому атом – электронейтральная частица. Физический смысл порядкового номера атома отражается в группах и периодах таблицы Д. И. Менделеева.
Каков физический смысл порядкового номера группы?
Группа – это вертикальная колонка. В группах все атомы обладают одинаковыми максимальными и отрицательными степенями окисления. Номер группы равен максимальной степени. Отрицательную степень определяют с помощью формулы: номер группы — 8. Например, хлор стоит в седьмой группе, значит, его отрицательную степень окисления можно найти по формуле: 7-8. Таким образом, его степень окисления -1.
Группы классифицируются на главные и побочные подгруппы. Атомы малых периодов и некоторые атомы больших периодов относятся к главным (А) подгруппам, элементы больших периодов – к побочным (В).
Номер группы соответствует числу электронов на наружном уровне атомов А-подгрупп. Сверху вниз по подгруппе происходят следующие изменения:
- радиус атома, заряд ядра и восстановительные свойства увеличиваются;
- электроотрицательность и окислительные свойства уменьшаются.
Для всех атомов, кроме гелия Не, неона Ne и аргона Ar, характерно образование высших оксидов, которые классифицируются на несколько форм. Они изображаются формулами, которые располагаются внизу периодической таблицы.
- Для R2O и RO (кроме BeO) характерны основные свойства, которые возрастают по мере увеличения заряда ядра.
- Для RO2, R2O5, RO3, R2O7 характерны кислотные свойства.
Элементы, находящиеся с четвертой по восьмую главную подгруппу, образуют одну из четырех форм соединений с водородом. Они обозначаются в виде формул внизу периодической таблицы.
- RH4 нейтральны.
- RH3 проявляют слабые основные свойства.
- Для RH2 характерны слабые кислые свойства.
- RH имеют сильнокислый характер.
Каков физический смысл порядкового номера периода?
Период – это горизонтальный ряд таблицы Д.И. Менделеева. Периоды можно классифицировать на малые и большие. Первые три периода – малые, а остальные – большие. Во всех периодах, кроме первого, на первом месте стоит щелочной металл, а последнем – инертный газ.
Номер периода соответствует числу энергетических уровней атома. Слева направо по периоду происходят следующие закономерные изменения:
- атомный заряд, электроотрицательность и окислительные свойства увеличиваются;
- атомный радиус и восстановительные свойства уменьшаются.
Таким образом, физический смысл периодического закона отражается в порядковом номере, группе и периоде химического элемента. Периодическая таблица Дмитрия Ивановича раскрывает тайны человечества и открывает новые границы химической науки.
Тема: Физический смысл
порядкового номера элементов, номеров группы и периода. Устройство периодической системы.
Обучающая
цель: Систематизировать и обобщить знания учащихся о
периодическом законе и периодической системе химических элементов); продолжить
развитие представлений о периодическом изменении свойств простых веществ,
состава и свойств соединений элементов с ростом величины их относительных
атомных масс.
Развивающая цель: развитие внимания, мышления, логики, умения анализировать и делать
выводы.
Воспитательная цель: воспитывать интерес к химии.
Принципы обучения: научность, связь теории с практикой,
доступность, индивидуальный подход к учащемуся, активизация учебного процесса.
Методы опрос,
рассказ, беседа.
Тип урока: изучение нового материала.
Средства обучения: доска,
таблицы.
Ход
урока
І. Организация работы группы (оглашение темы, цели, плана работы на уроке, заполнение журнала).
ІІ. Мотивация обучающихся
Опираясь на периодический закон, Д. И. Менделеев построил естественную
классификацию химических элементов — периодическую систему химических
элементов. Ее графическим изображением является таблица, которая так и
называется — периодическая система химических элементов.
ІIІ. Актуализация
опорных знаний.
1. Перечень вопросов:
Какую характеристику элемента взял Д.И.
Менделеев за основу систематизации элементов?
Какие закономерности были выявлены в рядах
элементов от Li до Ne, от Na до Ar, расположенных по возрастанию относительных
атомных масс?
Почему Д.И. Менделеев назвал открытый им
закон периодическим? Что такое периодичность?
Как формулируется периодический закон?
Какие группы химических элементов вам
знакомы? Дайте их краткую характеристику.
IV. Изучение нового материала.
Ход урока
Слово преподавателя:
В 1869 году Д.И.Менделеев на основе данных
накопленных о химических элементах сформулировал свой периодический закон.
Тогда он звучал так: «Свойства простых тел, а также формы и свойства
соединений элементов находятся в периодической зависимости от величины атомных
масс элементов». Очень долго физический смысл закона Д.И.Менделеева
был непонятен. Всё встало на свои места после открытия в XX веке строения
атома.
Современная формулировка
периодического закона: «Свойства простых веществ, также формы и свойства соединений
элементов находятся в периодической зависимости от величины заряда ядра атома».
Заряд ядра атома равен числу протонов в
ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом,
атом электронейтрален.
Заряд ядра атома в Периодической таблице –
это порядковый номер элемента.
Номер периода показывает число
энергетических уровней, на которых вращаются электроны.
Номер группы показывает число валентных
электронов. Для элементов главных подгрупп число валентных электронов
равно числу электронов на внешнем энергетическом уровне. Именно валентные
электроны отвечают за образование химических связей элемента.
Химические элементы 8 группы – инертные
газы имеют на внешней электронной оболочке 8 электронов. Такая электронная
оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю
электронную оболочку до 8 электронов.
Какие же характеристики атома
меняются в Периодической системе периодически?
— Повторяется строение внешнего
электронного уровня.
— Периодически меняется радиус
атома. В группе радиус увеличивается с
увеличением номера периода, так как увеличивается число энергетических
уровней. В периоде слева направо будет происходить рост
атомного ядра, но притяжение к ядру будет больше и поэтому радиус атома уменьшается.
— Каждый атом стремится завершить
последний энергетический уровень. У элементов 1 группы на последнем слое 1
электрон. Поэтому им легче его отдать. А элементам 7 группы легче
притянуть 1 недостающий до октета электрон. В группе способность отдавать
электроны будет увеличиваться сверху вниз, так ка увеличивается радиус атома и
притяжение к ядру меньше. В периоде слева направо способность отдавать
электроны уменьшается, потому что уменьшается радиус атома.
— Чем легче элемент отдает электроны
с внешнего уровня, тем большими металлическими свойствами он обладает, а его
оксиды и гидроксиды обладают большими основными свойствами. Значит,
металлические свойства в группах увеличиваются сверху вниз, а в периодах справа
налево. С неметаллическими свойствами все наоборот.
Понятия «период», «группа» (А и В группы)
Всего в таблице семь периодов. Их номера
указаны цифрами, стоящими слева. Каждый период содержит определенное число
химических элементов. Первые три периода называются малыми периодами.
Самый первый период состоит только из двух химических элементов — водорода Н и
гелия Не, причем водород не относится к щелочным металлам. Остальные четыре
периода называются большими.
Всего в таблице восемнадцать групп,
пронумерованных арабскими цифра-
ми. Кроме того, группы имеют традиционную
нумерацию римскими цифрами, сохранившуюся со времен Д. И. Менделеева, — от I до
VIII с добавлением латинских букв А или В. Группы А часто называют главными.
Они включают все элементы первых трех (малых) периодов, а также нижестоящие
элементы больших периодов. В этих группах находятся как металлы, так и
неметаллы. Граница между этими двумя типами элементов обычно выделяется жирной
линией. Эта граница достаточно условна, так как некоторые элементы, находящиеся
возле нее, могут проявлять как металлические, так и неметаллические свойства.
Некоторые главные группы имеют свои
собственные названия. Так, например, IА-группа — это группа щелочных металлов +
водород H, IIА-группа — группа щелочноземельных металлов + бериллий Ве и магний
Mg, VIIА-группа — группа галогенов, VIIIА-группа — группа благородных газов и
т. д.
Между I—IIA- и III—VIIIA-группами
располагаются переходные элементы групп В. Группы В иногда называют побочными.
В них находятся только элементы больших периодов, и они все являются металлами.
Эти группы также имеют собственные названия,
обычно связанные с названием первого элемента в группе.
В каждой группе находятся элементы со
сходными химическими свойствами их атомов. Номер группы (римскими цифрами)
указывает, как правило, высшую, т. е. максимальную, валентность элементов в
соединениях с кислородом.
Причину периодичности в изменении свойств
химических элементов можно объяснить только на основе знаний о строении атомов.
Это хорошо понимал и сам Д. И. Менделеев, предполагая, что атомы являются
сложными образованиями, а познание их структуры позволит обосновать открытую им
периодическую систему химических элементов.
Ребята, давайте с вами запишем основные
термины:
Периодическая таблица — является графическим
изображением периодического закона.
Периодический закон — свойства всех простых
веществ, как и формы и свойства соединений химических элементов определяются в
повторяемой (периодической) зависимости от заряда ядра химического элемента.
Период – это определенное число химических
элементов с одним и тем же наибольшим значением основного квантового количества
валентных электронов (с идентичным номером внешнего энергетического уровня),
равняющимся номеру периода.
Группа – это совокупность химических
элементов с идентичным количеством валентных электронов, которые равняются
номеру группы.
Химические символы – это не просто сокращенные
имена химических элементов, а и выражение их конкретного количества, т.е.
каждый символ означает или один атом химического элемента, или один моль его
атомов, или массу элемента, равную молярной массе этого элемента.
Главная подгруппа – это вертикальный ряд элементов,
атомы которых имеют одинаковое число электронов на внешнем энергетическом
уровне. Это число равно номеру группы (кроме водорода и гелия).
Все элементы в периодической системе
разделяются на 4 электронных семейства (s-, p-, d-,f-элементы)
в зависимости от того, какой подуровень в атоме элемента заполняется последним.
Побочная подгруппа – это вертикальный ряд d-элементов,
имеющих одинаковое суммарное число электронов на d-подуровне
предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно
равно номеру группы.
Важнейшими свойствами химических элементов
являются металличность и неметалличность.
Металличность – это способность атомов
химического элемента отдавать электроны. Количественной характеристикой
металличности является энергия ионизации.
Энергия ионизации атома – это количество энергии,
которое необходимо для отрыва электрона от атома элемента, т. е. для
превращения атома в катион. Чем меньше энергия ионизации, тем легче атом отдает
электрон, тем сильнее металлические свойства элемента.
Неметалличность – это способность атомов химического
элемента присоединять электроны. Количественной характеристикой неметалличности
является сродство к электрону.
Сродство к электрону – это энергия, которая выделяется
при присоединении электрона к нейтральному атому, т. е. при превращении атома в
анион.
Чем больше сродство к электрону, тем легче
атом присоединяет электрон, тем сильнее неметаллические свойства элемента.
Универсальной характеристикой металличности
и неметалличности является электроотрицательность (ЭО) элемента.
ЭО элемента характеризует способность его
атомов притягивать к себе электроны, которые участвуют в образовании химических
связей с другими атомами в молекуле.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
3.3 Закономерности изменения свойств
химических элементов по периоду и по группе.
В малых периодах от щелочного металла к
инертному газу:
• заряд ядер атомов увеличивается;
• число энергетических уровней не
изменяется;
• число электронов на внешнем уровне
увеличивается от 1 до 8;
• радиус атомов уменьшается;
• прочность связи электронов внешнего
слоя с ядром увеличивается;
• энергия ионизации увеличивается;
• сродство к электрону увеличивается;
• ЭО увеличивается;
• металличность элементов
уменьшается;
• неметалличность элементов
увеличивается.
Все d-элементы данного периода
похожи по своим свойствам – все они являются металлами, имеют мало
различающиеся радиусы атомов и значения ЭО, поскольку содержат одинаковое число
электронов на внешнем уровне (например, в 4-м периоде – кроме Cr и Cu).
В главных подгруппах сверху вниз:
• число энергетических уровней
в атоме увеличивается;
• число электронов на внешнем уровне
одинаково;
• радиус атомов увеличивается;
• прочность связи электронов внешнего
уровня с ядром уменьшается;
• энергия ионизации уменьшается;
• сродство к электрону уменьшается;
• ЭО уменьшается;
• металличность элементов
увеличивается;
• неметалличность элементов
уменьшается.
Описание элемента магния, астата, хлора

Рис. 1. Положение магния в таблице
В группе магний соседствует с бериллием и
кальцием. Рис.1. Магний стоит ниже, чем бериллий, но выше кальция в группе. У
магния больше металлические свойства, чем у бериллия, но меньше чем у кальция.
Основные свойства его оксидов и гидроксидов изменяются также. В периоде натрий
стоит левее, а алюминий правее магния. Натрий будет проявлять больше
металлические свойства, чем магний, а магний больше, чес алюминий. Таким образом,
можно сравнить любой элемент с соседями его по группе и периоду.
Кислотные и неметаллические свойства
изменяются противоположно основным и металлическим свойствам.
Степень окисления
В процессе отдачи или присоединения
электронов атом приобретает условный заряд. Этот условный заряд
называется степенью окисления.
— Простые вещества
обладают степенью окисления равной нулю.
— Элементы могут проявлять максимальную степень
окисления и минимальную. Максимальную степень
окисления элемент проявляет тогда, когда отдает все свои
валентные электроны с внешнего электронного уровня. Если число валентных
электронов равно номеру группы, то и максимальная степень окисления равна
номеру группы.
План характеристики химического элемента
1. Символ элемента
2. Порядковый номер элемента
3. Значение относительной атомной массы
элемента.
4. Число протонов, электронов, нейтронов.
5. Номер периода.
6. Номер и тип группы (тип элемента s -, p
-,d -,f — элемент)
7. Металл или неметалл
8. Сравнение свойств элемента
(металлических и неметаллических) с соседними элементами по периоду и группе.
9. Написать распределение электронов по
атомным орбиталям – квантовую диаграмму.
10. Написать электронную формулу.
11. Зарисовать распределение электронов по
энергетическим уровням
12. Определить высшую степень окисления
атома и формулу его высшего оксида. Определить характер оксида (основной,
кислотный, амфотерный).
13. Определить низшую степень окисления
элемента и формулу его водородного соединения (если такое есть).
V. Закрепление изученного на уроке.
Задание 1. Определить период, группу,
подгруппу, порядковый номер элементов.
Кислород: период — 2, группа- VI,
подгруппа — главная, порядковый номер — 8
Азот: период — 2, группа — V, подгруппа –
главная, порядковый номер – 7
Углерод: период — 2, группа- IV, подгруппа
– главная, порядковый номер – 6
Задание
2. Сравнить металлические свойства элементов, поставив знак больше
или меньше.
а) Al < Na; б) O <
S; в) P < As; г) Ca > Mg
VI. Подведение итогов урока.
Объяснение домашнего задания,
оценивание деятельности учащихся.
VII. Домашнее задание.
Выучить конспект. Решить задания в тетради.
Естествознание, 10 класс
Урок 31. Открываем периодическую систему
Перечень вопросов, рассматриваемых в теме:
- Что лежит в основе периодического закона? Периодической системы?
- В чем заключается физический смысл периодического закона?
- Как устроена периодическая система? В чем физический смысл периодов, групп, подгрупп?
- Каков характер изменения свойств элементов и их соединений в периодах и главных подгруппах?
Глоссарий по теме:
Периодический закон Д.И.Менделеева:
«Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса».
Современная формулировка:
«Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Периодическая система – это упорядоченное множество элементов, имеющих свой порядковый номер. Графическая форма представления периодической системы – периодическая таблица.
Период – это горизонтальный ряд элементов, расположенных в порядке возрастания заряда их атомных ядер и имеющих одинаковое значение главного квантового числа для внешних (валентных) электронов.
Группа – это вертикальный ряд элементов, имеющих сходную конфигурацию внешних (и предвнешних) энергетических уровней и обладающих в силу этого сходными свойствами.
Главная подгруппа (А) – это вертикальный ряд элементов, имеющих одинаковое число электронов на внешнем энергетическом уровне, числено равное номеру группы.
Побочная подгруппа (В) – это вертикальный ряд элементов, имеющих одинаковое число электронов на внешнем и предвнешнем энергетических уровнях, в сумме, как правило, равное номеру группы.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц):
- Дмитриев И. С. Человек эпохи перемен. Очерки о Д. И. Менделееве и его времени. – СПб., 2004.
- Дмитрий Иванович Менделеев. Биография русского гения [Электронный ресурс] // Экология и жизнь. — 2009. — №1. — Режим доступа: http://elementy.ru/lib/430731.
- Евдокимов, Ю. К истории периодического закона / Ю. Евдокимов // Наука и жизнь. — 2009. — №5. — С.12-15.
- Естествознание. 10 класс [Текст]: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017. : с 53 -58.
- Каланов В. Дмитрий Иванович Менделеев — великий учёный и патриот России [Электронный ресурс] / В. Каланов // Знание-сила. — 2010. — Режим доступа: http://znaniya-sila.narod.ru/people/011_01.htm.
- Книга для чтения по неорганической химии: Книга для учащихся: в 2-х ч. / Сост. В. А. Крицман. – 3-е изд. – М.: Просвещение, 1993. Ч. I. С. 143 – 150.
- Левченков С.И. Краткий очерк истории химии. – Ростов н/Д: Изд-во Рост. ун-та, 2006.
- Миттова И.Я., Самойлов А.М. История химии с древнейших времен до конца XX века: учебное пособие в 2-х томах. Т. 1. – Долгопрудный: ИД «Интеллект», 2009.
- Самин, Д.К., 100 великих ученых/ Д.К.Самин. – М.: Вече, 2003.
- Трифонов Д. Н., Трифонов В. Д. Как были открыты химические элементы: пособие для учащихся. – М., 1980.
- Философский словарь / Под ред. И. Т. Фролова. – 7-е изд. – М., 2001. С. 247.
Теоретический материал для самостоятельного изучения
Научной основой развития естественных наук в XIX веке становится периодический закон и периодическая система элементов Д. И. Менделеева, которые являются и на сегодняшний день основой познания строения и свойств простых и сложных веществ.
Предшественники Д.И. Менделеева – французский химик Шанкартуа, немецкий химик Дёберейнер, английский ученый Ньюлендс — осуществляли попытки классифицировать элементы, но в основу их классификации были положены свойства веществ (осуществлялся подбор элементов по свойствам). Ближе всех к решению задачи систематизации подошёл в 1864г. немецкий химик Юлиус Лотар Мейер. Изучение свойств элементов, равно как свойств образуемых ими соединений, привело к накоплению богатого фактического материала. В отличии от своих предшественников, Д.И. Менделеев находит общее среди всех элементов. И основой его классификации становится атомная масса.
Расположив все известные к тому времени химические элементы в порядке возрастания их относительных атомных масс, он увидел периодичность повторения свойств элементов и их соединений. Так Д.И. Менделеев в марте 1869г. сформулировал важнейшую для химии закономерность, называемую периодическим законом.
«Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса».
Несмотря на важность сделанного Д.И. Менделеевым открытия, многие противоречия все же не были разрешены. И было сделано ряд исключений для расположения элементов по атомным массам. Так, была непонятна причина периодичности изменения свойств элементов. Ответы на этот и другие вопросы были найдены лишь после раскрытия внутренней структуры атома. Учение о строении атома подтвердило глубинный смысл периодического закона и скорректировало его формулировку.
Современная формулировка:
«Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Свое выражение периодический закон нашел в построенной Д.И.Менделеевым периодической системе.


Периодическая система – это упорядоченное множество элементов, имеющих свой порядковый номер. Графическая форма представления периодической системы – периодическая таблица.
Периодическая система – одна, а форм периодических таблиц – более 500. Наиболее известны длинный, полудлинный и короткий варианты периодической таблицы.
Как показали достижения физики в области квантовой механики строения атома, периодичность свойств элементов обусловлена периодической повторяемостью расположения валентных электронов на уровнях и подуровнях по мере роста заряда ядра атома. Закономерности периодической системы элементов широко используются современными интегрированными науками: геохимией, космохимией, физхимией, биохимией, при подборе катализаторов и т.д.
После открытия строения атома главной характеристикой атома становится заряд ядра. Он численно равен количеству протонов в ядре и определяет число электронов в электронной оболочке атома, ее строение, а значит свойства элемента и его положение в периодической системе.
В периодах и группах периодической системы химические элементы располагаются в порядке возрастания заряда их атомных ядер, т.е. порядкового номера элемента. Последовательное увеличение заряда ядра определяет периодичность повторения структуры внешнего энергетического уровня атома, а значит и периодичность повторения свойств элементов и их соединений. В этом – физический смысл периодического закона.
Прямую связь со строением атома имеют также номер периода и группы. Всего в периодической системе семь периодов и восемь групп (короткая форма таблицы).
- Вспомните и дайте толкование: что такое период? Какие периоды бывают? Что такое группа? Какие бывают подгруппы?
- Что показывает номер периода? Номер группы? В чем их физический смысл?
Говоря о физическом смысле номера группы, важно помнить, что каждая из них делится на главную и побочную подгруппы.
Главная подгруппа (А) – это вертикальный ряд элементов, имеющих одинаковое число электронов на внешнем энергетическом уровне, числено равное номеру группы.
В главных подгруппах располагаются s- и p-элементы. Число внешних электронов для этих элементов определяется суммой s- и p-электронов последнего уровня и равно номеру группы.
Побочная подгруппа (В) – это вертикальный ряд элементов, имеющих одинаковое число электронов на внешнем и предвнешнем энергетических уровнях, в сумме, как правило, равное номеру группы.
В побочных подгруппах располагаются d— и f—элементы. В их атомах последними заполняются электронами d— и f-подуровни предвнешних энергетических уровней. Число внешних электронов для этих элементов не совпадает с номером группы. При этом валентными у элементов побочных подгрупп являются электроны как внешних, так и предвнешних энергетических уровней.
Характер изменения свойств элементов и их соединений в периодах и главных подгруппах
Изменение электронных структур атомов определяет горизонтальные (в периоде) и вертикальные (в подгруппе) закономерности изменения свойств химических элементов, обобщаемые периодическим законом (табл.). Поэтому, свойства элементов определяются на пересечении его горизонтальных и вертикальных отношений с соседями по периоду и подгруппе.
- Установите взаимосвязь между характером изменения металлических и неметаллических свойств элементов в периодах и главных подгруппах и другими свойствами элементов, используя интерактивную периодическую систему и следующие данные таблицы.
Таблица . Изменение свойств элементов в периодической системе и их соединений
| Свойство | Период (слева на право) | Главная подгруппа (сверху вниз) |
| Заряд ядра атома | Возрастает | |
| Радиус атома | Уменьшается | Увеличивается |
| Валентность по отношению к кислороду | Возрастает от I до VII | Не изменяется |
| Валентность по отношению к водороду | I−II−III−IV−III−II−I | |
| Относительная электроотрицательность | Возрастает | Уменьшается |
| Металлические свойства | Ослабевают | Усиливаются |
| Основные свойства соединений | ||
| Неметаллические свойства | Усиливаются | Ослабевают |
| Кислотные свойства соединений |
Выводы и обобщения:
- Научная классификация отражает закономерные взаимосвязи между классами объектов с целью определения места объектов в системе, которое указывает на его свойства. Именно так устроена Периодическая система химических элементов Д. И. Менделеева.
- На основании этой Системы были предсказаны свойства еще не открытых (неизвестных) элементов и эти прогнозы блестяще подтвердились.
- Многие свойства атомов, простых и сложных веществ изменяются периодически и зависят от местоположения соответствующего элемента в Периодической системе.
- Периодический закон имеет философское значение, как общий закон природы и носит прогностический характер, позволяет предсказывать новые элементы и их свойства.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Формула высшего оксида, соответствующая элементам III группы, …
а) R203;
б) R205;
в) R03;
г) RO.
Ответ: а.
Решение. Высшая степень окисления элемента определяется номером группы. Если группа III, то степень окисления равна +3, следовательно, формула высшего оксида
+3 -2
R2O3, что соответствует варианту а.
В варианте б приведена формула высшего оксида, соответствующая элементам V группы; в варианте в — элементам VI группы; в варианте г — элементам II группы.
Задание 2. Расставьте элементы в порядке убывания металлических свойств в каждом ряду элементов…
а) С, Si, Ge;
б) В, Be, Li;
в) Na, Mg, Al;
Ответы: а) Ge; Si; С
б) Li; Be; В
в) Na; Mg; Al
Подсказка. Сравните радиусы атомов химических элементов в зависимости от расположения в периодической системе. Чем больше радиус атома, тем больше металлические свойства элемента.
Решение. С увеличением порядкового номера в периоде металлические свойства элементов убывают слева направо, а с увеличением порядкового номера в главной подгруппе металлические свойства элементов возрастают сверху вниз.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Содержание
- Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
- Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
- Тренировочные задания
- Ответы
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
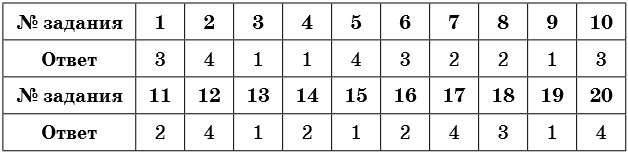
Ответы