 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Helium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (HEE-lee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | colorless gas, exhibiting a gray, cloudy glow (or reddish-orange if an especially high voltage is used) when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(He) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Helium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 0.95 K (−272.20 °C, −457.96 °F) (at 2.5 MPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 4.222 K (−268.928 °C, −452.070 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 0.1786 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.145 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 0.125 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 2.177 K, 5.043 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 5.1953 K, 0.22746 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 0.0138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 0.0829 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.78 J/(mol·K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure (defined by ITS-90)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: no data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 28 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of helium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 972 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 0.1513 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −1.88×10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-59-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Helios, Greek god of the Sun | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Pierre Janssen, Norman Lockyer (1868) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | William Ramsay, Per Teodor Cleve, Abraham Langlet (1895) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of helium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Helium (from Greek: ἥλιος, romanized: helios, lit. ‘sun’) is a chemical element with the symbol He and atomic number 2. It is a colorless, odorless, tasteless, non-toxic, inert, monatomic gas and the first in the noble gas group in the periodic table.[a] Its boiling and melting point are the lowest among all the elements. It is the second lightest and second most abundant element in the observable universe, after hydrogen. It is present at about 24% of the total elemental mass, which is more than 12 times the mass of all the heavier elements combined. Its abundance is similar to this in both the Sun and in Jupiter, due to the very high nuclear binding energy (per nucleon) of helium-4, with respect to the next three elements after helium. This helium-4 binding energy also accounts for why it is a product of both nuclear fusion and radioactive decay. The most common isotope of helium in the universe is helium-4, the vast majority of which was formed during the Big Bang. Large amounts of new helium are created by nuclear fusion of hydrogen in stars.
Helium was first detected as an unknown, yellow spectral line signature in sunlight during a solar eclipse in 1868 by Georges Rayet,[11] Captain C. T. Haig,[12] Norman R. Pogson,[13] and Lieutenant John Herschel,[14] and was subsequently confirmed by French astronomer Jules Janssen.[15] Janssen is often jointly credited with detecting the element, along with Norman Lockyer. Janssen recorded the helium spectral line during the solar eclipse of 1868, while Lockyer observed it from Britain. Lockyer was the first to propose that the line was due to a new element, which he named. The formal discovery of the element was made in 1895 by chemists Sir William Ramsay, Per Teodor Cleve, and Nils Abraham Langlet, who found helium emanating from the uranium ore, cleveite, which is now not regarded as a separate mineral species, but as a variety of uraninite.[16][17] In 1903, large reserves of helium were found in natural gas fields in parts of the United States, by far the largest supplier of the gas today.
Liquid helium is used in cryogenics (its largest single use, absorbing about a quarter of production), and in the cooling of superconducting magnets, with its main commercial application in MRI scanners. Helium’s other industrial uses—as a pressurizing and purge gas, as a protective atmosphere for arc welding, and in processes such as growing crystals to make silicon wafers—account for half of the gas produced. A well-known but minor use is as a lifting gas in balloons and airships.[18] As with any gas whose density differs from that of air, inhaling a small volume of helium temporarily changes the timbre and quality of the human voice. In scientific research, the behavior of the two fluid phases of helium-4 (helium I and helium II) is important to researchers studying quantum mechanics (in particular the property of superfluidity) and to those looking at the phenomena, such as superconductivity, produced in matter near absolute zero.
On Earth, it is relatively rare—5.2 ppm by volume in the atmosphere. Most terrestrial helium present today is created by the natural radioactive decay of heavy radioactive elements (thorium and uranium, although there are other examples), as the alpha particles emitted by such decays consist of helium-4 nuclei. This radiogenic helium is trapped with natural gas in concentrations as great as 7% by volume, from which it is extracted commercially by a low-temperature separation process called fractional distillation. Terrestrial helium is a non-renewable resource because once released into the atmosphere, it promptly escapes into space. Its supply is thought to be rapidly diminishing.[19][20] However, some studies suggest that helium produced deep in the earth by radioactive decay can collect in natural gas reserves in larger than expected quantities,[21] in some cases, having been released by volcanic activity.[22]
History
Scientific discoveries
The first evidence of helium was observed on August 18, 1868, as a bright yellow line with a wavelength of 587.49 nanometers in the spectrum of the chromosphere of the Sun. The line was detected by French astronomer Jules Janssen during a total solar eclipse in Guntur, India.[23][24] This line was initially assumed to be sodium. On October 20 of the same year, English astronomer, Norman Lockyer, observed a yellow line in the solar spectrum, which, he named the D3 because it was near the known D1 and D2 Fraunhofer line lines of sodium.[25][26] He concluded that it was caused by an element in the Sun unknown on Earth. Lockyer and English chemist Edward Frankland named the element with the Greek word for the Sun, ἥλιος (helios).[27][28]

In 1881, Italian physicist Luigi Palmieri detected helium on Earth for the first time through its D3 spectral line, when he analyzed a material that had been sublimated during a recent eruption of Mount Vesuvius.[29]


The cleveite sample from which Ramsay first purified helium[30]
On March 26, 1895, Scottish chemist Sir William Ramsay isolated helium on Earth by treating the mineral cleveite (a variety of uraninite with at least 10% rare-earth elements) with mineral acids. Ramsay was looking for argon but, after separating nitrogen and oxygen from the gas, liberated by sulfuric acid, he noticed a bright yellow line that matched the D3 line observed in the spectrum of the Sun.[26][31][32][33] These samples were identified as helium by Lockyer and British physicist William Crookes.[34][35] It was independently isolated from cleveite, in the same year, by chemists, Per Teodor Cleve and Abraham Langlet, in Uppsala, Sweden, who collected enough of the gas to accurately determine its atomic weight.[36][37][24][38] Helium was also isolated by the American geochemist, William Francis Hillebrand, prior to Ramsay’s discovery, when he noticed unusual spectral lines while testing a sample of the mineral uraninite. Hillebrand, however, attributed the lines to nitrogen.[39] His letter of congratulations to Ramsay offers an interesting case of discovery, and near-discovery, in science.[40]
In 1907, Ernest Rutherford and Thomas Royds demonstrated that alpha particles are helium nuclei, by allowing the particles to penetrate the thin, glass wall of an evacuated tube, then creating a discharge in the tube, to study the spectrum of the new gas inside.[41] In 1908, helium was first liquefied by Dutch physicist Heike Kamerlingh Onnes by cooling the gas to less than 5 K (−268.15 °C; −450.67 °F).[42][43] He tried to solidify it, by further reducing the temperature, but failed, because helium does not solidify at atmospheric pressure. Onnes’ student Willem Hendrik Keesom was eventually able to solidify 1 cm3 of helium in 1926 by applying additional external pressure.[44][45]
In 1913, Niels Bohr published his «trilogy»[46][47] on atomic structure that included a reconsideration of the Pickering–Fowler series as central evidence in support of his model of the atom.[48][49] This series is named for Edward Charles Pickering, who in 1896 published observations of previously unknown lines in the spectrum of the star ζ Puppis[50] (these are now known to occur with Wolf–Rayet and other hot stars).[51] Pickering attributed the observation (lines at 4551, 5411, and 10123 Å) to a new form of hydrogen with half-integer transition levels.[52][53] In 1912, Alfred Fowler[54] managed to produce similar lines from a hydrogen-helium mixture, and supported Pickering’s conclusion as to their origin.[55] Bohr’s model does not allow for half-integer transitions (nor does quantum mechanics) and Bohr concluded that Pickering and Fowler were wrong, and instead assigned these spectral lines to ionised helium, He+.[56] Fowler was initially skeptical[57] but was ultimately convinced[58] that Bohr was correct,[46] and by 1915 «spectroscopists had transferred [the Pickering–Fowler series] definitively [from hydrogen] to helium.»[49][59] Bohr’s theoretical work on the Pickering series had demonstrated the need for «a re-examination of problems that seemed already to have been solved within classical theories» and provided important confirmation for his atomic theory.[49]
In 1938, Russian physicist Pyotr Leonidovich Kapitsa discovered that helium-4 has almost no viscosity at temperatures near absolute zero, a phenomenon now called superfluidity.[60] This phenomenon is related to Bose–Einstein condensation. In 1972, the same phenomenon was observed in helium-3, but at temperatures much closer to absolute zero, by American physicists Douglas D. Osheroff, David M. Lee, and Robert C. Richardson. The phenomenon in helium-3 is thought to be related to pairing of helium-3 fermions to make bosons, in analogy to Cooper pairs of electrons producing superconductivity.[61]
Extraction and use

After an oil drilling operation in 1903 in Dexter, Kansas produced a gas geyser that would not burn, Kansas state geologist Erasmus Haworth collected samples of the escaping gas and took them back to the University of Kansas at Lawrence where, with the help of chemists Hamilton Cady and David McFarland, he discovered that the gas consisted of, by volume, 72% nitrogen, 15% methane (a combustible percentage only with sufficient oxygen), 1% hydrogen, and 12% an unidentifiable gas.[24][62] With further analysis, Cady and McFarland discovered that 1.84% of the gas sample was helium.[63][64] This showed that despite its overall rarity on Earth, helium was concentrated in large quantities under the American Great Plains, available for extraction as a byproduct of natural gas.[65]
This enabled the United States to become the world’s leading supplier of helium. Following a suggestion by Sir Richard Threlfall, the United States Navy sponsored three small experimental helium plants during World War I. The goal was to supply barrage balloons with the non-flammable, lighter-than-air gas. A total of 5,700 m3 (200,000 cu ft) of 92% helium was produced in the program even though less than a cubic meter of the gas had previously been obtained.[26] Some of this gas was used in the world’s first helium-filled airship, the U.S. Navy’s C-class blimp C-7, which flew its maiden voyage from Hampton Roads, Virginia, to Bolling Field in Washington, D.C., on December 1, 1921,[66] nearly two years before the Navy’s first rigid helium-filled airship, the Naval Aircraft Factory-built USS Shenandoah, flew in September 1923.
Although the extraction process using low-temperature gas liquefaction was not developed in time to be significant during World War I, production continued. Helium was primarily used as a lifting gas in lighter-than-air craft. During World War II, the demand increased for helium for lifting gas and for shielded arc welding. The helium mass spectrometer was also vital in the atomic bomb Manhattan Project.[67]
The government of the United States set up the National Helium Reserve in 1925 at Amarillo, Texas, with the goal of supplying military airships in time of war and commercial airships in peacetime.[26] Because of the Helium Act of 1925, which banned the export of scarce helium on which the US then had a production monopoly, together with the prohibitive cost of the gas, the Hindenburg, like all German Zeppelins, was forced to use hydrogen as the lift gas. The helium market after World War II was depressed but the reserve was expanded in the 1950s to ensure a supply of liquid helium as a coolant to create oxygen/hydrogen rocket fuel (among other uses) during the Space Race and Cold War. Helium use in the United States in 1965 was more than eight times the peak wartime consumption.[68]
After the «Helium Acts Amendments of 1960» (Public Law 86–777), the U.S. Bureau of Mines arranged for five private plants to recover helium from natural gas. For this helium conservation program, the Bureau built a 425-mile (684 km) pipeline from Bushton, Kansas, to connect those plants with the government’s partially depleted Cliffside gas field near Amarillo, Texas. This helium-nitrogen mixture was injected and stored in the Cliffside gas field until needed, at which time it was further purified.[69]
By 1995, a billion cubic meters of the gas had been collected and the reserve was US$1.4 billion in debt, prompting the Congress of the United States in 1996 to phase out the reserve.[24][70] The resulting Helium Privatization Act of 1996[71] (Public Law 104–273) directed the United States Department of the Interior to empty the reserve, with sales starting by 2005.[72]
Helium produced between 1930 and 1945 was about 98.3% pure (2% nitrogen), which was adequate for airships. In 1945, a small amount of 99.9% helium was produced for welding use. By 1949, commercial quantities of Grade A 99.95% helium were available.[73]
For many years, the United States produced more than 90% of commercially usable helium in the world, while extraction plants in Canada, Poland, Russia, and other nations produced the remainder. In the mid-1990s, a new plant in Arzew, Algeria, producing 17 million cubic meters (600 million cubic feet) began operation, with enough production to cover all of Europe’s demand. Meanwhile, by 2000, the consumption of helium within the U.S. had risen to more than 15 million kg per year.[74] In 2004–2006, additional plants in Ras Laffan, Qatar, and Skikda, Algeria were built. Algeria quickly became the second leading producer of helium.[75] Through this time, both helium consumption and the costs of producing helium increased.[76] From 2002 to 2007 helium prices doubled.[77]
As of 2012, the United States National Helium Reserve accounted for 30 percent of the world’s helium.[78] The reserve was expected to run out of helium in 2018.[78] Despite that, a proposed bill in the United States Senate would allow the reserve to continue to sell the gas. Other large reserves were in the Hugoton in Kansas, United States, and nearby gas fields of Kansas and the panhandles of Texas and Oklahoma. New helium plants were scheduled to open in 2012 in Qatar, Russia, and the US state of Wyoming, but they were not expected to ease the shortage.[78]
In 2013, Qatar started up the world’s largest helium unit,[79] although the 2017 Qatar diplomatic crisis severely affected helium production there.[80] 2014 was widely acknowledged to be a year of over-supply in the helium business, following years of renowned shortages.[81] Nasdaq reported (2015) that for Air Products, an international corporation that sells gases for industrial use, helium volumes remain under economic pressure due to feedstock supply constraints.[82]
Characteristics
Atom

The helium atom. Depicted are the nucleus (pink) and the electron cloud distribution (black). The nucleus (upper right) in helium-4 is in reality spherically symmetric and closely resembles the electron cloud, although for more complicated nuclei this is not always the case.
In quantum mechanics
In the perspective of quantum mechanics, helium is the second simplest atom to model, following the hydrogen atom. Helium is composed of two electrons in atomic orbitals surrounding a nucleus containing two protons and (usually) two neutrons. As in Newtonian mechanics, no system that consists of more than two particles can be solved with an exact analytical mathematical approach (see 3-body problem) and helium is no exception. Thus, numerical mathematical methods are required, even to solve the system of one nucleus and two electrons. Such computational chemistry methods have been used to create a quantum mechanical picture of helium electron binding which is accurate to within < 2% of the correct value, in a few computational steps.[83] Such models show that each electron in helium partly screens the nucleus from the other, so that the effective nuclear charge Zeff which each electron sees is about 1.69 units, not the 2 charges of a classic «bare» helium nucleus.
Related stability of the helium-4 nucleus and electron shell
The nucleus of the helium-4 atom is identical with an alpha particle. High-energy electron-scattering experiments show its charge to decrease exponentially from a maximum at a central point, exactly as does the charge density of helium’s own electron cloud. This symmetry reflects similar underlying physics: the pair of neutrons and the pair of protons in helium’s nucleus obey the same quantum mechanical rules as do helium’s pair of electrons (although the nuclear particles are subject to a different nuclear binding potential), so that all these fermions fully occupy 1s orbitals in pairs, none of them possessing orbital angular momentum, and each cancelling the other’s intrinsic spin. Adding another of any of these particles would require angular momentum and would release substantially less energy (in fact, no nucleus with five nucleons is stable). This arrangement is thus energetically extremely stable for all these particles, and this stability accounts for many crucial facts regarding helium in nature.
For example, the stability and low energy of the electron cloud state in helium accounts for the element’s chemical inertness, and also the lack of interaction of helium atoms with each other, producing the lowest melting and boiling points of all the elements.
In a similar way, the particular energetic stability of the helium-4 nucleus, produced by similar effects, accounts for the ease of helium-4 production in atomic reactions that involve either heavy-particle emission or fusion. Some stable helium-3 (two protons and one neutron) is produced in fusion reactions from hydrogen, but it is a very small fraction compared to the highly favorable helium-4.

Binding energy per nucleon of common isotopes. The binding energy per particle of helium-4 is significantly larger than all nearby nuclides.
The unusual stability of the helium-4 nucleus is also important cosmologically: it explains the fact that in the first few minutes after the Big Bang, as the «soup» of free protons and neutrons which had initially been created in about 6:1 ratio cooled to the point that nuclear binding was possible, almost all first compound atomic nuclei to form were helium-4 nuclei. Owing to the relatively tight binding of helium-4 nuclei, its production consumed nearly all of the free neutrons in a few minutes, before they could beta-decay, and thus few neutrons were available to form heavier atoms such as lithium, beryllium, or boron. Helium-4 nuclear binding per nucleon is stronger than in any of these elements (see nucleogenesis and binding energy) and thus, once helium had been formed, no energetic drive was available to make elements 3, 4 and 5.[84] It is barely energetically favorable for helium to fuse into the next element with a lower energy per nucleon, carbon. However, due to lack of intermediate elements, this process requires three helium nuclei striking each other nearly simultaneously (see triple alpha process). There was thus no time for significant carbon to be formed in the few minutes after the Big Bang, before the early expanding universe cooled to the temperature and pressure point where helium fusion to carbon was no longer possible. This left the early universe with a very similar ratio of hydrogen/helium as is observed today (3 parts hydrogen to 1 part helium-4 by mass), with nearly all the neutrons in the universe trapped in helium-4.
All heavier elements (including those necessary for rocky planets like the Earth, and for carbon-based or other life) have thus been created since the Big Bang in stars which were hot enough to fuse helium itself. All elements other than hydrogen and helium today account for only 2% of the mass of atomic matter in the universe. Helium-4, by contrast, makes up about 23% of the universe’s ordinary matter—nearly all the ordinary matter that is not hydrogen.
Gas and plasma phases

Helium discharge tube shaped like the element’s atomic symbol
Helium is the second least reactive noble gas after neon, and thus the second least reactive of all elements.[85] It is chemically inert and monatomic in all standard conditions. Because of helium’s relatively low molar (atomic) mass, its thermal conductivity, specific heat, and sound speed in the gas phase are all greater than any other gas except hydrogen. For these reasons and the small size of helium monatomic molecules, helium diffuses through solids at a rate three times that of air and around 65% that of hydrogen.[26]
Helium is the least water-soluble monatomic gas,[86] and one of the least water-soluble of any gas (CF4, SF6, and C4F8 have lower mole fraction solubilities: 0.3802, 0.4394, and 0.2372 x2/10−5, respectively, versus helium’s 0.70797 x2/10−5),[87] and helium’s index of refraction is closer to unity than that of any other gas.[88] Helium has a negative Joule–Thomson coefficient at normal ambient temperatures, meaning it heats up when allowed to freely expand. Only below its Joule–Thomson inversion temperature (of about 32 to 50 K at 1 atmosphere) does it cool upon free expansion.[26] Once precooled below this temperature, helium can be liquefied through expansion cooling.
Most extraterrestrial helium is found in a plasma state, with properties quite different from those of atomic helium. In a plasma, helium’s electrons are not bound to its nucleus, resulting in very high electrical conductivity, even when the gas is only partially ionized. The charged particles are highly influenced by magnetic and electric fields. For example, in the solar wind together with ionized hydrogen, the particles interact with the Earth’s magnetosphere, giving rise to Birkeland currents and the aurora.[89]
Liquid phase

Liquefied helium. This helium is not only liquid, but has been cooled to the point of superfluidity. The drop of liquid at the bottom of the glass represents helium spontaneously escaping from the container over the side, to empty out of the container. The energy to drive this process is supplied by the potential energy of the falling helium.
Unlike any other element, helium will remain liquid down to absolute zero at normal pressures. This is a direct effect of quantum mechanics: specifically, the zero point energy of the system is too high to allow freezing. Solid helium requires a temperature of 1–1.5 K (about −272 °C or −457 °F) at about 25 bar (2.5 MPa) of pressure.[90] It is often hard to distinguish solid from liquid helium since the refractive index of the two phases are nearly the same. The solid has a sharp melting point and has a crystalline structure, but it is highly compressible; applying pressure in a laboratory can decrease its volume by more than 30%.[91] With a bulk modulus of about 27 MPa[92] it is ~100 times more compressible than water. Solid helium has a density of 0.214±0.006 g/cm3 at 1.15 K and 66 atm; the projected density at 0 K and 25 bar (2.5 MPa) is 0.187±0.009 g/cm3.[93] At higher temperatures, helium will solidify with sufficient pressure. At room temperature, this requires about 114,000 atm.[94]
Helium I
Below its boiling point of 4.22 K (−268.93 °C; −452.07 °F) and above the lambda point of 2.1768 K (−270.9732 °C; −455.7518 °F), the isotope helium-4 exists in a normal colorless liquid state, called helium I.[26] Like other cryogenic liquids, helium I boils when it is heated and contracts when its temperature is lowered. Below the lambda point, however, helium does not boil, and it expands as the temperature is lowered further.
Helium I has a gas-like index of refraction of 1.026 which makes its surface so hard to see that floats of Styrofoam are often used to show where the surface is.[26] This colorless liquid has a very low viscosity and a density of 0.145–0.125 g/mL (between about 0 and 4 K),[95] which is only one-fourth the value expected from classical physics.[26] Quantum mechanics is needed to explain this property and thus both states of liquid helium (helium I and helium II) are called quantum fluids, meaning they display atomic properties on a macroscopic scale. This may be an effect of its boiling point being so close to absolute zero, preventing random molecular motion (thermal energy) from masking the atomic properties.[26]
Helium II
Liquid helium below its lambda point (called helium II) exhibits very unusual characteristics. Due to its high thermal conductivity, when it boils, it does not bubble but rather evaporates directly from its surface. Helium-3 also has a superfluid phase, but only at much lower temperatures; as a result, less is known about the properties of the isotope.[26]

Unlike ordinary liquids, helium II will creep along surfaces in order to reach an equal level; after a short while, the levels in the two containers will equalize. The Rollin film also covers the interior of the larger container; if it were not sealed, the helium II would creep out and escape.[26]
Helium II is a superfluid, a quantum mechanical state (see: macroscopic quantum phenomena) of matter with strange properties. For example, when it flows through capillaries as thin as 10−7 to 10−8 m it has no measurable viscosity.[24] However, when measurements were done between two moving discs, a viscosity comparable to that of gaseous helium was observed. Current theory explains this using the two-fluid model for helium II. In this model, liquid helium below the lambda point is viewed as containing a proportion of helium atoms in a ground state, which are superfluid and flow with exactly zero viscosity, and a proportion of helium atoms in an excited state, which behave more like an ordinary fluid.[96]
In the fountain effect, a chamber is constructed which is connected to a reservoir of helium II by a sintered disc through which superfluid helium leaks easily but through which non-superfluid helium cannot pass. If the interior of the container is heated, the superfluid helium changes to non-superfluid helium. In order to maintain the equilibrium fraction of superfluid helium, superfluid helium leaks through and increases the pressure, causing liquid to fountain out of the container.[97]
The thermal conductivity of helium II is greater than that of any other known substance, a million times that of helium I and several hundred times that of copper.[26] This is because heat conduction occurs by an exceptional quantum mechanism. Most materials that conduct heat well have a valence band of free electrons which serve to transfer the heat. Helium II has no such valence band but nevertheless conducts heat well. The flow of heat is governed by equations that are similar to the wave equation used to characterize sound propagation in air. When heat is introduced, it moves at 20 meters per second at 1.8 K through helium II as waves in a phenomenon known as second sound.[26]
Helium II also exhibits a creeping effect. When a surface extends past the level of helium II, the helium II moves along the surface, against the force of gravity. Helium II will escape from a vessel that is not sealed by creeping along the sides until it reaches a warmer region where it evaporates. It moves in a 30 nm-thick film regardless of surface material. This film is called a Rollin film and is named after the man who first characterized this trait, Bernard V. Rollin.[26][98][99] As a result of this creeping behavior and helium II’s ability to leak rapidly through tiny openings, it is very difficult to confine. Unless the container is carefully constructed, the helium II will creep along the surfaces and through valves until it reaches somewhere warmer, where it will evaporate. Waves propagating across a Rollin film are governed by the same equation as gravity waves in shallow water, but rather than gravity, the restoring force is the van der Waals force.[100] These waves are known as third sound.[101]
Isotopes
There are nine known isotopes of helium, but only helium-3 and helium-4 are stable. In the Earth’s atmosphere, one atom is 3
He for every million that are 4
He.[24] Unlike most elements, helium’s isotopic abundance varies greatly by origin, due to the different formation processes. The most common isotope, helium-4, is produced on Earth by alpha decay of heavier radioactive elements; the alpha particles that emerge are fully ionized helium-4 nuclei. Helium-4 is an unusually stable nucleus because its nucleons are arranged into complete shells. It was also formed in enormous quantities during Big Bang nucleosynthesis.[102]
Helium-3 is present on Earth only in trace amounts. Most of it has been present since Earth’s formation, though some falls to Earth trapped in cosmic dust.[103] Trace amounts are also produced by the beta decay of tritium.[104] Rocks from the Earth’s crust have isotope ratios varying by as much as a factor of ten, and these ratios can be used to investigate the origin of rocks and the composition of the Earth’s mantle.[103] 3
He is much more abundant in stars as a product of nuclear fusion. Thus in the interstellar medium, the proportion of 3
He to 4
He is about 100 times higher than on Earth.[105] Extraplanetary material, such as lunar and asteroid regolith, have trace amounts of helium-3 from being bombarded by solar winds. The Moon’s surface contains helium-3 at concentrations on the order of 10 ppb, much higher than the approximately 5 ppt found in the Earth’s atmosphere.[106][107] A number of people, starting with Gerald Kulcinski in 1986,[108] have proposed to explore the moon, mine lunar regolith, and use the helium-3 for fusion.
Liquid helium-4 can be cooled to about 1 K (−272.15 °C; −457.87 °F) using evaporative cooling in a 1-K pot. Similar cooling of helium-3, which has a lower boiling point, can achieve about 0.2 kelvin in a helium-3 refrigerator. Equal mixtures of liquid 3
He and 4
He below 0.8 K separate into two immiscible phases due to their dissimilarity (they follow different quantum statistics: helium-4 atoms are bosons while helium-3 atoms are fermions).[26] Dilution refrigerators use this immiscibility to achieve temperatures of a few millikelvins.[109]
It is possible to produce exotic helium isotopes, which rapidly decay into other substances. The shortest-lived heavy helium isotope is the unbound helium-10 with a half-life of 2.6(4)×10−22 s.[110] Helium-6 decays by emitting a beta particle and has a half-life of 0.8 second. Helium-7 also emits a beta particle as well as a gamma ray. Helium-7 and helium-8 are created in certain nuclear reactions.[26] Helium-6 and helium-8 are known to exhibit a nuclear halo.[26]
Properties
Table of thermal and physical properties of helium gas at atmospheric pressure:[111][112]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 100 | 5.193 | 9.63E-06 | 1.98E-05 | 0.073 | 2.89E-05 | 0.686 | |
| 120 | 0.406 | 5.193 | 1.07E-05 | 2.64E-05 | 0.0819 | 3.88E-05 | 0.679 |
| 144 | 0.3379 | 5.193 | 1.26E-05 | 3.71E-05 | 0.0928 | 5.28E-05 | 0.7 |
| 200 | 0.2435 | 5.193 | 1.57E-05 | 6.44E-05 | 0.1177 | 9.29E-05 | 0.69 |
| 255 | 0.1906 | 5.193 | 1.82E-05 | 9.55E-05 | 0.1357 | 1.37E-04 | 0.7 |
| 366 | 0.1328 | 5.193 | 2.31E-05 | 1.74E-04 | 0.1691 | 2.45E-04 | 0.71 |
| 477 | 0.10204 | 5.193 | 2.75E-05 | 2.69E-04 | 0.197 | 3.72E-04 | 0.72 |
| 589 | 0.08282 | 5.193 | 3.11E-05 | 3.76E-04 | 0.225 | 5.22E-04 | 0.72 |
| 700 | 0.07032 | 5.193 | 3.48E-05 | 4.94E-04 | 0.251 | 6.66E-04 | 0.72 |
| 800 | 0.06023 | 5.193 | 3.82E-05 | 6.34E-04 | 0.275 | 8.77E-04 | 0.72 |
| 900 | 0.05451 | 5.193 | 4.14E-05 | 7.59E-04 | 0.33 | 1.14E-03 | 0.687 |
| 1000 | 5.193 | 4.46E-05 | 9.14E-04 | 0.354 | 1.40E-03 | 0.654 |
Compounds


Structure of the suspected fluoroheliate anion, OHeF−
Helium has a valence of zero and is chemically unreactive under all normal conditions.[91] It is an electrical insulator unless ionized. As with the other noble gases, helium has metastable energy levels that allow it to remain ionized in an electrical discharge with a voltage below its ionization potential.[26] Helium can form unstable compounds, known as excimers, with tungsten, iodine, fluorine, sulfur, and phosphorus when it is subjected to a glow discharge, to electron bombardment, or reduced to plasma by other means. The molecular compounds HeNe, HgHe10, and WHe2, and the molecular ions He+
2, He2+
2, HeH+
, and HeD+
have been created this way.[113] HeH+ is also stable in its ground state, but is extremely reactive—it is the strongest Brønsted acid known, and therefore can exist only in isolation, as it will protonate any molecule or counteranion it contacts. This technique has also produced the neutral molecule He2, which has a large number of band systems, and HgHe, which is apparently held together only by polarization forces.[26]
Van der Waals compounds of helium can also be formed with cryogenic helium gas and atoms of some other substance, such as LiHe and He2.[114]
Theoretically, other true compounds may be possible, such as helium fluorohydride (HHeF) which would be analogous to HArF, discovered in 2000.[115] Calculations show that two new compounds containing a helium-oxygen bond could be stable.[116] Two new molecular species, predicted using theory, CsFHeO and N(CH3)4FHeO, are derivatives of a metastable FHeO− anion first theorized in 2005 by a group from Taiwan. If confirmed by experiment, the only remaining element with no known stable compounds would be neon.[117]
Helium atoms have been inserted into the hollow carbon cage molecules (the fullerenes) by heating under high pressure. The endohedral fullerene molecules formed are stable at high temperatures. When chemical derivatives of these fullerenes are formed, the helium stays inside.[118] If helium-3 is used, it can be readily observed by helium nuclear magnetic resonance spectroscopy.[119] Many fullerenes containing helium-3 have been reported. Although the helium atoms are not attached by covalent or ionic bonds, these substances have distinct properties and a definite composition, like all stoichiometric chemical compounds.
Under high pressures helium can form compounds with various other elements. Helium-nitrogen clathrate (He(N2)11) crystals have been grown at room temperature at pressures ca. 10 GPa in a diamond anvil cell.[120] The insulating electride Na2He has been shown to be thermodynamically stable at pressures above 113 GPa. It has a fluorite structure.[121]
Occurrence and production
Natural abundance
Although it is rare on Earth, helium is the second most abundant element in the known Universe, constituting 23% of its baryonic mass. Only hydrogen is more abundant.[24] The vast majority of helium was formed by Big Bang nucleosynthesis one to three minutes after the Big Bang. As such, measurements of its abundance contribute to cosmological models. In stars, it is formed by the nuclear fusion of hydrogen in proton–proton chain reactions and the CNO cycle, part of stellar nucleosynthesis.[102]
In the Earth’s atmosphere, the concentration of helium by volume is only 5.2 parts per million.[122][123] The concentration is low and fairly constant despite the continuous production of new helium because most helium in the Earth’s atmosphere escapes into space by several processes.[124][125][126] In the Earth’s heterosphere, a part of the upper atmosphere, helium and other lighter gases are the most abundant elements.
Most helium on Earth is a result of radioactive decay. Helium is found in large amounts in minerals of uranium and thorium, including uraninite and its varieties cleveite and pitchblende,[16][127] carnotite and monazite (a group name; «monazite» usually refers to monazite-(Ce)),[128][129] because they emit alpha particles (helium nuclei, He2+) to which electrons immediately combine as soon as the particle is stopped by the rock. In this way an estimated 3000 metric tons of helium are generated per year throughout the lithosphere.[130][131][132] In the Earth’s crust, the concentration of helium is 8 parts per billion. In seawater, the concentration is only 4 parts per trillion. There are also small amounts in mineral springs, volcanic gas, and meteoric iron. Because helium is trapped in the subsurface under conditions that also trap natural gas, the greatest natural concentrations of helium on the planet are found in natural gas, from which most commercial helium is extracted. The concentration varies in a broad range from a few ppm to more than 7% in a small gas field in San Juan County, New Mexico.[133][134]
As of 2021 the world’s helium reserves were estimated at 31 billion cubic meters, with a third of that being in Qatar.[135] In 2015 and 2016 additional probable reserves were announced to be under the Rocky Mountains in North America[136] and in the East African Rift.[137]
Modern extraction and distribution
For large-scale use, helium is extracted by fractional distillation from natural gas, which can contain as much as 7% helium.[138] Since helium has a lower boiling point than any other element, low temperature and high pressure are used to liquefy nearly all the other gases (mostly nitrogen and methane). The resulting crude helium gas is purified by successive exposures to lowering temperatures, in which almost all of the remaining nitrogen and other gases are precipitated out of the gaseous mixture. Activated charcoal is used as a final purification step, usually resulting in 99.995% pure Grade-A helium.[26] The principal impurity in Grade-A helium is neon. In a final production step, most of the helium that is produced is liquefied via a cryogenic process. This is necessary for applications requiring liquid helium and also allows helium suppliers to reduce the cost of long-distance transportation, as the largest liquid helium containers have more than five times the capacity of the largest gaseous helium tube trailers.[75][139]
In 2008, approximately 169 million standard cubic meters (SCM) of helium were extracted from natural gas or withdrawn from helium reserves with approximately 78% from the United States, 10% from Algeria, and most of the remainder from Russia, Poland and Qatar.[140] By 2013, increases in helium production in Qatar (under the company Qatargas managed by Air Liquide) had increased Qatar’s fraction of world helium production to 25%, and made it the second largest exporter after the United States.[141]
An estimated 54 billion cubic feet (1.5×109 m3) deposit of helium was found in Tanzania in 2016.[142] A large-scale helium plant was opened in Ningxia, China in 2020.[143]
In the United States, most helium is extracted from natural gas of the Hugoton and nearby gas fields in Kansas, Oklahoma, and the Panhandle Field in Texas.[75][144] Much of this gas was once sent by pipeline to the National Helium Reserve, but since 2005 this reserve is being depleted and sold off, and is expected to be largely depleted by 2021,[141] under the October 2013 Responsible Helium Administration and Stewardship Act (H.R. 527).[145]
Diffusion of crude natural gas through special semipermeable membranes and other barriers is another method to recover and purify helium.[146] In 1996, the U.S. had proven helium reserves, in such gas well complexes, of about 147 billion standard cubic feet (4.2 billion SCM).[147] At rates of use at that time (72 million SCM per year in the U.S.; see pie chart below) this would have been enough helium for about 58 years of U.S. use, and less than this (perhaps 80% of the time) at world use rates, although factors in saving and processing impact effective reserve numbers.
Helium must be extracted from natural gas because it is present in air at only a fraction of that of neon, yet the demand for it is far higher. It is estimated that if all neon production were retooled to save helium, 0.1% of the world’s helium demands would be satisfied. Similarly, only 1% of the world’s helium demands could be satisfied by re-tooling all air distillation plants.[148] Helium can be synthesized by bombardment of lithium or boron with high-velocity protons, or by bombardment of lithium with deuterons, but these processes are a completely uneconomical method of production.[149]
Helium is commercially available in either liquid or gaseous form. As a liquid, it can be supplied in small insulated containers called dewars which hold as much as 1,000 liters of helium, or in large ISO containers which have nominal capacities as large as 42 m3 (around 11,000 U.S. gallons). In gaseous form, small quantities of helium are supplied in high-pressure cylinders holding as much as 8 m3 (approx. 282 standard cubic feet), while large quantities of high-pressure gas are supplied in tube trailers which have capacities of as much as 4,860 m3 (approx. 172,000 standard cubic feet).
Conservation advocates
According to helium conservationists like Nobel laureate physicist Robert Coleman Richardson, writing in 2010, the free market price of helium has contributed to «wasteful» usage (e.g. for helium balloons). Prices in the 2000s had been lowered by the decision of the U.S. Congress to sell off the country’s large helium stockpile by 2015.[150] According to Richardson, the price needed to be multiplied by 20 to eliminate the excessive wasting of helium. In the paper Stop squandering helium published in 2012, it was also proposed to create an International Helium Agency that would build a sustainable market for «this precious commodity».[151]
Applications
The largest single use of liquid helium is to cool the superconducting magnets in modern MRI scanners.
Estimated 2014 U.S. fractional helium use by category. Total use is 34 million cubic meters.[152]
Cryogenics (32%)
Pressurizing and purging (18%)
Welding (13%)
Controlled atmospheres (18%)
Leak detection (4%)
Breathing mixtures (2%)
Other (13%)
While balloons are perhaps the best known use of helium, they are a minor part of all helium use.[70] Helium is used for many purposes that require some of its unique properties, such as its low boiling point, low density, low solubility, high thermal conductivity, or inertness. Of the 2014 world helium total production of about 32 million kg (180 million standard cubic meters) helium per year, the largest use (about 32% of the total in 2014) is in cryogenic applications, most of which involves cooling the superconducting magnets in medical MRI scanners and NMR spectrometers.[153] Other major uses were pressurizing and purging systems, welding, maintenance of controlled atmospheres, and leak detection. Other uses by category were relatively minor fractions.[152]
Controlled atmospheres
Helium is used as a protective gas in growing silicon and germanium crystals, in titanium and zirconium production, and in gas chromatography,[91] because it is inert. Because of its inertness, thermally and calorically perfect nature, high speed of sound, and high value of the heat capacity ratio, it is also useful in supersonic wind tunnels[154] and impulse facilities.[155]
Gas tungsten arc welding
Helium is used as a shielding gas in arc welding processes on materials that at welding temperatures are contaminated and weakened by air or nitrogen.[24] A number of inert shielding gases are used in gas tungsten arc welding, but helium is used instead of cheaper argon especially for welding materials that have higher heat conductivity, like aluminium or copper.
Minor uses
Industrial leak detection

A dual chamber helium leak detection machine
One industrial application for helium is leak detection. Because helium diffuses through solids three times faster than air, it is used as a tracer gas to detect leaks in high-vacuum equipment (such as cryogenic tanks) and high-pressure containers.[156] The tested object is placed in a chamber, which is then evacuated and filled with helium. The helium that escapes through the leaks is detected by a sensitive device (helium mass spectrometer), even at the leak rates as small as 10−9 mbar·L/s (10−10 Pa·m3/s). The measurement procedure is normally automatic and is called helium integral test. A simpler procedure is to fill the tested object with helium and to manually search for leaks with a hand-held device.[157]
Helium leaks through cracks should not be confused with gas permeation through a bulk material. While helium has documented permeation constants (thus a calculable permeation rate) through glasses, ceramics, and synthetic materials, inert gases such as helium will not permeate most bulk metals.[158]
Flight

Because of its low density and incombustibility, helium is the gas of choice to fill airships such as the Goodyear blimp.
Because it is lighter than air, airships and balloons are inflated with helium for lift. While hydrogen gas is more buoyant, and escapes permeating through a membrane at a lower rate, helium has the advantage of being non-flammable, and indeed fire-retardant. Another minor use is in rocketry, where helium is used as an ullage medium to displace fuel and oxidizers in storage tanks and to condense hydrogen and oxygen to make rocket fuel. It is also used to purge fuel and oxidizer from ground support equipment prior to launch and to pre-cool liquid hydrogen in space vehicles. For example, the Saturn V rocket used in the Apollo program needed about 370,000 m3 (13 million cubic feet) of helium to launch.[91]
Minor commercial and recreational uses
Helium as a breathing gas has no narcotic properties, so helium mixtures such as trimix, heliox and heliair are used for deep diving to reduce the effects of narcosis, which worsen with increasing depth.[159][160] As pressure increases with depth, the density of the breathing gas also increases, and the low molecular weight of helium is found to considerably reduce the effort of breathing by lowering the density of the mixture. This reduces the Reynolds number of flow, leading to a reduction of turbulent flow and an increase in laminar flow, which requires less work of breathing.[161][162] At depths below 150 metres (490 ft) divers breathing helium–oxygen mixtures begin to experience tremors and a decrease in psychomotor function, symptoms of high-pressure nervous syndrome.[163] This effect may be countered to some extent by adding an amount of narcotic gas such as hydrogen or nitrogen to a helium–oxygen mixture.[164]
Helium–neon lasers, a type of low-powered gas laser producing a red beam, had various practical applications which included barcode readers and laser pointers, before they were almost universally replaced by cheaper diode lasers.[24]
For its inertness and high thermal conductivity, neutron transparency, and because it does not form radioactive isotopes under reactor conditions, helium is used as a heat-transfer medium in some gas-cooled nuclear reactors.[156]
Helium, mixed with a heavier gas such as xenon, is useful for thermoacoustic refrigeration due to the resulting high heat capacity ratio and low Prandtl number.[165] The inertness of helium has environmental advantages over conventional refrigeration systems which contribute to ozone depletion or global warming.[166]
Helium is also used in some hard disk drives.[167]
Scientific uses
The use of helium reduces the distorting effects of temperature variations in the space between lenses in some telescopes, due to its extremely low index of refraction.[26] This method is especially used in solar telescopes where a vacuum tight telescope tube would be too heavy.[168][169]
Helium is a commonly used carrier gas for gas chromatography.
The age of rocks and minerals that contain uranium and thorium can be estimated by measuring the level of helium with a process known as helium dating.[24][26]
Helium at low temperatures is used in cryogenics, and in certain cryogenics applications. As examples of applications, liquid helium is used to cool certain metals to the extremely low temperatures required for superconductivity, such as in superconducting magnets for magnetic resonance imaging. The Large Hadron Collider at CERN uses 96 metric tons of liquid helium to maintain the temperature at 1.9 K (−271.25 °C; −456.25 °F).[170]
Medical uses
Helium was approved for medical use in the United States in April 2020 for humans and animals.[171][172]
As a contaminant
While chemically inert, helium contamination impairs the operation of microelectromechanical systems (MEMS) such that iPhones may fail.[173]
Inhalation and safety
Effects
Neutral helium at standard conditions is non-toxic, plays no biological role and is found in trace amounts in human blood.

The effect of helium on a human voice
The speed of sound in helium is nearly three times the speed of sound in air. Because the natural resonance frequency of a gas-filled cavity is proportional to the speed of sound in the gas, when helium is inhaled, a corresponding increase occurs in the resonant frequencies of the vocal tract, which is the amplifier of vocal sound.[24][174] This increase in the resonant frequency of the amplifier (the vocal tract) gives an increased amplification to the high-frequency components of the sound wave produced by the direct vibration of the vocal folds, compared to the case when the voice box is filled with air. When a person speaks after inhaling helium gas, the muscles that control the voice box still move in the same way as when the voice box is filled with air, therefore the fundamental frequency (sometimes called pitch) produced by direct vibration of the vocal folds does not change.[175] However, the high-frequency-preferred amplification causes a change in timbre of the amplified sound, resulting in a reedy, duck-like vocal quality. The opposite effect, lowering resonant frequencies, can be obtained by inhaling a dense gas such as sulfur hexafluoride or xenon.
Hazards
Inhaling helium can be dangerous if done to excess, since helium is a simple asphyxiant and so displaces oxygen needed for normal respiration.[24][176] Fatalities have been recorded, including a youth who suffocated in Vancouver in 2003 and two adults who suffocated in South Florida in 2006.[177][178] In 1998, an Australian girl from Victoria fell unconscious and temporarily turned blue after inhaling the entire contents of a party balloon.[179][180][181]
Inhaling helium directly from pressurized cylinders or even balloon filling valves is extremely dangerous, as high flow rate and pressure can result in barotrauma, fatally rupturing lung tissue.[176][182]
Death caused by helium is rare. The first media-recorded case was that of a 15-year-old girl from Texas who died in 1998 from helium inhalation at a friend’s party; the exact type of helium death is unidentified.[179][180][181]
In the United States only two fatalities were reported between 2000 and 2004, including a man who died in North Carolina of barotrauma in 2002.[177][182] A youth asphyxiated in Vancouver during 2003, and a 27-year-old man in Australia had an embolism after breathing from a cylinder in 2000.[177] Since then two adults asphyxiated in South Florida in 2006,[177][178][183] and there were cases in 2009 and 2010, one a Californian youth who was found with a bag over his head, attached to a helium tank,[184] and another teenager in Northern Ireland died of asphyxiation.[185] At Eagle Point, Oregon a teenage girl died in 2012 from barotrauma at a party.[186][187][188] A girl from Michigan died from hypoxia later in the year.[189]
On February 4, 2015, it was revealed that, during the recording of their main TV show on January 28, a 12-year-old member (name withheld) of Japanese all-girl singing group 3B Junior suffered from air embolism, losing consciousness and falling into a coma as a result of air bubbles blocking the flow of blood to the brain, after inhaling huge quantities of helium as part of a game. The incident was not made public until a week later.[190][191] The staff of TV Asahi held an emergency press conference to communicate that the member had been taken to the hospital and is showing signs of rehabilitation such as moving eyes and limbs, but her consciousness has not yet been sufficiently recovered. Police have launched an investigation due to a neglect of safety measures.[192][193]
The safety issues for cryogenic helium are similar to those of liquid nitrogen; its extremely low temperatures can result in cold burns, and the liquid-to-gas expansion ratio can cause explosions if no pressure-relief devices are installed. Containers of helium gas at 5 to 10 K should be handled as if they contain liquid helium due to the rapid and significant thermal expansion that occurs when helium gas at less than 10 K is warmed to room temperature.[91]
At high pressures (more than about 20 atm or two MPa), a mixture of helium and oxygen (heliox) can lead to high-pressure nervous syndrome, a sort of reverse-anesthetic effect; adding a small amount of nitrogen to the mixture can alleviate the problem.[194][163]
See also
- Abiogenic petroleum origin
- Helium-3 propulsion
- Leidenfrost effect
- Superfluid
- Tracer-gas leak testing method
- Hamilton Cady
Notes
- ^ A few authors dispute the placement of helium in the noble gas column, preferring to place it above beryllium with the alkaline earth metals. They do so on the grounds of helium’s 1s2 electron configuration, which is analogous to the ns2 valence configurations of the alkaline earth metals, and furthermore point to some specific trends that are more regular with helium over beryllium.[5][6][7][8][9] However, the classification of helium with the other noble gases remains near-universal, as its extraordinary inertness is extremely close to that of the other light noble gases neon and argon.[10]
References
- ^ «Standard Atomic Weights: Helium». CIAAW. 1983.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Grochala, Wojciech (1 November 2017). «On the position of helium and neon in the Periodic Table of Elements». Foundations of Chemistry. 20 (2018): 191–207. doi:10.1007/s10698-017-9302-7.
- ^ Bent Weberg, Libby (18 January 2019). ««The» periodic table». Chemical & Engineering News. 97 (3). Retrieved 27 March 2020.
- ^ Grandinetti, Felice (23 April 2013). «Neon behind the signs». Nature Chemistry. 5 (2013): 438. Bibcode:2013NatCh…5..438G. doi:10.1038/nchem.1631. PMID 23609097. Retrieved 27 March 2019.
- ^ Kurushkin, Mikhail (2020). «Helium’s placement in the Periodic Table from a crystal structure viewpoint». IUCrJ. 7 (4): 577–578. doi:10.1107/S2052252520007769. PMC 7340260. PMID 32695406. Retrieved 19 June 2020.
- ^ Labarca, Martín; Srivaths, Akash (2016). «On the Placement of Hydrogen and Helium in the Periodic System: A New Approach». Bulgarian Journal of Science Education. 25 (4): 514–530. Retrieved 19 June 2020.
- ^ Lewars, Errol G. (5 December 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. pp. 69–71. ISBN 978-1-4020-6973-4. Archived from the original on 19 May 2016.
- ^ Rayet, G. (1868) «Analyse spectral des protubérances observées, pendant l’éclipse totale de Soleil visible le 18 août 1868, à la presqu’île de Malacca» (Spectral analysis of the protuberances observed during the total solar eclipse, seen on 18 August 1868, from the Malacca peninsula), Comptes rendus … , 67 : 757–759. From p. 758: » … je vis immédiatement une série de neuf lignes brillantes qui … me semblent devoir être assimilées aux lignes principales du spectre solaire, B, D, E, b, une ligne inconnue, F, et deux lignes du groupe G.» ( … I saw immediately a series of nine bright lines that … seemed to me should be classed as the principal lines of the solar spectrum, B, D, E, b, an unknown line, F, and two lines of the group G.)
- ^ Captain C. T. Haig (1868) «Account of spectroscopic observations of the eclipse of the sun, August 18th, 1868» Proceedings of the Royal Society of London, 17 : 74–80. From p. 74: «I may state at once that I observed the spectra of two red flames close to each other, and in their spectra two broad bright bands quite sharply defined, one rose-madder and the other light golden.»
- ^ Pogson filed his observations of the 1868 eclipse with the local Indian government, but his report wasn’t published. (Biman B. Nath, The Story of Helium and the Birth of Astrophysics (New York, New York: Springer, 2013), p. 8.) Nevertheless, Lockyer quoted from his report. From p. 320 Archived 17 August 2018 at the Wayback Machine of Lockyer, J. Norman (1896) «The story of helium. Prologue,» Nature, 53 : 319–322 : «Pogson, in referring to the eclipse of 1868, said that the yellow line was «at D, or near D.» «
- ^ Lieutenant John Herschel (1868) «Account of the solar eclipse of 1868, as seen at Jamkandi in the Bombay Presidency,» Proceedings of the Royal Society of London, 17 : 104–120. From p. 113: As the moment of the total solar eclipse approached, » … I recorded an increasing brilliancy in the spectrum in the neighborhood of D, so great in fact as to prevent any measurement of that line till an opportune cloud moderated the light. I am not prepared to offer any explanation of this.» From p. 117: «I also consider that there can be no question that the ORANGE LINE was identical with D, so far as the capacity of the instrument to establish any such identity is concerned.»
- ^ In his initial report to the French Academy of Sciences about the 1868 eclipse, Janssen made no mention of a yellow line in the solar spectrum. See:
- Janssen (1868) «Indication de quelques-uns des résultats obtenus à Cocanada, pendant l’éclipse du mois d’août dernier, et à la suite de cette éclipse» (Information on some of the results obtained at Cocanada, during the eclipse of the month of last August, and following that eclipse), Comptes rendus … , 67 : 838–839.
- Wheeler M. Sears, Helium: The Disappearing Element (Heidelberg, Germany: Springer, 2015), p. 44.
- Françoise Launay with Storm Dunlop, trans., The Astronomer Jules Janssen: A Globetrotter of Celestial Physics (Heidelberg, Germany: Springer, 2012), p. 45.
However, subsequently, in an unpublished letter of 19 December 1868 to Charles Sainte-Claire Deville, Janssen asked Deville to inform the French Academy of Sciences that : «Several observers have claimed the bright D line as forming part of the spectrum of the prominences on 18 August. The bright yellow line did indeed lie very close to D, but the light was more refrangible [i.e., of shorter wavelength] than those of the D lines. My subsequent studies of the Sun have shown the accuracy of what I state here.» (See: (Launay, 2012), p. 45.)
- ^ a b «Cleveite». Mindat.org. Retrieved 14 February 2020.
- ^ «Uraninite». Mindat.org. Retrieved 14 February 2020.
- ^ Rose, Melinda (October 2008). «Helium: Up, Up and Away?». Photonics Spectra. Archived from the original on 22 August 2010. Retrieved 27 February 2010. For a more authoritative but older 1996 pie chart showing U.S. helium use by sector, showing much the same result, see the chart reproduced in «Applications» section of this article.
- ^ Connor, Steve (23 August 2010). «Why the world is running out of helium». The Independent. London. Archived from the original on 27 September 2013. Retrieved 16 September 2013.
- ^ Siegel, Ethan (12 December 2012). «Why the World Will Run Out of Helium». Starts with a Bang. Scienceblogs.com. Archived from the original on 14 September 2013. Retrieved 16 September 2013.
- ^ Szondy, David (24 August 2015). «We may not be running out of helium after all». www.gizmag.com. Archived from the original on 25 March 2016. Retrieved 1 April 2016.
- ^ Sample, Ian (28 June 2016). «Huge helium gas find in east Africa averts medical shortage». The Guardian. Archived from the original on 29 June 2016. Retrieved 29 June 2016.
- ^ Kochhar, R. K. (1991). «French astronomers in India during the 17th – 19th centuries». Journal of the British Astronomical Association. 101 (2): 95–100. Bibcode:1991JBAA..101…95K.
- ^ a b c d e f g h i j k l Emsley, John (2001). Nature’s Building Blocks. Oxford: Oxford University Press. pp. 175–179. ISBN 978-0-19-850341-5.
- ^ Lockyer, J. N. (October 1868). «Notice of an observation of the spectrum of a solar prominence». Proceedings of the Royal Society of London. 17: 91–92. Bibcode:1868RSPS…17…91L. doi:10.1098/rspl.1868.0011. JSTOR 112357. S2CID 163097539. Retrieved 3 June 2018.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Hampel, Clifford A. (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256–268. ISBN 978-0-442-15598-8.
- ^ Harper, Douglas. «helium». Online Etymology Dictionary.
- ^ Thomson, William (August 3, 1871). «Inaugural Address of Sir William Thomson». Nature. 4 (92): 261–278 [268]. Bibcode:1871Natur…4..261.. doi:10.1038/004261a0. PMC 2070380. Archived from the original on December 2, 2016. Retrieved February 22, 2016.
Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium
- ^ Palmieri, Luigi (1881). «La riga dell’Helium apparsa in una recente sublimazione vesuviana» [The line of helium appeared in a recently sublimated material [from Mt.] Vesuvius.]. Rendiconto dell’Accademia delle Scienze Fisiche e Matematiche (Naples, Italy). 20: 223. Archived from the original on 1 September 2018. Retrieved 1 May 2017.
Raccolsi alcun tempo fa una sostanza amorfa di consistenza butirracea e di colore giallo sbiadato sublimata sull’orlo di una fumarola prossima alla bocca di eruzione. Saggiata questa sublimazione allo spettroscopio, ho ravvisato le righe del sodio e del potassio ed una lineare ben distinta che corrisponde esattamente alla D3 che è quella dell’Helium. Do per ora il semplice annunzio del fatto, proponendomi di ritornare sopra questo argomento, dopo di aver sottoposta la sublimazione ad una analisi chimica. (I collected some time ago an amorphous substance having a buttery consistency and a faded yellow color which had sublimated on the rim of a fumarole near the mouth of the eruption. Having analyzed this sublimated substance with a spectroscope, I recognized the lines of sodium and potassium and a very distinct linear line which corresponds exactly to D3, which is that of helium. For the present, I’m making a mere announcement of the fact, proposing to return to this subject after having subjected the sublimate to a chemical analysis.)
- ^ Kirk, Wendy L. «Cleveite [not Clevite] and helium». Museums & Collections Blog. University College London. Archived from the original on 18 October 2018. Retrieved 18 August 2017.
- ^ Ramsay, William (1895). «On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3, One of the Lines in the Coronal Spectrum. Preliminary Note». Proceedings of the Royal Society of London. 58 (347–352): 65–67. Bibcode:1895RSPS…58…65R. doi:10.1098/rspl.1895.0006. S2CID 129872109.
- ^ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part I». Proceedings of the Royal Society of London. 58 (347–352): 81–89. Bibcode:1895RSPS…58…80R. doi:10.1098/rspl.1895.0010.
- ^ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part II – Density». Proceedings of the Royal Society of London. 59 (1): 325–330. Bibcode:1895RSPS…59..325R. doi:10.1098/rspl.1895.0097. S2CID 96589261.
- ^ Lockyer, J. Norman (1895). «On the new gas obtained from uraninite. Preliminary note, part II». Proceedings of the Royal Society of London. 58 (347–352): 67–70. doi:10.1098/rspl.1895.0008.
- ^ See:
- Crookes, William (1895). «The spectrum of the gas from clèveite». The Chemical News and Journal of Physical Science. 71 (1844): 151.
- Crookes, William (1895). «The spectrum of helium». The Chemical News and Journal of Physical Science. 72 (1865): 87–89.
- ^ See:
- Clève, P.T. (1895). «Sur la présence de l’hélium dans le clévéite» [On the presence of helium in cleveite]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 120: 834.
- English translation: Clève, P.T. (1895). «On the presence of helium in clèveite». The Chemical News and Journal of Physical Science. 71 (1849): 212.
- Thorpe, T. E. (1895). «Terrestrial helium?». Nature. 51 (1329): 586.
- Clève (1895). «Sur la densité de l’hélium» [On the density of helium]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 120: 1212.
- ^ Langlet, N. A. (1895). «Das Atomgewicht des Heliums» [The atomic weight of helium]. Zeitschrift für Anorganische Chemie (in German). 10 (1): 289–292. doi:10.1002/zaac.18950100130.
- ^ Weaver, E.R. (1919). Circular of the Bureau of Standards No. 81: Bibliography of Scientific Literature Relating to Helium (PDF). Washington, D.C., USA: U.S. Government Printing Office. p. 6.
- ^ Hillebrand (1890) «On the occurrence of nitrogen in uraninite and on the composition of uraninite in general,» Bulletin of the U.S. Geological Survey, no. 78, pp. 43–79.
- ^ Munday, Pat (1999). John A. Garraty; Mark C. Carnes (eds.). Biographical entry for W.F. Hillebrand (1853–1925), geochemist and U.S. Bureau of Standards administrator in American National Biography. Vol. 10–11. Oxford University Press. pp. 808–9, 227–8.
- ^ Rutherford, E.; Royds, T. (1908). «XXIV.Spectrum of the radium emanation». Philosophical Magazine. series 6. 16 (92): 313–317. doi:10.1080/14786440808636511.
- ^ Onnes, H. Kamerlingh (1908) «The liquefaction of helium,» Communications from the Physical Laboratory at the University of Leiden, 9 (108) : 1–23.
- ^ van Delft, Dirk (2008). «Little cup of Helium, big Science» (PDF). Physics Today. 61 (3): 36–42. Bibcode:2008PhT….61c..36V. doi:10.1063/1.2897948. Archived from the original (PDF) on June 25, 2008. Retrieved 2008-07-20.
- ^ See:
- Preliminary notice: Keesom, W. H. (17 July 1926) Letters to the Editor: «Solidification of helium,» Nature, 118 : 81.
- Preliminary notice: Keesom, W. H. (1926) «L’hélium solidifié,» Archived 2016-10-22 at the Wayback Machine Comptes rendus … , 183 : 26.
- Keesom, W. H. (1926) «Solid Helium,» Communications from the Physical Laboratory at the University of Leiden, 17 (184) .
- ^ «Coldest Cold». Time Inc. 1929-06-10. Archived from the original on 2008-12-06. Retrieved 2008-07-27.
- ^ a b Hoyer, Ulrich (1981). «Constitution of Atoms and Molecules». In Hoyer, Ulrich (ed.). Niels Bohr – Collected Works: Volume 2 – Work on Atomic Physics (1912–1917). Amsterdam: North Holland Publishing Company. pp. 103–316 (esp. pp. 116–122). ISBN 978-0720418002.
- ^ Kennedy, P. J. (1985). «A Short Biography». In French, A. P.; Kennedy, P. J. (eds.). Niels Bohr: A Centenary Volume. Harvard University Press. pp. 3–15. ISBN 978-0-674-62415-3.
- ^ Bohr, N. (1913). «On the constitution of atoms and molecules, part I» (PDF). Philosophical Magazine. 26 (151): 1–25. Bibcode:1913PMag…26….1B. doi:10.1080/14786441308634955. Archived (PDF) from the original on 2019-04-04. Retrieved 2017-12-27.
Bohr, N. (1913). «On the constitution of atoms and molecules, part II: Systems Containing Only a Single Nucleus» (PDF). Philosophical Magazine. 26 (153): 476–502. Bibcode:1913PMag…26..476B. doi:10.1080/14786441308634993. Archived (PDF) from the original on 2017-12-15. Retrieved 2017-12-27.
Bohr, N. (1913). «On the constitution of atoms and molecules, part III: Systems containing several nuclei». Philosophical Magazine. 26 (155): 857–875. Bibcode:1913PMag…26..857B. doi:10.1080/14786441308635031. - ^ a b c Robotti, Nadia (1983). «The Spectrum of ζ Puppis and the Historical Evolution of Empirical Data». Historical Studies in the Physical Sciences. 14 (1): 123–145. doi:10.2307/27757527. JSTOR 27757527.
- ^ Pickering, E. C. (1896). «Stars having peculiar spectra. New variable stars in Crux and Cygnus». Harvard College Observatory Circular. 12: 1–2. Bibcode:1896HarCi..12….1P. Also published as: Pickering, E. C.; Fleming, W. P. (1896). «Stars having peculiar spectra. New variable stars in Crux and Cygnus». Astrophysical Journal. 4: 369–370. Bibcode:1896ApJ…..4..369P. doi:10.1086/140291.
- ^ Wright, W. H. (1914). «The relation between the Wolf–Rayet stars and the planetary nebulae». Astrophysical Journal. 40: 466–472. Bibcode:1914ApJ….40..466W. doi:10.1086/142138.
- ^ Pickering, E. C. (1897). «Stars having peculiar spectra. New variable Stars in Crux and Cygnus». Astronomische Nachrichten. 142 (6): 87–90. Bibcode:1896AN….142…87P. doi:10.1002/asna.18971420605. Archived (PDF) from the original on 2019-08-24. Retrieved 2019-08-24.
- ^ Pickering, E. C. (1897). «The spectrum of zeta Puppis». Astrophysical Journal. 5: 92–94. Bibcode:1897ApJ…..5…92P. doi:10.1086/140312.
- ^ Lakatos, Imre (1980). «Bohr: A Research Programme Progressing on Inconsistent Foundations». In Worrall, John; Currie, Gregory (eds.). The Methodology of Scientific Research Programmes. Cambridge University Press. pp. 55–68. ISBN 9780521280310.
- ^ Fowler, A. (1912). «Observations of the Principal and other Series of Lines in the Spectrum of Hydrogen». Monthly Notices of the Royal Astronomical Society. 73 (2): 62–63. Bibcode:1912MNRAS..73…62F. doi:10.1093/mnras/73.2.62.
- ^ Bohr, N. (1913). «The Spectra of Helium and Hydrogen». Nature. 92 (2295): 231–232. Bibcode:1913Natur..92..231B. doi:10.1038/092231d0. S2CID 11988018.
- ^ Fowler, A. (1913). «The Spectra of Helium and Hydrogen». Nature. 92 (2291): 95–96. Bibcode:1913Natur..92…95F. doi:10.1038/092095b0. S2CID 3972599.
- ^ Fowler, A. (1913). «Reply to: The Spectra of Helium and Hydrogen». Nature. 92 (2295): 232–233. Bibcode:1913Natur..92..232F. doi:10.1038/092232a0. S2CID 3981817.
- ^ Bohr, N. (1915). «The Spectra of Hydrogen and Helium». Nature. 95 (6–7): 6–7. Bibcode:1915Natur..95….6B. doi:10.1038/095006a0. S2CID 3947572.
- ^ Kapitza, P. (1938). «Viscosity of Liquid Helium below the λ-Point». Nature. 141 (3558): 74. Bibcode:1938Natur.141…74K. doi:10.1038/141074a0. S2CID 3997900.
- ^ Osheroff, D. D.; Richardson, R. C.; Lee, D. M. (1972). «Evidence for a New Phase of Solid He3«. Phys. Rev. Lett. 28 (14): 885–888. Bibcode:1972PhRvL..28..885O. doi:10.1103/PhysRevLett.28.885. S2CID 89609083.
- ^ McFarland, D. F. (1903). «Composition of Gas from a Well at Dexter, Kan». Transactions of the Kansas Academy of Science. 19: 60–62. doi:10.2307/3624173. JSTOR 3624173.
- ^ «Discovery of Helium in Natural Gas at the University of Kansas». National Historic Chemical Landmarks. American Chemical Society. Archived from the original on 2014-02-26. Retrieved 2014-02-21.
- ^ Cady, H. P.; McFarland, D. F. (1906). «Helium in Natural Gas». Science. 24 (611): 344. Bibcode:1906Sci….24..344D. doi:10.1126/science.24.611.344. PMID 17772798. S2CID 27441003.
- ^ Cady, H. P.; McFarland, D. F. (1906). «Helium in Kansas Natural Gas». Transactions of the Kansas Academy of Science. 20: 80–81. doi:10.2307/3624645. JSTOR 3624645.
- ^ Emme, Eugene M. comp., ed. (1961). «Aeronautics and Astronautics Chronology, 1920–1924». Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915–1960. Washington, D.C.: NASA. pp. 11–19.
- ^ Hilleret, N. (1999). «Leak Detection» (PDF). In S. Turner (ed.). CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999. Geneva, Switzerland: CERN. pp. 203–212.
At the origin of the helium leak detection method was the Manhattan Project and the unprecedented leak-tightness requirements needed by the uranium enrichment plants. The required sensitivity needed for the leak checking led to the choice of a mass spectrometer designed by Dr. A.O.C. Nier tuned on the helium mass.
- ^ Williamson, John G. (1968). «Energy for Kansas». Transactions of the Kansas Academy of Science. 71 (4): 432–438. doi:10.2307/3627447. JSTOR 3627447.
- ^ «Conservation Helium Sale» (PDF). Federal Register. 70 (193): 58464. 2005-10-06. Archived (PDF) from the original on 2008-10-31. Retrieved 2008-07-20.
- ^ a b Stwertka, Albert (1998). Guide to the Elements: Revised Edition. New York; Oxford University Press, p. 24. ISBN 0-19-512708-0
- ^ Pub. L. 104–273: Helium Privatization Act of 1996 (text) (PDF)
- ^ Executive Summary. nap.edu. 2000. doi:10.17226/9860. ISBN 978-0-309-07038-6. Archived from the original on 2008-03-27. Retrieved 2008-07-20.
- ^ Mullins, P. V.; Goodling, R. M. (1951). Helium. Bureau of Mines / Minerals yearbook 1949. pp. 599–602. Archived from the original on 2008-12-06. Retrieved 2008-07-20.
- ^ «Helium End User Statistic» (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2008-09-21. Retrieved 2008-07-20.
- ^ a b c Smith, E. M.; Goodwin, T. W.; Schillinger, J. (2003). «Challenges to the Worldwide Supply of Helium in the Next Decade». Advances in Cryogenic Engineering. 49. A (710): 119–138. Bibcode:2004AIPC..710..119S. doi:10.1063/1.1774674. S2CID 109060534.
- ^ Kaplan, Karen H. (June 2007). «Helium shortage hampers research and industry». Physics Today. American Institute of Physics. 60 (6): 31–32. Bibcode:2007PhT….60f..31K. doi:10.1063/1.2754594.
- ^ Basu, Sourish (October 2007). Yam, Philip (ed.). «Updates: Into Thin Air». Scientific American. Vol. 297, no. 4. Scientific American, Inc. p. 18. Archived from the original on 2008-12-06. Retrieved 2008-08-04.
- ^ a b c Newcomb, Tim (21 August 2012). «There’s a Helium Shortage On—and It’s Affecting More than Just Balloons». Time.com. Archived from the original on 29 December 2013. Retrieved 2013-09-16.
- ^ «Air Liquide | the world leader in gases, technologies and services for Industry and Health». 19 February 2015. Archived from the original on 2014-09-14. Retrieved 2015-05-25. Air Liquide Press Release.
- ^ «Middle East turmoil is disrupting a vital resource for nuclear energy, space flight and birthday balloons». washingtonpost.com. 26 June 2017. Archived from the original on 26 June 2017. Retrieved 26 June 2017.
- ^ Cockerill, Rob (25 December 2014). «2015 – What lies ahead? Part 1». Gasworld. Archived from the original on 2015-01-17. Retrieved 15 September 2021.
- ^ «Will Air Products’ (APD) Earnings Surprise Estimates in Q2? — Analyst Blog». NASDAQ.com. April 28, 2015. Archived from the original on July 15, 2019. Retrieved August 4, 2019.
- ^ Watkins, Thayer. «The Old Quantum Physics of Niels Bohr and the Spectrum of Helium: A Modified Version of the Bohr Model». San Jose State University. Archived from the original on 2009-05-26. Retrieved 2009-06-24.
- ^ Vangioni-Flam, E.; Cassé, M. (1999). «Cosmic lithium-beryllium-boron story». Astrophysics and Space Science. 265: 77–86. arXiv:astro-ph/9902073. Bibcode:1999Ap&SS.265…77V. doi:10.1023/A:1002197712862. S2CID 10627727.
- ^ Lewars, Errol G. (2008). Modelling Marvels. Springer. pp. 70–71. Bibcode:2008moma.book…..L. ISBN 978-1-4020-6972-7.
- ^ Weiss, Ray F. (1971). «Solubility of helium and neon in water and seawater». J. Chem. Eng. Data. 16 (2): 235–241. doi:10.1021/je60049a019.
- ^ Scharlin, P.; Battino, R.; Silla, E.; Tuñón, I.; Pascual-Ahuir, J. L. (1998). «Solubility of gases in water: Correlation between solubility and the number of water molecules in the first solvation shell». Pure and Applied Chemistry. 70 (10): 1895–1904. doi:10.1351/pac199870101895. S2CID 96604119.
- ^ Stone, Jack A.; Stejskal, Alois (2004). «Using helium as a standard of refractive index: correcting errors in a gas refractometer». Metrologia. 41 (3): 189–197. Bibcode:2004Metro..41..189S. doi:10.1088/0026-1394/41/3/012. S2CID 250809634.
- ^ Buhler, F.; Axford, W. I.; Chivers, H. J. A.; Martin, K. (1976). «Helium isotopes in an aurora». J. Geophys. Res. 81 (1): 111–115. Bibcode:1976JGR….81..111B. doi:10.1029/JA081i001p00111.
- ^ «Solid Helium». Department of Physics University of Alberta. 2005-10-05. Archived from the original on May 31, 2008. Retrieved 2008-07-20.
- ^ a b c d e Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Grilly, E. R. (1973). «Pressure-volume-temperature relations in liquid and solid 4He». Journal of Low Temperature Physics. 11 (1–2): 33–52. Bibcode:1973JLTP…11…33G. doi:10.1007/BF00655035. S2CID 189850188.
- ^ Henshaw, D. B. (1958). «Structure of Solid Helium by Neutron Diffraction». Physical Review Letters. 109 (2): 328–330. Bibcode:1958PhRv..109..328H. doi:10.1103/PhysRev.109.328.
- ^ Pinceaux, J.-P.; Maury, J.-P.; Besson, J.-M. (1979). «Solidification of helium, at room temperature under high pressure» (PDF). Journal de Physique Lettres. 40 (13): 307–308. doi:10.1051/jphyslet:019790040013030700. S2CID 40164915.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 6-120. ISBN 0-8493-0486-5.
- ^ Hohenberg, P. C.; Martin, P. C. (2000). «Microscopic Theory of Superfluid Helium». Annals of Physics. 281 (1–2): 636–705 12091211. Bibcode:2000AnPhy.281..636H. doi:10.1006/aphy.2000.6019.
- ^ Warner, Brent. «Introduction to Liquid Helium». NASA. Archived from the original on 2005-09-01. Retrieved 2007-01-05.
- ^ Fairbank, H. A.; Lane, C. T. (1949). «Rollin Film Rates in Liquid Helium». Physical Review. 76 (8): 1209–1211. Bibcode:1949PhRv…76.1209F. doi:10.1103/PhysRev.76.1209.
- ^ Rollin, B. V.; Simon, F. (1939). «On the ‘film’ phenomenon of liquid helium II». Physica. 6 (2): 219–230. Bibcode:1939Phy…..6..219R. doi:10.1016/S0031-8914(39)80013-1.
- ^ Ellis, Fred M. (2005). «Third sound». Wesleyan Quantum Fluids Laboratory. Archived from the original on 2007-06-21. Retrieved 2008-07-23.
- ^ Bergman, D. (1949). «Hydrodynamics and Third Sound in Thin He II Films». Physical Review. 188 (1): 370–384. Bibcode:1969PhRv..188..370B. doi:10.1103/PhysRev.188.370.
- ^ a b Weiss, Achim. «Elements of the past: Big Bang Nucleosynthesis and observation». Max Planck Institute for Gravitational Physics. Archived from the original on 2010-07-29. Retrieved 2008-06-23.; Coc, Alain; Vangioni-Flam, Elisabeth; Descouvemont, Pierre; Adahchour, Abderrahim; Angulo, Carmen (2004). «Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements». Astrophysical Journal. 600 (2): 544–552. arXiv:astro-ph/0309480. Bibcode:2004ApJ…600..544C. doi:10.1086/380121. S2CID 16276658.
- ^ a b Anderson, Don L.; Foulger, G. R.; Meibom, A. (2006-09-02). «Helium Fundamentals». MantlePlumes.org. Archived from the original on 2007-02-08. Retrieved 2008-07-20.
- ^ Novick, Aaron (1947). «Half-Life of Tritium». Physical Review. 72 (10): 972. Bibcode:1947PhRv…72..972N. doi:10.1103/PhysRev.72.972.2.
- ^ Zastenker, G. N.; Salerno, E.; Buehler, F.; Bochsler, P.; Bassi, M.; Agafonov, Yu. N.; Eisomont, N. A.; Khrapchenkov, V. V.; et al. (2002). «Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements». Astrophysics. 45 (2): 131–142. Bibcode:2002Ap…..45..131Z. doi:10.1023/A:1016057812964. S2CID 116957905.
- ^ «Lunar Mining of Helium-3». Fusion Technology Institute of the University of Wisconsin-Madison. 2007-10-19. Archived from the original on 2010-06-09. Retrieved 2008-07-09.
- ^ Slyuta, E. N.; Abdrakhimov, A. M.; Galimov, E. M. (2007). «The estimation of helium-3 probable reserves in lunar regolith» (PDF). Lunar and Planetary Science Conference (1338): 2175. Bibcode:2007LPI….38.2175S. Archived (PDF) from the original on 2008-07-05. Retrieved 2008-07-20.
- ^ Hedman, Eric R. (2006-01-16). «A fascinating hour with Gerald Kulcinski». The Space Review. Archived from the original on 2011-01-09. Retrieved 2008-07-20.
- ^ Zu, H.; Dai, W.; de Waele, A.T.A.M. (2022). «Development of Dilution refrigerators – A review». Cryogenics. 121. Bibcode:2022Cryo..121….1Z. doi:10.1016/j.cryogenics.2021.103390. ISSN 0011-2275. S2CID 244005391.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ Hiby, Julius W. (1939). «Massenspektrographische Untersuchungen an Wasserstoff- und Heliumkanalstrahlen (H+
3, H−
2, HeH+
, HeD+
, He−
)». Annalen der Physik. 426 (5): 473–487. Bibcode:1939AnP…426..473H. doi:10.1002/andp.19394260506. - ^ Friedrich, Bretislav (8 April 2013). «A Fragile Union Between Li and He Atoms». Physics. Vol. 6. p. 42. Bibcode:2013PhyOJ…6…42F. doi:10.1103/Physics.6.42. hdl:11858/00-001M-0000-000E-F3CF-5. Archived from the original on 29 August 2017. Retrieved 24 August 2019.
- ^ Wong, Ming Wah (2000). «Prediction of a Metastable Helium Compound: HHeF». Journal of the American Chemical Society. 122 (26): 6289–6290. doi:10.1021/ja9938175.
- ^ Grochala, W. (2009). «On Chemical Bonding Between Helium and Oxygen». Polish Journal of Chemistry. 83: 87–122.
- ^ «Collapse of helium’s chemical nobility predicted by Polish chemist» (PDF). Archived from the original (PDF) on 2009-03-19. Retrieved 2009-05-15.
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Poreda, Robert J. (1993). «Stable Compounds of Helium and Neon: He@C60 and Ne@C60«. Science. 259 (5100): 1428–1430. Bibcode:1993Sci…259.1428S. doi:10.1126/science.259.5100.1428. PMID 17801275. S2CID 41794612.
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Freedberg, Darón I.; Anet, Frank A. L. (1994). «Probing the interior of fullerenes by 3He NMR spectroscopy of endohedral 3He@C60 and 3He@C70«. Nature. 367 (6460): 256–258. Bibcode:1994Natur.367..256S. doi:10.1038/367256a0. S2CID 4273677.
- ^ Vos, W. L.; Finger, L. W.; Hemley, R. J.; Hu, J. Z.; Mao, H. K.; Schouten, J. A. (1992). «A high-pressure van der Waals compound in solid nitrogen-helium mixtures». Nature. 358 (6381): 46–48. Bibcode:1992Natur.358…46V. doi:10.1038/358046a0. S2CID 4313676.
- ^ Dong, Xiao; Oganov, Artem R.; Goncharov, Alexander F.; Stavrou, Elissaios; Lobanov, Sergey; Saleh, Gabriele; Qian, Guang-Rui; Zhu, Qiang; Gatti, Carlo; Deringer, Volker L.; Dronskowski, Richard; Zhou, Xiang-Feng; Prakapenka, Vitali B.; Konôpková, Zuzana; Popov, Ivan A.; Boldyrev, Alexander I.; Wang, Hui-Tian (2017). «A stable compound of helium and sodium at high pressure». Nature Chemistry. 9 (5): 440–445. arXiv:1309.3827. Bibcode:2017NatCh…9..440D. doi:10.1038/nchem.2716. ISSN 1755-4330. PMID 28430195. S2CID 20459726.
- ^ Oliver, B. M.; Bradley, James G. (1984). «Helium concentration in the Earth’s lower atmosphere». Geochimica et Cosmochimica Acta. 48 (9): 1759–1767. Bibcode:1984GeCoA..48.1759O. doi:10.1016/0016-7037(84)90030-9.
- ^ «The Atmosphere: Introduction». JetStream – Online School for Weather. National Weather Service. 2007-08-29. Archived from the original on January 13, 2008. Retrieved 2008-07-12.
- ^ Lie-Svendsen, Ø.; Rees, M. H. (1996). «Helium escape from the terrestrial atmosphere: The ion outflow mechanism». Journal of Geophysical Research. 101 (A2): 2435–2444. Bibcode:1996JGR…101.2435L. doi:10.1029/95JA02208.
- ^ Strobel, Nick (2007). «Atmospheres». Nick Strobel’s Astronomy Notes. Archived from the original on 2010-09-19. Retrieved 2007-09-25.
- ^ G. Brent Dalrymple. «How Good Are Those Young-Earth Arguments?». Archived from the original on 2011-06-07. Retrieved 2011-02-13.
- ^ «Pitchblende». Mindat.org. Retrieved 14 February 2020.
- ^ «Monazite». Mindat.org. Retrieved 14 February 2020.
- ^ «Monazite-(Ce)». Mindat.org. Retrieved 14 February 2020.
- ^ Cook, Melvine A. (1957). «Where is the Earth’s Radiogenic Helium?». Nature. 179 (4552): 213. Bibcode:1957Natur.179..213C. doi:10.1038/179213a0. S2CID 4297697.
- ^ Aldrich, L. T.; Nier, Alfred O. (1948). «The Occurrence of He3 in Natural Sources of Helium». Phys. Rev. 74 (11): 1590–1594. Bibcode:1948PhRv…74.1590A. doi:10.1103/PhysRev.74.1590.
- ^ Morrison, P.; Pine, J. (1955). «Radiogenic Origin of the Helium Isotopes in Rock». Annals of the New York Academy of Sciences. 62 (3): 71–92. Bibcode:1955NYASA..62…71M. doi:10.1111/j.1749-6632.1955.tb35366.x. S2CID 85015694.
- ^ Zartman, R. E.; Wasserburg, G. J.; Reynolds, J. H. (1961). «Helium Argon and Carbon in Natural Gases» (PDF). Journal of Geophysical Research. 66 (1): 277–306. Bibcode:1961JGR….66..277Z. doi:10.1029/JZ066i001p00277. Archived (PDF) from the original on 2017-08-09. Retrieved 2019-01-29.
- ^ Broadhead, Ronald F. (2005). «Helium in New Mexico—geology distribution resource demand and exploration possibilities» (PDF). New Mexico Geology. 27 (4): 93–101. Archived from the original (PDF) on 2012-03-30. Retrieved 2008-07-21.
- ^ «Helium» (PDF). Mineral Commodity Summaries. U.S. geological survey. January 2021. Retrieved 12 February 2022.
- ^ «Press release: The unbearable lightness of helium…» European Association of Geochemistry. Archived from the original on 2015-09-06. Retrieved 5 March 2017.
- ^ Science, Ian (28 June 2016). «Huge helium gas find in east Africa averts medical shortage». The Guardian. Archived from the original on 22 February 2017. Retrieved 5 March 2017.
- ^ Winter, Mark (2008). «Helium: the essentials». University of Sheffield. Archived from the original on 2008-07-14. Retrieved 2008-07-14.
- ^ Cai, Z.; et al. (2007). Modelling Helium Markets (PDF). University of Cambridge. Archived from the original (PDF) on 2009-03-26. Retrieved 2008-07-14.
- ^ Helium (PDF). Mineral Commodity Summaries. U.S. Geological Survey. 2009. pp. 74–75. Archived (PDF) from the original on 2009-08-14. Retrieved 2009-12-19.
- ^ a b «Air Liquide and Linde in Helium Hunt as Texas Reserves Dry Up». Bloomberg. 2014. Archived from the original on 2017-03-10. Retrieved 2017-03-07.
- ^ Briggs, Helen (28 June 2016). «Helium discovery a ‘game-changer’«. BBC News. Archived from the original on 28 June 2016. Retrieved 2016-06-28.
- ^ Chen, Stephen (28 Jul 2020). «China opens first large-scale helium plant as it tries to reduce reliance on US imports». South China Morning Post. Beijing, China. Retrieved 28 Jul 2020.
- ^ Pierce, A. P., Gott, G. B., and Mytton, J. W. (1964). «Uranium and Helium in the Panhandle Gas Field Texas, and Adjacent Areas», Geological Survey Professional Paper 454-G, Washington:US Government Printing Office
- ^ «Responsible Helium Administration and Stewardship Act (H.R. 527)». House Committee on Natural Resources. Committee on Natural Resources United States House of Representatives. Archived from the original on 2017-03-06. Retrieved 5 March 2017.
- ^ Belyakov, V. P.; Durgar’yan, S. G.; Mirzoyan, B. A. (1981). «Membrane technology—A new trend in industrial gas separation». Chemical and Petroleum Engineering. 17 (1): 19–21. doi:10.1007/BF01245721. S2CID 109199653.
- ^ Committee on the Impact of Selling, Table 4.2 Archived 2014-09-10 at the Wayback Machine
- ^ Committee on the Impact of Selling, see page 40 Archived 2014-05-29 at the Wayback Machine for the estimate of total theoretical helium production by neon and liquid air plants
- ^ Dee, P. I.; Walton E. T. S. (1933). «A Photographic Investigation of the Transmutation of Lithium and Boron by Protons and of Lithium by Ions of the Heavy Isotope of Hydrogen». Proceedings of the Royal Society of London. 141 (845): 733–742. Bibcode:1933RSPSA.141..733D. doi:10.1098/rspa.1933.0151. S2CID 96565428.
- ^ Connor, Steve (23 August 2010). «Richard Coleman campaigning against US Congress’ decision to sell all helium supplies by 2015». London: Independent.co.uk. Archived from the original on 14 November 2010. Retrieved 2010-11-27.
- ^ Nuttall, William J.; Clarke, Richard H.; Glowacki, Bartek A. (2012). «Resources: Stop squandering helium». Nature. 485 (7400): 573–575. Bibcode:2012Natur.485..573N. doi:10.1038/485573a. PMID 22660302. S2CID 10351068.
- ^ a b U.S. Department of the Interior, U.S. Geological Survey (2015). «Helium» (PDF). Mineral Commodity Summaries 2014. pp. 72–73. Archived from the original on 2014-04-04. Retrieved 2014-05-31.
- ^ Helium sell-off risks future supply Archived 2012-06-10 at the Wayback Machine, Michael Banks, Physics World, 27 January 2010. accessed February 27, 2010.
- ^ Beckwith, I. E.; Miller, C. G. (1990). «Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley». Annual Review of Fluid Mechanics. 22 (1): 419–439. Bibcode:1990AnRFM..22..419B. doi:10.1146/annurev.fl.22.010190.002223.
- ^ Morris, C.I. (2001). Shock Induced Combustion in High Speed Wedge Flows (PDF). Stanford University Thesis. Archived from the original (PDF) on 2009-03-04.
- ^ a b Considine, Glenn D., ed. (2005). «Helium». Van Nostrand’s Encyclopedia of Chemistry. Wiley-Interscience. pp. 764–765. ISBN 978-0-471-61525-5.
- ^ Hablanian, M. H. (1997). High-vacuum technology: a practical guide. CRC Press. p. 493. ISBN 978-0-8247-9834-5.
- ^ Ekin, Jack W. (2006). Experimental Techniques for Low-Temperature measurements. Oxford University Press. ISBN 978-0-19-857054-7.
- ^ Fowler, B.; Ackles, K. N.; G, Porlier (1985). «Effects of inert gas narcosis on behavior—a critical review». Undersea Biomedical Research. 12 (4): 369–402. PMID 4082343. Archived from the original on 2010-12-25. Retrieved 2008-06-27.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Thomas, J. R. (1976). «Reversal of nitrogen narcosis in rats by helium pressure». Undersea Biomed. Res. 3 (3): 249–59. PMID 969027. Archived from the original on 2008-12-06. Retrieved 2008-08-06.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Butcher, Scott J.; Jones, Richard L.; Mayne, Jonathan R.; Hartley, Timothy C.; Petersen, Stewart R. (2007). «Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox». European Journal of Applied Physiology. 101 (6): 659–69. doi:10.1007/s00421-007-0541-5. PMID 17701048. S2CID 7311649.
- ^ «Heliox21». Linde Gas Therapeutics. 27 January 2009. Archived from the original on 10 September 2011. Retrieved 13 April 2011.
- ^ a b Hunger, W. L. Jr.; Bennett, P. B. (1974). «The causes, mechanisms and prevention of the high pressure nervous syndrome». Undersea Biomed. Res. 1 (1): 1–28. ISSN 0093-5387. OCLC 2068005. PMID 4619860. Archived from the original on 2010-12-25. Retrieved 2008-04-07.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Rostain, J. C.; Gardette-Chauffour, M. C.; Lemaire, C.; Naquet, R. (1988). «Effects of a H2-He-O2 mixture on the HPNS up to 450 msw». Undersea Biomed. Res. 15 (4): 257–70. OCLC 2068005. PMID 3212843. Archived from the original on 2008-12-06. Retrieved 2008-06-24.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Belcher, James R.; Slaton, William V.; Raspet, Richard; Bass, Henry E.; Lightfoot, Jay (1999). «Working gases in thermoacoustic engines». The Journal of the Acoustical Society of America. 105 (5): 2677–2684. Bibcode:1999ASAJ..105.2677B. doi:10.1121/1.426884. PMID 10335618.
- ^ Makhijani, Arjun; Gurney, Kevin (1995). Mending the Ozone Hole: Science, Technology, and Policy. MIT Press. ISBN 978-0-262-13308-1.
- ^ Gallagher, Sean (November 4, 2013). «HGST balloons disk capacity with helium-filled 6TB drive». Ars Technica. Archived from the original on July 7, 2017. Retrieved June 14, 2017.
- ^ Jakobsson, H. (1997). «Simulations of the dynamics of the Large Earth-based Solar Telescope». Astronomical & Astrophysical Transactions. 13 (1): 35–46. Bibcode:1997A&AT…13…35J. doi:10.1080/10556799708208113.
- ^ Engvold, O.; Dunn, R.B.; Smartt, R. N.; Livingston, W. C. (1983). «Tests of vacuum VS. helium in a solar telescope». Applied Optics. 22 (1): 10–12. Bibcode:1983ApOpt..22…10E. doi:10.1364/AO.22.000010. PMID 20401118.
- ^ «LHC: Facts and Figures» (PDF). CERN. Archived from the original (PDF) on 2011-07-06. Retrieved 2008-04-30.
- ^ «Helium, USP: FDA-Approved Drugs». U.S. Food and Drug Administration. Retrieved 30 April 2020.
- ^ «FDA approval letter» (PDF). 14 April 2020. Retrieved 30 April 2020.
- ^ Oberhaus, Daniel (30 October 2018). «Why a Helium Leak Disabled Every iPhone in a Medical Facility». Motherboard. Vice Media. Archived from the original on 1 November 2018. Retrieved 31 October 2018.
- ^ Ackerman, M. J.; Maitland, G. (1975). «Calculation of the relative speed of sound in a gas mixture». Undersea Biomed Res. 2 (4): 305–10. PMID 1226588. Archived from the original on 2011-01-27. Retrieved 2008-08-09.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ «Why does helium make your voice squeaky?». 14 July 2000. Archived from the original on 24 March 2013. Retrieved 2013-06-08.
- ^ a b Grassberger, Martin; Krauskopf, Astrid (2007). «Suicidal asphyxiation with helium: Report of three cases Suizid mit Helium Gas: Bericht über drei Fälle». Wiener Klinische Wochenschrift (in German and English). 119 (9–10): 323–325. doi:10.1007/s00508-007-0785-4. PMID 17571238. S2CID 22894287.
- ^ a b c d Montgomery B.; Hayes S. (2006-06-03). «2 found dead under deflated balloon». Tampa Bay Times. Archived from the original on 2013-12-30. Retrieved 2013-12-29.
- ^ a b «Two students die after breathing helium». CBC. 4 June 2006. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ^ a b «Helium inhalation – it’s no laughing matter – Article courtesy of BOC Gases». Balloon Artists & Suppliers Association of Australasia Ltd. Archived from the original on 2014-01-14. Retrieved 2014-01-03.
- ^ a b «Dangers of Helium Inhalation». Lou’s Balloons. Archived from the original on 2014-01-04.
- ^ a b «Helium Gas Safety & Data Sheet». bouncetime. Archived from the original on 2015-04-22. Retrieved 2014-01-03.
- ^ a b Engber, Daniel (2006-06-13). «Stay Out of That Balloon!». Slate.com. Archived from the original on 2011-10-20. Retrieved 2008-07-14.
- ^ Josefson, D. (2000). «Imitating Mickey Mouse can be dangerous». BMJ: British Medical Journal. 320 (7237): 732. PMC 1117755. PMID 10720344.
- ^ «Teen Dies After Inhaling Helium». KTLA News. RIVERSIDE: ktla.com. January 6, 2010. Archived from the original on January 9, 2012. Retrieved 2010-11-19.
- ^ «Tributes to ‘helium death’ teenager from Newtownabbey». BBC Online. 19 November 2010. Archived from the original on 20 November 2010. Retrieved 2010-11-19.
- ^ Mather, Kate (24 February 2012). «Parents of Eagle Point girl who died from inhaling helium hope to save others from same fate». The Oregonian. Archived from the original on 6 December 2013. Retrieved 2013-06-08.
- ^ Barnard, Jeff (22 February 2012). «Ashley Long, Oregon Teenager, Dies After Inhaling Helium at Wild Party (VIDEO)». Huffington Post. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ^ Barnard, Jeff (23 February 2012). «Teen girl dies after inhaling helium at party». Today. AP. Archived from the original on 2013-12-30. Retrieved 2013-12-30.
- ^ The Oxford Leader Newspaper, Sherman Publications, Inc., December 3, 2012.
- ^ «テレ朝事故で分かったヘリウム変声缶の危険性 意識を失うケースの大半が子ども» (in Japanese). 5 February 2015. Archived from the original on 5 February 2015. Retrieved 2015-02-05.
- ^ Rayman, Noah (5 February 2015). «J-Pop Teen Star Left in Coma After Inhaling Helium for TV Stunt». Time. Archived from the original on 5 February 2015. Retrieved 2015-02-06.
- ^ «アイドルが収録中に倒れ病院搬送 テレ朝、ヘリウムガス吸引» (in Japanese). 4 April 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«テレビ番組収録中、12歳アイドルが意識失い救急搬送 ヘリウムガスが原因か» (in Japanese). 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«テレ朝謝罪、12歳アイドルがヘリウム吸い救急搬送» (in Japanese). 4 February 2015. Archived from the original on 2015-02-04. Retrieved 2015-02-04.
«3b Junior idol in coma after inhaling helium on TV Asahi program». 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«アイドル救急搬送騒動で制作会社が実績削除の不可解» (in Japanese). 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04. - ^ «Japanese child star in coma after helium stunt goes wrong». BBC. 5 February 2015. Archived from the original on 5 February 2015. Retrieved 2015-02-06.
- ^ Rostain J.C.; Lemaire C.; Gardette-Chauffour M.C.; Doucet J.; Naquet R. (1983). «Estimation of human susceptibility to the high-pressure nervous syndrome». J Appl Physiol. 54 (4): 1063–70. doi:10.1152/jappl.1983.54.4.1063. PMID 6853282.
Bibliography
- Bureau of Mines (1967). Minerals yearbook mineral fuels Year 1965. Vol. II. U. S. Government Printing Office.
- Committee on the Impact of Selling the Federal Helium Reserve; Commission on Physical Sciences, Mathematics, and Applications; Commission on Engineering and Technical Systems; National Research Council (2000). The Impact of Selling the Federal Helium Reserve. The National Academies Press. ISBN 978-0-309-07038-6. Retrieved 2010-04-02.
- Emsley, John (1998). The Elements (3rd ed.). New York: Oxford University Press. ISBN 978-0-19-855818-7.
- Vercheval, J. (2003). «The thermosphere: a part of the heterosphere». Belgian Institute for Space Aeronomy. Archived from the original on 2005-01-01. Retrieved 2008-07-12.
External links
![]()
This audio file was created from a revision of this article dated 15 July 2009, and does not reflect subsequent edits.
General
- U.S. Government’s Bureau of Land Management: Sources, Refinement, and Shortage. With some history of helium.
- U.S. Geological Survey publications on helium beginning 1996: Helium
- Where is all the helium? Aga website
- It’s Elemental – Helium
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Helium
- International Chemical Safety Cards – Helium; includes health and safety information regarding accidental exposures to helium
More detail
- Helium at The Periodic Table of Videos (University of Nottingham)
- Helium at the Helsinki University of Technology; includes pressure-temperature phase diagrams for helium-3 and helium-4
- Lancaster University, Ultra Low Temperature Physics – includes a summary of some low temperature techniques
- Video: Demonstration of superfluid helium (Alfred Leitner, 1963, 38 min.)
Miscellaneous
- Physics in Speech with audio samples that demonstrate the unchanged voice pitch
- Article about helium and other noble gases
Helium shortage
- America’s Helium Supply: Options for Producing More Helium from Federal Land: Oversight Hearing before the Subcommittee on Energy and Mineral Resources of the Committee on Natural Resources, U.S. House Of Representatives, One Hundred Thirteenth Congress, First Session, Thursday, July 11, 2013
- Helium Program: Urgent Issues Facing BLM’s Storage and Sale of Helium Reserves: Testimony before the Committee on Natural Resources, House of Representatives Government Accountability Office
- Kramer, David (May 22, 2012). «Senate bill would preserve US helium reserve: Measure would give scientists first dibs on helium should a shortage develop. Physics Today web site». Archived from the original on October 27, 2012.
- Richardson, Robert C.; Chan, Moses (2009). «Helium, when will it run out?» (PDF). Archived from the original (PDF) on 2015-06-14.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Helium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (HEE-lee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | colorless gas, exhibiting a gray, cloudy glow (or reddish-orange if an especially high voltage is used) when placed in an electric field | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(He) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Helium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 18 (noble gases) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 0.95 K (−272.20 °C, −457.96 °F) (at 2.5 MPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 4.222 K (−268.928 °C, −452.070 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 0.1786 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.145 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 0.125 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 2.177 K, 5.043 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 5.1953 K, 0.22746 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 0.0138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 0.0829 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.78 J/(mol·K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure (defined by ITS-90)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: no data | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 28 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of helium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 972 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 0.1513 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −1.88×10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-59-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Helios, Greek god of the Sun | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Pierre Janssen, Norman Lockyer (1868) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | William Ramsay, Per Teodor Cleve, Abraham Langlet (1895) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of helium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Helium (from Greek: ἥλιος, romanized: helios, lit. ‘sun’) is a chemical element with the symbol He and atomic number 2. It is a colorless, odorless, tasteless, non-toxic, inert, monatomic gas and the first in the noble gas group in the periodic table.[a] Its boiling and melting point are the lowest among all the elements. It is the second lightest and second most abundant element in the observable universe, after hydrogen. It is present at about 24% of the total elemental mass, which is more than 12 times the mass of all the heavier elements combined. Its abundance is similar to this in both the Sun and in Jupiter, due to the very high nuclear binding energy (per nucleon) of helium-4, with respect to the next three elements after helium. This helium-4 binding energy also accounts for why it is a product of both nuclear fusion and radioactive decay. The most common isotope of helium in the universe is helium-4, the vast majority of which was formed during the Big Bang. Large amounts of new helium are created by nuclear fusion of hydrogen in stars.
Helium was first detected as an unknown, yellow spectral line signature in sunlight during a solar eclipse in 1868 by Georges Rayet,[11] Captain C. T. Haig,[12] Norman R. Pogson,[13] and Lieutenant John Herschel,[14] and was subsequently confirmed by French astronomer Jules Janssen.[15] Janssen is often jointly credited with detecting the element, along with Norman Lockyer. Janssen recorded the helium spectral line during the solar eclipse of 1868, while Lockyer observed it from Britain. Lockyer was the first to propose that the line was due to a new element, which he named. The formal discovery of the element was made in 1895 by chemists Sir William Ramsay, Per Teodor Cleve, and Nils Abraham Langlet, who found helium emanating from the uranium ore, cleveite, which is now not regarded as a separate mineral species, but as a variety of uraninite.[16][17] In 1903, large reserves of helium were found in natural gas fields in parts of the United States, by far the largest supplier of the gas today.
Liquid helium is used in cryogenics (its largest single use, absorbing about a quarter of production), and in the cooling of superconducting magnets, with its main commercial application in MRI scanners. Helium’s other industrial uses—as a pressurizing and purge gas, as a protective atmosphere for arc welding, and in processes such as growing crystals to make silicon wafers—account for half of the gas produced. A well-known but minor use is as a lifting gas in balloons and airships.[18] As with any gas whose density differs from that of air, inhaling a small volume of helium temporarily changes the timbre and quality of the human voice. In scientific research, the behavior of the two fluid phases of helium-4 (helium I and helium II) is important to researchers studying quantum mechanics (in particular the property of superfluidity) and to those looking at the phenomena, such as superconductivity, produced in matter near absolute zero.
On Earth, it is relatively rare—5.2 ppm by volume in the atmosphere. Most terrestrial helium present today is created by the natural radioactive decay of heavy radioactive elements (thorium and uranium, although there are other examples), as the alpha particles emitted by such decays consist of helium-4 nuclei. This radiogenic helium is trapped with natural gas in concentrations as great as 7% by volume, from which it is extracted commercially by a low-temperature separation process called fractional distillation. Terrestrial helium is a non-renewable resource because once released into the atmosphere, it promptly escapes into space. Its supply is thought to be rapidly diminishing.[19][20] However, some studies suggest that helium produced deep in the earth by radioactive decay can collect in natural gas reserves in larger than expected quantities,[21] in some cases, having been released by volcanic activity.[22]
History
Scientific discoveries
The first evidence of helium was observed on August 18, 1868, as a bright yellow line with a wavelength of 587.49 nanometers in the spectrum of the chromosphere of the Sun. The line was detected by French astronomer Jules Janssen during a total solar eclipse in Guntur, India.[23][24] This line was initially assumed to be sodium. On October 20 of the same year, English astronomer, Norman Lockyer, observed a yellow line in the solar spectrum, which, he named the D3 because it was near the known D1 and D2 Fraunhofer line lines of sodium.[25][26] He concluded that it was caused by an element in the Sun unknown on Earth. Lockyer and English chemist Edward Frankland named the element with the Greek word for the Sun, ἥλιος (helios).[27][28]

In 1881, Italian physicist Luigi Palmieri detected helium on Earth for the first time through its D3 spectral line, when he analyzed a material that had been sublimated during a recent eruption of Mount Vesuvius.[29]


The cleveite sample from which Ramsay first purified helium[30]
On March 26, 1895, Scottish chemist Sir William Ramsay isolated helium on Earth by treating the mineral cleveite (a variety of uraninite with at least 10% rare-earth elements) with mineral acids. Ramsay was looking for argon but, after separating nitrogen and oxygen from the gas, liberated by sulfuric acid, he noticed a bright yellow line that matched the D3 line observed in the spectrum of the Sun.[26][31][32][33] These samples were identified as helium by Lockyer and British physicist William Crookes.[34][35] It was independently isolated from cleveite, in the same year, by chemists, Per Teodor Cleve and Abraham Langlet, in Uppsala, Sweden, who collected enough of the gas to accurately determine its atomic weight.[36][37][24][38] Helium was also isolated by the American geochemist, William Francis Hillebrand, prior to Ramsay’s discovery, when he noticed unusual spectral lines while testing a sample of the mineral uraninite. Hillebrand, however, attributed the lines to nitrogen.[39] His letter of congratulations to Ramsay offers an interesting case of discovery, and near-discovery, in science.[40]
In 1907, Ernest Rutherford and Thomas Royds demonstrated that alpha particles are helium nuclei, by allowing the particles to penetrate the thin, glass wall of an evacuated tube, then creating a discharge in the tube, to study the spectrum of the new gas inside.[41] In 1908, helium was first liquefied by Dutch physicist Heike Kamerlingh Onnes by cooling the gas to less than 5 K (−268.15 °C; −450.67 °F).[42][43] He tried to solidify it, by further reducing the temperature, but failed, because helium does not solidify at atmospheric pressure. Onnes’ student Willem Hendrik Keesom was eventually able to solidify 1 cm3 of helium in 1926 by applying additional external pressure.[44][45]
In 1913, Niels Bohr published his «trilogy»[46][47] on atomic structure that included a reconsideration of the Pickering–Fowler series as central evidence in support of his model of the atom.[48][49] This series is named for Edward Charles Pickering, who in 1896 published observations of previously unknown lines in the spectrum of the star ζ Puppis[50] (these are now known to occur with Wolf–Rayet and other hot stars).[51] Pickering attributed the observation (lines at 4551, 5411, and 10123 Å) to a new form of hydrogen with half-integer transition levels.[52][53] In 1912, Alfred Fowler[54] managed to produce similar lines from a hydrogen-helium mixture, and supported Pickering’s conclusion as to their origin.[55] Bohr’s model does not allow for half-integer transitions (nor does quantum mechanics) and Bohr concluded that Pickering and Fowler were wrong, and instead assigned these spectral lines to ionised helium, He+.[56] Fowler was initially skeptical[57] but was ultimately convinced[58] that Bohr was correct,[46] and by 1915 «spectroscopists had transferred [the Pickering–Fowler series] definitively [from hydrogen] to helium.»[49][59] Bohr’s theoretical work on the Pickering series had demonstrated the need for «a re-examination of problems that seemed already to have been solved within classical theories» and provided important confirmation for his atomic theory.[49]
In 1938, Russian physicist Pyotr Leonidovich Kapitsa discovered that helium-4 has almost no viscosity at temperatures near absolute zero, a phenomenon now called superfluidity.[60] This phenomenon is related to Bose–Einstein condensation. In 1972, the same phenomenon was observed in helium-3, but at temperatures much closer to absolute zero, by American physicists Douglas D. Osheroff, David M. Lee, and Robert C. Richardson. The phenomenon in helium-3 is thought to be related to pairing of helium-3 fermions to make bosons, in analogy to Cooper pairs of electrons producing superconductivity.[61]
Extraction and use

After an oil drilling operation in 1903 in Dexter, Kansas produced a gas geyser that would not burn, Kansas state geologist Erasmus Haworth collected samples of the escaping gas and took them back to the University of Kansas at Lawrence where, with the help of chemists Hamilton Cady and David McFarland, he discovered that the gas consisted of, by volume, 72% nitrogen, 15% methane (a combustible percentage only with sufficient oxygen), 1% hydrogen, and 12% an unidentifiable gas.[24][62] With further analysis, Cady and McFarland discovered that 1.84% of the gas sample was helium.[63][64] This showed that despite its overall rarity on Earth, helium was concentrated in large quantities under the American Great Plains, available for extraction as a byproduct of natural gas.[65]
This enabled the United States to become the world’s leading supplier of helium. Following a suggestion by Sir Richard Threlfall, the United States Navy sponsored three small experimental helium plants during World War I. The goal was to supply barrage balloons with the non-flammable, lighter-than-air gas. A total of 5,700 m3 (200,000 cu ft) of 92% helium was produced in the program even though less than a cubic meter of the gas had previously been obtained.[26] Some of this gas was used in the world’s first helium-filled airship, the U.S. Navy’s C-class blimp C-7, which flew its maiden voyage from Hampton Roads, Virginia, to Bolling Field in Washington, D.C., on December 1, 1921,[66] nearly two years before the Navy’s first rigid helium-filled airship, the Naval Aircraft Factory-built USS Shenandoah, flew in September 1923.
Although the extraction process using low-temperature gas liquefaction was not developed in time to be significant during World War I, production continued. Helium was primarily used as a lifting gas in lighter-than-air craft. During World War II, the demand increased for helium for lifting gas and for shielded arc welding. The helium mass spectrometer was also vital in the atomic bomb Manhattan Project.[67]
The government of the United States set up the National Helium Reserve in 1925 at Amarillo, Texas, with the goal of supplying military airships in time of war and commercial airships in peacetime.[26] Because of the Helium Act of 1925, which banned the export of scarce helium on which the US then had a production monopoly, together with the prohibitive cost of the gas, the Hindenburg, like all German Zeppelins, was forced to use hydrogen as the lift gas. The helium market after World War II was depressed but the reserve was expanded in the 1950s to ensure a supply of liquid helium as a coolant to create oxygen/hydrogen rocket fuel (among other uses) during the Space Race and Cold War. Helium use in the United States in 1965 was more than eight times the peak wartime consumption.[68]
After the «Helium Acts Amendments of 1960» (Public Law 86–777), the U.S. Bureau of Mines arranged for five private plants to recover helium from natural gas. For this helium conservation program, the Bureau built a 425-mile (684 km) pipeline from Bushton, Kansas, to connect those plants with the government’s partially depleted Cliffside gas field near Amarillo, Texas. This helium-nitrogen mixture was injected and stored in the Cliffside gas field until needed, at which time it was further purified.[69]
By 1995, a billion cubic meters of the gas had been collected and the reserve was US$1.4 billion in debt, prompting the Congress of the United States in 1996 to phase out the reserve.[24][70] The resulting Helium Privatization Act of 1996[71] (Public Law 104–273) directed the United States Department of the Interior to empty the reserve, with sales starting by 2005.[72]
Helium produced between 1930 and 1945 was about 98.3% pure (2% nitrogen), which was adequate for airships. In 1945, a small amount of 99.9% helium was produced for welding use. By 1949, commercial quantities of Grade A 99.95% helium were available.[73]
For many years, the United States produced more than 90% of commercially usable helium in the world, while extraction plants in Canada, Poland, Russia, and other nations produced the remainder. In the mid-1990s, a new plant in Arzew, Algeria, producing 17 million cubic meters (600 million cubic feet) began operation, with enough production to cover all of Europe’s demand. Meanwhile, by 2000, the consumption of helium within the U.S. had risen to more than 15 million kg per year.[74] In 2004–2006, additional plants in Ras Laffan, Qatar, and Skikda, Algeria were built. Algeria quickly became the second leading producer of helium.[75] Through this time, both helium consumption and the costs of producing helium increased.[76] From 2002 to 2007 helium prices doubled.[77]
As of 2012, the United States National Helium Reserve accounted for 30 percent of the world’s helium.[78] The reserve was expected to run out of helium in 2018.[78] Despite that, a proposed bill in the United States Senate would allow the reserve to continue to sell the gas. Other large reserves were in the Hugoton in Kansas, United States, and nearby gas fields of Kansas and the panhandles of Texas and Oklahoma. New helium plants were scheduled to open in 2012 in Qatar, Russia, and the US state of Wyoming, but they were not expected to ease the shortage.[78]
In 2013, Qatar started up the world’s largest helium unit,[79] although the 2017 Qatar diplomatic crisis severely affected helium production there.[80] 2014 was widely acknowledged to be a year of over-supply in the helium business, following years of renowned shortages.[81] Nasdaq reported (2015) that for Air Products, an international corporation that sells gases for industrial use, helium volumes remain under economic pressure due to feedstock supply constraints.[82]
Characteristics
Atom

The helium atom. Depicted are the nucleus (pink) and the electron cloud distribution (black). The nucleus (upper right) in helium-4 is in reality spherically symmetric and closely resembles the electron cloud, although for more complicated nuclei this is not always the case.
In quantum mechanics
In the perspective of quantum mechanics, helium is the second simplest atom to model, following the hydrogen atom. Helium is composed of two electrons in atomic orbitals surrounding a nucleus containing two protons and (usually) two neutrons. As in Newtonian mechanics, no system that consists of more than two particles can be solved with an exact analytical mathematical approach (see 3-body problem) and helium is no exception. Thus, numerical mathematical methods are required, even to solve the system of one nucleus and two electrons. Such computational chemistry methods have been used to create a quantum mechanical picture of helium electron binding which is accurate to within < 2% of the correct value, in a few computational steps.[83] Such models show that each electron in helium partly screens the nucleus from the other, so that the effective nuclear charge Zeff which each electron sees is about 1.69 units, not the 2 charges of a classic «bare» helium nucleus.
Related stability of the helium-4 nucleus and electron shell
The nucleus of the helium-4 atom is identical with an alpha particle. High-energy electron-scattering experiments show its charge to decrease exponentially from a maximum at a central point, exactly as does the charge density of helium’s own electron cloud. This symmetry reflects similar underlying physics: the pair of neutrons and the pair of protons in helium’s nucleus obey the same quantum mechanical rules as do helium’s pair of electrons (although the nuclear particles are subject to a different nuclear binding potential), so that all these fermions fully occupy 1s orbitals in pairs, none of them possessing orbital angular momentum, and each cancelling the other’s intrinsic spin. Adding another of any of these particles would require angular momentum and would release substantially less energy (in fact, no nucleus with five nucleons is stable). This arrangement is thus energetically extremely stable for all these particles, and this stability accounts for many crucial facts regarding helium in nature.
For example, the stability and low energy of the electron cloud state in helium accounts for the element’s chemical inertness, and also the lack of interaction of helium atoms with each other, producing the lowest melting and boiling points of all the elements.
In a similar way, the particular energetic stability of the helium-4 nucleus, produced by similar effects, accounts for the ease of helium-4 production in atomic reactions that involve either heavy-particle emission or fusion. Some stable helium-3 (two protons and one neutron) is produced in fusion reactions from hydrogen, but it is a very small fraction compared to the highly favorable helium-4.

Binding energy per nucleon of common isotopes. The binding energy per particle of helium-4 is significantly larger than all nearby nuclides.
The unusual stability of the helium-4 nucleus is also important cosmologically: it explains the fact that in the first few minutes after the Big Bang, as the «soup» of free protons and neutrons which had initially been created in about 6:1 ratio cooled to the point that nuclear binding was possible, almost all first compound atomic nuclei to form were helium-4 nuclei. Owing to the relatively tight binding of helium-4 nuclei, its production consumed nearly all of the free neutrons in a few minutes, before they could beta-decay, and thus few neutrons were available to form heavier atoms such as lithium, beryllium, or boron. Helium-4 nuclear binding per nucleon is stronger than in any of these elements (see nucleogenesis and binding energy) and thus, once helium had been formed, no energetic drive was available to make elements 3, 4 and 5.[84] It is barely energetically favorable for helium to fuse into the next element with a lower energy per nucleon, carbon. However, due to lack of intermediate elements, this process requires three helium nuclei striking each other nearly simultaneously (see triple alpha process). There was thus no time for significant carbon to be formed in the few minutes after the Big Bang, before the early expanding universe cooled to the temperature and pressure point where helium fusion to carbon was no longer possible. This left the early universe with a very similar ratio of hydrogen/helium as is observed today (3 parts hydrogen to 1 part helium-4 by mass), with nearly all the neutrons in the universe trapped in helium-4.
All heavier elements (including those necessary for rocky planets like the Earth, and for carbon-based or other life) have thus been created since the Big Bang in stars which were hot enough to fuse helium itself. All elements other than hydrogen and helium today account for only 2% of the mass of atomic matter in the universe. Helium-4, by contrast, makes up about 23% of the universe’s ordinary matter—nearly all the ordinary matter that is not hydrogen.
Gas and plasma phases

Helium discharge tube shaped like the element’s atomic symbol
Helium is the second least reactive noble gas after neon, and thus the second least reactive of all elements.[85] It is chemically inert and monatomic in all standard conditions. Because of helium’s relatively low molar (atomic) mass, its thermal conductivity, specific heat, and sound speed in the gas phase are all greater than any other gas except hydrogen. For these reasons and the small size of helium monatomic molecules, helium diffuses through solids at a rate three times that of air and around 65% that of hydrogen.[26]
Helium is the least water-soluble monatomic gas,[86] and one of the least water-soluble of any gas (CF4, SF6, and C4F8 have lower mole fraction solubilities: 0.3802, 0.4394, and 0.2372 x2/10−5, respectively, versus helium’s 0.70797 x2/10−5),[87] and helium’s index of refraction is closer to unity than that of any other gas.[88] Helium has a negative Joule–Thomson coefficient at normal ambient temperatures, meaning it heats up when allowed to freely expand. Only below its Joule–Thomson inversion temperature (of about 32 to 50 K at 1 atmosphere) does it cool upon free expansion.[26] Once precooled below this temperature, helium can be liquefied through expansion cooling.
Most extraterrestrial helium is found in a plasma state, with properties quite different from those of atomic helium. In a plasma, helium’s electrons are not bound to its nucleus, resulting in very high electrical conductivity, even when the gas is only partially ionized. The charged particles are highly influenced by magnetic and electric fields. For example, in the solar wind together with ionized hydrogen, the particles interact with the Earth’s magnetosphere, giving rise to Birkeland currents and the aurora.[89]
Liquid phase

Liquefied helium. This helium is not only liquid, but has been cooled to the point of superfluidity. The drop of liquid at the bottom of the glass represents helium spontaneously escaping from the container over the side, to empty out of the container. The energy to drive this process is supplied by the potential energy of the falling helium.
Unlike any other element, helium will remain liquid down to absolute zero at normal pressures. This is a direct effect of quantum mechanics: specifically, the zero point energy of the system is too high to allow freezing. Solid helium requires a temperature of 1–1.5 K (about −272 °C or −457 °F) at about 25 bar (2.5 MPa) of pressure.[90] It is often hard to distinguish solid from liquid helium since the refractive index of the two phases are nearly the same. The solid has a sharp melting point and has a crystalline structure, but it is highly compressible; applying pressure in a laboratory can decrease its volume by more than 30%.[91] With a bulk modulus of about 27 MPa[92] it is ~100 times more compressible than water. Solid helium has a density of 0.214±0.006 g/cm3 at 1.15 K and 66 atm; the projected density at 0 K and 25 bar (2.5 MPa) is 0.187±0.009 g/cm3.[93] At higher temperatures, helium will solidify with sufficient pressure. At room temperature, this requires about 114,000 atm.[94]
Helium I
Below its boiling point of 4.22 K (−268.93 °C; −452.07 °F) and above the lambda point of 2.1768 K (−270.9732 °C; −455.7518 °F), the isotope helium-4 exists in a normal colorless liquid state, called helium I.[26] Like other cryogenic liquids, helium I boils when it is heated and contracts when its temperature is lowered. Below the lambda point, however, helium does not boil, and it expands as the temperature is lowered further.
Helium I has a gas-like index of refraction of 1.026 which makes its surface so hard to see that floats of Styrofoam are often used to show where the surface is.[26] This colorless liquid has a very low viscosity and a density of 0.145–0.125 g/mL (between about 0 and 4 K),[95] which is only one-fourth the value expected from classical physics.[26] Quantum mechanics is needed to explain this property and thus both states of liquid helium (helium I and helium II) are called quantum fluids, meaning they display atomic properties on a macroscopic scale. This may be an effect of its boiling point being so close to absolute zero, preventing random molecular motion (thermal energy) from masking the atomic properties.[26]
Helium II
Liquid helium below its lambda point (called helium II) exhibits very unusual characteristics. Due to its high thermal conductivity, when it boils, it does not bubble but rather evaporates directly from its surface. Helium-3 also has a superfluid phase, but only at much lower temperatures; as a result, less is known about the properties of the isotope.[26]

Unlike ordinary liquids, helium II will creep along surfaces in order to reach an equal level; after a short while, the levels in the two containers will equalize. The Rollin film also covers the interior of the larger container; if it were not sealed, the helium II would creep out and escape.[26]
Helium II is a superfluid, a quantum mechanical state (see: macroscopic quantum phenomena) of matter with strange properties. For example, when it flows through capillaries as thin as 10−7 to 10−8 m it has no measurable viscosity.[24] However, when measurements were done between two moving discs, a viscosity comparable to that of gaseous helium was observed. Current theory explains this using the two-fluid model for helium II. In this model, liquid helium below the lambda point is viewed as containing a proportion of helium atoms in a ground state, which are superfluid and flow with exactly zero viscosity, and a proportion of helium atoms in an excited state, which behave more like an ordinary fluid.[96]
In the fountain effect, a chamber is constructed which is connected to a reservoir of helium II by a sintered disc through which superfluid helium leaks easily but through which non-superfluid helium cannot pass. If the interior of the container is heated, the superfluid helium changes to non-superfluid helium. In order to maintain the equilibrium fraction of superfluid helium, superfluid helium leaks through and increases the pressure, causing liquid to fountain out of the container.[97]
The thermal conductivity of helium II is greater than that of any other known substance, a million times that of helium I and several hundred times that of copper.[26] This is because heat conduction occurs by an exceptional quantum mechanism. Most materials that conduct heat well have a valence band of free electrons which serve to transfer the heat. Helium II has no such valence band but nevertheless conducts heat well. The flow of heat is governed by equations that are similar to the wave equation used to characterize sound propagation in air. When heat is introduced, it moves at 20 meters per second at 1.8 K through helium II as waves in a phenomenon known as second sound.[26]
Helium II also exhibits a creeping effect. When a surface extends past the level of helium II, the helium II moves along the surface, against the force of gravity. Helium II will escape from a vessel that is not sealed by creeping along the sides until it reaches a warmer region where it evaporates. It moves in a 30 nm-thick film regardless of surface material. This film is called a Rollin film and is named after the man who first characterized this trait, Bernard V. Rollin.[26][98][99] As a result of this creeping behavior and helium II’s ability to leak rapidly through tiny openings, it is very difficult to confine. Unless the container is carefully constructed, the helium II will creep along the surfaces and through valves until it reaches somewhere warmer, where it will evaporate. Waves propagating across a Rollin film are governed by the same equation as gravity waves in shallow water, but rather than gravity, the restoring force is the van der Waals force.[100] These waves are known as third sound.[101]
Isotopes
There are nine known isotopes of helium, but only helium-3 and helium-4 are stable. In the Earth’s atmosphere, one atom is 3
He for every million that are 4
He.[24] Unlike most elements, helium’s isotopic abundance varies greatly by origin, due to the different formation processes. The most common isotope, helium-4, is produced on Earth by alpha decay of heavier radioactive elements; the alpha particles that emerge are fully ionized helium-4 nuclei. Helium-4 is an unusually stable nucleus because its nucleons are arranged into complete shells. It was also formed in enormous quantities during Big Bang nucleosynthesis.[102]
Helium-3 is present on Earth only in trace amounts. Most of it has been present since Earth’s formation, though some falls to Earth trapped in cosmic dust.[103] Trace amounts are also produced by the beta decay of tritium.[104] Rocks from the Earth’s crust have isotope ratios varying by as much as a factor of ten, and these ratios can be used to investigate the origin of rocks and the composition of the Earth’s mantle.[103] 3
He is much more abundant in stars as a product of nuclear fusion. Thus in the interstellar medium, the proportion of 3
He to 4
He is about 100 times higher than on Earth.[105] Extraplanetary material, such as lunar and asteroid regolith, have trace amounts of helium-3 from being bombarded by solar winds. The Moon’s surface contains helium-3 at concentrations on the order of 10 ppb, much higher than the approximately 5 ppt found in the Earth’s atmosphere.[106][107] A number of people, starting with Gerald Kulcinski in 1986,[108] have proposed to explore the moon, mine lunar regolith, and use the helium-3 for fusion.
Liquid helium-4 can be cooled to about 1 K (−272.15 °C; −457.87 °F) using evaporative cooling in a 1-K pot. Similar cooling of helium-3, which has a lower boiling point, can achieve about 0.2 kelvin in a helium-3 refrigerator. Equal mixtures of liquid 3
He and 4
He below 0.8 K separate into two immiscible phases due to their dissimilarity (they follow different quantum statistics: helium-4 atoms are bosons while helium-3 atoms are fermions).[26] Dilution refrigerators use this immiscibility to achieve temperatures of a few millikelvins.[109]
It is possible to produce exotic helium isotopes, which rapidly decay into other substances. The shortest-lived heavy helium isotope is the unbound helium-10 with a half-life of 2.6(4)×10−22 s.[110] Helium-6 decays by emitting a beta particle and has a half-life of 0.8 second. Helium-7 also emits a beta particle as well as a gamma ray. Helium-7 and helium-8 are created in certain nuclear reactions.[26] Helium-6 and helium-8 are known to exhibit a nuclear halo.[26]
Properties
Table of thermal and physical properties of helium gas at atmospheric pressure:[111][112]
| Temperature (K) | Density (kg/m^3) | Specific heat (kJ/kg °C) | Dynamic viscosity (kg/m s) | Kinematic viscosity (m^2/s) | Thermal conductivity (W/m °C) | Thermal diffusivity (m^2/s) | Prandtl Number |
| 100 | 5.193 | 9.63E-06 | 1.98E-05 | 0.073 | 2.89E-05 | 0.686 | |
| 120 | 0.406 | 5.193 | 1.07E-05 | 2.64E-05 | 0.0819 | 3.88E-05 | 0.679 |
| 144 | 0.3379 | 5.193 | 1.26E-05 | 3.71E-05 | 0.0928 | 5.28E-05 | 0.7 |
| 200 | 0.2435 | 5.193 | 1.57E-05 | 6.44E-05 | 0.1177 | 9.29E-05 | 0.69 |
| 255 | 0.1906 | 5.193 | 1.82E-05 | 9.55E-05 | 0.1357 | 1.37E-04 | 0.7 |
| 366 | 0.1328 | 5.193 | 2.31E-05 | 1.74E-04 | 0.1691 | 2.45E-04 | 0.71 |
| 477 | 0.10204 | 5.193 | 2.75E-05 | 2.69E-04 | 0.197 | 3.72E-04 | 0.72 |
| 589 | 0.08282 | 5.193 | 3.11E-05 | 3.76E-04 | 0.225 | 5.22E-04 | 0.72 |
| 700 | 0.07032 | 5.193 | 3.48E-05 | 4.94E-04 | 0.251 | 6.66E-04 | 0.72 |
| 800 | 0.06023 | 5.193 | 3.82E-05 | 6.34E-04 | 0.275 | 8.77E-04 | 0.72 |
| 900 | 0.05451 | 5.193 | 4.14E-05 | 7.59E-04 | 0.33 | 1.14E-03 | 0.687 |
| 1000 | 5.193 | 4.46E-05 | 9.14E-04 | 0.354 | 1.40E-03 | 0.654 |
Compounds


Structure of the suspected fluoroheliate anion, OHeF−
Helium has a valence of zero and is chemically unreactive under all normal conditions.[91] It is an electrical insulator unless ionized. As with the other noble gases, helium has metastable energy levels that allow it to remain ionized in an electrical discharge with a voltage below its ionization potential.[26] Helium can form unstable compounds, known as excimers, with tungsten, iodine, fluorine, sulfur, and phosphorus when it is subjected to a glow discharge, to electron bombardment, or reduced to plasma by other means. The molecular compounds HeNe, HgHe10, and WHe2, and the molecular ions He+
2, He2+
2, HeH+
, and HeD+
have been created this way.[113] HeH+ is also stable in its ground state, but is extremely reactive—it is the strongest Brønsted acid known, and therefore can exist only in isolation, as it will protonate any molecule or counteranion it contacts. This technique has also produced the neutral molecule He2, which has a large number of band systems, and HgHe, which is apparently held together only by polarization forces.[26]
Van der Waals compounds of helium can also be formed with cryogenic helium gas and atoms of some other substance, such as LiHe and He2.[114]
Theoretically, other true compounds may be possible, such as helium fluorohydride (HHeF) which would be analogous to HArF, discovered in 2000.[115] Calculations show that two new compounds containing a helium-oxygen bond could be stable.[116] Two new molecular species, predicted using theory, CsFHeO and N(CH3)4FHeO, are derivatives of a metastable FHeO− anion first theorized in 2005 by a group from Taiwan. If confirmed by experiment, the only remaining element with no known stable compounds would be neon.[117]
Helium atoms have been inserted into the hollow carbon cage molecules (the fullerenes) by heating under high pressure. The endohedral fullerene molecules formed are stable at high temperatures. When chemical derivatives of these fullerenes are formed, the helium stays inside.[118] If helium-3 is used, it can be readily observed by helium nuclear magnetic resonance spectroscopy.[119] Many fullerenes containing helium-3 have been reported. Although the helium atoms are not attached by covalent or ionic bonds, these substances have distinct properties and a definite composition, like all stoichiometric chemical compounds.
Under high pressures helium can form compounds with various other elements. Helium-nitrogen clathrate (He(N2)11) crystals have been grown at room temperature at pressures ca. 10 GPa in a diamond anvil cell.[120] The insulating electride Na2He has been shown to be thermodynamically stable at pressures above 113 GPa. It has a fluorite structure.[121]
Occurrence and production
Natural abundance
Although it is rare on Earth, helium is the second most abundant element in the known Universe, constituting 23% of its baryonic mass. Only hydrogen is more abundant.[24] The vast majority of helium was formed by Big Bang nucleosynthesis one to three minutes after the Big Bang. As such, measurements of its abundance contribute to cosmological models. In stars, it is formed by the nuclear fusion of hydrogen in proton–proton chain reactions and the CNO cycle, part of stellar nucleosynthesis.[102]
In the Earth’s atmosphere, the concentration of helium by volume is only 5.2 parts per million.[122][123] The concentration is low and fairly constant despite the continuous production of new helium because most helium in the Earth’s atmosphere escapes into space by several processes.[124][125][126] In the Earth’s heterosphere, a part of the upper atmosphere, helium and other lighter gases are the most abundant elements.
Most helium on Earth is a result of radioactive decay. Helium is found in large amounts in minerals of uranium and thorium, including uraninite and its varieties cleveite and pitchblende,[16][127] carnotite and monazite (a group name; «monazite» usually refers to monazite-(Ce)),[128][129] because they emit alpha particles (helium nuclei, He2+) to which electrons immediately combine as soon as the particle is stopped by the rock. In this way an estimated 3000 metric tons of helium are generated per year throughout the lithosphere.[130][131][132] In the Earth’s crust, the concentration of helium is 8 parts per billion. In seawater, the concentration is only 4 parts per trillion. There are also small amounts in mineral springs, volcanic gas, and meteoric iron. Because helium is trapped in the subsurface under conditions that also trap natural gas, the greatest natural concentrations of helium on the planet are found in natural gas, from which most commercial helium is extracted. The concentration varies in a broad range from a few ppm to more than 7% in a small gas field in San Juan County, New Mexico.[133][134]
As of 2021 the world’s helium reserves were estimated at 31 billion cubic meters, with a third of that being in Qatar.[135] In 2015 and 2016 additional probable reserves were announced to be under the Rocky Mountains in North America[136] and in the East African Rift.[137]
Modern extraction and distribution
For large-scale use, helium is extracted by fractional distillation from natural gas, which can contain as much as 7% helium.[138] Since helium has a lower boiling point than any other element, low temperature and high pressure are used to liquefy nearly all the other gases (mostly nitrogen and methane). The resulting crude helium gas is purified by successive exposures to lowering temperatures, in which almost all of the remaining nitrogen and other gases are precipitated out of the gaseous mixture. Activated charcoal is used as a final purification step, usually resulting in 99.995% pure Grade-A helium.[26] The principal impurity in Grade-A helium is neon. In a final production step, most of the helium that is produced is liquefied via a cryogenic process. This is necessary for applications requiring liquid helium and also allows helium suppliers to reduce the cost of long-distance transportation, as the largest liquid helium containers have more than five times the capacity of the largest gaseous helium tube trailers.[75][139]
In 2008, approximately 169 million standard cubic meters (SCM) of helium were extracted from natural gas or withdrawn from helium reserves with approximately 78% from the United States, 10% from Algeria, and most of the remainder from Russia, Poland and Qatar.[140] By 2013, increases in helium production in Qatar (under the company Qatargas managed by Air Liquide) had increased Qatar’s fraction of world helium production to 25%, and made it the second largest exporter after the United States.[141]
An estimated 54 billion cubic feet (1.5×109 m3) deposit of helium was found in Tanzania in 2016.[142] A large-scale helium plant was opened in Ningxia, China in 2020.[143]
In the United States, most helium is extracted from natural gas of the Hugoton and nearby gas fields in Kansas, Oklahoma, and the Panhandle Field in Texas.[75][144] Much of this gas was once sent by pipeline to the National Helium Reserve, but since 2005 this reserve is being depleted and sold off, and is expected to be largely depleted by 2021,[141] under the October 2013 Responsible Helium Administration and Stewardship Act (H.R. 527).[145]
Diffusion of crude natural gas through special semipermeable membranes and other barriers is another method to recover and purify helium.[146] In 1996, the U.S. had proven helium reserves, in such gas well complexes, of about 147 billion standard cubic feet (4.2 billion SCM).[147] At rates of use at that time (72 million SCM per year in the U.S.; see pie chart below) this would have been enough helium for about 58 years of U.S. use, and less than this (perhaps 80% of the time) at world use rates, although factors in saving and processing impact effective reserve numbers.
Helium must be extracted from natural gas because it is present in air at only a fraction of that of neon, yet the demand for it is far higher. It is estimated that if all neon production were retooled to save helium, 0.1% of the world’s helium demands would be satisfied. Similarly, only 1% of the world’s helium demands could be satisfied by re-tooling all air distillation plants.[148] Helium can be synthesized by bombardment of lithium or boron with high-velocity protons, or by bombardment of lithium with deuterons, but these processes are a completely uneconomical method of production.[149]
Helium is commercially available in either liquid or gaseous form. As a liquid, it can be supplied in small insulated containers called dewars which hold as much as 1,000 liters of helium, or in large ISO containers which have nominal capacities as large as 42 m3 (around 11,000 U.S. gallons). In gaseous form, small quantities of helium are supplied in high-pressure cylinders holding as much as 8 m3 (approx. 282 standard cubic feet), while large quantities of high-pressure gas are supplied in tube trailers which have capacities of as much as 4,860 m3 (approx. 172,000 standard cubic feet).
Conservation advocates
According to helium conservationists like Nobel laureate physicist Robert Coleman Richardson, writing in 2010, the free market price of helium has contributed to «wasteful» usage (e.g. for helium balloons). Prices in the 2000s had been lowered by the decision of the U.S. Congress to sell off the country’s large helium stockpile by 2015.[150] According to Richardson, the price needed to be multiplied by 20 to eliminate the excessive wasting of helium. In the paper Stop squandering helium published in 2012, it was also proposed to create an International Helium Agency that would build a sustainable market for «this precious commodity».[151]
Applications
The largest single use of liquid helium is to cool the superconducting magnets in modern MRI scanners.
Estimated 2014 U.S. fractional helium use by category. Total use is 34 million cubic meters.[152]
Cryogenics (32%)
Pressurizing and purging (18%)
Welding (13%)
Controlled atmospheres (18%)
Leak detection (4%)
Breathing mixtures (2%)
Other (13%)
While balloons are perhaps the best known use of helium, they are a minor part of all helium use.[70] Helium is used for many purposes that require some of its unique properties, such as its low boiling point, low density, low solubility, high thermal conductivity, or inertness. Of the 2014 world helium total production of about 32 million kg (180 million standard cubic meters) helium per year, the largest use (about 32% of the total in 2014) is in cryogenic applications, most of which involves cooling the superconducting magnets in medical MRI scanners and NMR spectrometers.[153] Other major uses were pressurizing and purging systems, welding, maintenance of controlled atmospheres, and leak detection. Other uses by category were relatively minor fractions.[152]
Controlled atmospheres
Helium is used as a protective gas in growing silicon and germanium crystals, in titanium and zirconium production, and in gas chromatography,[91] because it is inert. Because of its inertness, thermally and calorically perfect nature, high speed of sound, and high value of the heat capacity ratio, it is also useful in supersonic wind tunnels[154] and impulse facilities.[155]
Gas tungsten arc welding
Helium is used as a shielding gas in arc welding processes on materials that at welding temperatures are contaminated and weakened by air or nitrogen.[24] A number of inert shielding gases are used in gas tungsten arc welding, but helium is used instead of cheaper argon especially for welding materials that have higher heat conductivity, like aluminium or copper.
Minor uses
Industrial leak detection

A dual chamber helium leak detection machine
One industrial application for helium is leak detection. Because helium diffuses through solids three times faster than air, it is used as a tracer gas to detect leaks in high-vacuum equipment (such as cryogenic tanks) and high-pressure containers.[156] The tested object is placed in a chamber, which is then evacuated and filled with helium. The helium that escapes through the leaks is detected by a sensitive device (helium mass spectrometer), even at the leak rates as small as 10−9 mbar·L/s (10−10 Pa·m3/s). The measurement procedure is normally automatic and is called helium integral test. A simpler procedure is to fill the tested object with helium and to manually search for leaks with a hand-held device.[157]
Helium leaks through cracks should not be confused with gas permeation through a bulk material. While helium has documented permeation constants (thus a calculable permeation rate) through glasses, ceramics, and synthetic materials, inert gases such as helium will not permeate most bulk metals.[158]
Flight

Because of its low density and incombustibility, helium is the gas of choice to fill airships such as the Goodyear blimp.
Because it is lighter than air, airships and balloons are inflated with helium for lift. While hydrogen gas is more buoyant, and escapes permeating through a membrane at a lower rate, helium has the advantage of being non-flammable, and indeed fire-retardant. Another minor use is in rocketry, where helium is used as an ullage medium to displace fuel and oxidizers in storage tanks and to condense hydrogen and oxygen to make rocket fuel. It is also used to purge fuel and oxidizer from ground support equipment prior to launch and to pre-cool liquid hydrogen in space vehicles. For example, the Saturn V rocket used in the Apollo program needed about 370,000 m3 (13 million cubic feet) of helium to launch.[91]
Minor commercial and recreational uses
Helium as a breathing gas has no narcotic properties, so helium mixtures such as trimix, heliox and heliair are used for deep diving to reduce the effects of narcosis, which worsen with increasing depth.[159][160] As pressure increases with depth, the density of the breathing gas also increases, and the low molecular weight of helium is found to considerably reduce the effort of breathing by lowering the density of the mixture. This reduces the Reynolds number of flow, leading to a reduction of turbulent flow and an increase in laminar flow, which requires less work of breathing.[161][162] At depths below 150 metres (490 ft) divers breathing helium–oxygen mixtures begin to experience tremors and a decrease in psychomotor function, symptoms of high-pressure nervous syndrome.[163] This effect may be countered to some extent by adding an amount of narcotic gas such as hydrogen or nitrogen to a helium–oxygen mixture.[164]
Helium–neon lasers, a type of low-powered gas laser producing a red beam, had various practical applications which included barcode readers and laser pointers, before they were almost universally replaced by cheaper diode lasers.[24]
For its inertness and high thermal conductivity, neutron transparency, and because it does not form radioactive isotopes under reactor conditions, helium is used as a heat-transfer medium in some gas-cooled nuclear reactors.[156]
Helium, mixed with a heavier gas such as xenon, is useful for thermoacoustic refrigeration due to the resulting high heat capacity ratio and low Prandtl number.[165] The inertness of helium has environmental advantages over conventional refrigeration systems which contribute to ozone depletion or global warming.[166]
Helium is also used in some hard disk drives.[167]
Scientific uses
The use of helium reduces the distorting effects of temperature variations in the space between lenses in some telescopes, due to its extremely low index of refraction.[26] This method is especially used in solar telescopes where a vacuum tight telescope tube would be too heavy.[168][169]
Helium is a commonly used carrier gas for gas chromatography.
The age of rocks and minerals that contain uranium and thorium can be estimated by measuring the level of helium with a process known as helium dating.[24][26]
Helium at low temperatures is used in cryogenics, and in certain cryogenics applications. As examples of applications, liquid helium is used to cool certain metals to the extremely low temperatures required for superconductivity, such as in superconducting magnets for magnetic resonance imaging. The Large Hadron Collider at CERN uses 96 metric tons of liquid helium to maintain the temperature at 1.9 K (−271.25 °C; −456.25 °F).[170]
Medical uses
Helium was approved for medical use in the United States in April 2020 for humans and animals.[171][172]
As a contaminant
While chemically inert, helium contamination impairs the operation of microelectromechanical systems (MEMS) such that iPhones may fail.[173]
Inhalation and safety
Effects
Neutral helium at standard conditions is non-toxic, plays no biological role and is found in trace amounts in human blood.

The effect of helium on a human voice
The speed of sound in helium is nearly three times the speed of sound in air. Because the natural resonance frequency of a gas-filled cavity is proportional to the speed of sound in the gas, when helium is inhaled, a corresponding increase occurs in the resonant frequencies of the vocal tract, which is the amplifier of vocal sound.[24][174] This increase in the resonant frequency of the amplifier (the vocal tract) gives an increased amplification to the high-frequency components of the sound wave produced by the direct vibration of the vocal folds, compared to the case when the voice box is filled with air. When a person speaks after inhaling helium gas, the muscles that control the voice box still move in the same way as when the voice box is filled with air, therefore the fundamental frequency (sometimes called pitch) produced by direct vibration of the vocal folds does not change.[175] However, the high-frequency-preferred amplification causes a change in timbre of the amplified sound, resulting in a reedy, duck-like vocal quality. The opposite effect, lowering resonant frequencies, can be obtained by inhaling a dense gas such as sulfur hexafluoride or xenon.
Hazards
Inhaling helium can be dangerous if done to excess, since helium is a simple asphyxiant and so displaces oxygen needed for normal respiration.[24][176] Fatalities have been recorded, including a youth who suffocated in Vancouver in 2003 and two adults who suffocated in South Florida in 2006.[177][178] In 1998, an Australian girl from Victoria fell unconscious and temporarily turned blue after inhaling the entire contents of a party balloon.[179][180][181]
Inhaling helium directly from pressurized cylinders or even balloon filling valves is extremely dangerous, as high flow rate and pressure can result in barotrauma, fatally rupturing lung tissue.[176][182]
Death caused by helium is rare. The first media-recorded case was that of a 15-year-old girl from Texas who died in 1998 from helium inhalation at a friend’s party; the exact type of helium death is unidentified.[179][180][181]
In the United States only two fatalities were reported between 2000 and 2004, including a man who died in North Carolina of barotrauma in 2002.[177][182] A youth asphyxiated in Vancouver during 2003, and a 27-year-old man in Australia had an embolism after breathing from a cylinder in 2000.[177] Since then two adults asphyxiated in South Florida in 2006,[177][178][183] and there were cases in 2009 and 2010, one a Californian youth who was found with a bag over his head, attached to a helium tank,[184] and another teenager in Northern Ireland died of asphyxiation.[185] At Eagle Point, Oregon a teenage girl died in 2012 from barotrauma at a party.[186][187][188] A girl from Michigan died from hypoxia later in the year.[189]
On February 4, 2015, it was revealed that, during the recording of their main TV show on January 28, a 12-year-old member (name withheld) of Japanese all-girl singing group 3B Junior suffered from air embolism, losing consciousness and falling into a coma as a result of air bubbles blocking the flow of blood to the brain, after inhaling huge quantities of helium as part of a game. The incident was not made public until a week later.[190][191] The staff of TV Asahi held an emergency press conference to communicate that the member had been taken to the hospital and is showing signs of rehabilitation such as moving eyes and limbs, but her consciousness has not yet been sufficiently recovered. Police have launched an investigation due to a neglect of safety measures.[192][193]
The safety issues for cryogenic helium are similar to those of liquid nitrogen; its extremely low temperatures can result in cold burns, and the liquid-to-gas expansion ratio can cause explosions if no pressure-relief devices are installed. Containers of helium gas at 5 to 10 K should be handled as if they contain liquid helium due to the rapid and significant thermal expansion that occurs when helium gas at less than 10 K is warmed to room temperature.[91]
At high pressures (more than about 20 atm or two MPa), a mixture of helium and oxygen (heliox) can lead to high-pressure nervous syndrome, a sort of reverse-anesthetic effect; adding a small amount of nitrogen to the mixture can alleviate the problem.[194][163]
See also
- Abiogenic petroleum origin
- Helium-3 propulsion
- Leidenfrost effect
- Superfluid
- Tracer-gas leak testing method
- Hamilton Cady
Notes
- ^ A few authors dispute the placement of helium in the noble gas column, preferring to place it above beryllium with the alkaline earth metals. They do so on the grounds of helium’s 1s2 electron configuration, which is analogous to the ns2 valence configurations of the alkaline earth metals, and furthermore point to some specific trends that are more regular with helium over beryllium.[5][6][7][8][9] However, the classification of helium with the other noble gases remains near-universal, as its extraordinary inertness is extremely close to that of the other light noble gases neon and argon.[10]
References
- ^ «Standard Atomic Weights: Helium». CIAAW. 1983.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). «Noble Gases». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Grochala, Wojciech (1 November 2017). «On the position of helium and neon in the Periodic Table of Elements». Foundations of Chemistry. 20 (2018): 191–207. doi:10.1007/s10698-017-9302-7.
- ^ Bent Weberg, Libby (18 January 2019). ««The» periodic table». Chemical & Engineering News. 97 (3). Retrieved 27 March 2020.
- ^ Grandinetti, Felice (23 April 2013). «Neon behind the signs». Nature Chemistry. 5 (2013): 438. Bibcode:2013NatCh…5..438G. doi:10.1038/nchem.1631. PMID 23609097. Retrieved 27 March 2019.
- ^ Kurushkin, Mikhail (2020). «Helium’s placement in the Periodic Table from a crystal structure viewpoint». IUCrJ. 7 (4): 577–578. doi:10.1107/S2052252520007769. PMC 7340260. PMID 32695406. Retrieved 19 June 2020.
- ^ Labarca, Martín; Srivaths, Akash (2016). «On the Placement of Hydrogen and Helium in the Periodic System: A New Approach». Bulgarian Journal of Science Education. 25 (4): 514–530. Retrieved 19 June 2020.
- ^ Lewars, Errol G. (5 December 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. pp. 69–71. ISBN 978-1-4020-6973-4. Archived from the original on 19 May 2016.
- ^ Rayet, G. (1868) «Analyse spectral des protubérances observées, pendant l’éclipse totale de Soleil visible le 18 août 1868, à la presqu’île de Malacca» (Spectral analysis of the protuberances observed during the total solar eclipse, seen on 18 August 1868, from the Malacca peninsula), Comptes rendus … , 67 : 757–759. From p. 758: » … je vis immédiatement une série de neuf lignes brillantes qui … me semblent devoir être assimilées aux lignes principales du spectre solaire, B, D, E, b, une ligne inconnue, F, et deux lignes du groupe G.» ( … I saw immediately a series of nine bright lines that … seemed to me should be classed as the principal lines of the solar spectrum, B, D, E, b, an unknown line, F, and two lines of the group G.)
- ^ Captain C. T. Haig (1868) «Account of spectroscopic observations of the eclipse of the sun, August 18th, 1868» Proceedings of the Royal Society of London, 17 : 74–80. From p. 74: «I may state at once that I observed the spectra of two red flames close to each other, and in their spectra two broad bright bands quite sharply defined, one rose-madder and the other light golden.»
- ^ Pogson filed his observations of the 1868 eclipse with the local Indian government, but his report wasn’t published. (Biman B. Nath, The Story of Helium and the Birth of Astrophysics (New York, New York: Springer, 2013), p. 8.) Nevertheless, Lockyer quoted from his report. From p. 320 Archived 17 August 2018 at the Wayback Machine of Lockyer, J. Norman (1896) «The story of helium. Prologue,» Nature, 53 : 319–322 : «Pogson, in referring to the eclipse of 1868, said that the yellow line was «at D, or near D.» «
- ^ Lieutenant John Herschel (1868) «Account of the solar eclipse of 1868, as seen at Jamkandi in the Bombay Presidency,» Proceedings of the Royal Society of London, 17 : 104–120. From p. 113: As the moment of the total solar eclipse approached, » … I recorded an increasing brilliancy in the spectrum in the neighborhood of D, so great in fact as to prevent any measurement of that line till an opportune cloud moderated the light. I am not prepared to offer any explanation of this.» From p. 117: «I also consider that there can be no question that the ORANGE LINE was identical with D, so far as the capacity of the instrument to establish any such identity is concerned.»
- ^ In his initial report to the French Academy of Sciences about the 1868 eclipse, Janssen made no mention of a yellow line in the solar spectrum. See:
- Janssen (1868) «Indication de quelques-uns des résultats obtenus à Cocanada, pendant l’éclipse du mois d’août dernier, et à la suite de cette éclipse» (Information on some of the results obtained at Cocanada, during the eclipse of the month of last August, and following that eclipse), Comptes rendus … , 67 : 838–839.
- Wheeler M. Sears, Helium: The Disappearing Element (Heidelberg, Germany: Springer, 2015), p. 44.
- Françoise Launay with Storm Dunlop, trans., The Astronomer Jules Janssen: A Globetrotter of Celestial Physics (Heidelberg, Germany: Springer, 2012), p. 45.
However, subsequently, in an unpublished letter of 19 December 1868 to Charles Sainte-Claire Deville, Janssen asked Deville to inform the French Academy of Sciences that : «Several observers have claimed the bright D line as forming part of the spectrum of the prominences on 18 August. The bright yellow line did indeed lie very close to D, but the light was more refrangible [i.e., of shorter wavelength] than those of the D lines. My subsequent studies of the Sun have shown the accuracy of what I state here.» (See: (Launay, 2012), p. 45.)
- ^ a b «Cleveite». Mindat.org. Retrieved 14 February 2020.
- ^ «Uraninite». Mindat.org. Retrieved 14 February 2020.
- ^ Rose, Melinda (October 2008). «Helium: Up, Up and Away?». Photonics Spectra. Archived from the original on 22 August 2010. Retrieved 27 February 2010. For a more authoritative but older 1996 pie chart showing U.S. helium use by sector, showing much the same result, see the chart reproduced in «Applications» section of this article.
- ^ Connor, Steve (23 August 2010). «Why the world is running out of helium». The Independent. London. Archived from the original on 27 September 2013. Retrieved 16 September 2013.
- ^ Siegel, Ethan (12 December 2012). «Why the World Will Run Out of Helium». Starts with a Bang. Scienceblogs.com. Archived from the original on 14 September 2013. Retrieved 16 September 2013.
- ^ Szondy, David (24 August 2015). «We may not be running out of helium after all». www.gizmag.com. Archived from the original on 25 March 2016. Retrieved 1 April 2016.
- ^ Sample, Ian (28 June 2016). «Huge helium gas find in east Africa averts medical shortage». The Guardian. Archived from the original on 29 June 2016. Retrieved 29 June 2016.
- ^ Kochhar, R. K. (1991). «French astronomers in India during the 17th – 19th centuries». Journal of the British Astronomical Association. 101 (2): 95–100. Bibcode:1991JBAA..101…95K.
- ^ a b c d e f g h i j k l Emsley, John (2001). Nature’s Building Blocks. Oxford: Oxford University Press. pp. 175–179. ISBN 978-0-19-850341-5.
- ^ Lockyer, J. N. (October 1868). «Notice of an observation of the spectrum of a solar prominence». Proceedings of the Royal Society of London. 17: 91–92. Bibcode:1868RSPS…17…91L. doi:10.1098/rspl.1868.0011. JSTOR 112357. S2CID 163097539. Retrieved 3 June 2018.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Hampel, Clifford A. (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256–268. ISBN 978-0-442-15598-8.
- ^ Harper, Douglas. «helium». Online Etymology Dictionary.
- ^ Thomson, William (August 3, 1871). «Inaugural Address of Sir William Thomson». Nature. 4 (92): 261–278 [268]. Bibcode:1871Natur…4..261.. doi:10.1038/004261a0. PMC 2070380. Archived from the original on December 2, 2016. Retrieved February 22, 2016.
Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium
- ^ Palmieri, Luigi (1881). «La riga dell’Helium apparsa in una recente sublimazione vesuviana» [The line of helium appeared in a recently sublimated material [from Mt.] Vesuvius.]. Rendiconto dell’Accademia delle Scienze Fisiche e Matematiche (Naples, Italy). 20: 223. Archived from the original on 1 September 2018. Retrieved 1 May 2017.
Raccolsi alcun tempo fa una sostanza amorfa di consistenza butirracea e di colore giallo sbiadato sublimata sull’orlo di una fumarola prossima alla bocca di eruzione. Saggiata questa sublimazione allo spettroscopio, ho ravvisato le righe del sodio e del potassio ed una lineare ben distinta che corrisponde esattamente alla D3 che è quella dell’Helium. Do per ora il semplice annunzio del fatto, proponendomi di ritornare sopra questo argomento, dopo di aver sottoposta la sublimazione ad una analisi chimica. (I collected some time ago an amorphous substance having a buttery consistency and a faded yellow color which had sublimated on the rim of a fumarole near the mouth of the eruption. Having analyzed this sublimated substance with a spectroscope, I recognized the lines of sodium and potassium and a very distinct linear line which corresponds exactly to D3, which is that of helium. For the present, I’m making a mere announcement of the fact, proposing to return to this subject after having subjected the sublimate to a chemical analysis.)
- ^ Kirk, Wendy L. «Cleveite [not Clevite] and helium». Museums & Collections Blog. University College London. Archived from the original on 18 October 2018. Retrieved 18 August 2017.
- ^ Ramsay, William (1895). «On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3, One of the Lines in the Coronal Spectrum. Preliminary Note». Proceedings of the Royal Society of London. 58 (347–352): 65–67. Bibcode:1895RSPS…58…65R. doi:10.1098/rspl.1895.0006. S2CID 129872109.
- ^ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part I». Proceedings of the Royal Society of London. 58 (347–352): 81–89. Bibcode:1895RSPS…58…80R. doi:10.1098/rspl.1895.0010.
- ^ Ramsay, William (1895). «Helium, a Gaseous Constituent of Certain Minerals. Part II – Density». Proceedings of the Royal Society of London. 59 (1): 325–330. Bibcode:1895RSPS…59..325R. doi:10.1098/rspl.1895.0097. S2CID 96589261.
- ^ Lockyer, J. Norman (1895). «On the new gas obtained from uraninite. Preliminary note, part II». Proceedings of the Royal Society of London. 58 (347–352): 67–70. doi:10.1098/rspl.1895.0008.
- ^ See:
- Crookes, William (1895). «The spectrum of the gas from clèveite». The Chemical News and Journal of Physical Science. 71 (1844): 151.
- Crookes, William (1895). «The spectrum of helium». The Chemical News and Journal of Physical Science. 72 (1865): 87–89.
- ^ See:
- Clève, P.T. (1895). «Sur la présence de l’hélium dans le clévéite» [On the presence of helium in cleveite]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 120: 834.
- English translation: Clève, P.T. (1895). «On the presence of helium in clèveite». The Chemical News and Journal of Physical Science. 71 (1849): 212.
- Thorpe, T. E. (1895). «Terrestrial helium?». Nature. 51 (1329): 586.
- Clève (1895). «Sur la densité de l’hélium» [On the density of helium]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French). 120: 1212.
- ^ Langlet, N. A. (1895). «Das Atomgewicht des Heliums» [The atomic weight of helium]. Zeitschrift für Anorganische Chemie (in German). 10 (1): 289–292. doi:10.1002/zaac.18950100130.
- ^ Weaver, E.R. (1919). Circular of the Bureau of Standards No. 81: Bibliography of Scientific Literature Relating to Helium (PDF). Washington, D.C., USA: U.S. Government Printing Office. p. 6.
- ^ Hillebrand (1890) «On the occurrence of nitrogen in uraninite and on the composition of uraninite in general,» Bulletin of the U.S. Geological Survey, no. 78, pp. 43–79.
- ^ Munday, Pat (1999). John A. Garraty; Mark C. Carnes (eds.). Biographical entry for W.F. Hillebrand (1853–1925), geochemist and U.S. Bureau of Standards administrator in American National Biography. Vol. 10–11. Oxford University Press. pp. 808–9, 227–8.
- ^ Rutherford, E.; Royds, T. (1908). «XXIV.Spectrum of the radium emanation». Philosophical Magazine. series 6. 16 (92): 313–317. doi:10.1080/14786440808636511.
- ^ Onnes, H. Kamerlingh (1908) «The liquefaction of helium,» Communications from the Physical Laboratory at the University of Leiden, 9 (108) : 1–23.
- ^ van Delft, Dirk (2008). «Little cup of Helium, big Science» (PDF). Physics Today. 61 (3): 36–42. Bibcode:2008PhT….61c..36V. doi:10.1063/1.2897948. Archived from the original (PDF) on June 25, 2008. Retrieved 2008-07-20.
- ^ See:
- Preliminary notice: Keesom, W. H. (17 July 1926) Letters to the Editor: «Solidification of helium,» Nature, 118 : 81.
- Preliminary notice: Keesom, W. H. (1926) «L’hélium solidifié,» Archived 2016-10-22 at the Wayback Machine Comptes rendus … , 183 : 26.
- Keesom, W. H. (1926) «Solid Helium,» Communications from the Physical Laboratory at the University of Leiden, 17 (184) .
- ^ «Coldest Cold». Time Inc. 1929-06-10. Archived from the original on 2008-12-06. Retrieved 2008-07-27.
- ^ a b Hoyer, Ulrich (1981). «Constitution of Atoms and Molecules». In Hoyer, Ulrich (ed.). Niels Bohr – Collected Works: Volume 2 – Work on Atomic Physics (1912–1917). Amsterdam: North Holland Publishing Company. pp. 103–316 (esp. pp. 116–122). ISBN 978-0720418002.
- ^ Kennedy, P. J. (1985). «A Short Biography». In French, A. P.; Kennedy, P. J. (eds.). Niels Bohr: A Centenary Volume. Harvard University Press. pp. 3–15. ISBN 978-0-674-62415-3.
- ^ Bohr, N. (1913). «On the constitution of atoms and molecules, part I» (PDF). Philosophical Magazine. 26 (151): 1–25. Bibcode:1913PMag…26….1B. doi:10.1080/14786441308634955. Archived (PDF) from the original on 2019-04-04. Retrieved 2017-12-27.
Bohr, N. (1913). «On the constitution of atoms and molecules, part II: Systems Containing Only a Single Nucleus» (PDF). Philosophical Magazine. 26 (153): 476–502. Bibcode:1913PMag…26..476B. doi:10.1080/14786441308634993. Archived (PDF) from the original on 2017-12-15. Retrieved 2017-12-27.
Bohr, N. (1913). «On the constitution of atoms and molecules, part III: Systems containing several nuclei». Philosophical Magazine. 26 (155): 857–875. Bibcode:1913PMag…26..857B. doi:10.1080/14786441308635031. - ^ a b c Robotti, Nadia (1983). «The Spectrum of ζ Puppis and the Historical Evolution of Empirical Data». Historical Studies in the Physical Sciences. 14 (1): 123–145. doi:10.2307/27757527. JSTOR 27757527.
- ^ Pickering, E. C. (1896). «Stars having peculiar spectra. New variable stars in Crux and Cygnus». Harvard College Observatory Circular. 12: 1–2. Bibcode:1896HarCi..12….1P. Also published as: Pickering, E. C.; Fleming, W. P. (1896). «Stars having peculiar spectra. New variable stars in Crux and Cygnus». Astrophysical Journal. 4: 369–370. Bibcode:1896ApJ…..4..369P. doi:10.1086/140291.
- ^ Wright, W. H. (1914). «The relation between the Wolf–Rayet stars and the planetary nebulae». Astrophysical Journal. 40: 466–472. Bibcode:1914ApJ….40..466W. doi:10.1086/142138.
- ^ Pickering, E. C. (1897). «Stars having peculiar spectra. New variable Stars in Crux and Cygnus». Astronomische Nachrichten. 142 (6): 87–90. Bibcode:1896AN….142…87P. doi:10.1002/asna.18971420605. Archived (PDF) from the original on 2019-08-24. Retrieved 2019-08-24.
- ^ Pickering, E. C. (1897). «The spectrum of zeta Puppis». Astrophysical Journal. 5: 92–94. Bibcode:1897ApJ…..5…92P. doi:10.1086/140312.
- ^ Lakatos, Imre (1980). «Bohr: A Research Programme Progressing on Inconsistent Foundations». In Worrall, John; Currie, Gregory (eds.). The Methodology of Scientific Research Programmes. Cambridge University Press. pp. 55–68. ISBN 9780521280310.
- ^ Fowler, A. (1912). «Observations of the Principal and other Series of Lines in the Spectrum of Hydrogen». Monthly Notices of the Royal Astronomical Society. 73 (2): 62–63. Bibcode:1912MNRAS..73…62F. doi:10.1093/mnras/73.2.62.
- ^ Bohr, N. (1913). «The Spectra of Helium and Hydrogen». Nature. 92 (2295): 231–232. Bibcode:1913Natur..92..231B. doi:10.1038/092231d0. S2CID 11988018.
- ^ Fowler, A. (1913). «The Spectra of Helium and Hydrogen». Nature. 92 (2291): 95–96. Bibcode:1913Natur..92…95F. doi:10.1038/092095b0. S2CID 3972599.
- ^ Fowler, A. (1913). «Reply to: The Spectra of Helium and Hydrogen». Nature. 92 (2295): 232–233. Bibcode:1913Natur..92..232F. doi:10.1038/092232a0. S2CID 3981817.
- ^ Bohr, N. (1915). «The Spectra of Hydrogen and Helium». Nature. 95 (6–7): 6–7. Bibcode:1915Natur..95….6B. doi:10.1038/095006a0. S2CID 3947572.
- ^ Kapitza, P. (1938). «Viscosity of Liquid Helium below the λ-Point». Nature. 141 (3558): 74. Bibcode:1938Natur.141…74K. doi:10.1038/141074a0. S2CID 3997900.
- ^ Osheroff, D. D.; Richardson, R. C.; Lee, D. M. (1972). «Evidence for a New Phase of Solid He3«. Phys. Rev. Lett. 28 (14): 885–888. Bibcode:1972PhRvL..28..885O. doi:10.1103/PhysRevLett.28.885. S2CID 89609083.
- ^ McFarland, D. F. (1903). «Composition of Gas from a Well at Dexter, Kan». Transactions of the Kansas Academy of Science. 19: 60–62. doi:10.2307/3624173. JSTOR 3624173.
- ^ «Discovery of Helium in Natural Gas at the University of Kansas». National Historic Chemical Landmarks. American Chemical Society. Archived from the original on 2014-02-26. Retrieved 2014-02-21.
- ^ Cady, H. P.; McFarland, D. F. (1906). «Helium in Natural Gas». Science. 24 (611): 344. Bibcode:1906Sci….24..344D. doi:10.1126/science.24.611.344. PMID 17772798. S2CID 27441003.
- ^ Cady, H. P.; McFarland, D. F. (1906). «Helium in Kansas Natural Gas». Transactions of the Kansas Academy of Science. 20: 80–81. doi:10.2307/3624645. JSTOR 3624645.
- ^ Emme, Eugene M. comp., ed. (1961). «Aeronautics and Astronautics Chronology, 1920–1924». Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915–1960. Washington, D.C.: NASA. pp. 11–19.
- ^ Hilleret, N. (1999). «Leak Detection» (PDF). In S. Turner (ed.). CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999. Geneva, Switzerland: CERN. pp. 203–212.
At the origin of the helium leak detection method was the Manhattan Project and the unprecedented leak-tightness requirements needed by the uranium enrichment plants. The required sensitivity needed for the leak checking led to the choice of a mass spectrometer designed by Dr. A.O.C. Nier tuned on the helium mass.
- ^ Williamson, John G. (1968). «Energy for Kansas». Transactions of the Kansas Academy of Science. 71 (4): 432–438. doi:10.2307/3627447. JSTOR 3627447.
- ^ «Conservation Helium Sale» (PDF). Federal Register. 70 (193): 58464. 2005-10-06. Archived (PDF) from the original on 2008-10-31. Retrieved 2008-07-20.
- ^ a b Stwertka, Albert (1998). Guide to the Elements: Revised Edition. New York; Oxford University Press, p. 24. ISBN 0-19-512708-0
- ^ Pub. L. 104–273: Helium Privatization Act of 1996 (text) (PDF)
- ^ Executive Summary. nap.edu. 2000. doi:10.17226/9860. ISBN 978-0-309-07038-6. Archived from the original on 2008-03-27. Retrieved 2008-07-20.
- ^ Mullins, P. V.; Goodling, R. M. (1951). Helium. Bureau of Mines / Minerals yearbook 1949. pp. 599–602. Archived from the original on 2008-12-06. Retrieved 2008-07-20.
- ^ «Helium End User Statistic» (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2008-09-21. Retrieved 2008-07-20.
- ^ a b c Smith, E. M.; Goodwin, T. W.; Schillinger, J. (2003). «Challenges to the Worldwide Supply of Helium in the Next Decade». Advances in Cryogenic Engineering. 49. A (710): 119–138. Bibcode:2004AIPC..710..119S. doi:10.1063/1.1774674. S2CID 109060534.
- ^ Kaplan, Karen H. (June 2007). «Helium shortage hampers research and industry». Physics Today. American Institute of Physics. 60 (6): 31–32. Bibcode:2007PhT….60f..31K. doi:10.1063/1.2754594.
- ^ Basu, Sourish (October 2007). Yam, Philip (ed.). «Updates: Into Thin Air». Scientific American. Vol. 297, no. 4. Scientific American, Inc. p. 18. Archived from the original on 2008-12-06. Retrieved 2008-08-04.
- ^ a b c Newcomb, Tim (21 August 2012). «There’s a Helium Shortage On—and It’s Affecting More than Just Balloons». Time.com. Archived from the original on 29 December 2013. Retrieved 2013-09-16.
- ^ «Air Liquide | the world leader in gases, technologies and services for Industry and Health». 19 February 2015. Archived from the original on 2014-09-14. Retrieved 2015-05-25. Air Liquide Press Release.
- ^ «Middle East turmoil is disrupting a vital resource for nuclear energy, space flight and birthday balloons». washingtonpost.com. 26 June 2017. Archived from the original on 26 June 2017. Retrieved 26 June 2017.
- ^ Cockerill, Rob (25 December 2014). «2015 – What lies ahead? Part 1». Gasworld. Archived from the original on 2015-01-17. Retrieved 15 September 2021.
- ^ «Will Air Products’ (APD) Earnings Surprise Estimates in Q2? — Analyst Blog». NASDAQ.com. April 28, 2015. Archived from the original on July 15, 2019. Retrieved August 4, 2019.
- ^ Watkins, Thayer. «The Old Quantum Physics of Niels Bohr and the Spectrum of Helium: A Modified Version of the Bohr Model». San Jose State University. Archived from the original on 2009-05-26. Retrieved 2009-06-24.
- ^ Vangioni-Flam, E.; Cassé, M. (1999). «Cosmic lithium-beryllium-boron story». Astrophysics and Space Science. 265: 77–86. arXiv:astro-ph/9902073. Bibcode:1999Ap&SS.265…77V. doi:10.1023/A:1002197712862. S2CID 10627727.
- ^ Lewars, Errol G. (2008). Modelling Marvels. Springer. pp. 70–71. Bibcode:2008moma.book…..L. ISBN 978-1-4020-6972-7.
- ^ Weiss, Ray F. (1971). «Solubility of helium and neon in water and seawater». J. Chem. Eng. Data. 16 (2): 235–241. doi:10.1021/je60049a019.
- ^ Scharlin, P.; Battino, R.; Silla, E.; Tuñón, I.; Pascual-Ahuir, J. L. (1998). «Solubility of gases in water: Correlation between solubility and the number of water molecules in the first solvation shell». Pure and Applied Chemistry. 70 (10): 1895–1904. doi:10.1351/pac199870101895. S2CID 96604119.
- ^ Stone, Jack A.; Stejskal, Alois (2004). «Using helium as a standard of refractive index: correcting errors in a gas refractometer». Metrologia. 41 (3): 189–197. Bibcode:2004Metro..41..189S. doi:10.1088/0026-1394/41/3/012. S2CID 250809634.
- ^ Buhler, F.; Axford, W. I.; Chivers, H. J. A.; Martin, K. (1976). «Helium isotopes in an aurora». J. Geophys. Res. 81 (1): 111–115. Bibcode:1976JGR….81..111B. doi:10.1029/JA081i001p00111.
- ^ «Solid Helium». Department of Physics University of Alberta. 2005-10-05. Archived from the original on May 31, 2008. Retrieved 2008-07-20.
- ^ a b c d e Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Grilly, E. R. (1973). «Pressure-volume-temperature relations in liquid and solid 4He». Journal of Low Temperature Physics. 11 (1–2): 33–52. Bibcode:1973JLTP…11…33G. doi:10.1007/BF00655035. S2CID 189850188.
- ^ Henshaw, D. B. (1958). «Structure of Solid Helium by Neutron Diffraction». Physical Review Letters. 109 (2): 328–330. Bibcode:1958PhRv..109..328H. doi:10.1103/PhysRev.109.328.
- ^ Pinceaux, J.-P.; Maury, J.-P.; Besson, J.-M. (1979). «Solidification of helium, at room temperature under high pressure» (PDF). Journal de Physique Lettres. 40 (13): 307–308. doi:10.1051/jphyslet:019790040013030700. S2CID 40164915.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 6-120. ISBN 0-8493-0486-5.
- ^ Hohenberg, P. C.; Martin, P. C. (2000). «Microscopic Theory of Superfluid Helium». Annals of Physics. 281 (1–2): 636–705 12091211. Bibcode:2000AnPhy.281..636H. doi:10.1006/aphy.2000.6019.
- ^ Warner, Brent. «Introduction to Liquid Helium». NASA. Archived from the original on 2005-09-01. Retrieved 2007-01-05.
- ^ Fairbank, H. A.; Lane, C. T. (1949). «Rollin Film Rates in Liquid Helium». Physical Review. 76 (8): 1209–1211. Bibcode:1949PhRv…76.1209F. doi:10.1103/PhysRev.76.1209.
- ^ Rollin, B. V.; Simon, F. (1939). «On the ‘film’ phenomenon of liquid helium II». Physica. 6 (2): 219–230. Bibcode:1939Phy…..6..219R. doi:10.1016/S0031-8914(39)80013-1.
- ^ Ellis, Fred M. (2005). «Third sound». Wesleyan Quantum Fluids Laboratory. Archived from the original on 2007-06-21. Retrieved 2008-07-23.
- ^ Bergman, D. (1949). «Hydrodynamics and Third Sound in Thin He II Films». Physical Review. 188 (1): 370–384. Bibcode:1969PhRv..188..370B. doi:10.1103/PhysRev.188.370.
- ^ a b Weiss, Achim. «Elements of the past: Big Bang Nucleosynthesis and observation». Max Planck Institute for Gravitational Physics. Archived from the original on 2010-07-29. Retrieved 2008-06-23.; Coc, Alain; Vangioni-Flam, Elisabeth; Descouvemont, Pierre; Adahchour, Abderrahim; Angulo, Carmen (2004). «Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements». Astrophysical Journal. 600 (2): 544–552. arXiv:astro-ph/0309480. Bibcode:2004ApJ…600..544C. doi:10.1086/380121. S2CID 16276658.
- ^ a b Anderson, Don L.; Foulger, G. R.; Meibom, A. (2006-09-02). «Helium Fundamentals». MantlePlumes.org. Archived from the original on 2007-02-08. Retrieved 2008-07-20.
- ^ Novick, Aaron (1947). «Half-Life of Tritium». Physical Review. 72 (10): 972. Bibcode:1947PhRv…72..972N. doi:10.1103/PhysRev.72.972.2.
- ^ Zastenker, G. N.; Salerno, E.; Buehler, F.; Bochsler, P.; Bassi, M.; Agafonov, Yu. N.; Eisomont, N. A.; Khrapchenkov, V. V.; et al. (2002). «Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements». Astrophysics. 45 (2): 131–142. Bibcode:2002Ap…..45..131Z. doi:10.1023/A:1016057812964. S2CID 116957905.
- ^ «Lunar Mining of Helium-3». Fusion Technology Institute of the University of Wisconsin-Madison. 2007-10-19. Archived from the original on 2010-06-09. Retrieved 2008-07-09.
- ^ Slyuta, E. N.; Abdrakhimov, A. M.; Galimov, E. M. (2007). «The estimation of helium-3 probable reserves in lunar regolith» (PDF). Lunar and Planetary Science Conference (1338): 2175. Bibcode:2007LPI….38.2175S. Archived (PDF) from the original on 2008-07-05. Retrieved 2008-07-20.
- ^ Hedman, Eric R. (2006-01-16). «A fascinating hour with Gerald Kulcinski». The Space Review. Archived from the original on 2011-01-09. Retrieved 2008-07-20.
- ^ Zu, H.; Dai, W.; de Waele, A.T.A.M. (2022). «Development of Dilution refrigerators – A review». Cryogenics. 121. Bibcode:2022Cryo..121….1Z. doi:10.1016/j.cryogenics.2021.103390. ISSN 0011-2275. S2CID 244005391.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4, Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ Hiby, Julius W. (1939). «Massenspektrographische Untersuchungen an Wasserstoff- und Heliumkanalstrahlen (H+
3, H−
2, HeH+
, HeD+
, He−
)». Annalen der Physik. 426 (5): 473–487. Bibcode:1939AnP…426..473H. doi:10.1002/andp.19394260506. - ^ Friedrich, Bretislav (8 April 2013). «A Fragile Union Between Li and He Atoms». Physics. Vol. 6. p. 42. Bibcode:2013PhyOJ…6…42F. doi:10.1103/Physics.6.42. hdl:11858/00-001M-0000-000E-F3CF-5. Archived from the original on 29 August 2017. Retrieved 24 August 2019.
- ^ Wong, Ming Wah (2000). «Prediction of a Metastable Helium Compound: HHeF». Journal of the American Chemical Society. 122 (26): 6289–6290. doi:10.1021/ja9938175.
- ^ Grochala, W. (2009). «On Chemical Bonding Between Helium and Oxygen». Polish Journal of Chemistry. 83: 87–122.
- ^ «Collapse of helium’s chemical nobility predicted by Polish chemist» (PDF). Archived from the original (PDF) on 2009-03-19. Retrieved 2009-05-15.
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Poreda, Robert J. (1993). «Stable Compounds of Helium and Neon: He@C60 and Ne@C60«. Science. 259 (5100): 1428–1430. Bibcode:1993Sci…259.1428S. doi:10.1126/science.259.5100.1428. PMID 17801275. S2CID 41794612.
- ^ Saunders, Martin; Jiménez-Vázquez, Hugo A.; Cross, R. James; Mroczkowski, Stanley; Freedberg, Darón I.; Anet, Frank A. L. (1994). «Probing the interior of fullerenes by 3He NMR spectroscopy of endohedral 3He@C60 and 3He@C70«. Nature. 367 (6460): 256–258. Bibcode:1994Natur.367..256S. doi:10.1038/367256a0. S2CID 4273677.
- ^ Vos, W. L.; Finger, L. W.; Hemley, R. J.; Hu, J. Z.; Mao, H. K.; Schouten, J. A. (1992). «A high-pressure van der Waals compound in solid nitrogen-helium mixtures». Nature. 358 (6381): 46–48. Bibcode:1992Natur.358…46V. doi:10.1038/358046a0. S2CID 4313676.
- ^ Dong, Xiao; Oganov, Artem R.; Goncharov, Alexander F.; Stavrou, Elissaios; Lobanov, Sergey; Saleh, Gabriele; Qian, Guang-Rui; Zhu, Qiang; Gatti, Carlo; Deringer, Volker L.; Dronskowski, Richard; Zhou, Xiang-Feng; Prakapenka, Vitali B.; Konôpková, Zuzana; Popov, Ivan A.; Boldyrev, Alexander I.; Wang, Hui-Tian (2017). «A stable compound of helium and sodium at high pressure». Nature Chemistry. 9 (5): 440–445. arXiv:1309.3827. Bibcode:2017NatCh…9..440D. doi:10.1038/nchem.2716. ISSN 1755-4330. PMID 28430195. S2CID 20459726.
- ^ Oliver, B. M.; Bradley, James G. (1984). «Helium concentration in the Earth’s lower atmosphere». Geochimica et Cosmochimica Acta. 48 (9): 1759–1767. Bibcode:1984GeCoA..48.1759O. doi:10.1016/0016-7037(84)90030-9.
- ^ «The Atmosphere: Introduction». JetStream – Online School for Weather. National Weather Service. 2007-08-29. Archived from the original on January 13, 2008. Retrieved 2008-07-12.
- ^ Lie-Svendsen, Ø.; Rees, M. H. (1996). «Helium escape from the terrestrial atmosphere: The ion outflow mechanism». Journal of Geophysical Research. 101 (A2): 2435–2444. Bibcode:1996JGR…101.2435L. doi:10.1029/95JA02208.
- ^ Strobel, Nick (2007). «Atmospheres». Nick Strobel’s Astronomy Notes. Archived from the original on 2010-09-19. Retrieved 2007-09-25.
- ^ G. Brent Dalrymple. «How Good Are Those Young-Earth Arguments?». Archived from the original on 2011-06-07. Retrieved 2011-02-13.
- ^ «Pitchblende». Mindat.org. Retrieved 14 February 2020.
- ^ «Monazite». Mindat.org. Retrieved 14 February 2020.
- ^ «Monazite-(Ce)». Mindat.org. Retrieved 14 February 2020.
- ^ Cook, Melvine A. (1957). «Where is the Earth’s Radiogenic Helium?». Nature. 179 (4552): 213. Bibcode:1957Natur.179..213C. doi:10.1038/179213a0. S2CID 4297697.
- ^ Aldrich, L. T.; Nier, Alfred O. (1948). «The Occurrence of He3 in Natural Sources of Helium». Phys. Rev. 74 (11): 1590–1594. Bibcode:1948PhRv…74.1590A. doi:10.1103/PhysRev.74.1590.
- ^ Morrison, P.; Pine, J. (1955). «Radiogenic Origin of the Helium Isotopes in Rock». Annals of the New York Academy of Sciences. 62 (3): 71–92. Bibcode:1955NYASA..62…71M. doi:10.1111/j.1749-6632.1955.tb35366.x. S2CID 85015694.
- ^ Zartman, R. E.; Wasserburg, G. J.; Reynolds, J. H. (1961). «Helium Argon and Carbon in Natural Gases» (PDF). Journal of Geophysical Research. 66 (1): 277–306. Bibcode:1961JGR….66..277Z. doi:10.1029/JZ066i001p00277. Archived (PDF) from the original on 2017-08-09. Retrieved 2019-01-29.
- ^ Broadhead, Ronald F. (2005). «Helium in New Mexico—geology distribution resource demand and exploration possibilities» (PDF). New Mexico Geology. 27 (4): 93–101. Archived from the original (PDF) on 2012-03-30. Retrieved 2008-07-21.
- ^ «Helium» (PDF). Mineral Commodity Summaries. U.S. geological survey. January 2021. Retrieved 12 February 2022.
- ^ «Press release: The unbearable lightness of helium…» European Association of Geochemistry. Archived from the original on 2015-09-06. Retrieved 5 March 2017.
- ^ Science, Ian (28 June 2016). «Huge helium gas find in east Africa averts medical shortage». The Guardian. Archived from the original on 22 February 2017. Retrieved 5 March 2017.
- ^ Winter, Mark (2008). «Helium: the essentials». University of Sheffield. Archived from the original on 2008-07-14. Retrieved 2008-07-14.
- ^ Cai, Z.; et al. (2007). Modelling Helium Markets (PDF). University of Cambridge. Archived from the original (PDF) on 2009-03-26. Retrieved 2008-07-14.
- ^ Helium (PDF). Mineral Commodity Summaries. U.S. Geological Survey. 2009. pp. 74–75. Archived (PDF) from the original on 2009-08-14. Retrieved 2009-12-19.
- ^ a b «Air Liquide and Linde in Helium Hunt as Texas Reserves Dry Up». Bloomberg. 2014. Archived from the original on 2017-03-10. Retrieved 2017-03-07.
- ^ Briggs, Helen (28 June 2016). «Helium discovery a ‘game-changer’«. BBC News. Archived from the original on 28 June 2016. Retrieved 2016-06-28.
- ^ Chen, Stephen (28 Jul 2020). «China opens first large-scale helium plant as it tries to reduce reliance on US imports». South China Morning Post. Beijing, China. Retrieved 28 Jul 2020.
- ^ Pierce, A. P., Gott, G. B., and Mytton, J. W. (1964). «Uranium and Helium in the Panhandle Gas Field Texas, and Adjacent Areas», Geological Survey Professional Paper 454-G, Washington:US Government Printing Office
- ^ «Responsible Helium Administration and Stewardship Act (H.R. 527)». House Committee on Natural Resources. Committee on Natural Resources United States House of Representatives. Archived from the original on 2017-03-06. Retrieved 5 March 2017.
- ^ Belyakov, V. P.; Durgar’yan, S. G.; Mirzoyan, B. A. (1981). «Membrane technology—A new trend in industrial gas separation». Chemical and Petroleum Engineering. 17 (1): 19–21. doi:10.1007/BF01245721. S2CID 109199653.
- ^ Committee on the Impact of Selling, Table 4.2 Archived 2014-09-10 at the Wayback Machine
- ^ Committee on the Impact of Selling, see page 40 Archived 2014-05-29 at the Wayback Machine for the estimate of total theoretical helium production by neon and liquid air plants
- ^ Dee, P. I.; Walton E. T. S. (1933). «A Photographic Investigation of the Transmutation of Lithium and Boron by Protons and of Lithium by Ions of the Heavy Isotope of Hydrogen». Proceedings of the Royal Society of London. 141 (845): 733–742. Bibcode:1933RSPSA.141..733D. doi:10.1098/rspa.1933.0151. S2CID 96565428.
- ^ Connor, Steve (23 August 2010). «Richard Coleman campaigning against US Congress’ decision to sell all helium supplies by 2015». London: Independent.co.uk. Archived from the original on 14 November 2010. Retrieved 2010-11-27.
- ^ Nuttall, William J.; Clarke, Richard H.; Glowacki, Bartek A. (2012). «Resources: Stop squandering helium». Nature. 485 (7400): 573–575. Bibcode:2012Natur.485..573N. doi:10.1038/485573a. PMID 22660302. S2CID 10351068.
- ^ a b U.S. Department of the Interior, U.S. Geological Survey (2015). «Helium» (PDF). Mineral Commodity Summaries 2014. pp. 72–73. Archived from the original on 2014-04-04. Retrieved 2014-05-31.
- ^ Helium sell-off risks future supply Archived 2012-06-10 at the Wayback Machine, Michael Banks, Physics World, 27 January 2010. accessed February 27, 2010.
- ^ Beckwith, I. E.; Miller, C. G. (1990). «Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley». Annual Review of Fluid Mechanics. 22 (1): 419–439. Bibcode:1990AnRFM..22..419B. doi:10.1146/annurev.fl.22.010190.002223.
- ^ Morris, C.I. (2001). Shock Induced Combustion in High Speed Wedge Flows (PDF). Stanford University Thesis. Archived from the original (PDF) on 2009-03-04.
- ^ a b Considine, Glenn D., ed. (2005). «Helium». Van Nostrand’s Encyclopedia of Chemistry. Wiley-Interscience. pp. 764–765. ISBN 978-0-471-61525-5.
- ^ Hablanian, M. H. (1997). High-vacuum technology: a practical guide. CRC Press. p. 493. ISBN 978-0-8247-9834-5.
- ^ Ekin, Jack W. (2006). Experimental Techniques for Low-Temperature measurements. Oxford University Press. ISBN 978-0-19-857054-7.
- ^ Fowler, B.; Ackles, K. N.; G, Porlier (1985). «Effects of inert gas narcosis on behavior—a critical review». Undersea Biomedical Research. 12 (4): 369–402. PMID 4082343. Archived from the original on 2010-12-25. Retrieved 2008-06-27.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Thomas, J. R. (1976). «Reversal of nitrogen narcosis in rats by helium pressure». Undersea Biomed. Res. 3 (3): 249–59. PMID 969027. Archived from the original on 2008-12-06. Retrieved 2008-08-06.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Butcher, Scott J.; Jones, Richard L.; Mayne, Jonathan R.; Hartley, Timothy C.; Petersen, Stewart R. (2007). «Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox». European Journal of Applied Physiology. 101 (6): 659–69. doi:10.1007/s00421-007-0541-5. PMID 17701048. S2CID 7311649.
- ^ «Heliox21». Linde Gas Therapeutics. 27 January 2009. Archived from the original on 10 September 2011. Retrieved 13 April 2011.
- ^ a b Hunger, W. L. Jr.; Bennett, P. B. (1974). «The causes, mechanisms and prevention of the high pressure nervous syndrome». Undersea Biomed. Res. 1 (1): 1–28. ISSN 0093-5387. OCLC 2068005. PMID 4619860. Archived from the original on 2010-12-25. Retrieved 2008-04-07.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Rostain, J. C.; Gardette-Chauffour, M. C.; Lemaire, C.; Naquet, R. (1988). «Effects of a H2-He-O2 mixture on the HPNS up to 450 msw». Undersea Biomed. Res. 15 (4): 257–70. OCLC 2068005. PMID 3212843. Archived from the original on 2008-12-06. Retrieved 2008-06-24.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ Belcher, James R.; Slaton, William V.; Raspet, Richard; Bass, Henry E.; Lightfoot, Jay (1999). «Working gases in thermoacoustic engines». The Journal of the Acoustical Society of America. 105 (5): 2677–2684. Bibcode:1999ASAJ..105.2677B. doi:10.1121/1.426884. PMID 10335618.
- ^ Makhijani, Arjun; Gurney, Kevin (1995). Mending the Ozone Hole: Science, Technology, and Policy. MIT Press. ISBN 978-0-262-13308-1.
- ^ Gallagher, Sean (November 4, 2013). «HGST balloons disk capacity with helium-filled 6TB drive». Ars Technica. Archived from the original on July 7, 2017. Retrieved June 14, 2017.
- ^ Jakobsson, H. (1997). «Simulations of the dynamics of the Large Earth-based Solar Telescope». Astronomical & Astrophysical Transactions. 13 (1): 35–46. Bibcode:1997A&AT…13…35J. doi:10.1080/10556799708208113.
- ^ Engvold, O.; Dunn, R.B.; Smartt, R. N.; Livingston, W. C. (1983). «Tests of vacuum VS. helium in a solar telescope». Applied Optics. 22 (1): 10–12. Bibcode:1983ApOpt..22…10E. doi:10.1364/AO.22.000010. PMID 20401118.
- ^ «LHC: Facts and Figures» (PDF). CERN. Archived from the original (PDF) on 2011-07-06. Retrieved 2008-04-30.
- ^ «Helium, USP: FDA-Approved Drugs». U.S. Food and Drug Administration. Retrieved 30 April 2020.
- ^ «FDA approval letter» (PDF). 14 April 2020. Retrieved 30 April 2020.
- ^ Oberhaus, Daniel (30 October 2018). «Why a Helium Leak Disabled Every iPhone in a Medical Facility». Motherboard. Vice Media. Archived from the original on 1 November 2018. Retrieved 31 October 2018.
- ^ Ackerman, M. J.; Maitland, G. (1975). «Calculation of the relative speed of sound in a gas mixture». Undersea Biomed Res. 2 (4): 305–10. PMID 1226588. Archived from the original on 2011-01-27. Retrieved 2008-08-09.
{{cite journal}}: CS1 maint: unfit URL (link) - ^ «Why does helium make your voice squeaky?». 14 July 2000. Archived from the original on 24 March 2013. Retrieved 2013-06-08.
- ^ a b Grassberger, Martin; Krauskopf, Astrid (2007). «Suicidal asphyxiation with helium: Report of three cases Suizid mit Helium Gas: Bericht über drei Fälle». Wiener Klinische Wochenschrift (in German and English). 119 (9–10): 323–325. doi:10.1007/s00508-007-0785-4. PMID 17571238. S2CID 22894287.
- ^ a b c d Montgomery B.; Hayes S. (2006-06-03). «2 found dead under deflated balloon». Tampa Bay Times. Archived from the original on 2013-12-30. Retrieved 2013-12-29.
- ^ a b «Two students die after breathing helium». CBC. 4 June 2006. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ^ a b «Helium inhalation – it’s no laughing matter – Article courtesy of BOC Gases». Balloon Artists & Suppliers Association of Australasia Ltd. Archived from the original on 2014-01-14. Retrieved 2014-01-03.
- ^ a b «Dangers of Helium Inhalation». Lou’s Balloons. Archived from the original on 2014-01-04.
- ^ a b «Helium Gas Safety & Data Sheet». bouncetime. Archived from the original on 2015-04-22. Retrieved 2014-01-03.
- ^ a b Engber, Daniel (2006-06-13). «Stay Out of That Balloon!». Slate.com. Archived from the original on 2011-10-20. Retrieved 2008-07-14.
- ^ Josefson, D. (2000). «Imitating Mickey Mouse can be dangerous». BMJ: British Medical Journal. 320 (7237): 732. PMC 1117755. PMID 10720344.
- ^ «Teen Dies After Inhaling Helium». KTLA News. RIVERSIDE: ktla.com. January 6, 2010. Archived from the original on January 9, 2012. Retrieved 2010-11-19.
- ^ «Tributes to ‘helium death’ teenager from Newtownabbey». BBC Online. 19 November 2010. Archived from the original on 20 November 2010. Retrieved 2010-11-19.
- ^ Mather, Kate (24 February 2012). «Parents of Eagle Point girl who died from inhaling helium hope to save others from same fate». The Oregonian. Archived from the original on 6 December 2013. Retrieved 2013-06-08.
- ^ Barnard, Jeff (22 February 2012). «Ashley Long, Oregon Teenager, Dies After Inhaling Helium at Wild Party (VIDEO)». Huffington Post. Archived from the original on 31 December 2013. Retrieved 30 December 2013.
- ^ Barnard, Jeff (23 February 2012). «Teen girl dies after inhaling helium at party». Today. AP. Archived from the original on 2013-12-30. Retrieved 2013-12-30.
- ^ The Oxford Leader Newspaper, Sherman Publications, Inc., December 3, 2012.
- ^ «テレ朝事故で分かったヘリウム変声缶の危険性 意識を失うケースの大半が子ども» (in Japanese). 5 February 2015. Archived from the original on 5 February 2015. Retrieved 2015-02-05.
- ^ Rayman, Noah (5 February 2015). «J-Pop Teen Star Left in Coma After Inhaling Helium for TV Stunt». Time. Archived from the original on 5 February 2015. Retrieved 2015-02-06.
- ^ «アイドルが収録中に倒れ病院搬送 テレ朝、ヘリウムガス吸引» (in Japanese). 4 April 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«テレビ番組収録中、12歳アイドルが意識失い救急搬送 ヘリウムガスが原因か» (in Japanese). 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«テレ朝謝罪、12歳アイドルがヘリウム吸い救急搬送» (in Japanese). 4 February 2015. Archived from the original on 2015-02-04. Retrieved 2015-02-04.
«3b Junior idol in coma after inhaling helium on TV Asahi program». 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04.
«アイドル救急搬送騒動で制作会社が実績削除の不可解» (in Japanese). 4 February 2015. Archived from the original on 4 February 2015. Retrieved 2015-02-04. - ^ «Japanese child star in coma after helium stunt goes wrong». BBC. 5 February 2015. Archived from the original on 5 February 2015. Retrieved 2015-02-06.
- ^ Rostain J.C.; Lemaire C.; Gardette-Chauffour M.C.; Doucet J.; Naquet R. (1983). «Estimation of human susceptibility to the high-pressure nervous syndrome». J Appl Physiol. 54 (4): 1063–70. doi:10.1152/jappl.1983.54.4.1063. PMID 6853282.
Bibliography
- Bureau of Mines (1967). Minerals yearbook mineral fuels Year 1965. Vol. II. U. S. Government Printing Office.
- Committee on the Impact of Selling the Federal Helium Reserve; Commission on Physical Sciences, Mathematics, and Applications; Commission on Engineering and Technical Systems; National Research Council (2000). The Impact of Selling the Federal Helium Reserve. The National Academies Press. ISBN 978-0-309-07038-6. Retrieved 2010-04-02.
- Emsley, John (1998). The Elements (3rd ed.). New York: Oxford University Press. ISBN 978-0-19-855818-7.
- Vercheval, J. (2003). «The thermosphere: a part of the heterosphere». Belgian Institute for Space Aeronomy. Archived from the original on 2005-01-01. Retrieved 2008-07-12.
External links
![]()
This audio file was created from a revision of this article dated 15 July 2009, and does not reflect subsequent edits.
General
- U.S. Government’s Bureau of Land Management: Sources, Refinement, and Shortage. With some history of helium.
- U.S. Geological Survey publications on helium beginning 1996: Helium
- Where is all the helium? Aga website
- It’s Elemental – Helium
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Helium
- International Chemical Safety Cards – Helium; includes health and safety information regarding accidental exposures to helium
More detail
- Helium at The Periodic Table of Videos (University of Nottingham)
- Helium at the Helsinki University of Technology; includes pressure-temperature phase diagrams for helium-3 and helium-4
- Lancaster University, Ultra Low Temperature Physics – includes a summary of some low temperature techniques
- Video: Demonstration of superfluid helium (Alfred Leitner, 1963, 38 min.)
Miscellaneous
- Physics in Speech with audio samples that demonstrate the unchanged voice pitch
- Article about helium and other noble gases
Helium shortage
- America’s Helium Supply: Options for Producing More Helium from Federal Land: Oversight Hearing before the Subcommittee on Energy and Mineral Resources of the Committee on Natural Resources, U.S. House Of Representatives, One Hundred Thirteenth Congress, First Session, Thursday, July 11, 2013
- Helium Program: Urgent Issues Facing BLM’s Storage and Sale of Helium Reserves: Testimony before the Committee on Natural Resources, House of Representatives Government Accountability Office
- Kramer, David (May 22, 2012). «Senate bill would preserve US helium reserve: Measure would give scientists first dibs on helium should a shortage develop. Physics Today web site». Archived from the original on October 27, 2012.
- Richardson, Robert C.; Chan, Moses (2009). «Helium, when will it run out?» (PDF). Archived from the original (PDF) on 2015-06-14.
У этого термина существуют и другие значения, см. Гелий (значения).
| |||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
| |||
| Свойства атома | |||
| Имя, символ, номер | Ге́лий/Helium (He), 2 | ||
| Атомная масса (молярная масса) | 4,002602 а. е. м. (г/моль) | ||
| Электронная конфигурация | 1s2 | ||
| Радиус атома | ? (31)[1] пм | ||
| Химические свойства | |||
| Ковалентный радиус | 28[1] пм | ||
| Радиус иона | 93[1] пм | ||
| Электроотрицательность | 4,5 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | 0 | ||
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 0,147 (при −270 °C) 0,00017846 (при +20 °C) г/см³ | ||
| Температура плавления | 0,95 (при 2,5 МПа) | ||
| Температура кипения | 4,215 (для 4He)[2] | ||
| Теплота испарения | 0,08 кДж/моль | ||
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) | ||
| Молярный объём | 31,8 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | гексагональная | ||
| Параметры решётки | a=3,570; c=5,84 Å | ||
| Отношение c/a | 1,633 | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 0,152 Вт/(м·К) |
Ге́лий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической системы. Возглавляет группу инертных газов в периодической системе Менделеева. Обозначается символом He (лат. Helium). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим веществом.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространённость
- 2.1 Во Вселенной
- 2.2 Земная кора
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 5.1 Свойства в газовой фазе
- 5.2 Свойства конденсированных фаз
- 6 Изотопы
- 7 Получение
- 8 Транспортировка
- 9 Применение
- 9.1 В геологии
- 10 В астрономии
- 11 Биологическая роль
- 11.1 Физиологическое действие
- 12 Стоимость
- 13 Интересные факты
- 14 См. также
- 15 Примечания
- 16 Ссылки
История
18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую Академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов[3][4].
Спустя два месяца 20 октября английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно 587,56 нм), он обозначил её D3, так как она была очень близко расположена к Фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер, совместно с английским химиком Эдвардом Франкландом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»)[4].
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифического бога Солнца Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор[4].
В 1881 году итальянец Луиджи Пальмиери опубликовал сообщение об открытии им гелия в вулканических газах (фумаролах). Он исследовал светло-желтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмиери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Ученые круги встретили это сообщение с недоверием, так как свой опыт Пальмиери описал неясно. Спустя многие годы в составе фумарол действительно были найдены небольшие количества гелия и аргона[4].
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому ученому-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло[4].
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента[источник не указан 1252 дня].
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а еще через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере[4][5][6].
Еще до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот[6] и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома[7].

![]()
График зависимости теплоёмкости жидкого гелия от температуры
Только в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий дросселированием (см. Эффект Джоуля — Томсона), после того как газ был предварительно охлажден в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий еще долго оставались безуспешными даже при температуре в 0,71 K, которых достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы[8].
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка»[8]. Более точное значение температуры в этой точке, установленное позднее — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причем без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II[8].
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения[8][9]. Вот что он писал в одном из своих докладов про открытие этого явления[10]:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим. …
… Если вязкость воды равняется 10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
От греч. ἥλιος — «Солнце» (см. Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (по лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»)[4]. В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе[11]. Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва[12][13], во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4)[14]. Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восьмой группы гелий по содержанию в земной коре занимает второе место (после аргона)[15].
Содержание гелия в атмосфере (образуется в результате распада Ac, Th, U) — 5,27·10−4 % по объёму, 7,24·10−5 % по массе[2][6][14]. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5·1014 м³[2]. Гелионосные природные газы содержат как правило до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8 — 16 %[14].
Среднее содержание гелия в земном веществе — 0,003 мг/кг или 0,003 г/т[14]. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8 — 3,5 л/кг, а в торианите оно достигает 10,5 л/кг[6][14]. Этот гелий является радиогенным и содержит лишь изотоп 4He, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов.
Определение
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.)[2].
Физические свойства
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4He) наименьшая среди всех простых веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Химические свойства
Гелий — наименее химически активный элемент восьмой группы таблицы Менделеева (инертные газы) [16]. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2+, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Энергия связи молекулярного иона гелия He2+ составляет 58 ккал/моль, равновесное межъядерное расстояние 1,09 Å.[17]
Известно химическое соединение гелия LiHe (возможно, имелось в виду соединение LiHe7)[18][19].
Свойства в газовой фазе
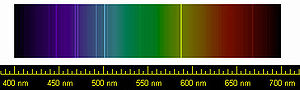
![]()
Спектральные линии гелия
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При нормальных условиях, плотность составляет 0,17847 кг/м³, обладает теплопроводностью 0,1437 Вт⁄(м·К) — бо́льшей, чем у всех других газов за исключением водорода, а его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж⁄(кг·К), для сравнения — 14,23 кДж⁄(кг·К) для Н2).

![]()
Символ элемента, выполненный из газоразрядных трубок, наполненных гелием
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра, важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм[8]. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю.
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце 19 века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. звёздный. Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт.ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 г.[20] (см. Обменное взаимодействие). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) назван ортогелием. Линия парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения.[21] В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно, и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2).
Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49·108 с, или 7,9 года[22]. Первые теоретические оценки[23] показывали[24], что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых гелиеподобных ионов в спектрах солнечной короны[25] было обнаружено[26], что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8·103 с[27].
Следует отметить, что время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ[28], а для двухфотонного распада время жизни составляет 19,5 мс[22].
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л (15 °C), 3,2 мл/л (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
В 1908 году Х.Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 К (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 (4He) при температуре 2,17K; назвал фазы гелий-I и гелий-II (ниже 2,17 K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики. В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид) при исследовании его в торсионном осцилляторе. Однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления.
Изотопы
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Эту смесь, т. н. сырой гелий, (He — 70-90 % об.) очищают от водорода (4-5 %) с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург»[29] в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость. Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (0,15-1 % об.), что позволит намного снизить его себестоимость.
По производству гелия лидируют США (140 млн м³ в год), затем — Алжир (16 млн м³). Россия занимает третье место в мире — 6 млн м³ в год. Мировые запасы гелия составляют 45,6 млрд м³.
В 2003 г. производство гелия в мире составило 110 млн м3, в том числе в США — 87 млн м3, Алжире — 16 млн м3, России — более 6 млн м3, Польше — около 1 млн м3.[30]
Транспортировка

Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение
Уникальные свойства гелия широко используются в промышленности и народном хозяйстве:
- в металлургии в качестве защитного инертного газа для выплавки чистых металлов[источник не указан 214 дней]
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E939, в качестве пропеллента и упаковочного газа
- используется в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние)
- для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъемной силе гелий в силу негорючести абсолютно безопасен
- в дыхательных смесях для глубоководного погружения (см. Баллон для дайвинга)
- для наполнения воздушных шариков и оболочек метеорологических зондов
- для заполнения газоразрядных трубок
- в качестве теплоносителя в некоторых типах ядерных реакторов
- в качестве носителя в газовой хроматографии
- для поиска утечек в трубопроводах и котлах (см. Гелиевый течеискатель)
- как компонент рабочего тела в гелий-неоновых лазерах
- нуклид 3He активно используется в технике нейтронного рассеяния в качестве поляризатора и наполнителя для позиционно-чувствительных нейтронных детекторов
- нуклид 3He является перспективным топливом для термоядерной энергетики
В геологии
Гелий — удобный индикатор для геологов. При помощи гелиевой съёмки[31] можно определять на поверхности Земли расположение глубинных разломов. Гелий, как продукт распада радиоактивных элементов, насыщающих верхний слой земной коры, просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд. Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов[32].
В астрономии
В честь гелия назван астероид (895) Гелио (англ.)русск., открытый в 1918 году.
Биологическая роль
На данный момент биологическая роль не выяснена.
Физиологическое действие
- Хотя инертные газы обладают наркозным действием, это воздействие у гелия и неона при атмосферном давлении не проявляется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[33].
- Вдыхание гелия вызывает кратковременное повышение тембра голоса (обратное эффекту вдыхания ксенона).
Стоимость
- В 2009 г. цены частных компаний на газообразный гелий находились в пределах 2,5—3 $/м³[34].
- В 2010 г. цена в Европе на сжиженный гелий была около 11 евро за литр. В 2012 году — 23 евро за литр
Интересные факты
- Гелий — вещество с самой низкой температурой кипения. Гелий кипит при температуре −269 °C[35].
См. также
- Гелий-3 — лёгкий нерадиоактивный изотоп гелия.
- Эффект Померанчука — аномальный характер плавления (или затвердевания) лёгкого изотопа гелия 3He
- Гелиеметрия — наука, изучающая прохождение гелия через различные среды.
- Жидкий гелий
- Твёрдый гелий
Примечания
- ↑ 1 2 3 Size of helium in several environments (англ.). www.webelements.com. Проверено 10 июля 2009.
- ↑ 1 2 3 4 5 Соколов В. Б. Гелий // Химическая энциклопедия / гл. редактор Кнунянц И. Л.. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 513-514. — ISBN 5-85270-008-8.
- ↑ Kochhar, R. K. French astronomers in India during the 17th — 19th centuries (англ.) // Journal of the British Astronomical Association. — 1991. — Т. 101. — № 2. — С. 95-100.
- ↑ 1 2 3 4 5 6 7 Финкельштейн Д.Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 40-46. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Aaron John Ihde. Chapter 14. Inorganic chemistry I. Fundamental developments // The development of modern chemistry. — Изд. 2-е. — М.: Courier Dover Publications, 1984. — С. 373. — 851 с. — ISBN 0486642356
- ↑ 1 2 3 4 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3-13. — 352 с. — 2400 экз.
- ↑ Бронштейн М.П. Солнечное вещество // Солнечное вещество; Лучи икс; Изобретатели радиотелеграфа. — М.: ТЕРРА — Книжный клуб, 2002. — 224 с. — (Мир вокруг нас). — ISBN 5-275-00531-8
- ↑ 1 2 3 4 5 Финкельштейн Д.Н. Глава V. Гелий // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 111-128. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Капица, П.Л. Viscosity of Liquid Helium below the λ-Point (англ.) // Nature. — 1938. — Т. 141. — P. 74.
- ↑ «Свойства жидкого гелия» (П. Л. Капица)
- ↑ Helium: geological information (англ.). www.webelements.com. Проверено 11 июля 2009.
- ↑ Хокинг С., Млодинов Л. Глава восьмая. Большой взрыв, черные дыры и эволюция Вселенной // Кратчайшая история времени. — СПб: Амфора. ТИД Амфора, 2006. — С. 79-98. — 180 с. — 5000 экз. — ISBN 5-367-00164-5
- ↑ Вайнберг С. V. Первые три минуты // Первые три минуты: современный взгляд на происхождение Вселенной. — Изд. 2-е. — Ижевск: НИЦ «Регулярная и хаотическая динамика», 2000. — С. 105-122. — 272 с. — 1000 экз. — ISBN 5-93972-013-7
- ↑ 1 2 3 4 5 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76-110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Abundance in Earth’s crust (англ.). www.webelements.com. Проверено 11 июля 2009.
- ↑ Фаустовский В. Г., Ровынский А. Е. Петровский Ю.В. Инертные газы. — Изд. 2. — М.: Атомиздат, 1972. — 352 с.
- ↑ Л.Паулинг Природа химической связи / перевод с англ. М.Е.Дяткиной, под ред. проф. Я.К.Сыркина. — М.-Л.: ГНТИ Химической литературы, 1947. — С. 262. — 440 с.
- ↑ Успехи физических наук
- ↑ Эксимерные лазеры
- ↑ W. Heisenberg, Z. Physik 39, 499 (1926).
- ↑ Фриш С.Э. Оптические спектры атомов. — М.-Л.: Издательство физико-математической литературы, 1963. — С. 69-71. — 640 с.
- ↑ 1 2 G. W. F. Drake, G. A. Victor, A. Dalgarno. Two-Photon Decay of the Singlet and Triplet Metastable States of Helium-like Ions. Phys. Rev. 180, 25-32 (1969).
- ↑ G. Breit and E. Teller, Astrophys. J. 91, 215 (1940).
- ↑ R.D.Knight. Lifetime of the Metastable 23S1 State in Stored Li+ Ions. — Ph.D.Thesis. Lawrence Berkeley Laboratory. — 1979. — 136 с.
- ↑ A.H. Gabriel and C. Jordan. Long Wavelength Satellites to the He-like Ion Resonance Lines in the Laboratory and in the Sun. Nature 221, 947 (1969).
- ↑ H.R. Griem, Spontaneous single-photon decay of 23S1 in Helium-like ions. Astrophys. J. 156, L103 (1969).
- ↑ G. Feinberg, J. Sucher. Calculation of the Decay Rate for 23S1 → 11S0 + One Photon in Helium. Phys. Rev. Lett. 26, 681—684 (1971).
- ↑ Это легко объяснимо из соображений симметрии. Как начальное, так и конечное состояние атома сферически симметричны и не имеют выделенного направления — оба электрона находятся в s-состоянии, и сумммарный спиновый момент также нулевой. Излучение фотона с определённым импульсом требует нарушения этой симметрии.
- ↑ Основным поставщиком гелия являлся ОГЗ
- ↑ Сырьевая база и перспективы развития гелиевой промышленности России и мира
- ↑ Helium studies confirm presence of oil on the Aysky block in Russia
- ↑ Государственный реестр открытий СССР. Яницкий И. Н. Научное открытие № 68 «Закономерность распределения концентрации гелия в земной коре»
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 21 августа 2011. Проверено 6 июля 2009.
- ↑ http://www.ngtp.ru/rub/3/15_2009.pdf Нефтегазовая технология. Теория и практика. 2009 (4) ISSN 2070-5379.
- ↑ Книга рекордов Гиннесса для химических веществ
Ссылки
| Гелий на Викискладе? |
- Гелий на Webelements
- Гелий в Популярной библиотеке химических элементов
- Гелиевая съемка
- Гелиевая съемка на Рустамовской площади и Айском блоке в Башкирии
| гелий в Викисловаре? |
| Изотопы гелия |
|---|
| Гипотетические: 2He: Гелий-2 (Дипротон) Стабильные: 3He: Гелий-3, 4He: Гелий-4 Нестабильные (менее суток): 5He: Гелий-5, 6He: Гелий-6, 7He: Гелий-7, 8He: Гелий-8, 9He: Гелий-9, 10He: Гелий-10 см. также. Гелий, Таблица нуклидов |
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
|
|
| Гелий | |
|---|---|
| Атомный номер | 2 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
| Атомная масса (молярная масса) | 4,002602 а. е. м. (г/моль) |
| Радиус атома | ? (31) пм |
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) |
| Электронная конфигурация | 1s2 |
| Химические свойства | |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Электроотрицательность (по Полингу) | 4,5 |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Термодинамические свойства простого вещества | |
| Плотность | 0,147 (при −270 °C) 0,00017846 (при +20 °C) г/см³ |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Теплопроводность | 0,152 Вт/(м·K) |
| Температура плавления | 0,95 (при 2,5 МПа) K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 4,215 (для 4He) K |
| Теплота испарения | 0,08 кДж/моль |
| Молярный объём | 31,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,570; c=5,84 Å |
| Отношение c/a | 1,633 |
| Температура Дебая | n/a K |
Гелий — второй порядковый элемент периодической системы химических элементов Д. И. Менделеева, с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической системы. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He (Helium). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим элементом.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
История открытия Гелия

![]()
Схема атома гелия
18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую Академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов.
Спустя два месяца 20 октября английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно 587,56 нм), он обозначил её D3, так как она была очень близко расположена к Фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер, совместно с английским химиком Эдвардом Франкландом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» ( ήλιος — «солнце»).
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной строне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифического бога Солнца Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор
В 1881 году итальянец Луиджи Пальмиери опубликовал сообщение об открытии им гелия в вулканических газах (фумаролах). Он исследовал светло-желтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмиери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Ученые круги встретили это сообщение с недоверием, так как свой опыт Пальмиери описал неясно. Спустя многие годы в составе фумарол действительно были найдены небольшие количества гелия и аргона
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому ученому-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло.
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента.
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а еще через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере.
Еще до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома.

![]()
График зависимости теплоёмкости жидкого гелия от температуры
Только в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий дросселированием (Эффект Джоуля — Томсона), после того как как газ был предварительно охлажден в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий еще долго оставались безуспешными даже при температуре в 0,71 K, которых достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы.
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка». Более точное значение температуры в этой точке, установленное позднее — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причем без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II.
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения. Вот что он писал в одном из своих докладов про открытие этого явления:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим. …
… Если вязкость воды равняется 10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
От ἥλιος — «Солнце» (Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (по лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»). В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе . Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4). Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восьмой группы гелий по содержанию в земной коре занимает второе место (после аргона).
Содержание гелия в атмосфере (образуется в результате распада Ac, Th, U) — 5,27·10−4 % по объёму, 7,24·10−5 % по массе. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5·1014 м³. Гелионосные природные газы содержат как правило до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8 — 16 %.
Среднее содержание гелия в земном веществе — 3 г/т. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8 — 3,5 л/кг, а в торианите оно достигает 10,5 л/кг.
Определение Гелия
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.).
Физические свойства Гелия
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4He) наименьшая среди всех простых веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Свойства в газовой фазе

![]()
Спектральные линии гелия
При нормальных условиях гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный. Плотность 0,17847 кг/м³. Он обладает теплопроводностью (0,1437 Вт/(м·К) при н.у.) большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж/(кг·К) при н.у., для сравнения — 14,23 кДж/(кг·К) для Н2).

![]()
Символ элемента, выполненный из газоразрядных трубок, наполненных гелием
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра, важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с большей энергией, в результате чего и происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю.
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 (15 °C), 3,2 (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля-Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля-Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
В 1908 году Х.Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 К (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 (4He) при температуре 2,17K; назвал фазы гелий-I и гелий-II (ниже 2,17K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики. В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия, однако интерпретация этого явления не до конца понятна.
Химические свойства Гелия
Гелий — наименее химически активный элемент восьмой группы (Инертные газы) таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)).
Известно химическое соединение гелия LiHe. (возможно, имелось ввиду соединение LiHe7)
Изотопы Гелия
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение Гелия
Промышленность — химический элемент гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Сырой гелий (70-90 % по объёму гелий) очищают от водорода (4-5 %) с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением сырого гелий кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург» в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость. Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (от 0,15 до 1 %), что позволит намного снизить его себестоимость.
По производству гелия лидируют следующие страны мира: США (140 млн м³ в год), затем — Алжир (16 млн м³). Россия занимает третье место в мире — 6 млн м³ в год. Мировые запасы гелия составляют 45,6 млрд м³. Крупные месторождения находятся в США(45 % от мировых ресурсов), далее идут Россия (32 %), Алжир (7 %), Канада (7 %) и Китай (4 %).
Транспортировка гелия
Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды типа СТГ-10, СТГ-25 и СТГ-40 светло-серого цвета объёмом 10, 25 и 40 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение гелия
Уникальные свойства гелия широко используются в промышленности и народном хозяйстве:
— в металлургии в качестве защитного инертного газа для выплавки чистых металлов
— в пищевой промышленности зарегистрирован в качестве пищевой добавки E939, в качестве пропеллента и упаковочного газа
— используется в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние)
— для наполнения воздухоплавающих судов (дирижабли)
— в дыхательных смесях для глубоководного погружения (Баллон для дайвинга)
— для наполнения воздушных шариков и оболочек метеорологических зондов
— для заполнения газоразрядных трубок
— в качестве теплоносителя в некоторых типах ядерных реакторов
— в качестве носителя в газовой хроматографии
— для поиска утечек в трубопроводах и котлах (см. Гелиевый течеискатель)
— как компонент рабочего тела в гелий-неоновых лазерах
— нуклид 3He активно используется в технике нейтронного рассеяния в качестве поляризатора и наполнителя для позиционно-чувствительных нейтронных детекторов
— нуклид 3He является перспективным топливом для термоядерной энергетики
— для изменения тембра голосовых связок (эффект повышенной тональности голоса) за счет различия плотности обычной воздушной смеси и гелия (аналогично гексафториду серы)
Биологическая роль гелия
Гелий не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие гелия (и неона) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)
Интересные факты
В 2000 г. цены частных компаний на газообразный гелий находились в пределах 1,5 — 1,8 $/м³
В 2009 году цены на газообразный гелий находились в пределах 1.800-2.500 рублей за 6 м³ (40-литровый баллон) (Санкт-Петербург).
Дополнительная информация по гелию
Гелий-3 — лёгкий, нерадиоактивный изотоп гелия.
Эффект Померанчука — аномальный характер плавления (или затвердевания) лёгкого изотопа гелия 3He
Гелий, Helium, Не (2)
В 1868 г. французский астроном Жансен наблюдал в Индии полное солнечное затмение и спектроскопически исследовал хромосферу солнца. Он обнаружил в спектре солнца яркую желтую линию, обозначенную им D3, которая не совпадала с желтой линией D натрия. Одновременно с ним эту же линию в спектре солнца увидел английский астроном Локьер, который понял, что она принадлежит неизвестному элементу. Локьер совместно с Франкландом, у которого он тогда работал, решил назвать новый элемент гелием (от греч.- гелиос, солнце). Затем новая желтая линия была обнаружена другими исследователями в спектрах «земных» продуктов; так, в 1881 г. итальянец Пальмиери обнаружил ее при исследовании пробы газа, отобранного в кратере Везувия.
Bсследуя урановые минералы химик Гиллебранд, установил, что они при действии крепкой серной кислоты выделяют газы. Сам Гиллебранд считал, что это азот. Рамзай, обративший внимание на сообщение Гиллебранда, подверг спектроскопическому анализу газы, выделяемые при обработке кислотой минерала клевеита. Он обнаружил, что в газах содержатся азот, аргон, а также неизвестный газ, дающий яркую желтую линию. Не имея в своем распоряжении достаточно хорошего спектроскопа, Рамзай послал пробы нового газа Круксу и Локьеру, которые вскоре идентифицировали газ как гелий. В том же 1895 г. Рамзай выделил гелий из смеси газов; он оказался химически инертным, подобно аргону. Вскоре после этого Локьер, Рунге и Пашен выступили с заявлением, что гелий состоит из смеси двух газов — ортогелий и парагелий; один из них дает желтую линию спектра, другой зеленую. Этот второй газ они предложили назвать астерием (Asterium) от греч.- звездный. Совместно с Траверсом Рамзай проверил это утверждение и доказал, что оно ошибочно, так как цвет линии гелия зависит от давления газа.
| Гелий | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |
 Свечение гелия в газоразрядной трубке | |
| Название, символ, номер | Гелий/Helium (He), 2 |
| Атомная масса (молярная масса) | 4,002602 ± 0,000002 а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 |
| Радиус атома | ? (31) пм |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Электроотрицательность | 4,5 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,147 г/см3 (при −270 °C); 0,00017846 (при +20 °C) г/см³ |
| Температура плавления | 0,95 K (-272,2 °C, -457,96 °F) (при 2,5 МПа) |
| Температура кипения | 4,2152 K (-268,94 °C, -452,08 °F) (для 4He) |
| Уд. теплота плавления | 0,0138 кДж/моль |
| Уд. теплота испарения | 0,0829 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 31,81 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,570 Å; c=5,84 Å |
| Отношение c/a | 1,633 |
| Теплопроводность | (300 K) 0,152 Вт/(м·К) |
| Номер CAS | 7440-59-7 |
Гелий (He, лат. helium) — химический элемент 18-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы VIII группы) первого периода системы химических элементов Д. И. Менделеева, с атомным номером 2. Возглавляет группу инертных газов.
Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
По распространённости во Вселенной занимает второе место после водорода и является вторым по лёгкости, также после водорода, химическим веществом. Его температура кипения — самая низкая среди всех известных веществ.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой.
Содержание
- 1 История открытия
- 1.1 Происхождение названия
- 2 Распространённость
- 2.1 Во Вселенной
- 2.2 Земная кора
- 3 Определение
- 4 Физические свойства
- 5 Химические свойства
- 5.1 Свойства в газовой фазе
- 5.2 Свойства конденсированных фаз
- 6 Изотопы
- 7 Получение
- 8 Транспортировка
- 9 Применение
- 9.1 В геологии
- 9.2 Военное применение
- 9.3 В астрономии
- 10 Биологическая роль
- 10.1 Физиологическое действие
- 10.2 Риски для здоровья
- 11 Стоимость
История открытия

18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов.
Спустя два месяца, 20 октября, английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно — 587,56 нм), он обозначил её D3, так как она была очень близко расположена к фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер совместно с английским химиком Эдуардом Франклендом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»).
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещёнными ветвями лавра, а на другой — изображение мифологического бога света Аполлона, правящего в колеснице четвёркой коней, скачущей во весь опор.
В 1881 году итальянец Луиджи Пальмьери опубликовал сообщение об открытии им гелия в вулканических газах фумарол. Он исследовал светло-жёлтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмьери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Учёные круги встретили это сообщение с недоверием, так как свой опыт Пальмьери описал неясно. Спустя многие годы в составе фумарольных газов действительно были найдены небольшие количества гелия и аргона.
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому учёному-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло.
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента.
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а ещё через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере.
Ещё до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот, и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома.
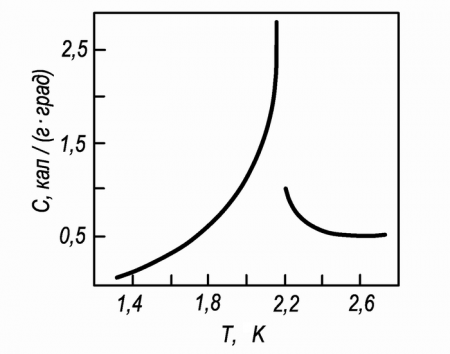
График зависимости теплоёмкости жидкого гелия от температуры.
Только в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий. Он использовал дросселирование (см. Эффект Джоуля — Томсона), после того как газ был предварительно охлаждён в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий ещё долго оставались безуспешными даже при температуре в 0,71 K, которую достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы.
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением, и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка». Более точное значение температуры в этой точке, установленное позднее, — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причем без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II.
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения. Вот что он писал в одном из своих докладов про открытие этого явления:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим.
… Если вязкость воды равняется 10⋅10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
От греч. ἥλιος — «Солнце» (см. Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (на лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»). В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе. Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде, — это ядра гелия-4). Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восемнадцатой группы гелий по содержанию в земной коре занимает второе место (после аргона).
Содержание гелия в атмосфере (образуется в результате распада тория, урана и их дочерних радионуклидов) — 5,27⋅10−4 % по объёму, 7,24⋅10−5 % по массе. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5⋅1014 м³. Гелионосные природные газы содержат, как правило, до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8—16 %.
Среднее содержание гелия в земном веществе — 0,003 мг/кг или 0,003 г/т. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8—3,5 л/кг, а в торианите оно достигает 10,5 л/кг. Этот гелий является радиогенным и содержит лишь изотоп 4
He, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов, а также других природных альфа-активных элементов (самарий, гадолиний и т. д.).
В 2016 году норвежские и британские ученые обнаружили залежи гелия в районе озера Виктория в Танзании. По примерным оценкам экспертов, объём запасов — 1,5 млрд кубических метров.
Значительные запасы гелия содержатся в восточносибирских газовых месторождениях в России. Запасы гелия в Ковыктинском месторождении оцениваются в 2,3 млрд. кубометров , в Чаяндинском месторождении — в 1.4 млрд. кубометров.
Определение
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.).
Физические свойства
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксичное, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4
He) наименьшая среди всех веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при абсолютном нуле. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Химические свойства
Гелий — наименее химически активный элемент 18-й группы (инертные газы) и вообще всей таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He+
2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Энергия связи молекулярного иона гелия He+
2 составляет 58 ккал/моль, равновесное межъядерное расстояние — 1,09 Å.
Известно эксимерное химическое соединение гелия LiHe.
Свойства в газовой фазе
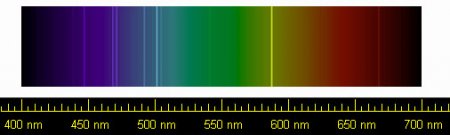
Спектральные линии гелия.
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При нормальных условиях плотность составляет 0,17847 кг/м³, обладает теплопроводностью 0,1437 Вт⁄(м·К) — бо́льшей, чем у всех других газов, за исключением водорода, а его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж⁄кг·К; для сравнения — для H2 она равна 14,23 кДж⁄кг·К).

Символ элемента, выполненный из газоразрядных трубок, наполненных гелием.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце XIX века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них, по их предположению, имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. «звёздный». Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт. ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 году (см. Обменное взаимодействие). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) — ортогелия. Линии парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения. В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно, и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2).
Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49⋅108 с, или 7,9 года. Первые теоретические оценки показывали, что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых гелиеподобных ионов в спектрах солнечной короны, было обнаружено, что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8⋅103 с.
Следует отметить, что время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ, а для двухфотонного распада время жизни составляет 19,5 мс.
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л (15 °C), 3,2 мл/л (25 °C).
Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается при дросселировании через пористые перегородки или маленькие отверстия, но, как и все газы, охлаждается при любой температуре при адиабатическом расширении. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает в процессе дросселирования.
После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
Основные статьи: Жидкий гелий и Твёрдый гелий
В 1908 году Х. Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 K (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 при температуре 2,17 K; он назвал фазы гелий-I и гелий-II (ниже 2,17 K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид) при исследовании его в торсионном осцилляторе, однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления.
Изотопы
Основная статья: Изотопы гелия
Природный гелий состоит из двух стабильных изотопов: 4
He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3
He (0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Охлаждение производят дросселированием в несколько стадий, очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода.
Эту смесь, так называемый сырой гелий (70—90 % гелия по объёму) очищают от водорода (4—5 %) с помощью CuO при 650—800 К.
Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активированном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % гелия по объёму) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург» в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость. Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (0,15—1 % об.), что позволит намного снизить его себестоимость.
Мировые запасы гелия составляют 45,6 млрд м³. В 2003 году производство гелия в мире составило 110 млн м³, в том числе в США — 87 млн м³, Алжире — 16 млн м³, России — более 6 млн м³, Польше — около 1 млн м³.
Транспортировка

Два сосуда Дьюара по 250 л с жидким гелием.
Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды Дьюара типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение
Гелий широко используется в промышленности и народном хозяйстве:
- в металлургии в качестве защитного инертного газа для выплавки чистых металлов;
- в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
- в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
- для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъёмной силе гелий в силу негорючести абсолютно безопасен;
- в дыхательных смесях для глубоководного погружения (см. Баллон для дайвинга);
- для наполнения воздушных шариков и оболочек метеорологических зондов;
- для заполнения газоразрядных трубок;
- в качестве теплоносителя в некоторых типах ядерных реакторов;
- в качестве носителя в газовой хроматографии;
- для поиска утечек в трубопроводах и котлах (см. Гелиевый течеискатель);
- как компонент рабочего тела в гелий-неоновых лазерах;
- в качестве наполнителя в некоторых современных моделях накопителей на жестких магнитных дисках;
- для наполнения колб филаментных светодиодных ламп, что позволяет эффективно отводить тепло от светодиодных нитей.
Кроме того, нуклид 3
He используется как рабочее вещество газовых нейтронных детекторов, в том числе позиционно-чувствительных, в технике нейтронного рассеяния в качестве поляризатора. Гелий-3 является также перспективным топливом для термоядерной энергетики. Растворение гелия-3 в гелии-4 используется для получения сверхнизких температур.
В геологии
Гелий — удобный индикатор для геологов. При помощи гелиевой съёмки можно определять на поверхности Земли расположение глубинных разломов. Гелий как продукт распада радиоактивных элементов, насыщающих верхний слой земной коры, просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд. Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов.
Также гелий может использоваться для выявления геотермальных источников. Согласно опубликованным исследованиям, концентрации гелия в почвенном газе над геотермальными источниками превышает фоновые значения в 20-200 раз.
Повышенные концентрации гелия в почвенном газе могут указывать на наличие залежей урана
Военное применение
- Первая мировая война — заправка военных дирижаблей в США и Германии.
- 1930-е — 1960-е годы — ошибочно считалось, что выделения гелия можно применять для поиска урановых руд. Против этого ещё в 1911 году выступала М. Склодовская-Кюри.
- С 1950-х годов — продувка топливных баков жидкостных ракет.
В астрономии
В честь гелия назван астероид (895) Гелио, открытый в 1918 году.
Биологическая роль
Гелий, насколько это известно, не несёт какой-либо биологической функции.
Физиологическое действие
- Хотя инертные газы обладают наркозным действием, это воздействие у гелия и неона при атмосферном давлении не проявляется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД).
- Содержание гелия в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания). Аналогичный эффект часто оказывает единоразовый вдох чистого гелия, например, из шарика с гелием. Как и при вдыхании других инертных газов, ввиду отсутствия вкуса и запаха часто происходит неожиданная потеря сознания при вдохе больших концентраций.
- При вдыхании гелия тембр голоса становится тонким, похожим на кряканье утки. Более высокая, чем в воздухе, скорость звука в гелии при прочих равных условиях (например, температуре) увеличивает значение частоты резонанса голосового тракта (как ёмкости, наполненной газом).
Риски для здоровья
Вдыхание гелия может быть опасно для здоровья, в связи с тем, что в лёгкие не попадает кислород.
Стоимость
- В 2009 году цены частных компаний на газообразный гелий находились в пределах 2,5—3 долл./м³.
- В 2019 году цена гелия существенно выросла и составляет 30-32 долл./м3 за газ чистотой 99,995 %.
| Изотопы гелия |
|---|
|
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Запрос «He» перенаправляется сюда; см. также другие значения.
У этого термина существуют и другие значения, см. Гелий (значения).
| Гелий | |||
|---|---|---|---|
| ← Водород | Литий → | |||
| |||
| Внешний вид простого вещества | |||
 Свечение гелия в газоразрядной трубке | |||
| Свойства атома | |||
| Название, символ, номер | Гелий/Helium (He), 2 | ||
| Группа, период, блок | 18 (устар. 8), 1, s-элемент | ||
| Атомная масса (молярная масса) | 4,002602 ± 2,0E−6[1][2] а. е. м. (г/моль) | ||
| Электронная конфигурация | 1s2 | ||
| Радиус атома | ? (31)[3] пм | ||
| Химические свойства | |||
| Ковалентный радиус | 28[3] пм | ||
| Радиус иона | 93[3] пм | ||
| Электроотрицательность | 4,5 (шкала Полинга) | ||
| Электродный потенциал | 0 | ||
| Степени окисления | 0 | ||
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 0,147 г/см3 (при −270 °C); 0,00017846 (при +20 °C) г/см³ | ||
| Температура плавления | 0,95 K (-272,2 °C, -457,96 °F) (при 2,5 МПа) | ||
| Температура кипения | 4,2152 K (-268,94 °C, -452,08 °F) (для 4He)[4] | ||
| Уд. теплота плавления | 0,0138 кДж/моль | ||
| Уд. теплота испарения | 0,0829 кДж/моль | ||
| Молярная теплоёмкость | 20,79[4] Дж/(K·моль) | ||
| Молярный объём | 22,4⋅103 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Гексагональная | ||
| Параметры решётки | a=3,570 Å; c=5,84 Å | ||
| Отношение c/a | 1,633 | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 0,152 Вт/(м·К) | ||
| Номер CAS | 7440-59-7 | ||
| Эмиссионный спектр | |||
|
|
Ге́лий (химический символ — He, лат. Helium) — химический элемент 18-й группы (по устаревшей классификации — побочной подгруппы восьмой группы, VIIIB)[5] первого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 2.
Простое вещество, гелий — инертный одноатомный газ без цвета, вкуса и запаха.
По распространённости во Вселенной и по лёгкости занимает второе место после водорода. Его температура кипения — самая низкая среди всех известных веществ.
История открытия

18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелёно-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов[6][7].
Спустя два месяца, 20 октября, английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно — 587,56 нм), он обозначил её D3, так как она была очень близко расположена к фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер совместно с английским химиком Эдуардом Франклендом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»)[7].
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещёнными ветвями лавра, а на другой — изображение мифологического бога света Аполлона, правящего в колеснице четвёркой коней, скачущей во весь опор[7].
В 1881 году итальянец Луиджи Пальмьери опубликовал сообщение об открытии им гелия в вулканических газах фумарол. Он исследовал светло-жёлтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмьери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Учёные круги встретили это сообщение с недоверием, так как свой опыт Пальмьери описал неясно. Спустя многие годы в составе фумарольных газов действительно были найдены небольшие количества гелия и аргона[7].
Через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому учёному-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло[7].
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента[8][9].
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а в 1898 году Эдвард Бэли окончательно доказали присутствие гелия в атмосфере[7][10][11].
Ещё до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд (англ. Hillebrand), однако он ошибочно полагал, что получил азот[11][12], и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. В 1906 году Э. Резерфорд и Т. Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия[13]. Эти исследования положили начало современной теории строения атома[14].

График зависимости теплоёмкости жидкого гелия-4 от температуры
В 1908 году нидерландский физик Хейке Камерлинг-Оннес получил жидкий гелий. Он использовал дросселирование (см. Эффект Джоуля — Томсона), после того как газ был предварительно охлаждён в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий ещё долго оставались безуспешными даже при температуре в 0,71 K, которую достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. В 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, он выделил кристаллы[15].
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением, и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка»[15]. Более точное значение температуры в этой точке, установленное позднее, — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причём без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II[15].
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения[15][16]. Вот что он писал в одном из своих докладов про открытие этого явления[17]:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.
И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим.
… Если вязкость воды равняется 10⋅10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
Название произошло от греч. ἥλιος — «Солнце» (см. Гелиос). В названии элемента было использовано характерное для металлов окончание «-ий» (на лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»)[7]. В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3[18].
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе[19]. Однако на Земле этот элемент редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого взрыва[20][21], во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде, — это ядра гелия-4)[22]. Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восемнадцатой группы гелий по содержанию в земной коре занимает второе место (после аргона)[23].
Содержание гелия в атмосфере (образуется в результате распада тория, урана и их дочерних радионуклидов) — 5,27⋅10−4 % по объёму, 7,24⋅10−5 % по массе[4][11][22]. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5⋅1014 м³[4]. Гелионосные природные газы содержат, как правило, до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8—16 %[22].
Среднее содержание гелия в земном веществе — 0,003 мг/кг, или 0,003 г/т[22]. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий[24]: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8—3,5 л/кг, а в торианите оно достигает 10,5 л/кг[11][22]. Этот гелий является радиогенным и содержит лишь изотоп 4
He, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов, а также других природных альфа-активных элементов (самарий, гадолиний и т. д.).
В 2016 году норвежские и британские ученые обнаружили залежи гелия в районе озера Виктория в Танзании. По примерным оценкам экспертов, объём запасов — 1,5 млрд кубических метров[25].
Значительные запасы гелия содержатся в восточносибирских газовых месторождениях в России. Запасы гелия в Ковыктинском месторождении оцениваются в 2,3 млрд кубометров[26] , в Чаяндинском месторождении — в 1,4 млрд кубометров[27].
Мировой рынок гелия
Гелий извлекают из природного и нефтяного газов; мировые запасы оцениваются в 45,6 млрд м³.
Мировой рынок гелия — 170—190 млн м³/год[28] Основная доля мирового производства гелия приходится на США и Катар; с 2015 года доля Соединенных Штатов в мировом производственном балансе снизилась с 67 % до примерно 56 % и продолжает сокращаться, Катар и Алжир занимают соответственно около 28 и 9 % рынка.
Добыча в России
Россия сама обеспечивает себя этим газом; внутренний спрос на 2020 год не превышал 5 млн м³.[29] До последнего времени практически весь гелий производился на гелиевом заводе ООО «Газпром добыча Оренбург»[30] из газа с низким содержанием гелия (до 0,055 % об.), поэтому имел высокую себестоимость.
9 июня 2021 года возле города Свободный Амурской области состоялся запуск крупнейшего в мире по производству гелия Амурского газоперерабатывающего завода мощностью 60 млн м³ гелия в год[31]. Ресурсной базой для него служит газ Чаяндинского месторождения с содержанием гелия на порядок более высоким — что позволяет намного снизить его себестоимость. Россия с 2021 года планирует стать одним из крупнейших экспортеров гелия[32].
С 2018 года Иркутская нефтяная компания ведет строительство двух гелиевых заводов в Иркутской области.[33] Плановая мощность — 15-17 млн л гелия в год, запуск первого завода — 2022 год.
Актуальной проблемой является дальнейшее освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири, отличающихся сходным с Чаяндинским высоким содержанием гелия (0,15—1 % об.).
Стоимость
- В 2009 году цены частных компаний на газообразный гелий находились в пределах 2,5—3 долл./м³[34].
- В 2019 году цена гелия существенно выросла и составляет 30-32 долл./м³ за газ чистотой 99,995 %[источник не указан 1365 дней].
Производство гелия
Гелий добывается из природного газа процессом низкотемпературного разделения — фракционной дистилляцией либо путём мембранного газоразделения[35].
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Охлаждение производят дросселированием в несколько стадий, очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода.
Эту смесь, так называемый сырой гелий (70—90 % гелия по объёму) очищают от водорода (4—5 %) с помощью CuO при 650—800 К.
Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активированном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % гелия по объёму) и высокой чистоты (99,985 %).
Определение
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.)[4].
Физические свойства

Фазовая диаграмма 4Не

Гелий — практически инертный химический элемент.
Простое вещество гелий нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4
He) наименьшая среди всех веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при абсолютном нуле. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Гелий 3Не и 4Не не имеют основной тройной точки (в которой равновесные фазы находятся в различных агрегатных состояниях — твёрдом, жидком и газообразном) — в обоих случаях линии равновесия твёрдой фазы с жидкими (Не I и Не II) и жидких фаз с газообразной нигде не пересекаются: твёрдая фаза находится в равновесии только с жидкой[36][37][38]. Другие вещества с такой особенностью неизвестны[37]. Наличие на фазовой диаграмме гелия кривой сосуществования твёрдой и жидкой фаз и отсутствие на диаграмме кривой сосуществования твёрдой и газовой фаз означает, что твёрдый гелий может плавиться, но не может испаряться[39].
Химические свойства
Гелий — наименее химически активный элемент 18-й группы (инертные газы) и вообще всей таблицы Менделеева[40]. Все химические соединения гелия (как и аргона, неона) существуют только в виде так называемых эксимерных молекул (крайне нестабильных), у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He+
2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Также существует возможность связи атома гелия силами Ван-дер-Ваальса, например, с молекулой фуллерена или с атомом неона, однако в таких структурах другие атомы не влияют на электронную структуру атома гелия[41][42].
Энергия связи молекулярного иона гелия He+
2 составляет 58 ккал/моль, равновесное межъядерное расстояние — 1,09 Å[43].
Свойства в газовой фазе
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При стандартных условиях (ст.у.: 0 °C, 105 Па) его плотность составляет 0,17847 кг/м³, он обладает теплопроводностью 0,1437 Вт/(м·К), а его удельная теплоёмкость чрезвычайно высока: ср = 5,193 кДж/(кг·К)[44][45]; для сравнения — для Н2 она равна 14,23 кДж/(кг·К). Удельная теплоёмкость при постоянном объёме сv = 3,116 кДж/(кг·К) (ст.у.)[44]. Скорость звука в гелии равна 972,8 м/с (ст.у.)[44]. Таким образом, теплопроводность, удельная теплоёмкость, скорость звука и удельный объём (величина, обратная плотности) у гелия больше, чем у всех других газов, за исключением водорода.

Символ элемента, выполненный из газоразрядных трубок, наполненных гелием
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л при 15 °C и 3,2 мл/л при 25 °C.
Скорость диффузии сквозь твёрдые материалы, которая в первом приближении обратно пропорциональна корню из молекулярной массы, у гелия в три раза выше, чем у воздуха, и составляет приблизительно 65 % от скорости диффузии водорода[46].
Коэффициент преломления гелия ближе к единице, чем у любого другого газа при равных условиях. Например, для излучения с длиной волны 589,6 нм (спектральная линия натрия D) показатель преломления (ст.у.) у гелия равен nD = 1 + 35·10−6, у водорода 1 + 132·10−6, у азота 1 + 298·10−6[47].
Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается при дросселировании через пористые перегородки или маленькие отверстия, но, как и все газы, охлаждается при любой температуре при адиабатическом расширении. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает в процессе дросселирования.
После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Спектр нейтрального гелия

Спектральные линии гелия

Эмиссионный спектр нейтрального гелия в диапазоне длин волн 380—780 нм в тлеющем разряде при давлении ~10 торр. Наиболее интенсивная жёлтая линия с длиной волны 587,562 нм представляет собой очень тесный триплет
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,62 нм и 447,14 нм[15]. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце XIX века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них, по их предположению, имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. «звёздный». Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт. ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 году[48] (см. Обменное взаимодействие). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) — ортогелия. Линии парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного состояния. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения[49]. В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2).
Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49⋅108 с, или 7,9 года[50]. Первые теоретические оценки[51] показывали[52], что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых подобных гелию ионов в спектрах солнечной короны[53], было обнаружено[54], что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8⋅103 с[55].
Время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ[56], а для двухфотонного распада время жизни составляет 19,5 мс[50].
Свойства конденсированных фаз
В 1908 году Х. Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 K (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 при температуре 2,17 K; он назвал фазы гелий-I и гелий-II (ниже 2,17 K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид) при исследовании его в торсионном осцилляторе, однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления.[источник не указан 995 дней]
Изотопы
Природный гелий состоит из двух стабильных изотопов: 4
He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3
He (0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Транспортировка

Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды Дьюара типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение
Гелий широко используется в промышленности и народном хозяйстве:
- в металлургии в качестве защитного инертного газа для выплавки чистых металлов[источник не указан 3893 дня];
- в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
- в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
- для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъёмной силе гелий в силу негорючести абсолютно безопасен;
- в дыхательных смесях для глубоководного погружения (см. Баллон для дайвинга);
- для наполнения воздушных шариков и оболочек метеорологических зондов;
- для заполнения газоразрядных трубок;
- в качестве теплоносителя в некоторых типах ядерных реакторов;
- в качестве носителя в газовой хроматографии;
- для поиска утечек в трубопроводах и котлах (см. Гелиевый течеискатель);
- как компонент рабочего тела в гелий-неоновых лазерах;
- в качестве наполнителя в некоторых современных моделях накопителей на жёстких магнитных дисках;
- для наполнения колб филаментных светодиодных ламп, что позволяет эффективно отводить тепло от светодиодных нитей.
Кроме того, нуклид 3
He используется как рабочее вещество газовых нейтронных детекторов, в том числе позиционно-чувствительных, в технике нейтронного рассеяния в качестве поляризатора. Гелий-3 является также перспективным топливом для термоядерной энергетики. Растворение гелия-3 в гелии-4 используется для получения сверхнизких температур.
В геологии
Гелий — удобный индикатор для геологов. При помощи гелиевой съёмки[57] можно определять на поверхности Земли расположение глубинных разломов. Гелий как продукт распада радиоактивных элементов, насыщающих верхний слой земной коры, просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд. Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов[58].
Также гелий может использоваться для выявления геотермальных источников. Согласно опубликованным исследованиям, концентрации гелия в почвенном газе над геотермальными источниками превышает фоновые значения в 20—200 раз[59].
Повышенные концентрации гелия в почвенном газе могут указывать на наличие залежей урана[60]
Военное применение
- Первая мировая война — заправка военных дирижаблей в США и Германии.
- 1930-е — 1960-е годы — ошибочно считалось, что выделения гелия можно применять для поиска урановых руд[61]. Против этого ещё в 1911 году выступала М. Склодовская-Кюри.
- С 1950-х годов — продувка топливных баков жидкостных ракет.
В астрономии
В честь гелия назван астероид (895) Гелио, открытый в 1918 году.
Биологическая роль
Гелий, насколько это известно, не несёт какой-либо биологической функции.
Физиологическое действие
- Хотя инертные газы обладают наркозным действием, это воздействие у гелия и неона при атмосферном давлении не проявляется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[62].
- Содержание гелия в высоких концентрациях (более 80 %) во вдыхаемой смеси может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания и газовой эмболии)[63]. Аналогичный эффект часто оказывает единоразовый вдох чистого гелия, например, из шарика с гелием. Как и при вдыхании других инертных газов, ввиду отсутствия вкуса и запаха часто происходит неожиданная потеря сознания при вдохе больших концентраций.
- При вдыхании гелия тембр голоса становится тонким, похожим на кряканье утки[64]. Более высокая, чем в воздухе, скорость звука в гелии при прочих равных условиях (например, температуре) увеличивает значение частоты резонанса голосового тракта (как ёмкости, наполненной газом).
Риски для здоровья
Вдыхание гелия может быть опасно для здоровья в связи с тем, что в лёгкие не попадает кислород, однако гелиокс и тримикс (кислород, азот, гелий) считаются относительно безопасными дыхательными смесями[65][66][67].
См. также
- Изотопы гелия: гелий-2 (дипротон), гелий-3, гелий-4.
- Агрегатные состояния: жидкий гелий, твёрдый гелий.
- Гелиеметрия — наука, изучающая прохождение гелия через различные среды.
- Гелиевая съёмка — один из методов геохимических геологоразведочных работ.
- Эффект Померанчука — аномальный характер плавления (или затвердевания) лёгкого изотопа гелия 3
He.
Примечания
- ↑ 1 2 Meija J., Coplen T. B., Berglund M., Brand W. A., Bièvre P. D., Gröning M., Holden N. E., Irrgeher J., Loss R. D., Walczyk T. et al. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry — IUPAC, 2016. — Vol. 88, Iss. 3. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2015-0305
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 Size of helium in several environments (англ.). www.webelements.com. Дата обращения: 10 июля 2009. Архивировано 19 декабря 2008 года.
- ↑ 1 2 3 4 5 Соколов В. Б. Гелий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 513—514. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Бердоносов С. С. Гелий. Большая российская энциклопедия (2016). Дата обращения: 31 декабря 2019. Архивировано 31 декабря 2019 года.
- ↑ Kochhar R. K. French astronomers in India during the 17th – 19th centuries (англ.) // Journal of the British Astronomical Association (англ.) (рус.. — 1991. — Vol. 101, no. 2. — P. 95—100.
- ↑ 1 2 3 4 5 6 7 Финкельштейн Д. Н. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 40—46. — (Наука и технический прогресс). — 19 000 экз.
- ↑ Langlet N. A. Das Atomgewicht des Heliums (нем.) // Zeitschrift für anorganische Chemie (англ.) (рус.. — 1895. — Bd. 10, № 1. — С. 289—292. — doi:10.1002/zaac.18950100130.
- ↑ Weaver, E. R. Bibliography of Helium Literature // Industrial & Engineering Chemistry. — 1919.
- ↑ Aaron John Ihde. Chapter 14. Inorganic chemistry I. Fundamental developments // The development of modern chemistry. — Изд. 2-е. — М.: Courier Dover Publications, 1984. — С. 373. — 851 с. — ISBN 0486642356.
- ↑ 1 2 3 4 Фастовский В. Г., Ровинский А. Е., Петровский Ю. В. Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3—13. — 352 с. — 2400 экз.
- ↑ Lockyer J. N. The Story of Helium // Nature. — 1896. — Vol. 53, № 1372. — P. 342—346.
- ↑ Окунев В. С. Основы прикладной ядерной физики и введение в физику реакторов. — 2-е изд., испр. и доп. — М.: Издательство МГТУ им. Н. Э. Баумана, 2015. — С. 138.
- ↑ Бронштейн М. П. Солнечное вещество; Лучи икс; Изобретатели радиотелеграфа. — М.: ТЕРРА — Книжный клуб, 2002. — 224 с. — (Мир вокруг нас). — ISBN 5-275-00531-8.
- ↑ 1 2 3 4 5 Финкельштейн Д. Н. Гелий // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 111—128. — (Наука и технический прогресс). — 19 000 экз.
- ↑ Капица П. Л. Viscosity of Liquid Helium below the λ-Point (англ.) // Nature. — 1938. — Vol. 141. — P. 74.
- ↑ Рубинин П. Е., Дмитриев В. В. Академик П. Л. Капица. Свойства жидкого гелия // Природа. — 1997. — № 12. Архивировано 21 февраля 2016 года.
- ↑ Аруев Н. Н., Неронов Ю. И. Газовые образцы со смесью изотопов водорода и гелия-3 для ЯМР-спектроскопии и оценка магнитного момента ядра гелия-3 // Журнал технической физики. — 2012. — Т. 82, № 11. — С. 116—121. Архивировано 14 января 2020 года.
- ↑ Helium: geological information (англ.). www.webelements.com. Дата обращения: 11 июля 2009. Архивировано 4 августа 2020 года.
- ↑ Хокинг С., Млодинов Л. Глава восьмая. Большой взрыв, черные дыры и эволюция Вселенной // Кратчайшая история времени. — СПб.: Амфора. ТИД Амфора, 2006. — С. 79—98. — 180 с. — 5000 экз. — ISBN 5-367-00164-5.
- ↑ Вайнберг С. V. Первые три минуты // Первые три минуты: современный взгляд на происхождение Вселенной. — Изд. 2-е. — Ижевск: НИЦ «Регулярная и хаотическая динамика», 2000. — С. 105—122. — 272 с. — 1000 экз. — ISBN 5-93972-013-7.
- ↑ 1 2 3 4 5 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76—110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Abundance in Earth’s crust (англ.). www.webelements.com. Дата обращения: 11 июля 2009. Архивировано из оригинала 23 мая 2008 года.
- ↑ Самарий, как и уран и торий, является природным альфа-радиоактивным элементом.
- ↑ Scientists Just Discovered a Massive Field of Precious Helium Gas in Africa. Дата обращения: 28 июня 2016. Архивировано 29 июня 2016 года.
- ↑ Ковыктинское газоконденсатное месторождение. Дата обращения: 5 августа 2019. Архивировано 5 августа 2019 года.
- ↑ Чаяндинское нефтегазоконденсатное месторождение. Дата обращения: 5 августа 2019. Архивировано 5 августа 2019 года.
- ↑ Мировой рынок гелия — ООО «Газпром гелий сервис». Дата обращения: 2 мая 2021. Архивировано 2 мая 2021 года.
- ↑ Взлететь к солнцу: новое российское предприятие окажет влияние на мировой рынок гелия // Рамблер, 18 января 2020
- ↑ Основным поставщиком гелия являлся ОГЗ. Дата обращения: 9 июня 2010. Архивировано 9 мая 2010 года.
- ↑ Путин принял участие в запуске Амурского газоперерабатывающего завода. Дата обращения: 9 июня 2021. Архивировано 9 июня 2021 года.
- ↑ The New York Times: в результате прорыва в производстве гелия мир может оказаться в зависимости от России Архивная копия от 9 декабря 2020 на Wayback Machine // ИноСМИ.ру, 9.12.2020
- ↑ ИНК построит 2-й гелиевый завод в Иркутской области. Дата обращения: 29 сентября 2021. Архивировано 29 сентября 2021 года.
- ↑ Нефтегазовая технология Архивная копия от 7 сентября 2012 на Wayback Machine. Теория и практика. 2009 (4) ISSN 2070-5379.
- ↑ Наращивая мощности. Дата обращения: 11 марта 2021. Архивировано 23 апреля 2021 года.
- ↑ Мюнстер А., Химическая термодинамика, 2002, с. 222.
- ↑ 1 2 Жданов Л. С., Жданов Г. Л., Физика, 1984, с. 121.
- ↑ Глаголев К. В., Морозов А. Н., Физическая термодинамика, 2007, с. 241.
- ↑ Бродянский В. М., От твёрдой воды до жидкого гелия, 1995, с. 253.
- ↑ Фаустовский В. Г., Ровынский А. Е. Петровский Ю.В. Инертные газы. — Изд. 2. — М.: Атомиздат, 1972. — 352 с.
- ↑ Первое стабильное соединение гелия • Картинка дня. «Элементы». Дата обращения: 21 октября 2022.
- ↑ Александр Войтюк. Гелий заставили создать устойчивое химическое соединение. N + 1: научные статьи, новости, открытия. Дата обращения: 21 октября 2022.
- ↑ Л. Паулинг. Природа химической связи / перевод с англ. М. Е. Дяткиной, под ред. проф. Я. К. Сыркина. — М.—Л.: ГНТИ Химической литературы, 1947. — С. 262. — 440 с.
- ↑ 1 2 3 Mc Carty R. D. Thermodynamic Properties of Helium 4 from 2 to 1500 K at Pressures to 108 Pa (англ.) // Journal of Physical and Chemical Reference Data. — 1973. — Vol. 2, no. 4. — P. 923—1042. — ISSN 0047-2689. — doi:10.1063/1.3253133. [исправить]
- ↑ Helium - Element information, properties and uses | Periodic Table. www.rsc.org. Дата обращения: 21 октября 2022.
- ↑ Hampel C. A. The Encyclopedia of the Chemical Elements. — New York : Van Nostrand Reinhold, 1968. — P. 256–268. — ISBN 978-0-442-15598-8.
- ↑ Свойства элементов : Ч. I. Физические свойства / Под ред. Г. В. Самсонова. — 2-е изд. — М.: Металлургия, 1976. — С. 366. — 600 с. — 15 000 экз.
- ↑ W. Heisenberg, Z. Physik 39, 499 (1926).
- ↑ Фриш С. Э. Оптические спектры атомов. — М.—Л.: Издательство физико-математической литературы, 1963. — С. 69—71. — 640 с.
- ↑ 1 2 G. W. F. Drake, G. A. Victor, A. Dalgarno. Two-Photon Decay of the Singlet and Triplet Metastable States of Helium-like Ions. Phys. Rev. 180, 25-32 (1969).
- ↑ G. Breit and E. Teller, Astrophys. J. 91, 215 (1940).
- ↑ R.D.Knight. Lifetime of the Metastable 23S1 State in Stored Li+ Ions. — Ph.D.Thesis. Lawrence Berkeley Laboratory. — 1979. — 136 с.
- ↑ A.H. Gabriel and C. Jordan. Long Wavelength Satellites to the He-like Ion Resonance Lines in the Laboratory and in the Sun Архивная копия от 31 августа 2010 на Wayback Machine. Nature 221, 947 (1969).
- ↑ H.R. Griem, Spontaneous single-photon decay of 23S1 in Helium-like ions. Astrophys. J. 156, L103 (1969).
- ↑ G. Feinberg, J. Sucher. Calculation of the Decay Rate for 23S1 → 11S0 + One Photon in Helium. Phys. Rev. Lett. 26, 681—684 (1971).
- ↑ Это объяснимо из соображений симметрии. Как начальное, так и конечное состояние атома сферически симметричны и не имеют выделенного направления — оба электрона находятся в s-состоянии, и суммарный спиновый момент также нулевой. Излучение фотона с определённым импульсом требует нарушения этой симметрии.
- ↑ Helium studies confirm presence of oil on the Aysky block in Russia. Дата обращения: 21 октября 2011. Архивировано из оригинала 2 апреля 2015 года.
- ↑ Государственный реестр открытий СССР. Яницкий И. Н. Научное открытие № 68 «Закономерность распределения концентрации гелия в земной коре»
- ↑ Helium Survey, A Possible Technique For Locating Geothermal Reservoirs. Alan A. Roberts, Irving Friedman, Terrence J. Donovan, Edward H. Denton. US Geological Survey, Denver, Colorado 80225.
- ↑ Helium Soil Gas Survey of Aurora Uranium Deposit, McDermitt Caldera Complex, Oregon. G. Michael Reimer. U.S. Geological Survey, Branch of Isotope Geology, Denver, Colorado Архивная копия от 1 февраля 2016 на Wayback Machine.
- ↑ Мусиченко Н. И. Закономерности распределения гелия в земной коре и их значение при поисках геохимическими методами месторождений газа, нефти и радиоактивных элементов [Текст] : (Метод. рекомендации) / Н. И. Мусиченко, В. В. Иванов ; М-во геологии СССР. Всесоюз. науч.-исслед. ин-т ядерной геофизики и геохимии «ВНИИЯГГ». — Москва : [б. и.], 1970. — 228 с., 1 л.
- ↑ Павлов Б. Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания. www.argonavt.com (15 мая 2007). Дата обращения: 6 июля 2009. Архивировано из оригинала 21 августа 2011 года.
- ↑ Зотов П. Б., Скрябин Е. Г., Рейхерт Л. И., Жмуров В. А., Спадерова Н. Н., Бухна А. Г., Зенкевич А. А., Плотникова Д. С. Гелий среди средств суицидальных действий // Суицидология. — 2022. — Т. 13, № 2 (47). — С. 92—116. — ISSN 2224-1264. — doi:10.32878/suiciderus.22-13-02(47)-92-116.
- ↑ В. Н. Витер. Эксперименты с гелием ч.8. Дата обращения: 16 декабря 2014. Архивировано 15 сентября 2014 года.
- ↑ Grassberger, Martin; Krauskopf, Astrid. Suicidal asphyxiation with helium: Report of three cases / Suizid mit Helium Gas: Bericht über drei Fälle (German, English) // Wiener Klinische Wochenschrift (англ.) (рус.. — 2007. — Т. 119, № 9—10. — С. 323—325. — doi:10.1007/s00508-007-0785-4. — PMID 17571238.
- ↑ Montgomery B.. 2 found dead under deflated balloon, Tampa Bay Times (3 июня 2006). Архивировано 30 декабря 2013 года. Дата обращения: 27 сентября 2016.
- ↑ Two students die after breathing helium, CBC (4 июня 2006). Архивировано 31 декабря 2013 года. Дата обращения: 27 сентября 2016.
Литература
- Бродянский В. М. От твёрдой воды до жидкого гелия (история холода). — М.: Энергоатомиздат, 1995. — 336 с. — (Научно-популярная библиотека школьника). — ISBN 5-283-00176-8.
- Глаголев К. В., Морозов А. Н. Физическая термодинамика. — 2-е изд., испр. — М.: Изд-во МГТУ им. Н. Э. Баумана, 2007. — 270 с. — (Физика в техническом университете). — ISBN 978-5-7038-3026-0.
- Жданов Л. С., Жданов Г. Л. Физика для средних специальных учебных заведений. — 4-е изд., испр. — М.: Наука, 1984. — 512 с.
- Мюнстер А.[de]. Химическая термодинамика / Пер. с нем. под. ред. чл.-корр. АН СССР Я. И. Герасимова. — 2-е изд., стер. — М.: УРСС, 2002. — 296 с. — ISBN 5-354-00217-6.
- Евдошенко Ю.В. Как открыли советский гелий. К столетию гелиевой промышленности России // Газовый бизнес. 2022. № 2. С. 79-86.
Ссылки
- Гелий на Webelements Архивная копия от 9 мая 2008 на Wayback Machine.
- Гелий в Популярной библиотеке химических элементов Архивная копия от 20 января 2007 на Wayback Machine.
- Гелиевая съёмка Архивная копия от 23 января 2022 на Wayback Machine.
- Гелиевая съёмка на Рустамовской площади и Айском блоке в Башкирии Архивная копия от 27 августа 2016 на Wayback Machine.
![]()
Эта страница в последний раз была отредактирована 2 декабря 2022 в 11:12.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
- Гелий
- химический элемент, атомный номер 2, атомная масса 4,0026, относится к инертным газам, без цвета и запаха. Объемное содержание гелия в воздухе 0,00052%. Гелий значительно легче воздуха, плотность 0,1785 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -268,9°С. Потенциал ионизации 25,4 В. Бесцветный, неядовитый, негорючий и невзрывоопасный газ, хорошо диффундирует через твердые тела. Химическая формула — He.

Содержание
- История открытия
- Способы получения
- Применение
- Применение в сварке
- Опасность и вред
- Хранение и транспортировка
- Характеристики гелия
- Коэффициенты перевода объема и массы He при Т=15°С и Р=0,1 МПа
- Коэффициенты перевода объема и массы He при Т=0°С и Р=0,1 МПа
- Гелий в баллоне
- Давление гелия в баллоне при различной температуре окружающей среды
История открытия гелия
Впервые гелий был обнаружен во время солнечного затмения 1868 г. астрономы впервые применили спектроскопию для исследования атмосферы Солнца.
24 октября 1868 г. Французская академия наук получила два сообщения — от Пьера Жюль Сезара Жансена (Pierre Jules Cesar Janssen) из Индии и от Джозефа Нормана Локьера (Joseph Norman Lockyer) из Лондона — об открытии ими в спектре солнечной короны новой ярко-желтой линии, которой впоследствии был присвоен символ D3. Совпадение двух независимых сообщений из разных концов мира свидетельствовало о возможности методами спектроскопии проникнуть в тайны солнечной атмосферы и других далеких звезд.
Вопрос о том, какому веществу отвечает линия D3, долго еще оставался открытым. Было лишь установлено, что в спектрах элементов, известных на нашей планете, пока не обнаружено спектральной линии, подобной ярко-желтой линии D3. Локьер ошибочно считал, что раскаленный газ, излучение которого дает таинственную линию D3, является модификацией водорода, не встречающейся на Земле.
В августе 1871 г. Кельвин заявил, что линия D3 до сих пор не идентифицирована с каким-либо земным элементом. Возможно, что она принадлежит новому веществу, которому Локьер и Жансен предложили дать название гелий (от греческого слова гелиос — солнце).
В 1895 г. Сэр Уильям Рамзай (Sir William Ramsay) изучал газ, выделенный им из минерала клевеита, и в гейслеровой трубке неожиданно обнаружил яркую желтую линию. Выдающийся спектроскопист того времени Уильям Крукс (William Crookes) определил длину волны новой линии (5874,9 А) и установил, что это линия D3, на этом основании Рамзай сообщил (23 марта 1895 г.) об открытии им гелия на Земле.
Такова история открытия важнейшего представителя группы инертных газов, который сначала был обнаружен в солнечной атмосфере, а затем (через 27 лет) — на Земле.
Вскоре гелий был обнаружен в других минералах и горных породах, содержащих уран. Наличие гелия в земной коре позволило сделать вывод о его содержании в атмосфере, хотя многие ученые утверждали, что этот легкий газ, выделяющийся из земной коры, полностью уносится из атмосферы в космическое пространство. Вскоре Генрих Кайзер, а затем Зигберт Фридлендер (1896 г.), а также Эдвард Бэли в результате анализа первой выпаренной фракции жидкого воздуха доказали его присутствие в атмосфере.
Способы получения гелия
Гелий получают из гелийсодержащих природных газов, минералов и воздуха. Об этом мы писали в статье о производстве гелия, поэтому здесь не будем повторять написанное.
Применение гелия
В промышленности гелий применяют в меньших масштабах, чем газ аргон. Чаще всего его используют:
- хладагент – охлаждение сверхпроводящих магнитов в медицинских сканерах МРТ;
- металлургия – выплавка чистых металлов;
- подводно-спасательное дело – в составе дыхательных смесей;
- сварочное производство – защитный газ;
- в индустрии развлечений – заполнение шариков.
Применение гелия в сварке
В связи с тем, что He примерно в 10 раз легче Ar, что понижает эффективность защиту сварочной ванны при сварке в нижнем положении, но способствует лучшей защите при сварке в потолочном положении, поэтому расход гелия при сварке увеличивается в 1,5-3 раза.
Применяют его в основном при сварке неплавящимся электродом химически чистых и активных материалов и сплавов, а также сплавов на основе алюминия и магния.

Гелий становится предпочтительнее аргона при необходимости дополнительной защиты швов при сварке в потолочном положении. Особенно при сварке титановых сплавов и других химически активных металлов, поглощающих азот и кислород не только в расплавленном состоянии, но и в твердом при нагреве выше определенной температуры.
Однако не только защитные свойства Ar и He различны. Различными являются и характеристики дуги в этих газах. Так, при одинаковой силе тока напряжение дуги в гелии значительно выше, чем дуги в аргоне. Такая дуга имеет большую проплавляющую способность и менее концентрирована (создает иную форму проплавления, более равномерную, в то время как дуга в аргоне при сварке, например, титановых сплавов вольфрамовым электродом дает большое проплавление в центре и значительно меньшее по краям ванны). Перепад напряжения в столбе дуги в гелии больше, чем в аргоне, поэтому изменение длины дуги заметнее сказывается на напряжении и общей ее теплоэффективности. Для более развернутой информации обязательно прочитайте статью о сварочной дуге в инертных газах.

Форма шва и проплавление для различных защитных газов
В зависимости от применения того или иного газа меняется и поверхностное натяжение на границе металл-газовая фаза. Так, для хромоникелевых сталей аустенитного класса поверхностное натяжение жидкого металла при сварке в He заметно меньше, чем в Ar. Это сказывается и на формировании поверхности швов. Более плавные переходы от шва к основному металлу, при сварке в гелии, имеют место и для других металлов, в частности титановых сплавов и в ряде случаев оказывают влияние на некоторые характеристики работоспособности сварных соединений.
Чаще всего He используют для образования инертных газовых смесей c Ar. Обладая большей плотностью, чем гелий, такие смеси лучше защищают металл сварочной ванны от воздуха и увеличивают производительность сварки в целом. В смеси в полной мере реализуются преимущества обоих газов:
- аргон — обеспечивает стабильность горения дуги;
- гелий — обеспечивает высокую степень проплавления.
Опасность и вред гелия
Гелий не относится к ядовитым и токсичным газам, поэтому в малых количествах он не является опасным. Он может оказать действие как удушающий газ (асфиксант) только в том случае, если в результате утечки уровень кислорода окажется ниже допустимой концентрации. Но утечку гелия очень легко выявить т.к. за счет сжимания голосовых связок у человека меняется голос. Мы все знаем данный комический и мультяшный эффект, когда при вдыхании гелия из шарика голос становится более высоким.
Гелий является опасным, только в случае снижения уровня кислорода в окружающей среде ниже допустимой концентрации.
Хранение и траспортировка гелия
Транспортируют и хранят гелий в газообразном состоянии в стальных баллонах при давлении 15 МПа или в сжиженном состоянии при давлении менее 0,2 МПа.
Баллоны с гелием окрашены в коричневый цвет с надписью белыми буквами «ГЕЛИЙ». Баллоны должны соответствовать требованиям ГОСТ 949.

Методы определения доли примесей и условий поставки регламентируются ГОСТ 20461.
Характеристики гелия
Характеристики He указаны в таблицах ниже:
Коэффициенты перевода объема и массы He при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 0,167 | 1 | 1,336 |
| 0,125 | 0,749 | 1 |
| 1 | 5,988 | 8,000 |
Коэффициенты перевода объема и массы He при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 0,178 | 1 | 1,425 |
| 0,125 | 0,702 | 1 |
| 1 | 5,618 | 8,000 |
Гелий в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| He | 40 | 1,002 | 6,0 |
- Сколько литров гелия в баллоне?
Ответ: 40 литров - Сколько гелия в баллоне 40л?
Ответ: 6,5 м3 или 10,85 кг - Сколько весит баллон с гелием 40 литров
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
1,002 — кг масса гелия в баллоне;
Итого: 58,5 + 1,002 = 59,502 кг вес баллона с аргоном.
Давление гелия в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
| -40 | 12,2 |
| -30 | 12,7 |
| -20 | 13,2 |
| -10 | 13,7 |
| 0 | 14,3 |
| +10 | 14,7 |
| +20 | 15,3 |
| +30 | 15,8 |
- https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BB%D0%B8%D0%B9
- http://www.favorit-nn.ru/articles/?child_id=6
| Гелий (He) | |
|---|---|
| Атомный номер | 2 |
| Внешний вид | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
| Атомная масса (молярная масса) | 4,002602 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 2361,3(24,47) кДж/моль (эВ) |
| Электронная конфигурация | 1s2 |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | 93 пм |
| Электроотрицательность (по Полингу) | 4,5 |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Термодинамические свойства | |
| Плотность | 0,147 (при -270 °C) г/см³ |
| Удельная теплоёмкость | 5,188 Дж/(K·моль) |
| Теплопроводность | 0,152 Вт/(м·K) |
| Температура плавления | 0,95 (при 2,5 МПа) K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 4,216 K |
| Теплота испарения | 0,08 кДж/моль |
| Молярный объём | 31,8 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | гексагональная |
| Период решётки | 3,570 Å |
| Отношение c/a | 1,633 |
| Температура Дебая | n/a K |
Ге́лий (He) — 2 элемент периодической системы элементов, газ.
Гелий — практически инертный химический элемент. Возглавляет группу инертных газов в периодической таблице. Нетоксичен, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,216 K) наименьшая среди всех элементов; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при абсолютном нуле. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при стандартных температуре и давлении. Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Гелий занимает второе место по распространённости во Вселенной и лёгкости (после водорода). Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва, во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд. На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4). Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма. Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
История
Открытие гелия началось с 1868 года, когда при наблюдении солнечного затмения два астронома — француз П. Ж. Жансен и англичанин Д. Н. Локьер — независимо друг от друга обнаружили в спектре солнечной короны жёлтую линию (она получила название D3-линии), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 году Локьер объяснил её происхождение присутствием на Солнце нового элемента. В 1895 году англичанин У. Рамзай выделил из природной радиоактивной руды клевеита газ, в спектре которого присутствовала та же D3-линия.
Происхождение названия
Локьер дал гелию имя, отражающее историю его открытия (от греч. Ήλιο (Helio) — солнце). Поскольку Локьер полагал, что обнаруженный элемент — металл, он использовал в латинском названии элемента окончание «-ium» (соответствует русскому окончанию «-ий»), которое обычно употребляется в названии металлов. Таким образом, гелий задолго до своего открытия на Земле получил имя, которое окончанием отличает его от названий остальных инертных газов.
Получение
В настоящее время гелий выделяют из природных гелийсодержащих газов, пользуясь методом глубокого охлаждения (гелий сжижается труднее всех остальных газов). Месторождения таких газов имеются в России, США, Канаде, Китае, Алжире, Польше и Катаре. Гелий содержится также в некоторых минералах (монаците, торианите и других), при этом из 1 кг минерала при нагревании можно выделить до 10 л гелия.
Свойства в газовой фазе
Гелий —— наименее химически активный элемент восьмой группы (инертные газы) таблицы Менделеева. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)). При стандартных температуре и давлении гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный. Он обладает теплопроводностью большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока. Гелий также менее растворим в воде, чем любой другой известный газ. Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода. Примерный диаметр молекулы He2 — 0,20 нм. Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля-Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля-Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры, гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
В 1908 году Х.Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 К (В.Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-IV при температуре 2,17K; назвал фазы гелий-I и гелий-II (ниже 2,17K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики. В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия, однако интерпретация этого явления не до конца понятна.
Применение
Гелий используют для создания инертной и защитной атмосферы при сварке, резке и плавке металлов, при перекачивании ракетного топлива, для наполнения дирижаблей и аэростатов, как компонент активной среды гелий-неоновых лазеров. Гелий-3 используется для наполнения газовых нейтронных детекторов, как рабочее тело гелиевых течеискателей. Жидкий гелий, самая холодная жидкость на Земле, — уникальный хладагент в экспериментальной физике, позволяющий использовать сверхнизкие температуры в научных исследованиях (например, при изучении электрической сверхпроводимости). Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть газовой смеси, подаваемой для дыхания водолазам — замена азота воздуха на гелий предотвращает кессонную болезнь (при вдыхании обычного воздуха содержащийся в нём азот под повышенным давлением растворяется в крови, а при падении давления выделяется из неё в виде пузырьков, закупоривающих мелкие сосуды).
Ссылки
- Гелий на Webelements
- Гелий в Популярной библиотеке химических элементов
- «Гелий» — статья в Физической энциклопедии
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Выделить Гелий и найти в:
|
|
|
- Страница 0 — краткая статья
- Страница 1 — энциклопедическая статья
- Разное — на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Гелий 1», чтобы сохранить ее
Комментарии читателей:
Гелий, свойства атома, химические и физические свойства.
He 2 Гелий
4,002602(2) 1s2
Гелий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), первом периоде периодической системы.
Атом и молекула гелия. Формула гелия. Строение атома гелия
Изотопы и модификации гелия. Гелий-I и гелий-II Гелий-3
Свойства гелия (таблица): температура, плотность, давление и пр.
Физические свойства гелия
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием
Получение гелия
Применение гелия
Таблица химических элементов Д.И. Менделеева
Атом и молекула гелия. Формула гелия. Строение атома гелия:
Гелий (He, лат. helium) – химический элемент VIII группы короткой формы (18-й группы длинной формы) периодической системы химических элементов первого периода системы химических элементов Д. И. Менделеева, с атомным номером 2.
Гелий – неметалл. Гелий возглавляет группу инертных газов в периодической таблицы химических элементов Д. И. Менделеева.
Гелий обозначается символом He.
Как простое вещество гелий при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула гелия одноатомна.
Химическая формула гелия He.
Электронная конфигурация атома гелия 1s2. Потенциал ионизации (первый электрон) атома гелия равен 2372,32 кДж/моль (24,58738880 (15) эВ).
Строение атома гелия. Атом гелия состоит из положительно заряженного ядра (+2), вокруг которого по атомной оболочке (s-орбитали) движутся два электрона. Поскольку гелий расположен в первом периоде, оболочка всего одна. В свою очередь ядро атома гелия состоит из двух протонов и двух нейтронов. Гелий относится к элементам s-семейства.
Радиус атома гелия (вычисленный) составляет 31 пм.
Атомная масса атома гелия 4,002602(2) а. е. м. (г/моль).
Гелий – практически инертный химический элемент.
Изотопы и модификации гелия. Гелий-I и гелий-II:
Изотопы гелия – разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре.
Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Остальные представляют собой шесть искусственных радиоактивных изотопа.
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость – 99,99986 %) и гораздо более редкого 3He (0,00014 %, содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах).
Гелий в атмосфере, почти весь состоящий из тяжёлого нуклида 4He, является продуктом α-распада тяжёлых радиоактивных элементов (урана, тория, актиния), лишь незначительная его часть является реликтовой (то есть захваченной миллиарды лет назад уплотнявшейся космической пылью, из которой образовалась Земля). Ежегодно накапливается в доступных для изучения толщах Земли и вод (25-28)⋅106 м³ гелия.
Содержание 3He в выделенном из атмосферы гелии ничтожно мало, отношение 3He/4He для воздуха равно 1,1⋅10−6, а для гелия из природных газов 1,4⋅10−7. Установлено, что 3He получается в результате β-распада тяжёлого нуклида водорода – трития, который образуется в ряде ядерных реакций в земной коре и верхних слоях атмосферы.
Звёздный гелий (гелий Вселенной) – продукт термоядерной реакции синтеза ядер водорода, протекающей на Солнце и звездах по протон-протонному и углеродно-азотному циклам.
Искусственно получены также другие – тяжёлые радиоактивные изотопы гелия с массовыми числами 5-10:
– 5He, состоящий из двух протонов и трех нейтронов,
– 6He, состоящий из двух протонов и четырех нейтронов,
– 7He, состоящий из двух протонов и пяти нейтронов,
– 8He, состоящий из двух протонов и шести нейтронов.
– 9He, состоящий из двух протонов и семи нейтронов.
– 10He, состоящий из двух протонов и восьми нейтронов.
Свойства гелия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Гелий |
| 102 | Прежнее название | |
| 103 | Латинское название | Helium |
| 104 | Английское название | Helium |
| 105 | Символ | Нe |
| 106 | Атомный номер (номер в таблице) | 2 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Джозеф Норман Локьер, Великобритания, 1868 г., Пьер Жюль Сезар Жансен, Франция, 1868 г. |
| 110 | Год открытия | 1868 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,000073 % |
| 119 | Содержание в земной коре (по массе) | 5,5·10-10 % |
| 120 | Содержание в морях и океанах (по массе) | 7,2·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 23 % |
| 122 | Содержание в Солнце (по массе) | 23 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 4,002602(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 |
| 203 | Электронная оболочка | K2 L0 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 31 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус | 28 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 2 электрона, 2 протона, 2 нейтрона |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 1 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,5 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 2372,32 кДж/моль (24,58738880 (15) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | -48(20) кДж/моль (-0,5(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 1,7846·10-4 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – газ), 1,785·10-4 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 0,125 г/см3 (при температуре кипения -268,928 °C и иных стандартных условиях, состояние вещества – жидкость), 0,147 г/см3 (при -270 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления | -272,20 °C (0,95 К, -457,96 °F) (при давлении 2,5 МПа) |
| 403 | Температура кипения | -268,928 °C (4,222 K, -452,070 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,0138 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 0,0829 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,78 Дж/(K·моль) |
| 411 | Молярный объём | 22,42354 см³/моль |
| 412 | Теплопроводность | 0,1513 Вт/(м·К) (при стандартных условиях), 0,152 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,570 Å, c = 5,84 Å |
| 514 | Отношение c/a | 1,633 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-59-7 |
Примечание:
401* Плотность гелия согласно [1] составляет 1,786·10-4 г/см3 (при 0 °C и нормальных условиях, состояние вещества – газ).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) гелия согласно [4] составляет 0,00723 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) гелия согласно [4] составляет 0,084 кДж/моль.
410* Молярная теплоемкость гелия согласно [3] составляет 20,79 Дж/(K·моль).
Физические свойства гелия:
При стандартных температуре и давлении гелий – бесцветный, не имеющий запаха и вкуса, нетоксичный, инертный одноатомный газ с химической формулой He.
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом.
Гелий – лёгкий газ. Гелий легче воздуха в 7,26 раза, но тяжелее водорода. Так, один кубический метр воздуха, который состоит из смеси разных газов, весит 1,293 кг, а один кубический метр гелия 0,178 кг. Поэтому, например, мыльные пузыри, наполненные гелием, на воздухе стремятся вверх. Один кубический метр гелия может поднять предмет массой 1,115 кг.
Плотность гелия (Нe) составляет 0,00017846 г/см3 при 20 °C и иных стандартных условиях, а при –269 °C и иных стандартных условиях плотность жидкого гелия составляет 0,13 г/см3.
Теплопроводность гелия при 300 K составляет 0,152 Вт/(м·К). Гелий обладает большей теплопроводностью, чем у всех других газов, за исключением водорода. Теплопроводность гелия примерно в 6,255 раз выше теплопроводности воздуха – 0,0243 Вт/(м·К).
Гелий (Нe) почти не растворяется в воде и органических растворителях. Так, растворимость гелия в воде составляет 0,000179 г/100 г (при температуре 30 °C).
Гелий не растворяется в металлах, как, например, водород.
Скорость диффузии гелия сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
При обычных условиях и выше −250 °С при расширении гелий разогревается, а не охлаждается как большинство газов (“нормально” он начинает себя вести ниже −250 оС).
Температура кипения гелия (Нe) составляет −268,928 °C.
Точка кипения гелия (T = 4,222 K для 4He) наименьшая среди всех веществ. При атмосферном давлении гелий не переходит в твёрдую фазу даже при абсолютном нуле.
При 2,1768 К (-270,9732 °C; -455,7518 ° F) и обычном давлении гелий претерпевает фазовый переход второго рода (от гелия I к гелию II), сопровождающийся резким изменением ряда свойств: теплоемкости, вязкости, плотности. Для гелия II (при температуре ниже 2,1768 K) характерна сверхтекучесть – способность протекать без трения через узкие щели (размером менее 100 нм). У гелия II отсутствует вязкость. Гелий II также обладает огромной теплопроводностью. Поэтому в отличие от бурно кипящего гелия I, выглядит как спокойная жидкость с ясно видимым мениском. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
Наглядно сверхтекучесть жидкого гелия проявляется, например, в ходе следующего опыта. Если сверхтекучий жидкий гелий налить в сосуд, он начнет вытекать наружу через его края в направлении более высокой температуры, даже если уровень жидкости сильно ниже краев этого сосуда.
Жидкий гелий практически не растворяет другие вещества.
Гелий – единственное вещество не затвердевающее при обычном давлении даже вблизи 0 K, он кристаллизуется только под давлением выше 2,5 МПа. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Температура плавления гелия (Нe) при давлении 2,5 МПа составляет −272,2 °C.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Критические параметры гелия (Нe) очень низкие: критическая температура гелия − 267,95 °C и критическое давление гелия 0,22746 МПа. Этим объясняются трудности при сжижении гелия.
Скорость звука в гелии (Нe) составляет: 1056 м/с (при 30 °C, состояние вещества – газ), 965 м/с (при 0 °C, состояние вещества – газ), 237,66 м/с (при -272,165 °C, состояние вещества – жидкость), 231,4 м/с (при -271,39 °C, состояние вещества – жидкость), 221,7 м/с (при -270,97 °C, состояние вещества – жидкость), 223,3 м/с (при -270,65 °C, состояние вещества – жидкость), 179,8 м/с (при -268,93 °C, состояние вещества – жидкость).
Динамическая вязкость гелия (Нe) составляет: 0,0188 мПа·с (при 0°C, состояние вещества – газ), 0,0229 мПа·с (при 100°C, состояние вещества – газ), 0,0269 мПа·с (при 200°C, состояние вещества – газ), 0,0342 мПа·с (при 400°C, состояние вещества – газ),
0,0407 мПа·с (при 600°C, состояние вещества – газ).
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием:
При нормальных условиях гелий химически инертен.
Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.
Например, гелий образует двухатомные молекулы He+2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Получение гелия:
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя его свойство сжижаться труднее всех остальных газов.
Жидкий гелий впервые получен в 1908 г., твердый – в 1926 г.
Применение гелия:
Гелий используется во многих областях промышленности и быту:
– в металлургии в качестве защитного инертного газа для выплавки чистых металлов;
– в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
– в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
– для наполнения воздухоплавающих судов (дирижаблей и аэростатов). В отличие от водорода гелий в силу негорючести абсолютно безопасен;
– в дыхательных смесях для глубоководного погружения;
– для наполнения воздушных шариков и оболочек метеорологических зондов;
– для заполнения газоразрядных трубок;
– как компонент рабочего тела в гелий-неоновых лазерах;
– в качестве носителя в газовой хроматографии;
– и пр.
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Helium
- https://de.wikipedia.org/wiki/Helium
- https://ru.wikipedia.org/wiki/Гелий
- http://chemister.ru/Database/properties.php?dbid=1&id=212
- https://chemicalstudy.ru/geliy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
гелий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле гелия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
4 085






