Узнать, из чего состоят аккумуляторы телефона можно, только разобрав его самостоятельно. И то, куча непонятных деталей для неспециалиста мало о чем скажет. Еще один нюанс – разбор батарейки опасная вещь, возможны даже взрывы. Проще – детально изучить устройство, основные элементы и принцип работы батареи из статьи.
Содержание
- Как устроен и работает аккумулятор телефона?
- Принципы и устройства аккумулятора
- Что внутри батарейки?
- Корпус для батареек и из чего он сделан
- Примерный химический состав аккумуляторов телефона
Как устроен и работает аккумулятор телефона?
С виду батарея мобильной техники – небольшой блок и информацией о производителе на поверхности. Чтобы разобраться в особенностях этой детали, нужно детальнее осмотреть устройство аккумуляторов смартфонов.
Принципы и устройства аккумулятора
Батарея телефона, благодаря своим химическим и физическим свойствам является живительным элементом для процессора, дисплея и других частей.
Принцип, по которому работает аккумулятор:
- Ионы лития попадают в специальную решетку графита.
- Ионы при контакте с молекулами углерода создают химическую реакцию.
- Происходят разрывы.
- В результате реакции вырабатывается энергия.
- Энергия оседает на полюсах аккумулятора в форме электричества.
Долгое время производители питательных элементов трудились над одной проблемой. Дело в том, что литий внутри аккумулятора – жидкий. Это плохо сказывалось на стабильности его химических свойств. Когда появлялись трещины на корпусе – жидкий состав просто вытекал. Несмотря на такие недостатки, жидкий вариант обладал низким сопротивлением, поэтому лучше выполнял функции, чем сухой.
Современные батарейки сочетают в себе качественную работу Li-Ion и сухих частиц. Принцип работы аккумуляторов телефона основан на тех же ионах лития, но в устройстве установлен сухой сепаратор. Риск возникновения химических реакций сведен к минимуму. Механизм устроенный так, что при правильной эксплуатации батарейки она не взорвется.
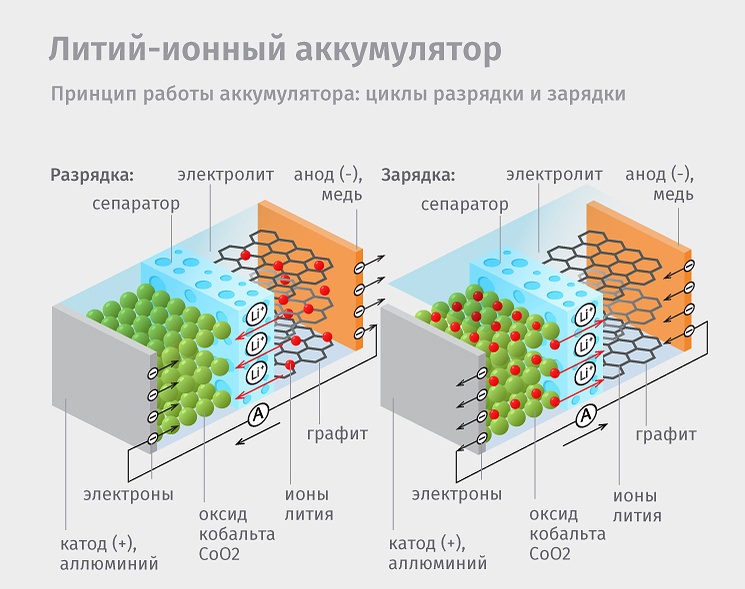
Что внутри батарейки?
Самые сложные элементы аккумуляторов мобильников находятся внутри корпуса. Можно изучить их конструкцию и основные функции. Кроме банки с ионами лития и сепаратора, конструкция оснащена контроллером.
Контроллер – это «мозги» батареи сотового, состоит из таких элементов:
- Резисторы (в схеме питания, защиты).
- Терморезистор.
- MOSFET-транзисторы.
- Микросхема.
- Конденсатор накопления.
Контроллер выполняет следующие функции:
- Контроль заряда. Аккумуляторы телефонов заряжаются постепенно. Первых 10% с невысокой скоростью, потом ускорение до 80%, и конечный этап – замедление. С высокой скоростью заряжается лишь «средняя часть» батарейки, такая особенность работы для снижения нагрузки.
- Защита от перезаряда. Ток от сети поступает, но при достижении напряжения в 4,2 В питание автоматически останавливается.
- Защита от разряда. Установлено и минимальное напряжение, на уровне, примерно в 2,9 В. Даже если процент упал до 0, и мобильный телефон выключился, в аккумуляторе остается небольшой запас. Если его не будет – потеряется полезная емкость.
- Ограничение тока. Напряжение не всегда стабильно, великие скачки или короткое замыкание – однозначно повредят батарею. Это плохо скажется на длительности срока эксплуатации. Ограничитель препятствует этому.
- Балансировка батареи. Это конструкция, состоящая из последовательных электронных элементов. Такая схема обеспечивает равномерный заряд разных частей. От функции зависит долговечность батарейки.
- Контроль за температурой. В каждой батарейке установлен терморезистор. Он контролирует температуру и при надобности защищает устройство от перегрева или переохлаждения.

Корпус для батареек и из чего он сделан
После ознакомления с тем, как устроен аккумулятор телефона, остается ознакомиться с корпусом этой детали.
Он состоит их двух слоев:
- Верхний слой. Пластиковое покрытие. Изолирует банку батареи, защищает ее от воздействия внешних факторов. Еще на покрытии производитель печатает информационный блок.
- Внутренний слой. Это – металл. Материал твердый и прочный, защищает внутренности от повреждений.
Производители аккумуляторов для техники используют металл с определенным показателем эластичности. Это делается для того, чтобы корпус выдержал деформации в случае вздутия батареи.

Примерный химический состав аккумуляторов телефона
Современные производители батареек для смартфонов применяют три класса катодных соединений:
- Кобальт лития. LiCoO2.
- Литий-марганцевая шпинель LiMn2O2.
- Литий-феррофосфат LiFePO4.
Электрохимические цепочки батарей телефонов будут состоять из следующих элементов:
- Литий-кобальтовые: LiCoO2 + 6C → Li1xCoO2 + LiC6
- Литий феррофосфатные: LiFePO4 + 6C → Li1xFePO4 + LiC6
Чтобы понять, как работает и какие функции выполняет батарея смартфона – следует изучить его устройство. Тогда станет понятно, какой элемент за что отвечает, и какие материалы используются.
Как вам статья?
Оценка этой статьи по мнению читателей:
Этой статьей мы начинаем серию увлекательных материалов, посвященных аккумулятору смартфона. На первый взгляд слова «увлекательный» и «аккумулятор» не имеют логической связи. Однако, прочитав эту статью до конца, вы убедитесь в обратном!
Проблема с подобного рода статьями заключается в том, что советы по поводу «правильной» зарядки дает каждый второй пользователь смартфона и нередко можно увидеть прямо противоположную информацию.
Кто-то говорит, что можно без проблем оставлять смартфон на зарядке на всю ночь или разряжать телефон до нуля, ведь система управления питанием не допустит критического падения или превышения напряжения внутри аккумулятора. Другие с этим в корне не согласны, приводя в качестве аргументов личный печальный опыт.
В этой серии мы затронем все вопросы, начиная от принципа работы аккумулятора и заканчивая быстрыми и беспроводными зарядками. В первой части поговорим о том, как вообще работает аккумулятор, откуда там появляется ток и куда он девается, а также ответим на некоторые важные практические вопросы.
Загадочная «баночка с энергией» или как работает аккумулятор смартфона
Многие люди представляют себе аккумулятор телефона в виде небольшой баночки, в которую по проводу из розетки «заливается» ток. Набрали полную батарейку электронов — теперь можем в течение дня расходовать эту энергию на подпитку дисплея, динамиков, процессора и других компонентов смартфона. Закончились электроны в батарейке — телефон разрядился и нужна новая порция электронов.
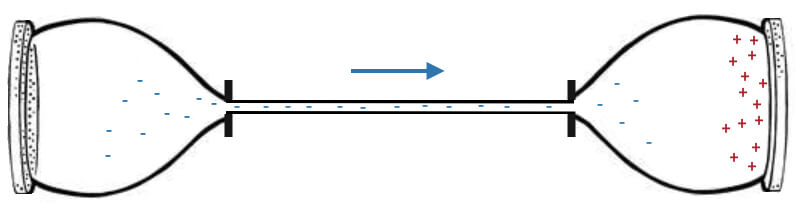
Выглядит эта картина вполне логично, но не совсем верно. В реальности аккумулятор больше похож на закрытые песочные часы, только вместо песка у нас «засыпаны» электроны:
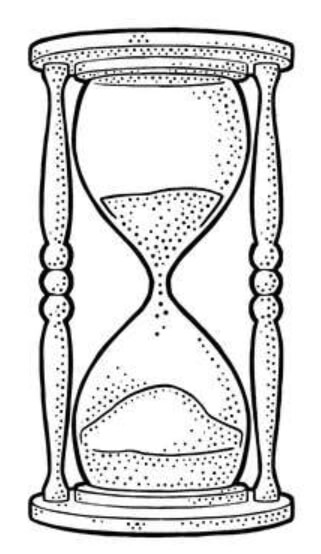
Когда верхний «сосуд» с электронами опустошится, нужно будет зарядить смартфон, то есть, как-то перевернуть часы, чтобы электроны снова посыпались вниз. Зарядка «переворачивает часы», забирая «песок» с нижней части аккумулятора и пересыпая его в «верхнюю» чашу, чтобы электроны снова могли двигаться в нужном направлении.
Мы все прекрасно понимаем, почему песок сыпется вниз. Это происходит под действием силы тяжести. Если бы часы лежали на боку, песок не пересыпался бы с одного сосуда в другой. Теперь представим, что часы лежат на столе (для простоты уберем лишние детали), но электроны «часов» почему-то продолжают «пересыпаться» с одной части в другую:

Как это происходит!? Для ответа на этот вопрос давайте вспомним, что вообще такое электрон. Всё, что нас окружает, состоит из атомов. Атомы, в свою очередь, состоят из ядра, вокруг которого, словно планеты вокруг солнца, вращаются электроны (на самом деле, это примитивная и устаревшая модель, так как электроны не летают по орбитам, да и орбит никаких нет, но для нашего разговора такая модель сгодится):
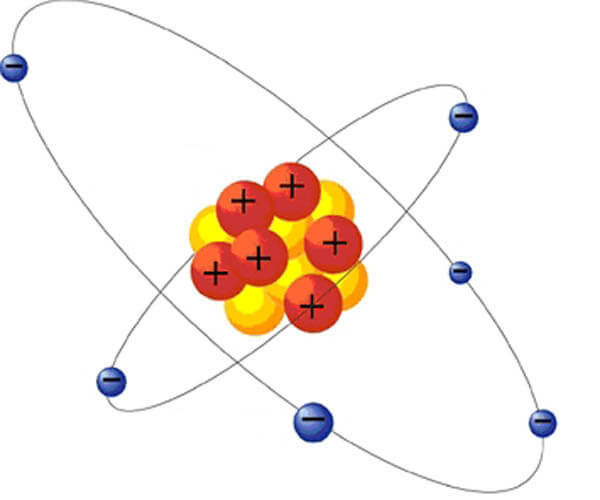
Электроны (синие шарики со знаком минус) — это отрицательно заряженные частицы, а внутри ядра находятся положительно заряженные (протоны) и нейтрально заряженные (нейтроны) частицы. Опять
Если количество электронов (-) и протонов (+) одинаково, атом считается электрически нейтральным. Если больше электронов (-), тогда атом обладает отрицательным зарядом, а если больше протонов (+), тогда атом обладает положительным зарядом.
Так вот, разноименные заряды (плюс и минус) всегда притягиваются друг ко другу, а одноименные (плюс-плюс или минус-минус) — отталкиваются. И не нужно пугаться слов «положительный» и «отрицательный» заряд. Это просто названия, не имеющие под собой никакого основания. Раньше такие заряды назывались «стеклянными» и «смоляными». Затем их решили называть «положительными» и «отрицательными». Главный смысл — показать, что заряды бывают двух типов и они между собой как-то взаимодействуют.
Теперь немножко подправим наши часы, сделав их более похожими на батарейку смартфона. Для этого изолируем две чаши и в одну из них поместим отрицательные заряды, а в другую — положительные:
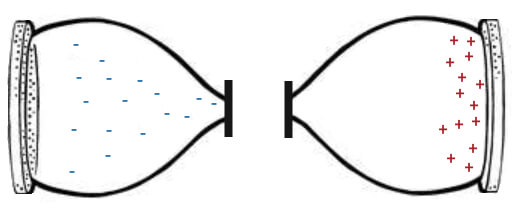
Слева находится множество отрицательных электронов, а справа — положительных ионов. Ион — это просто другое название для атома, который потерял или получил электрон. В нашем случае, он потерял электрон («минус») и заряжен положительно. Получается, слева избыток электронов, а справа — их недостаток.
Но в природе все стремится к равновесию, атомы «хотят» быть нейтральными. То есть, количество положительных зарядов должно соответствовать количеству отрицательных зарядов. Если мы соединим обе чаши проводником (проводом), электроны слева моментально начнут движение по этому проводу в правую чашу:
И в этот момент в проводе возникнет электрический ток, так как ток — это и есть движение электронов в одном направлении. Теперь можно этот провод провести через все компоненты смартфона. Электроны, проходя от отрицательной «чаши» к положительной, будут давать электрический ток. Соответственно, будет работать экран, динамики и другие компоненты.
Теперь представьте, что чаша слева — это одна сторона аккумулятора (минус), а чаша справа — другая (плюс) и ток течет от отрицательной стороны батарейки к положительной. Но наступит момент, когда количество электронов выровняется. Больше нет «плюса» и «минуса», так как атомы везде стали нейтральными, все лишние электроны присоединились к ионам и телефон полностью разрядился.
Если бы это была обычная батарейка, толку от нее больше не было бы. Но так как это аккумулятор, можно попытаться снова разделить атомы на положительные ионы и отрицательные электроны, собрав «минусы» на одной стороне аккумулятора, а «плюсы» — на другой. И весь процесс запустится по кругу.
Что такое амперы и вольты?
Вернемся к потоку электронов. Чем большее их количество протекает по проводу за 1 секунду, тем выше сила тока, то есть, тем больше ампер выдает аккумулятор. Заряд одного электрона ничтожно мал, соответственно, нужно очень много электронов, чтобы силы тока было достаточно для питания смартфона. Амперы — это и есть наш ток. Если не будет ампер, значит, нет и электронов, которые бы двигались в одном направлении. Соответственно, нет и электричества. Если говорить точно, тогда 1 ампер — это поток из 6240 квадриллионов электронов, протекающих за 1 секунду.
Теперь возьмем батарейку смартфона, на одной стороне которой собралось много отрицательных частиц (со знаком «минус»), а на другой — положительных (со знаком «плюс»). В результате мы получаем два потенциала, один из которых «хочет» избавиться от лишних электронов. Их слишком много, им мало места, они выталкивают друг друга (электроны с одинаковым зарядом отталкиваются). А на втором конце наблюдается сильная недостача электронов и атомы пытаются их притянуть. Так вот, разница между такими потенциалами («плюс» и «минус») называется напряжением и измеряется в вольтах. Чем больше с одной стороны свободных электронов и сильнее их недостача с другой стороны, тем выше напряжение.
Если сравнить течение тока с водой в трубке, тогда сила тока (амперы) — это количество воды в трубке, а напряжение (вольты) — это давление, с которым мы толкаем воду. Соответственно, сколько бы воды не было в трубке, если мы не можем ее протолкнуть — никакого тока не будет. Верно и обратное — если воды очень и очень мало, то с каким бы давлением мы не пытались ее вытолкнуть, большой мощности не будет. То есть, эта вода будет бесполезной, так как она не сможет сделать никакой полезной работы, например, вращать водяную мельницу. Нужно не только много воды, но и хорошее давление.
Итак, только что мы рассмотрели базовый принцип работы батарейки. Электроны из одной части аккумулятора по проводам перетекают в другую часть. Только на нашей картинке обе части находились на расстоянии друг от друга, а внутри смартфона — это цельная конструкция. Просто электроны не могут попасть с одной стороны (минус) на другую (плюс) напрямую, так как между ними стоит «барьер». Соответственно, нужно между этими частями «проложить мостик», по которому электроны моментально начнут движение. Таким мостиком является проводка внутри смартфона.
Принцип работы литий-ионного (Li-ion) аккумулятора
Все смартфоны уже давно используют исключительно один тип аккумуляторов — это литий-ионные батареи (Li-Ion). О них и поговорим подробнее.
Кто-то может возразить и сказать, что в его смартфоне установлен литий-полимерный (Li-Po или LiPo) аккумулятор, который гораздо лучше литий-ионного. В доказательство можно привести тысячи статей на всевозможных сайтах, включая самые авторитетные. Однако в реальности, «литий-полимерный» аккумулятор — это не более, чем маркетинговая уловка, не имеющая никакого отношения к твердотелым аккумуляторам. Подробнее об этом я упомяну чуть позже. На этом этапе будет непонятной разница между литий-ионной и литий-полимерной батарейкой.
Итак, главным действующим лицом в литий-ионных аккумуляторах, как следует из названия, является литий, а точнее, его ионы. У лития всего 1 электрон на внешней оболочке атома (то есть, на самой дальней и нестабильной орбите). Соответственно, такой электрон очень легко может оторваться, превратив атом в положительно заряженный ион (вспоминаем, электрон — это отрицательная частица и если ее оторвать, атом станет положительным). По этой причине литий в чистом виде легко вступает в реакцию.
Но если атом лития станет частью оксида металла (соединение химических элементов), тогда он будет достаточно стабильным. Схематически это можно отобразить так:
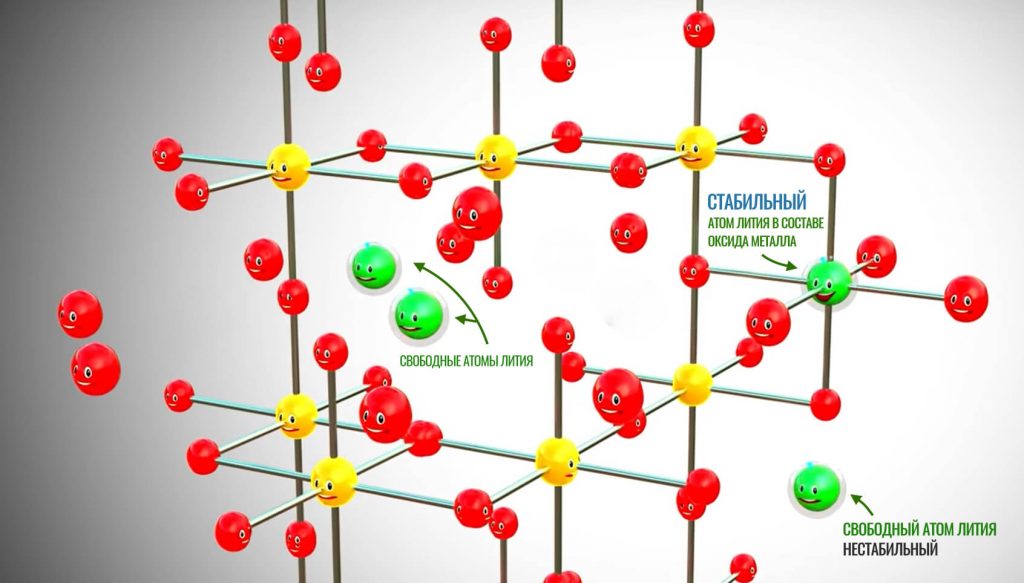
Свободные атомы лития (зеленые шарики) очень нестабильные и могут вступать в реакцию, теряя электрон, а те, что в структуре оксида металла (в основном используется кобальт) — достаточно стабильные. Когда атом лития нестабилен, он, как и все мы, стремится к стабильности, возвращаясь на место в оксид металла.
Теперь вспоминаем устройство батарейки. Литий-ионный аккумулятор состоит из двух «камер» или частей. Одна из них будет отрицательной (называется Анод), а вторая положительной — Катод. Как и в нашем примере, электроны из Анода (-) должны попасть в Катод (+). Но сделать это напрямую внутри аккумулятора они не могут, так как между анодом и катодом находится жидкий электролит (переносчик положительных зарядов).
В современных аккумуляторах, кажется, что нет никакой жидкости внутри. Но это только так кажется. Многие современные аккумуляторы используют полимер, смоченный электролитом или же специальный пористый разделитель (сепаратор) из полимера, пропитанного электролитом. Но это всё тот же жидкий электролит, просто немного в другом виде. А существуют настоящие литий-полимерные аккумуляторы, у которых сам полимер проводит литий, то есть, там вообще нет никакого жидкого электролита. Такие аккумуляторы не используются в смартфонах.
Итак, посмотрим на схему нашего аккумулятора:
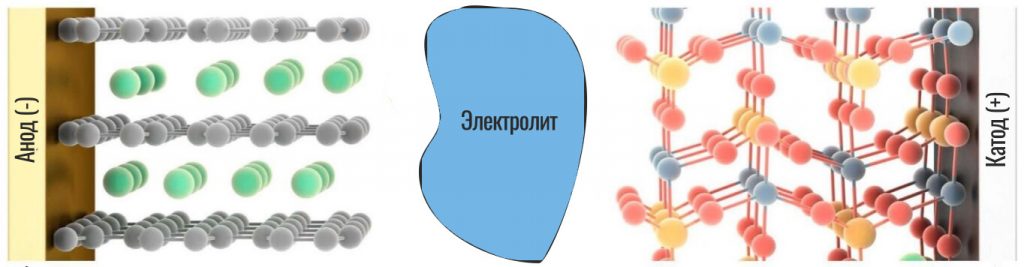
Мы видим здесь две части батареи: минус (слева) и плюс (справа). Они разделены по центру сепаратором, пропитанным электролитом. В левой части (в аноде) между слоями графита размещаются атомы лития. Кристаллическая решетка графита позволяет легко задерживать атомы лития между слоями. То есть, литий в нем, как бы, «застревает» (это явление называется интеркаляцией). Сам графит не вступает ни в какие реакции, он просто служит своеобразными «полочками», на которых можно удобно разместить все ионы.
Справа от электролита (в катоде) находится оксид кобальта, который вступает в реакцию с литием.
Разрядка телефона
Атомы кобальта на катоде (плюсе) из-за химической реакции потеряли электроны и их заряд стал еще более положительным. В результате они хотят вернуть свои электроны, чтобы нейтрализовать заряд. А как мы помним, на аноде (минусе) в графите «застряло» много лития, который без проблем отдаст свой электрон.
Но эти электроны не могут пройти через электролит, чтобы соединиться с кобальтом (оксидом металла).
Аккумулятор подключается плюсом и минусом к контактам смартфона. Дорожка от одного контакта (-) проходит через все компоненты смартфона и доходит до второго контакта (+). Она и соединяет две части батареи.
Как только между анодом и катодом появляется путь, электроны на аноде отрываются от лития и устремляются по нему, чтобы примкнуть к положительно заряженному кобальту. А литий в это же время свободно проходит через электролит и встраивается в оксид кобальта.
По дороге электроны «заходят» во все компоненты смартфона, которые встречаются им по пути и заставляют их работать.
Еще раз хочу обратить внимание на то, что электроны не «тратятся», как, например, топливо. Электрон вышел из точки А и пришел в точку Б, а если по пути встретилась лампочка, то еще и ее «зажег», но сам при этом никуда не испарился.
Зарядка телефона
Когда весь литий перейдет через электролит от анода к катоду, больше не останется электронов, которые бы могли путешествовать по внешнему проводу (по электрической цепи). Теперь нам нужно провернуть обратный процесс, а именно, «перетянуть» литий из катода в анод.
Для этого мы прикладываем внешний источник питания «плюсом» к катоду батарейки (+) и «минусом» к аноду батарейки (-). Так как напряжение внешнего источника выше напряжения батарейки, происходит химическая реакция. От кобальта отрываются электроны и уходят в «розетку». При этом атомы лития также вылетают из оксида металла.
В то же время от блока питания на «минус» батарейки залетают электроны и эта часть аккумулятора становится всё более и более отрицательно заряженной. В результате положительные ионы лития проходят через электролит и на аноде (в графите) встречаются с электронами.
Теперь весь литий снова на аноде и когда зарядка будет прекращена, начнется обратный процесс — электроны устремятся к положительному кобальту через весь смартфон, а литий следом — через электролит:
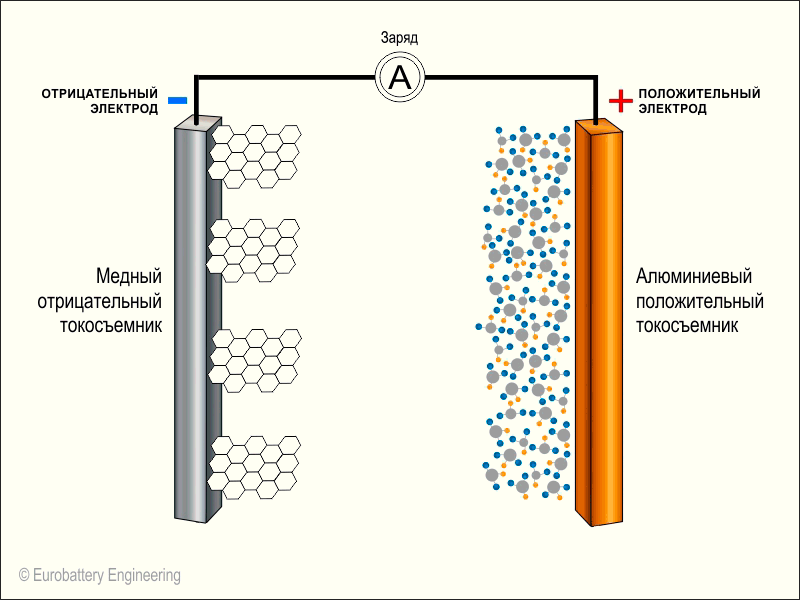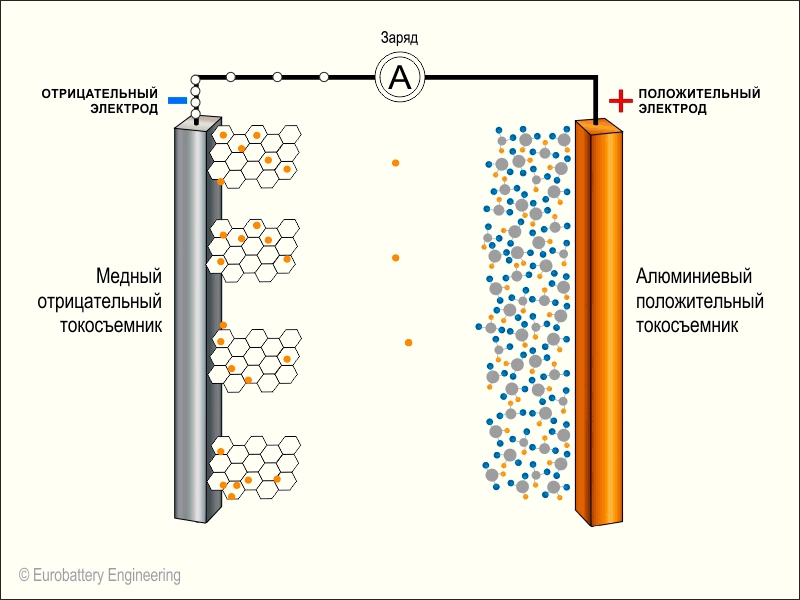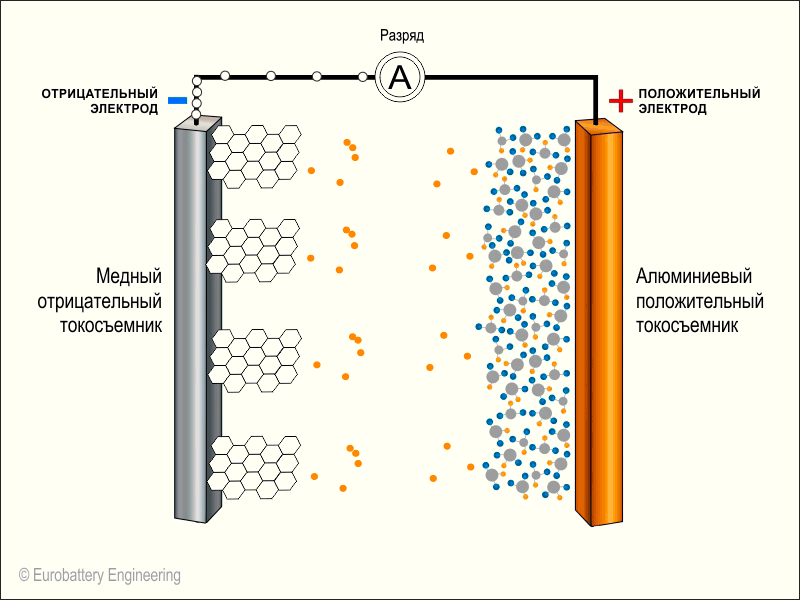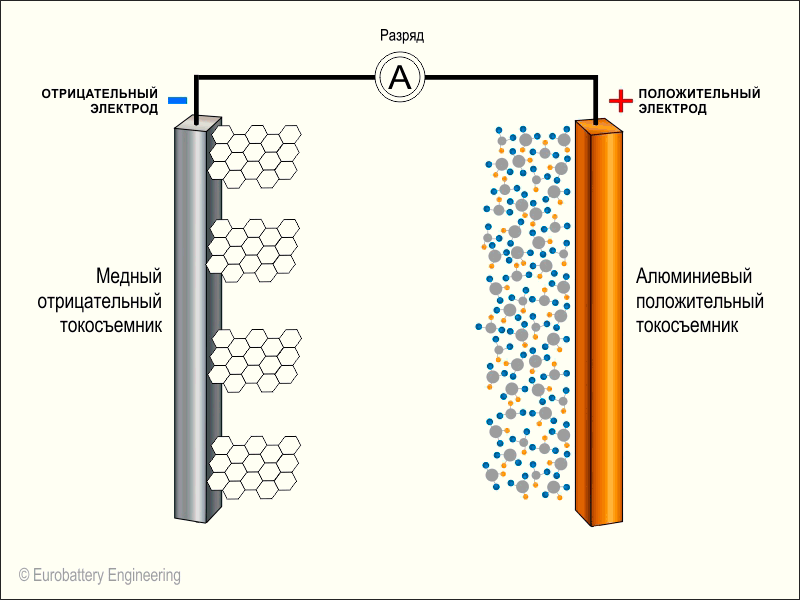
На этой иллюстрации вместо буквы А в кружочке и находятся компоненты нашего смартфона. Также на анимации не показан электролит по центру. Оранжевые кружочки — это положительные ионы лития, а белые кружочки — это электроны.
Так можно ли полностью разряжать свой смартфон или оставлять его на зарядке на всю ночь?
Вы можете делать все, что вашей душе угодно. Но стоит помнить, что у любого действия есть свои последствия. Это может прозвучать очевидно, но именно заряд/разряд смартфона и сокращает его емкость. По этой причине существует такое понятие как цикл разряда/заряда.
Я думаю, вы не раз слышали о том, что смартфоны рассчитаны на определенное количество циклов заряда/разряда, например, 500 полных циклов. Apple на своем сайте заявляет, что если полностью зарядить iPhone до 100%, после чего разрядить его до 0%, тогда через 500 таких зарядок/разрядок, емкость аккумулятора снизится до 80%. В случае с Apple Watch количество циклов увеличено до 1000.
Многие пользователи знают об этом и всё пытаются понять, как злобный производитель подсчитывает эти циклы, снижая емкость их аккумулятора. Кто-то старается выяснить, что считается полным циклом и как можно обмануть смартфон, разряжая его не совсем до нуля или заряжая не совсем до 100%.
На самом же деле, никто не считает циклы, чтобы специально испортить батарейку. Понятие полных/неполных циклов заряда введено для удобства. А портит батарейку именно заряд/разряд.
Понимая все, что мы разобрали в статье, посмотрим, кто же портит наш аккумулятор. Итак, при зарядке литий проходит через электролит от плюса к минусу, то есть, от катода к аноду.
Теперь, когда начинается разрядка смартфона, обратно вернутся не все ионы лития. Кто-то из них погибнет по пути домой. Возвращаясь через электролит, на внешней границе происходит реакция, в которой участвуют органические вещества электролита, сам литий и его электроны. В результате такой реакции образуется тонкая пленочка на аноде под названием SEI (Solid Electrolyte Interface).
С одной стороны, она и защищает слой электролита от бомбардировки электронами, которые стремятся пройти через электролит вслед за ионами лития, но не могут. С другой же стороны, на ее образование уходит часть атомов лития. То есть, самого лития становится меньше. А значит, уменьшается и емкость батарейки. И с каждым новым циклом заряда/разряда этот слой (SEI) становится все толще. Рано или поздно это приведет к созданию барьера, через который литий уже не сможет переходить к графиту анода.
На катоде тоже происходит реакция — окисление электролита. Чем выше напряжение — тем быстрее это происходит. Соответственно, собирать большое количество лития на одном из полюсов и держать его в таком состоянии, приводит к более быстрой деградации аккумулятора.
Получается, когда вы ставите смартфон на ночь на зарядку, конечно же, BMS (система управления батареей) не позволит аккумулятору «перезарядиться», то есть, получить большее напряжение, чем он способен выдержать. И проблема совершенно не в этом.
Всю ночь аккумулятор вашего смартфона будет находиться в состоянии, при котором деградация батареи будет максимально ускоряться. То же касается и падения заряда ниже 15-20%. В этом случае, мы получаем ту же ситуацию, что и с полностью заряженным аккумулятором, только наоборот. На ускорение вредных процессов влияет также и температура батареи.
Таким образом, для максимального срока службы литий-ионного аккумулятора нужно не только не оставлять свой смартфон на зарядке на всю ночь, но и не заряжать его вовсе до 100%, как и не разряжать ниже 20%. Гораздо лучше для батареи зарядить смартфон дважды в день (от 30 до 80%), нежели один раз в сутки ставить его на зарядку на всю ночь. Аккумулятор прослужит дольше, даже если вы будете заряжать его 4 раза в день от 40 до 70%, нежели проходить полный цикл заряда/разряда.
К слову, бывают случаи, когда человек использует свое устройство очень редко, например, зеркальную камеру. И в связи с этим хочет максимально эффективно хранить батарейку, чтобы она не теряла емкость. В таком случае, лучше всего разрядить аккумулятор до 40% и поместить его в полиэтиленовый пакет. А сам пакет с батареей хранить в холодильнике (не морозилке) при температуре от 0 до 3°C.
Ниже в таблице вы можете увидеть зависимость деградации аккумулятора от уровня его заряда и температуры хранения через 1 год:
| Температура | 40%-уровень заряда | 100%-уровень заряда |
| 0°C | 98% | 94% |
| 25°C | 96% | 80% |
| 40°C | 85% | 65% |
| 60°C | 75% | 60% через 3 мес. |
Надеюсь, вам понравилась первая часть из нашей новой серии, а во второй мы поговорим о беспроводной зарядке.
Алексей, главный редактор Deep-Review
P.S. Не забудьте подписаться в Telegram на наш научно-популярный сайт о мобильных технологиях, чтобы не пропустить самое интересное!

При недавнем добавлении новых разделов сайта нашего интернет-магазина Neovolt.ru, посвящённых замене элементов питания на нашем производственном предприятии, появилась идея сделать простые схемы устройства аккумуляторов для иллюстрирования материалов.
Несложная с виду идея вылилась в многочасовую проверку возможных изобретений новых вариантов конструкций, в перелопачивание тонны публикаций на BatteryUniversity, в общение с экспертами и инженерами на Quora и в Reddit по материалам в сепараторах и проводниках, чтобы ничего не упустить из внимания.
Получился огромный материал, который в дальнейшем пришлось сократить, иначе можно книгу написать. Результатом делимся с вами.
→ О принципах выбора ёмкости, определения ремонтопригодности, формы и размеров аккумулятора смартфона — в исследовании Карстена Шишке.

Что внутри аккумулятора смартфона
Батареи литий-ионного или литий-полимерного типа работают с помощью химических реакций, которые «отправляют» электроны и ионы с одного электрода на другой. Вот, как всё выглядит, когда наш инженер разбирает внешнюю часть корпуса аккумулятора, например, Samsung Galaxy S9 или любого другого смартфона после извлечения из устройства.

Устройство аккумулятора телефона/смартфона:
(1) Соединительный элемент подключает аккумулятор к системной плате смартфона (в несъёмной конструкции) или к контактам на внешнем корпусе батареи (в съёмной конструкции).
- • Он может быть в виде многожильного провода (как на схеме) или в виде шлейфа.
- • Шлейф имеет гибкую (как у iPhone 6) или формованную (как у Galaxy S8 Plus) основу.
- • У соединительного кабеля чаще всего есть коннектор с несколькими контактами (от двух до пяти).
- • В редких старых или бюджетных смартфонах соединение с системной платой выполняется не через разъём, а методом пайки (у нас есть пример такого соединения в инструкции разборки iPod Touch 6).

(2) — Плата системы управления аккумулятором (Battery Management System, BMS). На неё устанавливается логика работы батареи и предохранитель.
(3) и (4) — Положительный и отрицательные выводы питания для работы в электрической цепи.
(5) и (7) — Электродные материалы размещаются на тонкой металлической основе, напоминающей фольгу. Она собирает электроны и передаёт их из батареи к устройству.
Электроды не способны хранить много энергии в ограниченной зоне.
Поэтому нужны длинные скрутки таких полос, чтобы аккумулятор смог обеспечить смартфон необходимой энергией. Их количество и размеры влияют на конечную ёмкость и габариты батареи. Кстати, мы уже рассказывали, по какому принципу производители выбирают и проектируют аккумулятор в процессе разработки очередного смартфона.

(6) и (8) — Сепаратор препятствует электрической проводимости между электродными материалами (катодом и анодом) в пределах тока, который должен проходить через сепаратор в процессе движения ионов от катода к аноду (во время заряда) и обратно (во время разряда).
С превышением температуры (выше 130°C) материал плавится и закрывает поры во избежания дальнейшей катализации химической реакции и взрыва аккумулятора.
В большинстве смартфонов сепаратор однослойный из полиэтиленового материала, пропитанного электролитом.
Хотя последнее время в применение вошли сепараторы трёхслойной «гамбургерной» конструкции для более надёжной работы аккумулятора в условиях повышенной нагрузки:
- • Полипропилен (стойкость +155°C)
- • Полиэтилен (стойкость +130°C)
- • Полипропилен (стойкость +155°C)
(9) — Корпус аккумулятора представляет собой термостойкий материал с достаточной прочностью, чтобы выдерживать небольшие физические воздействия (например, от стягивания внутренних комплектующих смартфона).
В съёмной конструкции размещается в ударостойкую оболочку с контактной площадкой.
Это нужно для удобного и, главное, безопасного хранения вне мобильного устройства (из-за чего превышает габариты несъёмного аккумулятора аналогичных технических характеристик). Может иметь разные виды материалов, выбор которых зависит от производителя.

Вы помогаете наполнять базу знаний Neovolt без ошибок и упущений. Пишите в комментарии предложения, свои взгляды и замечания — мы их читаем все без исключения. Или отправьте сообщение нам ВКонтакте @NeovoltRu.
Подпишитесь в группе на новости из мира гаджетов, узнайте об улучшении их автономности и прогрессе в научных исследованиях аккумуляторов. Подключайтесь к нам в Facebook и Twitter. Мы также ведём насыщенный блог в «Дзене» и на Medium — заходите посмотреть.
Время автономной работы — важный аспект, на который мы обращаем внимание при выборе нового смартфона. Ведь возможность проработать полтора-два дня без подключения к розетке — весомый довод в пользу того или иного аппарата. Но такие показатели сегодня демонстрируют далеко не все гаджеты. Разбираемся, каким образом работают аккумуляторы в современной технике, каких типов могут быть батареи в них, а также вспоминаем простые правила, которые позволят сохранить целостность аккумулятора смартфона, планшета или ноутбука дольше.
Как вообще работают аккумуляторы и каким образом с этим помогают песочные часы
Литийионные аккумуляторы — самые распространенные. Они применяются практически во всей мобильной технике — от ноутбуков со смартфонами и планшетами до геймпадов игровых консолей. И да, сразу разрушим устоявшийся миф о том, что новый телефон сперва стоит полностью разрядить, потом восполнить энергию до 100%, после чего им можно пользоваться.
Очевидно, что это не так — во всяком случае для современной техники. Подобные манипуляции еще каким-то образом можно оправдать в отношении железоникелевых или никелево-металлогидридных аккумуляторов, для которых так называемый эффект памяти был актуален: это было обусловлено материалами, которые применялись в их внутренней структуре. Но для литийионных батарей эти правила не действуют (ну или почти не действуют).
Но обо всем по порядку. Все аккумуляторы работают за счет химических реакций по обмену электронами между атомами. Если упростить, одно вещество отдает другому электроны, и во время подобного обмена выделятся энергия. Так что утверждать, пусть и на бытовом уровне, что аккумуляторы (те же пауэрбанки) являются простыми «хранилищами» энергии, заполняемыми до предела, не до конца верно.
Более уместный пример — песочные часы, в которых вместо песка как раз используются электроны. Вспоминаем школьный курс физики: электроны — это составная часть атомов. Последние состоят из ядра, включающего нейтроны и протоны, и вращающихся возле них электронов.
Важно упомянуть: электроны — это отрицательно заряженные частицы, протоны — положительно заряженные, нейтроны — нейтрально заряженные. И такие «положительные» и «отрицательные» частицы постоянно стремятся к равновесию, то есть притягиваются друг к другу. Вот и получается (в суперупрощенном виде), что в условных песочных часах в одной половине находятся «плюсы», а в другой — «минусы». И в процессе их перемещения возникает электрический ток.
Если бы мы говорили про простую батарейку, процесс был бы необратим. То есть в какой-то момент частицы пришли бы в равновесное состояние (нейтральное), и энергия бы больше не возникала. Но в аккумуляторе можно попытаться заново разделить атомы на положительные ионы и отрицательные электроны — по сути, перегнать «плюсы» и «минусы» в свои части весов. Другими славами, запустить весь процесс заново.
Если говорить техническим языком, в литийионном аккумуляторе есть два электрода: положительный и отрицательный, катод и анод. Популярным материалом для «минуса» выступает графит, для «плюса» — оксид кобальта. В графите заключены атомы лития, которые оксид кобальта стремится притянуть. Этому мешает жидкий электролит, переносящий только положительный заряд.
Аккумулятор подключается к системной плате «плюсом» и «минусом» к соответствующим контактам, и в этот момент между катодом и анодом электроны лития выскальзывают из ловушки и через все компоненты устройства идут к кобальту (вот и электрический ток). Тем временем потерявший электрон литий становится положительным ионом и проходит через электролит, встраиваясь в оксид кобальта.
В общем, суть остается неизменной: при подключении к внешнему питанию в аккумуляторной батарее стартует химическая реакция по возвращению электронов и лития в графитовый анод (то есть на «минус»). Так и происходит процесс зарядки девайсов.
Похоже, литийионные аккумуляторы с нами надолго
У нас уже выходил отдельный материал, в котором подробно рассказывалось о перспективах развития «аккумуляторного дела», с приходом инноваций в который емкость аккумуляторов кратно увеличится при сохранении их размеров, опасность возгорания (об этом подробнее немного позднее) снизится, да и заряжаться такие батареи смогут за секунды.
Кажется, до таких радужных перспектив прогрессу еще далеко. Во всяком случае о прорывных «батарейных» технологиях со схожими свойствами, которые применялись бы в бытовом плане, а не в узкоспециализированном, пока говорят мало. Есть несколько экспериментальных вариантов, обещающих улучшить эффективность аккумуляторных батарей, но пока речь там идет только о предсерийных образцах без массовых сборочных линий.
Кобальт — наше все? И при чем тут Конго
Но и литийионных аккумуляторов существует несколько разновидностей. Да, в смартфонах и другой мобильной технике чаще всего применяются описанные выше батареи с «сердцевиной» из графита и кобальта — вероятно, сейчас вы просматриваете этот материал с устройства с именно такой батареей. Но с кобальтом в последнее время не все так просто.
Порядка 60% разведанных запасов кобальта находятся в Конго, куда менее обширные запасы разбросаны по планете — например, на территории Австралии, на Кубе, Филиппинах, есть месторождения в США, России, Китае, Канаде, Казахстане, Франции. Но основная проблема заключается в том, что запасы конечны. А с учетом быстрорастущего рынка электромобилей истощение происходит еще стремительнее. Несколько лет назад Китай даже попытался установить контроль над мировыми поставками кобальта (основные мощности по переработке кобальта находятся именно там): настолько ценным является ресурс.
В такой ситуации цены на него растут. В сети утверждают, что кобальт обходится едва ли не вдвое дороже никеля, в 15 раз дороже алюминия и в 1000 раз дороже марганца. Но есть альтернативы: на сегодня известно о шести типах литийионных аккумуляторов, которые различают по материалу катода:
- литий-кобальтовые;
- литий-марганцево-оксидные;
- литий-никель-марганец-кобальт-оксидные;
- литий-никель-кобальт-алюминий-оксидные;
- литий-железо-фосфатные;
- литий-титанат-оксидные.
Некоторые варианты после литий-кобальтовых аккумуляторов выглядят перспективнее. Одни выдерживают больше циклов «перезаписи» электронов, то есть циклов перезарядки, другие способны работать в более широких температурных диапазонах, а еще они долговечнее. Но опять же, несмотря на все преимущества в сравнении с «чисто кобальтовыми» аккумуляторными батареями, производство тех же литий-титанатных вариантов (по сути, самых продвинутых) обходится еще на порядок дороже. Поэтому их используют в лучшем случае в каких-нибудь общественных установках — например, в электробусах.
Иногда ставят на литий-никель-марганец-кобальт-оксидные аккумуляторы (укороченное название — NMC). Они более энергоемкие, выдерживают порядка 2 тыс. циклов перезарядки (кратно больше, чем у литий-кобальтовых) и могут работать в широких температурных диапазонах (за счет чего их любят производители электрокаров). Но, похоже, массовости в микроэлектронике у технологии пока нет — во всяком случае о планах какой-либо из крупных компаний установить подобные батареи в смартфоны информация почти отсутствует. Вероятно, все из-за того, что некоторые модификации NMC-аккумуляторов вполне стабильны, а другие, с чуть измененными характеристиками — уже не настолько (из-за окисления). Хотя это только теория.
Почему аккумуляторы взрываются?
Итак, литий-кобальтовые аккумуляторы, во всяком случае в гаджетах, пока главенствуют. Но довольно часто появляются новости, что смартфоны воспламеняются едва ли не в руках у пользователей. Получается, технология опасна?
На самом деле чаще всего дело во вспламенившейся батарее (причем именно кобальтового типа). Такое может произойти при физическом повреждении самого аккумулятора (скажем, если смартфон упал с высоты) или перегреве. Последнее случается, когда в процессе зарядки поступающее напряжение продолжает поддерживать химическую реакцию (вспоминаем про стремящиеся друг к другу катоды и аноды), даже если аккумулятор уже поврежден или есть сбои в контроллере питания.
Один участок становится слишком горячим, электролит нагревает компоненты батареи, ее корпус трескается. Важно понимать: мини-взрывы случаются крайне редко, чаще всего аккумулятор просто вздувается. Ситуацию можно сравнить с падениями самолетов: каждый раз подобное вызывает небывалый резонанс, однако в целом авиатранспорт считается одним из самых безопасных. Однако если попытаться воздействовать на такую «битую» батарею самостоятельно, заранее не обесточив другие компоненты, то девайс действительно может воспламениться и причинить вред. Таким образом, при первых признаках вздутия несите телефон (планшет, ноутбук, другой гаджет) в сервис.
Есть мнение, что к подобным «перегревам» приводят блоки питания с повышенной мощностью, которые начали распространяться в последние несколько лет. Но подтверждения этой версии отсутствуют. На самом деле до сих пор до конца не понятно, насколько сильно ускоренная зарядка влияет (или не влияет) даже на основные характеристики аккумулятора вроде скорости его износа.
В целом если пользоваться смартфоном или другим «умным» устройством по два-три года, то разницу в скорости деградации аккумулятора заметить вряд ли получится. А после этого срока вы, вероятно, либо уже купите другой телефон, либо просто замените в своем устройстве батарею (более демократичный по цене вариант).
Советы, как заряжать смартфон правильно (и стоит ли этим заморачиваться)
Об этом у нас также выходил отдельный материал. Напомним основные тезисы и добавим кое-что новое.
- Правильнее всего заряжать смартфон в пределах 20—80% емкости аккумулятора. Это обеспечивает оптимальные условия для долголетия батареи. Это понимают и сами производители: многие современные модели изначально настроены так, чтобы они заряжались до 80% и только потом, поняв, что девайсом в это время не пользуются, на более низкой скорости восполняли запас энергии до 100%. Это касается и ноутбуков.
- Можно ли оставлять телефон (или другой «умный» гаджет) на зарядке на всю ночь? Можно. Что в самом устройстве, что в адаптере питания устанавливаются уже упоминавшиеся контроллеры питания, не позволяющие принять больше энергии, чем необходимо. Правда, по этой причине стоит использовать только фирменные либо сертифицированные адаптеры питания. В «серых» блоках, продающихся в условном переходе, контроллеров просто может не оказаться — тогда появляется теоретическая опасность описанного выше возгорания.
- Можно ли пользоваться телефоном во время подзарядки? Прямых ограничений нет, но есть нюанс. В теории лучше отказаться от запуска «тяжелых» программ вроде AAA-игр, и так нагревающих внутренние компоненты устройства. Во время подзарядки батарея также нагревается, и при неудачном стечении обстоятельств может случиться общий перегрев. Но опять же: если аккумулятор механически не поврежден, риски возгорания минимальны. Просто такой подход усиливает естественную деградацию батареи.
- А беспроводная зарядка может как-то навредить? Не больше, чем проводная — опять же если используются сертифицированные зарядные устройства. Никакой корреляции между беспроводным способом восполнения энергии и проводным с точки зрения безопасности не замечено. Скорее всего, по «беспроводу» процесс займет немного больше времени.
- Пункты выше кажутся слегка чрезмерными? Основная мысль такая: скорее всего, естественная деградация аккумулятора устройства (обычно современные аппараты рассчитаны на 500 таких полных циклов) произойдет быстрее, чем пользователь успеет навредить батарее режимами вроде ускоренной подзарядки. Легче через пару-тройку лет заменить батарею на новую, когда после 500 таких циклов емкость снизится примерно до 80%.
Читайте также:
- Закон Мура устарел, а Apple совершила революцию. Вот как работает процессор в вашем компьютере
- Почему смартфоны так хорошо снимают и днем, и ночью? Что такое вычислительная фотография и почему за ней будущее
Наш канал в Telegram. Присоединяйтесь!
Есть о чем рассказать? Пишите в наш телеграм-бот. Это анонимно и быстро
Перепечатка текста и фотографий Onlíner без разрешения редакции запрещена. ng@onliner.by

Сегодня редко встретишь устройство, работающее от механической энергии, – подавляющее большинство гаджетов питается электричеством. Аккумуляторы стали неотъемлемой частью электронных девайсов. Как устроена батарейка? Попробуем разобраться.
Существует много разновидностей аккумуляторов, но в бытовой электронике чаще всего применяются никель-кадмиевые (NiCd), никель-металл-гидридные (NiMh) и литий-ионные (Li-Ion) батареи.
Дольше всего используются NiCd-аккумуляторы благодаря своей простоте в изготовлении, эксплуатации и хранении. До сих пор NiCd-аккумуляторы остаются наиболее популярными для питания радиостанций, медицинского оборудования, профессиональных видеокамер и мощных инструментов.
NiMH-аккумулятор, по сравнению с NiCd, выделяет значительно большее количество тепла во время заряда. Ему также требуется более сложный алгоритм определения момента полного заряда. Поэтому большинство NiMH-аккумуляторов оборудовано внутренним температурным датчиком. Кроме того, NiMH-аккумулятор не может заряжаться быстро – время заряда обычно вдвое больше, чем у NiCd. Но зато их емкость больше, чем у NiCd.
Характеристики Li-Ion-аккумуляторов вдвое превышают показатели NiCd- аккумуляторов в пересчете на один килограмм веса. Именно поэтому Li-Ion-батареи используются во всех ноутбуках и телефонах, где важен вес и время автономной работы.
Как работает аккумулятор?
Аккумуляторы и батарейки работают благодаря разности напряжения между двумя металлическими пластинами, погруженными в раствор электролита. Впервые источник тока, работающий по такому принципу, был создан в XIX веке. Одна пластина в нем была медной, вторая – цинковой, которая очень быстро растворялась.
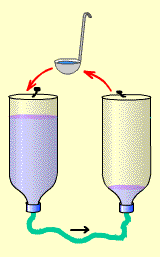
Разность напряжений можно объяснить на примере аналогии с двумя емкостями с жидкостью, которые соединены трубкой. Чтобы вода в трубке начала двигаться, нужно создать разность уровней, например, поднять одну емкость выше другой. Постепенно вода перетечет из левой бутылки в правую. Когда уровни сравняются, ток воды прекращается. Для аккумулятора это значит полный разряд.
Чтобы его перезарядить, надо вернуть воду в первоначальную емкость. Например, с помощью черпачка или чашки. Если вычерпывать воду из правой бутылки и выливать ее в левую, аккумулятор будет заряжаться. Конечно, вычерпывать нужно с такой же скоростью, с какой вода вытекает по шлангу. Иначе опять аккумулятор разрядится.

Конструктивно же сам аккумулятор – предельно простое устройство. Это два длинных листка из графита и из оксида лития с кобальтом. Они смазываются электролитом и сворачиваются в рулон. Литий-ионный аккумулятор готов.

Мифы об аккумуляторах
Распространено мнение, что сразу после покупки Li-Ion-аккумулятор нужно «раскачать» – провести несколько циклов полного заряда-разряда. Обычно – от трех до пяти. Этот миф не очень вредный для аккумуляторов, но, тем не менее, тратит его циклы работы.
Свойство Li-Ion-аккумуляторов заключается в том, что они не имеют эффекта памяти, как это было с NiCd-батареями. Этот эффект заключался в том, что если зарядить не до конца разряженный NiCd-аккумулятор, его емкость падала. Li-Ion такой особенности не имеет. Более того, производитель гарантирует, что емкость аккумулятора не снизится за 300 циклов разряда-заряда.
Еще раз: плеер, телефон, рацию, кпк, планшет, часы или любой другой мобильный девайс с Li-Ion «тренировать» бесполезно.
Аккумуляторы Li-Ion вообще не любят слишком большого заряда и разряда. Производитель гарантирует 300 циклов, но это не значит, что на 301 цикл батарею можно выбрасывать. Все будет зависеть от условий эксплуатации. «Тепличными» условиями для Li-Ion является максимальный заряд до 80%, а минимальный разряд – до 40%. Некоторые модели ноутбуков позволяют выставить эти параметры в сервисном ПО, продлевая «жизнь» батарее. Также аккумуляторы безвозвратно теряют емкость при температуре ниже нуля градусов и при нагреве выше +40 градусов. Поэтому гаджеты лучше беречь от мороза и высокого нагрева.
Принципы и устройства аккумулятора
Батарея телефона, благодаря своим химическим и физическим свойствам является живительным элементом для процессора, дисплея и других частей.
Принцип, по которому работает аккумулятор:
- Ионы лития попадают в специальную решетку графита.
- Ионы при контакте с молекулами углерода создают химическую реакцию.
- Происходят разрывы.
- В результате реакции вырабатывается энергия.
- Энергия оседает на полюсах аккумулятора в форме электричества.
Долгое время производители питательных элементов трудились над одной проблемой. Дело в том, что литий внутри аккумулятора – жидкий. Это плохо сказывалось на стабильности его химических свойств. Когда появлялись трещины на корпусе – жидкий состав просто вытекал. Несмотря на такие недостатки, жидкий вариант обладал низким сопротивлением, поэтому лучше выполнял функции, чем сухой.
Современные батарейки сочетают в себе качественную работу Li-Ion и сухих частиц. Принцип работы аккумуляторов телефона основан на тех же ионах лития, но в устройстве установлен сухой сепаратор. Риск возникновения химических реакций сведен к минимуму. Механизм устроенный так, что при правильной эксплуатации батарейки она не взорвется.

Коммерческие типы аккумуляторов в телефонах и смартфонах
Всего существует около десятка разновидностей аккумуляторов для коммерческой эксплуатации. Но есть также и те, что находятся в разработке, исследуются и готовятся заменить собой устаревающие типы в ближайшие годы. Мы рассмотрим те из них, которые сейчас встречаются в телефонах и смартфонах прежних и новых поколений.
Список типов аккумуляторов по убыванию популярности применения в мобильных устройствах: 1. Li-Ion — литий-ионный (иногда называют литиево-ионный). 2. Li-Po, Li-Pol, Li-Poly — литий-полимерный (также литиево-полимерный). 3. NiCd, Ni-Cd — никель-кадмиевый. 4. NiMH, Ni-MH — никель-металл-гидридный (никель-металлгидридный).
Перезаряжаемые батареи Ni-Cd или Ni-MH вы встретите в основном в бытовых устройствах, в старых телефонах или в специализированных коммуникаторах для промышленной эксплуатации. Почти все современные смартфоны оснащены Li-Ion батареями. Аккумулятор Li-Poly — это относительно новый тип, который появился позднее остальных и распространён в определённых сегментах электроники.
Что внутри батарейки?
Самые сложные элементы аккумуляторов мобильников находятся внутри корпуса. Можно изучить их конструкцию и основные функции. Кроме банки с ионами лития и сепаратора, конструкция оснащена контроллером.
Контроллер – это «мозги» батареи сотового, состоит из таких элементов:
- Резисторы (в схеме питания, защиты).
- Терморезистор.
- MOSFET-транзисторы.
- Микросхема.
- Конденсатор накопления.
Контроллер выполняет следующие функции:
- Контроль заряда. Аккумуляторы телефонов заряжаются постепенно. Первых 10% с невысокой скоростью, потом ускорение до 80%, и конечный этап – замедление. С высокой скоростью заряжается лишь «средняя часть» батарейки, такая особенность работы для снижения нагрузки.
- Защита от перезаряда. Ток от сети поступает, но при достижении напряжения в 4,2 В питание автоматически останавливается.
- Защита от разряда. Установлено и минимальное напряжение, на уровне, примерно в 2,9 В. Даже если процент упал до 0, и мобильный телефон выключился, в аккумуляторе остается небольшой запас. Если его не будет – потеряется полезная емкость.
- Ограничение тока. Напряжение не всегда стабильно, великие скачки или короткое замыкание – однозначно повредят батарею. Это плохо скажется на длительности срока эксплуатации. Ограничитель препятствует этому.
- Балансировка батареи. Это конструкция, состоящая из последовательных электронных элементов. Такая схема обеспечивает равномерный заряд разных частей. От функции зависит долговечность батарейки.
- Контроль за температурой. В каждой батарейке установлен терморезистор. Он контролирует температуру и при надобности защищает устройство от перегрева или переохлаждения.

Смартфоны и телефоны с литий-ионным аккумулятором
Общие характеристики: • плотность вмещаемой энергии — 125-200 Втч/кг; • число циклов — до 1000; • саморазряд — 10% в месяц; • напряжение — 3.6В; • температуры эксплуатации — +60…-20°C; • эффект памяти — отсутствует (не требует «тренировки» и «калибровки»); • сбалансированная стоимость производства.
Литий-ионные (Li-Ion) аккумуляторы доминируют в области носимых гаджетов, смартфонов, телефонов, ноутбуков и других автономных устройств.
Высокая плотность запасаемой энергии при компактных размерах, гарантированный срок службы в течение полутора лет при активной эксплуатации.
Это вписывается в общую картину ежегодного выпуска новых моделей потребительской электроники. Однако конструктивные недостатки и особенности привели к появлению усовершенствованного последователя.
Корпус для батареек и из чего он сделан
После ознакомления с тем, как устроен аккумулятор телефона, остается ознакомиться с корпусом этой детали.
Он состоит их двух слоев:
- Верхний слой. Пластиковое покрытие. Изолирует банку батареи, защищает ее от воздействия внешних факторов. Еще на покрытии производитель печатает информационный блок.
- Внутренний слой. Это – металл. Материал твердый и прочный, защищает внутренности от повреждений.
Производители аккумуляторов для техники используют металл с определенным показателем эластичности. Это делается для того, чтобы корпус выдержал деформации в случае вздутия батареи.

Смартфоны и телефоны с никель-кадмиевым аккумулятором
Общие характеристики: • плотность вмещаемой энергии — до 60 Втч/кг; • число циклов — до 1500; • саморазряд — 20% в месяц; • напряжение — 1.25В; • температуры эксплуатации — +60…-40°C; • эффект памяти — есть («калибровка» каждые 30 дней); • самая низкая стоимость производства.
Никель-кадмиевые (NiCd) аккумуляторы повсеместно применялись в 1990-х и в начале 2000-х годов для создания автономных телефонов, радиостанций, ноутбуков, камер и так далее. Этот тип батареи остаётся популярным и до сих пор в отдельных категориях бытовых и промышленных устройств.
NiCd быстро заряжается, допускает большие токи и выдерживает суровый климат, что особенно ценится в индустриальной и строительной сферах.
Значительные эксплуатационные недостатки, включая заметный саморазряд и пресловутый «эффект памяти» (уменьшение ёмкости без обслуживания в виде тренировочных циклов подзарядки), заставили производителей потребительских телефонов перейти на другие технологии.
Примерный химический состав аккумуляторов телефона
Современные производители батареек для смартфонов применяют три класса катодных соединений:
- Кобальт лития. LiCoO2.
- Литий-марганцевая шпинель LiMn2O2.
- Литий-феррофосфат LiFePO4.
Электрохимические цепочки батарей телефонов будут состоять из следующих элементов:
- Литий-кобальтовые: LiCoO2 + 6C → Li1xCoO2 + LiC6
- Литий феррофосфатные: LiFePO4 + 6C → Li1xFePO4 + LiC6
Чтобы понять, как работает и какие функции выполняет батарея смартфона – следует изучить его устройство. Тогда станет понятно, какой элемент за что отвечает, и какие материалы используются.
Батареи в мобильных устройствах: Все, что нужно знать

Рассказывам об особенностях устройства батарей в мобильных девайсах.
Миллионы людей во всем мире являются активными пользователями мобильных устройств. Это плоды гигантской, мультимиллиардной индустрии, раз и навсегда изменившей наш образ жизни. Маленькие и не очень, функциональные и простые, дорогие и дешевые мобильные телефоны, планшеты и ноутбуки объединяет один фактор — все они используют для работы заряд батарей. Без них, все эти девайсы превратились бы в куски пластика, метала и текстолита, неспособные прожить и минуты без розетки.
Батареи внутри вашего мобильного устройства представляют собой чудеса химической инженерии — они способны накапливать огромный заряд энергии, способный поддерживать работоспособность устройств на протяжении часов. Как же они устроены?

Большинство современных мобильных устройств используют литий-ионные (или Li-ion) батареи, состоящие из двух основных частей: пары электродов и электролита между ними. Материалы, из которых сделаны эти электроды, варьируются (литий, графит и даже нанопровода), но все они полагаются на химические процессы в основе которых стоит литий.
Это химически активный метал, что подразумевает его способность вступать в реакцию с другими элементами. Чистый литий настолько активен, что воспламеняется под воздействием воздуха, поэтому большинство батарей используют его более безопасную разновидность, именуемую литий оксид кобальта.
Между двух электродов находится электролит, в роли которого обычно выступает жидкий органический растворитель, способный пропускать ток. Когда литий-ионная батарея заряжена, молекулы литий оксид кобальта удерживают электроны, которые затем высвобождаются, когда ваш телефон работает.
Литий-ионные батареи являются наиболее распространенными, потому что могут накапливать большой заряд при малом размере. Это измеряется по шкале плотности энергии на единицу массы. Для литий-ионной батареи этот показатель равен 0,46–0,72 МДж/кг. Для сравнения, у Никель-металл-гидридного аккумулятора (Ni-MH) он равняется 0,33 МДж/кг. Иными словами, литий-ионные батареи меньше и легче, чем другие типы аккумуляторов, что подразумевает более компактные девайсы с более продолжительной «живучестью» от одного заряда.
Емкость аккумулятора

Емкость батареи измеряется в миллиампер-часах (мАч), что означает какое количество энергии сможет выдать аккумулятор за конкретный промежуток времени. К примеру, если емкость батареи равна 1000 мАч, то она сможет предоставить вам 1000 миллиампер на протяжении 1 часа. Если ваш девас будет потреблять 500 миллиампер в час, то проработает он уже 2 часа.
Однако понятие «живучести батареи» чуть сложнее, вышеописанного принципа, так как потребление энергии варьируется в зависимости от того, какие задачи девайс выполняет. Например, если у него включен экран, работает антенна сотовой связи, а процессор загружен тяжелой работой, то девайс будет потреблять больше энергии, чем когда экран выключен, а процессор и антенна находятся в режиме ожидания.
Именно поэтому не нужно слепо полагаться на заявленные производителем показателям автономности работы — производитель может выдавать эти цифры с учетом основе яркости экрана, без включения некоторых функций, как-то Wi-Fi или GPS. Стоит отметить, что Apple в этом отношении действует более честно, указывая «живучесть» устройства на основании выполнения конкретных задач. Если вам любопытно сколько энергии поглощает iPhone в том или ином режиме работы, советуем воспользоваться специальным приложением Battery Life Pro.
Контроль за потоком энергии

Так как у литий-ионных батарей имеется тенденция к возгоранию, они должны быть подвержены тщательному контролю. Производители батарей достигли этого путем включения специального контроллера, который следит за силой тока. В итоге, каждый аккумулятор содержит внутри маленький компьютер, который предотвращает слишком быструю разрядку и потерю заряда до опасно низкого уровня. Этот компонент также регулирует силу тока во время зарядки, понижая его по мере того, как заряд батареи приближается к максимальной отметке, чтобы избежать чрезмерной зарядки.
Именно поэтому, полностью разряженный девайс, поставленный на подзарядку, греется в этом процессе намного сильнее, чем лишь немного разряженный.
Будущее аккумуляторов

Технологии по производству батарей не стоят на месте — множество исследовательских лабораторий по всему миру исследуют новые технологии, способные заменить литий, а также новые походы по созданию литий-ионных батарей. Среди новых технологий, много работы было проделано с супер-конденсаторами, в которых батарея хранит энергию в форме электричества, а затем высвобождает ее подобно вспышке на фотоаппарате.
Супер-конденсаторы заряжаются намного быстрее, так как в этом процессе практически не задействованы химические реакции, но современные представители такого рода накопителей способны отдавать заряд лишь короткими порциями, что является противоположностю тому, что требуется для большинства мобильных устройств.
Топливные элементы на основе водорода, тоже являются альтернативой существующим батареям. Система топливных элементов от Nectar, представленная на недавней CES, использует десятидолларовый картридж, способный питать мобильный телефон до двух недель. Однако топливные элементы все еще слишком велики, чтобы поместится в телефоне — та же система от Nectar просто подзаряжает литий-ионную батарею, а не заменяет ее.
А вот сера вполне может занять место внутри литий-ионных батарей. Ученые из Стэндфордского Университета недавно представили нанотехнологию по включению серы в химический состав батареи, что увеличило ее емкость в пять раз, а также увеличило срок службы. В то же время, эта технология находится пока на ранней стадии развития и не выйдет на рынок в ближайшие несколько лет.
P.S. Аккумуляторы в мобильных устройствах, равно как и обычные батарейки, требуют определенной утилизации — просто так выбрасывать их в мусорный бак нельзя. Поэтому рады напомнить вам, что iLand готов взять на себя утилизацию отживших свое элементов питания. Просто принесите их к нам в офис, а об остальном мы позаботимся!
Tags: iPhone, iСтатьи, аккумулятор
Что такое емкость аккумулятора телефона?
Емкость аккумулятора телефона — количество электроэнергии, которую полностью заряженный аккумулятор может отдать автономному устройству до того, как полностью разрядится. Проще говоря, этот показатель может дать примерное представление о том, сколько времени телефон будет работать самостоятельно до полной разрядки.

Новый аккумулятор телефона использует практически 100% емкости. Малая часть заряда батареи остается нетронутой даже при 0%, чтобы поддерживать память телефона. Однако со временем доступная емкость уменьшается, поэтому эта характеристика актуальна только на протяжении непродолжительного использования телефона.
Емкость аккумулятора измеряется в миллиампер-часах (mAh или мАч), а само значение индивидуально для каждого мобильного устройства. Узнать его можно из технических характеристик телефона, в инструкции по эксплуатации или с помощью специального приложения, например, CPU-Z, которое необходимо скачать на телефон. Стандартная емкость аккумулятора варьируется от 3000 до 5000 мАч, но может быть как больше, так и меньше. По этому показателю можно вычислить примерное время автономной работы мобильного телефона:
- Аккумулятор емкостью 2000-2500 мАч точно потребует зарядки раз в сутки.
- Аккумулятор емкостью 3000-4000 мАч при низких нагрузках продержится два дня.
- Аккумулятор емкостью свыше 5000 мАч может проработать без подзарядки 3 дня.
Важно! Описанные выше данные являются примерными, так как на время автономной работы влияет огромное количество факторов.
