Порядковый номер химического элемента
- Порядковый номер химического элемента
-
Заря́довое число́ атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядру химического элемента в таблице Менделеева.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и химии, тогда как эквивалентный термин «зарядовое число» — в физике ядра. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Зарядовое число обычно обозначается буквой Z. Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства.
Wikimedia Foundation.
2010.
Смотреть что такое «Порядковый номер химического элемента» в других словарях:
-
ПОРЯДКОВЫЙ НОМЕР — элемента, то же, что (см. АТОМНЫЙ НОМЕР). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. ПОРЯДКОВЫЙ НОМЕР … Физическая энциклопедия
-
ПОРЯДКОВЫЙ НОМЕР — химического элемента то же, что атомный номер … Большой Энциклопедический словарь
-
Порядковый номер элемента — Зарядовое число атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому… … Википедия
-
порядковый номер — химического элемента, то же, что атомный номер. * * * ПОРЯДКОВЫЙ НОМЕР ПОРЯДКОВЫЙ НОМЕР химического элемента, то же, что атомный номер (см. АТОМНЫЙ НОМЕР) … Энциклопедический словарь
-
Атомный номер — порядковый номер химического элемента в периодической системе элементов (См. Периодическая система элементов) Д. И. Менделеева. А. н. равен числу протонов в атомном ядре, которое, в свою очередь, равно числу электронов в электронной… … Большая советская энциклопедия
-
АТОМНЫЙ НОМЕР — АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома … Современная энциклопедия
-
Атомный номер — АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома. … Иллюстрированный энциклопедический словарь
-
атомный номер — порядковый номер, Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома. * * * АТОМНЫЙ НОМЕР АТОМНЫЙ НОМЕР (порядковый номер), Z, номер… … Энциклопедический словарь
-
АТОМНЫЙ НОМЕР — (порядковый номер) Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома … Большой Энциклопедический словарь
-
Химический элемент — Химический элемент совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева[1]. Каждый химический элемент имеет свои название и символ, которые приводятся в… … Википедия
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА
 Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
 В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
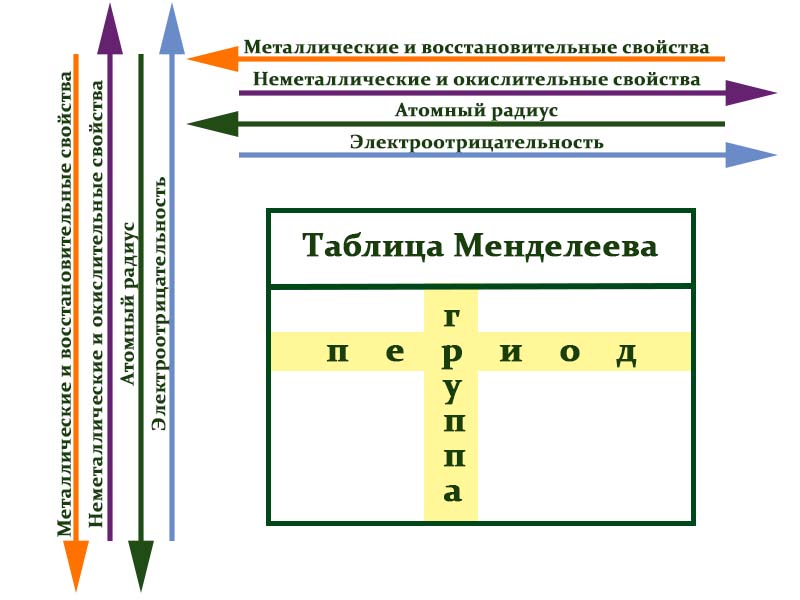
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Первоначальные представления
о строении атома и химических
элементах
Цель настоящей статьи – изложение
сложных вопросов общей химии, а именно
первоначальных представлений о строении атомов
химических элементов, в доступной форме. Этот
материал может предварять изучение темы на более
сложном уровне. Такой подход многократно
использовался мной на уроках химии.
Как известно, химия – это наука о веществах.
Разные вещества имеют различное строение. Бывают
вещества атомного строения, они состоят из
атомов. Пример вещества атомного строения –
алмаз. Вещества молекулярного строения
образованы молекулами. Например, вода состоит из
молекул H2O. Любая молекула состоит из
атомов. Известны вещества ионного строения.
Например, поваренная соль NaCl состоит из ионов
натрия и ионов хлора. Ионы – это тоже атомы или
группы атомов, только заряженные. Вот и
получается, какое вещество ни возьми, в основе
его строения лежит атом. Чтобы изучить вещества,
нам вначале следует понять, что такое атом.
Еще 150 лет назад некоторые ученые подвергали
сомнению факт существования атомов. Однако
несколько десятилетий спустя, в конце XIX – начале
XX в., была не только подтверждена реальность
атомов, но и доказано их сложное строение. Было
установлено, что в центре атома находится ядро.
Размеры самого атома во много раз превышают
размеры ядра. Представьте себе футбольное поле с
теннисным мячиком посередине. Если увеличить
атом до размеров футбольного поля, то размеры его
ядра будут сопоставимы с теннисным мячиком.
Атом состоит из элементарных частиц –
протонов, нейтронов и электронов. Элементарными
эти частицы назвали потому, что в отличие от
атома они неделимы. Два вида элементарных частиц
– протоны и нейтроны – образуют ядро. Электроны
образуют электронную оболочку вокруг ядра.
Электроны в отличие от ядер находятся в
постоянном движении. Говоря о движении
электрона, я избегаю употребления слов «вокруг»
и «вращается» и заменяю их словами «около» и
«движется». Если бы я сказала: «Электрон
вращается вокруг ядра», вы могли бы подумать, что
у него (электрона) есть постоянная орбита,
подобно тому как у планет Солнечной системы есть
свои орбиты вокруг Солнца. Кстати, на заре
исследований атома некоторое время ученые так и
думали. Была выдвинута так называемая
«планетарная теория строения атома». Однако
позже было установлено, что движение электрона
гораздо сложнее и что скорость этого движения
очень велика. Именно благодаря быстрому движению
электронов возникает электронное облако.
(Возможно, в детстве вы играли с пуговицей и
ниткой. К середине нитки привязывается пуговица
и много раз один ее конец вращается по часовой
стрелке или против нее, а потом концы нитки
натягиваются и пуговица на большой скорости
начинает двигаться в противоположном
направлении. Возникает иллюзия веретена.
Проделайте с пуговицей и ниткой все, как здесь
описано, наблюдайте веретено, и, может быть, тогда
вы лучше себе представите, что такое электронное
облако.)
В табл. 1 представлены характеристики
элементарных частиц, составляющих атомы.
Таблица 1
Сведения о частицах, составляющих
атомы
| Части атома | Элементарные частицы | Условное обозначение | Заряд | Масса |
|---|---|---|---|---|
| Ядро | Протон | р | +1 | 1 а.е.м. |
| Нейтрон | n | 0 | 1 а.е.м. | |
| Электронная оболочка | Электрон | е | –1 | Можно пренебречь |
Из табл. 1 видно, что нейтрон –
электронейтральная частица, ее заряд равен нулю,
а протон и электрон – это заряженные частицы.
Заряды протона и электрона одинаковы по
величине, но отличаются по знаку заряда. Как
всякая материальная частица, электрон имеет
массу. Однако эта масса так мала (масса электрона
в 1840 раз меньше массы одного протона или
нейтрона), что ее вкладом в общую массу атома
можно пренебречь. Отсюда следует важный вывод: масса
атома сосредоточена в ядре.
Масса протона почти такая же, как масса
нейтрона, и равна атомной единице массы (а.е.м). За
атомную единицу массы принята 1/12 часть массы
изотопа углерода 12С.
Для выражения массы атомов чаще используют
относительную атомную массу (безразмерная
величина), которая обозначается Ar.
Например, для кислорода и серы: Ar(О) = 16 и Ar(S)
= 32.
В состав атома входят заряженные частицы,
однако атом – это электронейтральная
частица.
Заряд свободного атома или
атомов простого вещества равен нулю.Число
протонов в атоме равно числу электронов.
В природе существуют разновидности атомов,
различающихся размерами, массой и другими
характеристиками. Совокупность атомов одного
вида называется химическим элементом. Можно
сказать по-другому: химический элемент – это вид
атомов. Известно более ста химических элементов.
Чем же отличаются атомы различных химических
элементов? Во-первых, размерами, во-вторых,
массой, в-третьих, строением.
Рассмотрим более подробно строение атомов
различных химических элементов. Возьмите
периодическую систему химических элементов
Д.И.Менделеева и найдите химический элемент
водород.
Атомы водорода имеют самое простое строение.
Ядро состоит всего из одного протона. Заряд ядра
равен +1. Поскольку масса атома сосредоточена в
ядре, его масса равна 1 а.е.м. Атом – это
электронейтральная частица, около ядра
находится один электрон.
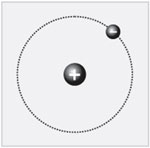
Более сложный элемент – гелий. В периодической
системе он числится под номером 2. Найдите этот
элемент и его порядковый номер в таблице
Менделеева (цифру 2). На рисунке показано, как
условно выглядит строение атома гелия. Как видим,
ядро образовано двумя протонами и двумя
нейтронами. Заряд ядра +2. Около ядра в атоме – два
электрона. Массовое число (оно характеризует
массу атома) равно четырем.
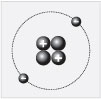
Найдите в периодической системе химический
элемент, порядковый номер которого равен трем.
Это – литий. В атоме лития ядро образовано тремя
протонами и четырьмя нейтронами. Заряд ядра
равен +3, около него находятся три электрона,
массовое число равно семи. Внимательно
рассмотрите клетку периодической системы, в
которой расположен литий, и найдите число 6,94.
Если его округлить, то получится 7. Это массовое
число лития.
Запомните, что меньшее из чисел, расположенных
в клетке периодической системы, – это порядковый
номер элемента. Другое число характеризует массу
атома, при округлении его до целых чисел получают
массовое число. Если хотят указать порядковый
номер и массовое число элемента, например гелия,
это делают так: ![]() .
.
А эта запись относится к литию: ![]() . Здесь 7 – массовое число, равное
. Здесь 7 – массовое число, равное
сумме протонов и нейтронов. Число электронов в
атоме равно числу протонов (заряд ядра) и такое
же, как порядковый номер элемента (3).
Следующее положение необходимо хорошо
запомнить:
порядковый номер элемента
указывает на число электронов, число протонов и
заряд ядра атома.
Найдите в периодической системе элемент
серебро. Чему равны его порядковый номер и
массовое число? Оказывается, порядковый номер 47,
а массовое число 108. Какие выводы можно сделать из
этого? Число электронов в атоме серебра 47, число
протонов также 47, заряд ядра +47. Масса атома (масса
ядра) равна 108 а.е.м. Напомним, что ядро образовано
протонами и нейтронами. Чтобы найти число
нейтронов, необходимо из 108 вычесть 47. В атоме
серебра 61 нейтрон.
Если бы все 47 электронов атома серебра
двигались на одинаковом расстоянии от ядра,
«аварий» (столкновений электронов) нельзя было
бы избежать. Чтобы этого не произошло, природа
распорядилась таким образом, что электроны
располагаются на различных расстояниях от ядра.
Так, в атоме лития два электрона находятся ближе
к ядру, а третий – дальше от него. Располагаясь
на различных расстояниях от ядра, электроны
образуют энергетические уровни. Электроны,
находящиеся на различных энергетических
уровнях, обладают различным запасом энергии. Чем
дальше электрон от ядра, тем больше его энергия.
Чтобы легче запомнить это утверждение, приведу
шуточную аналогию. Представьте, что ваши
родители – это ядро, а вы – электрон. Когда ваша
энергия (активность, независимость) больше: когда
вы близко от родителей (например, в одной с ними
квартире) или далеко от них? Конечно же, во втором
случае. Моим ученикам нравится этот пример, и они
легко запоминают сложное утверждение об энергии.
Сколько же электронов может находиться на
различных энергетических уровнях? На ближайшем к
ядру (первом) энергетическом уровне может
находиться не более двух электронов. Вместимость
других электронных слоев показана на схеме.
Схема
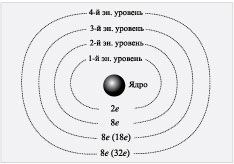
В некоторых учебниках вы найдете буквенное
обозначение энергетических уровней:
1-й – уровень К, 2-й – уровень L, 3-й – уровень М, 4-й
– уровень N.
На 2-м энергетическом уровне может находиться 8
электронов. Но что означают цифры 8 (18), 8 (32)?
Установлено, что если 3-й или более дальний
энергетический уровень является внешним, то на
нем может находиться не более восьми электронов.
Если же за 3-м энергетическим уровнем есть другие
энергетические уровни, то на нем может
накапливаться до 18 электронов. Аналогично
обстоит дело с 4-м энергетическим уровнем. Если он
внешний, то может содержать максимально 8
электронов, если же за ним есть другие
энергетические уровни, то на 4-м энергетическом
уровне может накапливаться до 32 электронов.
Важное заключение:
на внешнем энергетическом
уровне не может быть более 8 электронов.
Для нас будет очень важной информация о внешнем
энергетическом уровне, поэтому воспользуемся
сокращением этого словосочетания – ВЭУ.
В дальнейшем, показывая схему атома, мы не будем
обозначать все его протоны и нейтроны, а лишь
укажем в центре заряд его ядра. Заряду ядра атома
мы всегда будем уделять большое внимание, и скоро
вы поймете почему.
Рассмотрим последовательность заполнения
электронами энергетических уровней у атомов
первых 20 элементов периодической системы (табл.
2).
Таблица 2
| Название элемента | Порядковый номер | Число электронов на энергетических уровнях | |||
|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | ||
| Водород | 1 | 1 | c | c | c |
| Гелий | 2 | 2 | c | c | c |
| Литий | 3 | 2 | 1 | c | c |
| Бериллий | 4 | 2 | 2 | c | c |
| Бор | 5 | 2 | 3 | c | c |
| Углерод | 6 | 2 | 4 | c | c |
| Азот | 7 | 2 | 5 | c | c |
| Kислород | 8 | 2 | 6 | c | c |
| Фтор | 9 | 2 | 7 | c | c |
| Неон | 10 | 2 | 8 | c | c |
| Натрий | 11 | 2 | 8 | 1 | c |
| Магний | 12 | 2 | 8 | 2 | c |
| Алюминий | 13 | 2 | 8 | 3 | c |
| Kремний | 14 | 2 | 8 | 4 | c |
| Фосфор | 15 | 2 | 8 | 5 | c |
| Сера | 16 | 2 | 8 | 6 | c |
| Хлор | 17 | 2 | 8 | 7 | c |
| Аргон | 18 | 2 | 8 | 8 | c |
| Kалий | 19 | 2 | 8 | 8 | 1 |
| Kальций | 20 | 2 | 8 | 8 | 2 |
Следующий за литием элемент –
бериллий. Его порядковый номер 4, а значит, около
ядра 4 электрона, 2 – на 1-м уровне и 2 – на 2-м. Далее
по мере увеличения порядкового номера идет
накопление электронов на 2-м энергетическом
уровне, и у элемента под номером 10 (неона) на 2-м
(внешнем) энергетическом уровне уже 8 электронов.
Поскольку на внешнем энергетическом уровне не
может быть более 8 электронов, у следующего
элемента с порядковым номером 11 (натрия)
одиннадцатый электрон образует 3-й
энергетический уровень. С увеличением
порядкового номера идет накопление электронов,
но уже на 3-м энергетическом уровне. У аргона, как
и у неона, на ВЭУ максимальное число электронов –
8. Следующий за аргоном элемент – калий.
Размещение электронов на его четырех
энергетических уровнях – 2, 8, 8, 1.
Будем одновременно анализировать табл. 2 и
периодическую систему элементов Д.И.Менделеева.
Обратите внимание, что первые два элемента в
нашей таблице отделены от остальных чертой. Что
объединяет их? И у водорода, и у гелия в атоме
всего лишь один энергетический уровень. В
периодической системе эти элементы расположены
в первой строчке. За гелием следуют 8 элементов:
литий, бериллий, бор, углерод, азот, кислород, фтор
и неон. В табл. 2 эти элементы отделены от других
также чертой. Почему? В атомах этих элементов
электроны распределены по двум энергетическим
уровням. В периодической системе Д.И.Менделеева
элементы от Li по Ne размещены во второй строчке.
Оставшуюся часть табл. 2 проанализируйте сами и
найдите эти элементы в периодической системе.
Напомним, что горизонтальная строчка в
периодической системе элементов Д.И.Менделеева
называется периодом. Такое определение периода
упрощено, и пользоваться им можно лишь на
начальном этапе изучения химии. Обратите
внимание, что четвертый, пятый и шестой периоды
включают в себя не одну, а две строчки (это
большие периоды).
Проанализировав обе таблицы, вы, наверное, сами
смогли сделать вывод:
номер периода указывает на
число энергетических уровней в атоме.
Например, элемент 47Ag (серебро) расположен
в пятом периоде, следовательно, 47 его электронов
распределены на пяти энергетических уровнях.
Обобщим знания и дадим характеристику строения
атомов натрия и калия.
Атом натрия имеет порядковый номер 11,
массовое число 23. Ядро содержит 11 протонов и
12 нейтронов. Заряд ядра +11. Около ядра движется 11
электронов. Натрий находится в третьем периоде,
поэтому 11 его электронов распределены на трех
энергетических уровнях (2е, 8е, 1е).
Атом калия – порядковый номер 19, массовое
число 39. В ядре – 19 протонов и 20 нейтронов. Заряд
ядра +19. Около ядра движется 19 электронов. Калий
находится в четвертом периоде, поэтому 19 его
электронов распределены на четырех
энергетических уровнях (2е, 8е, 8е, 1е).
Сравним распределение электронов в атомах так
называемых сходных элементов, сначала – в атомах
лития, натрия и калия (табл. 3).
Таблица 3
| Элемент | Число электронов на энергетических уровнях | |||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Литий | 2 | 1 | ||
| Натрий | 2 | 8 | 1 | |
| Kалий | 2 | 8 | 8 | 1 |
Из табл. 3 видно, что на ВЭУ у атомов этих
элементов по одному электрону. Найдем в
периодической системе элементы литий, натрий,
калий. Все они расположены в первом столбце
периодической системы.
Рассмотрим распределение электронов в атомах
бериллия, магния и кальция (табл. 4).
Таблица 4
| Элемент | Число электронов на энергетических уровнях | |||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Бериллий | 2 | 2 | ||
| Магний | 2 | 8 | 2 | |
| Kальций | 2 | 8 | 8 | 2 |
Оказывается, на ВЭУ у атомов этих
элементов по два электрона. В периодической
системе они расположены во втором столбце.
Рассмотрим распределение электронов в атомах
фтора, хлора и брома (табл. 5).
Таблица 5
| Элемент | Число электронов на энергетических уровнях | |||
|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | |
| Фтор | 2 | 7 | ||
| Хлор | 2 | 8 | 7 | |
| Бром | 2 | 8 | 18 | 7 |
Из схемы видно, что на ВЭУ у атомов этих
элементов по семь электронов. Они расположены в
седьмом столбце периодической системы.
Вертикальный столбец периодической системы
называется группой. Это определение группы, как и
определение периода, упрощено, и пользоваться им
можно лишь на начальном этапе изучения химии.
Групп в периодической системе – восемь. Как вы
думаете, почему именно восемь, а не семь или
девять? Чтобы ответить на этот вопрос, вспомним,
каково максимальное число электронов на внешнем
энергетическом уровне. Восемь! А теперь очень
важный вывод:
номер группы указывает число
электронов на внешнем энергетическом уровне
атома.
Сколько электронов на ВЭУ у атома серебра?
Чтобы ответить на этот вопрос, уточните
положение серебра в периодической системе.
Серебро находится в первой группе, значит, на
внешнем энергетическом уровне его атомов – один
электрон.
Может быть, кто-то из вас скажет: «Для первых 20
элементов мы знаем распределение электронов в
атоме. А как узнать распределение электронов в
атомах других элементов? Например, как узнать,
что у атома брома на третьем энергетическом
уровне 18 электронов?» На первых порах эту
информацию можно получать из периодической
системы. Найдите в таблице Д.И.Менделеева элемент
№ 35. В его клетке имеется столбик мелких цифр,
если считать снизу, – 2, 8, 18, 7. Значит, на 1-м
энергетическом уровне атома Br – 2e, на 2-м – 8e,
на 3-м – 18e и на 4-м – 7e.
Найдите в периодической системе распределение
электронов в атоме серебра. Как много сведений
можно извлечь из периодической системы! На
экзамене по химии разрешено пользоваться
периодической системой Д.И.Менделеева. Поэтому в
ваших интересах как можно лучше в ней
разобраться. Это не только увлекательно и
интересно, но и может вам пригодиться.
Найдите в периодической системе элементы
гелий, неон, аргон, криптон, ксенон и радон.
Напишите самостоятельно распределение
электронов в атомах этих элементов, а потом
сравните с приведенной ниже табл. 6.
Таблица 6
| Элемент | Число электронов на энергетических уровнях | |||||
|---|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | |
| Гелий | 2 | |||||
| Неон | 2 | 8 | ||||
| Аргон | 2 | 8 | 8 | |||
| Kриптон | 2 | 8 | 18 | 8 | ||
| Kсенон | 2 | 8 | 18 | 18 | 8 | |
| Радон | 2 | 8 | 18 | 32 | 18 | 8 |
Из табл. 6 видно, что на ВЭУ у атомов этих
элементов максимальное число электронов – по 8.
Перечисленные элементы объединены в группу
инертных газов. Синонимами слова «инертный»
являются слова «неактивный», «пассивный». И
действительно, атомы этих элементов отличаются
чрезвычайно низкой химической активностью.
Правильней было бы сказать, что они отличаются
особой химической неактивностью. Эти газы при
обычных условиях не взаимодействуют ни с какими
веществами, а при особых условиях
взаимодействуют с очень немногими веществами.
Может быть, поэтому другое их название –
благородные газы.
Т.А.ЖУРАВЛЕВА,
учитель химии гимназии № 272
(Санкт-Петербург)

Заря́довое число́атомного ядра (b) (синонимы: а́томный но́мер, а́томное число́, поря́дковый но́мерхимического элемента (b) ) — количество протонов (b) в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда (b) и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева (b) . Обычно обозначается буквой Z[⇨].
Термин «атомный» или «порядковый» номер обычно используется в атомной физике (b) и в химии (b) , тогда как эквивалентный термин «зарядовое число» — в ядерной физике (b) . В неионизированном (b) атоме количество электронов (b) в электронных оболочках (b) совпадает с зарядовым числом.
Ядра с одинаковым зарядовым числом, но различным массовым числом (b) A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами (b) одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства. Более трёх четвертей химических элементов существует в природе в виде смеси изотопов (см. Моноизотопный элемент (b) ), и средняя изотопная масса изотопной смеси элемента (называемая относительной атомной массой (b) ) в определённой среде на Земле определяет стандартную атомную массу (b) элемента (ранее использовалось название «атомный вес»). Исторически именно эти атомные веса элементов (по сравнению с водородом) были величинами, которые измеряли химики в XIX веке.
Поскольку протоны и нейтроны имеют приблизительно одинаковую массу (масса электронов (b) пренебрежимо мала по сравнению с их массой), а дефект массы (b) нуклонного связывания всегда мал по сравнению с массой нуклона, значение атомной массы любого атома, выраженной в атомных единицах массы (b) , находится в пределах 1 % от целого числа А.
История
Периодическая таблица и порядковые номера для каждого элемента

Поиски основы естественной классификации и систематизации химических элементов, основанной на связи их физических и химических свойств с атомным весом, предпринимались на протяжении длительного времени. В 1860-х годах появился ряд работ, связывающих эти характеристики — спираль Шанкуртуа (b) , таблица Ньюлендса (b) , таблицы Одлинга (b) и Мейера (b) , но ни одна из них не давала однозначного исчерпывающего описания закономерности. Сделать это удалось русскому химику Д. И. Менделееву (b) . 6 марта 1869 года (18 марта (b) 1869 года (b) ) на заседании Русского химического общества (b) было зачитано сообщение Менделеева об открытии им Периодического закона химических элементов (b) [1], а вскоре его статья «Соотношение свойств с атомным весом элементов» была опубликована в «Журнале Русского физико-химического общества (b) »[2]. В том же году вышло первое издание учебника Менделеева «Основы химии», где была приведена его периодическая таблица. В статье, датированной 29 ноября 1870 года (11 декабря (b) 1870 года (b) ), опубликованной в «Журнале Русского химического общества» под названием «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», Менделеев впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов[3].
В своих работах Менделеев расположил элементы в порядке их атомных весов, но при этом сознательно допустил отклонение от этого правила, поместив теллур (b) (атомный вес 127,6) впереди иода (b) (атомный вес 126,9)[4], объясняя это химическими свойствами элементов. Такое размещение элементов правомерно с учётом их зарядового числа Z, которое было неизвестно Менделееву. Последующее развитие атомной химии подтвердило правильность догадки учёного.
Модели атома Резерфорда-Бора и Ван ден Брука

В 1911 году британский физик Эрнест Резерфорд (b) предложил модель атома (b) , согласно которой в центре атома расположено ядро, содержащее б́ольшую часть массы атома и положительный заряд, который в единицах заряда электрона должен был быть равен примерно половине атомного веса атома, выраженного в числе атомов водорода. Резерфорд сформулировал свою модель на основе данных об атоме золота (b) (Z = 79, A = 197), и, таким образом, получалось, что у золота должен быть заряд ядра около 100 (в то время как порядковый номер золота в периодической таблице 79). Через месяц после выхода статьи Резерфорда голландский физик-любитель Антониус ван ден Брук (b) впервые предположил, что заряд ядра и число электронов в атоме должны быть точно равны его порядковому номеру в периодической таблице (он же — атомный номер, обозначаемый Z). Эта гипотеза в конечном счёте подтвердилась.
Но с точки зрения классической электродинамики, в модели Резерфорда электрон, двигаясь вокруг ядра, должен был бы излучать (b) энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы разрешить эту проблему, в 1913 году датский физик Нильс Бор (b) предложил свою модель (b) атома. Бор ввёл допущение, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых, они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. При этом стационарными являются лишь те орбиты, при движении по которым момент количества движения (b) электрона равен целому числу постоянных Планка (b) [5]: .
Эксперименты Мозли 1913 года и «пропавшие» химические элементы
В 1913 году британский химик Генри Мозли (b) после дискуссии с Н.Бором решил проверить гипотезы Ван ден Брука и Бора на эксперименте[6]. Для этого Мозли измерил длины волн спектральных линий (b) фотонных переходов (линии K и L) в атомах алюминия (Z = 13) и золота (Z = 79), использовавшихся в качестве серии мишеней внутри рентгеновской трубки (b) [7]. Квадратный корень частоты этих фотонов (рентгеновских лучей) увеличивался от одной цели к другой в арифметической прогрессии. Это привело Мозли к заключению (закон Мозли (b) ), что значение атомного номера почти соответствует (в работе Мозли — со смещением на одну единицу для K-линий) вычисленному электрическому заряду ядра, то есть величине Z. Среди прочего эксперименты Мозли продемонстрировали, что ряд лантаноидов (b) (от лантана (b) до лютеция (b) включительно) должен содержать ровно 15 элементов — не меньше и не больше, что было далеко не очевидно для химиков того времени.
После смерти Мозли в 1915 году его методом были исследованы атомные номера всех известных элементов от водорода до урана (b) (Z = 92). Было обнаружено, что в периодической таблице отсутствуют семь химических элементов (с Z < 92), которые были идентифицированы как ещё не открытые, с атомными номерами 43, 61, 72, 75, 85, 87 и 91[8]. Все эти семь «пропавших» элементов были обнаружены в период с 1918 по 1947 год: технеций (b) (Z = 43), прометий (b) (Z = 61), гафний (b) (Z = 72), рений (b) (Z = 75), астат (b) (Z = 85), франций (b) (Z = 87) и протактиний (b) (Z = 91)[8]. К этому времени также были обнаружены первые четыре трансурановых элемента (b) , поэтому периодическая таблица была заполнена без пробелов до кюрия (b) (Z = 96).
Протон и гипотеза «ядерных электронов»

К 1915 году в научном сообществе сложилось понимание того факта, что зарядовые числа Z, они же — порядковые номера элементов, должны быть кратны величине заряда ядра атома водорода, но не было объяснения причин этого. Сформулированная ещё в 1816 году гипотеза Праута (b) предполагала, что водород является некоей первичной материей, из которой путём своего рода конденсации образовались атомы всех других элементов и, следовательно, атомные веса всех элементов, равно как и заряды их ядер, должны измеряться целыми числами. Но в 1907 году опыты Резерфорда и Ройдса (b) [en] показали, что альфа-частицы (b) с зарядом +2 являются ядрами атомов гелия, масса которых превышает массу водорода в четыре, а не в два раза. Если гипотеза Праута верна, то что-то должно было нейтрализовать заряды ядер водорода, присутствующие в ядрах более тяжёлых атомов.
В 1917 году (в экспериментах, результаты которых были опубликованы в 1919 и 1925 годах), Резерфорд доказал, что ядро водорода присутствует в других ядрах; этот результат обычно интерпретируют как открытие протонов (b) [9]. Эти эксперименты начались после того, как Резерфорд заметил, что, когда альфа-частицы были выброшены в воздух (в основном состоящий из азота), детекторы зафиксировали следы типичных ядер водорода. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводятся в чистый газообразный азот, эффект оказывается больше. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод (b) . После наблюдения изображений камеры Блэкетта в 1925 году Резерфорд понял, что произошло обратное: после захвата альфа-частицы протон выбрасывается, поэтому тяжёлый кислород (b) , а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это была первая описанная ядерная реакция (b) : 14N + α → 17O + p.
Резерфорд назвал новые тяжёлые ядерные частицы протонами в 1920 году (предлагались альтернативные названия — «прутоны» и «протилы»). Из работ Мозли следовало, что ядра тяжёлых атомов имеют более чем вдвое большую массу, чем можно было бы ожидать при условии, что они состоят только из ядер водорода, и поэтому требовалось объяснение для «нейтрализации» предполагаемых дополнительных протонов, присутствующих во всех тяжелых ядрах. В связи с этим была выдвинута гипотеза о так называемых «ядерных электронах». Так, предполагалось, что ядро гелия состоит из четырёх протонов и двух «ядерных электронов», нейтрализующих заряд двух протонов. В случае золота с атомной массой 197 и зарядом 79, ранее рассмотренном Резерфордом, предполагалось, что ядро атома золота содержит 118 этих «ядерных электронов».
Открытие нейтрона и его значение
Несостоятельность гипотезы «ядерных электронов» стала очевидной после открытия нейтрона (b) [en]Джеймсом Чедвиком (b) в 1932 году[10]. Наличие нейтронов (b) в ядрах атомов легко объясняло расхождение между атомным весом и зарядным числом атома: так, в атоме золота содержится 118 нейтронов, а не 118 ядерных электронов, а положительный заряд ядра полностью состоит из 79 протонов. Таким образом, после 1932 года атомный номер элемента Z стал рассматриваться как число протонов в его ядре.
Символ Z
Зарядовое число обычно обозначается буквой Z, от нем. (b) atomzahl — «атомное число», «атомный номер»[11] Условный символ Z, вероятно, происходит от немецкого слова Atomzahl (атомный номер)[12], обозначающего число, которое ранее просто обозначало порядковое место элемента в периодической таблице и которое приблизительно (но не точно) соответствовало порядку элементов по возрастанию их атомных весов. Только после 1915 года, когда было доказано, что число Z является также величиной заряда ядра и физической характеристикой атома, немецкое слово Atomzahl (и его английский эквивалент англ. (b) Atomic number) стали широко использоваться в этом контексте.
Химические свойства
Каждый элемент обладает определённым набором химических свойств как следствие количества электронов, присутствующих в нейтральном атоме, которое представляет собой Z (атомный номер). Конфигурация электронов (b) в атоме следует из принципов квантовой механики (b) . Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке (b) , является основным фактором, определяющим его химические связи. Следовательно, только атомный номер определяет химические свойства элемента, и именно поэтому элемент может быть определён как состоящий из любой смеси атомов с данным атомным номером.
Новые элементы
При поиске новых элементов исследователи руководствуются представлениями об зарядовых числах этих элементов. По состоянию на конец 2019 года были обнаружены все элементы с зарядовыми числами от 1 до 118. Синтез новых элементов осуществляется путем бомбардировки атомов-мишеней тяжёлых элементов ионами таким образом, что сумма зарядовых чисел атома-мишени и иона-«снаряда» равна зарядовому числу создаваемого элемента. Как правило, период полураспада (b) элемента становится короче с увеличением атомного номера, хотя для неизученных изотопов с определённым числом протонов и нейтронов могут существовать так называемые «острова стабильности (b) »[13].
См. также
- Атомная теория (b)
- Гипотеза Праута (b)
- Химический элемент (b)
- Периодическая таблица химических элементов (b)
- Список химических элементов (b)
Примечания
- ↑ Трифонов Д. Н. Несостоявшееся выступление Менделеева (6 (18) марта 1869 г.)Архивная копия от 18 марта 2014 на Wayback Machine (b) // Химия, № 04 (699), 16-28.02.2006
- ↑ Менделеев Д. И. Соотношение свойств с атомным весом элементов // Журнал Русского химического общества. — 1869. — Т. I. — С. 60—77. Архивировано 18 марта 2014 года.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества (b) . — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Периодический закон химических элементов // Энциклопедический словарь (b) юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика (b) , 1990. — С. 185. — ISBN 5-7155-0292-6.
- ↑ Планетарная модель атома. Постулаты БораАрхивная копия от 21 февраля 2009 на Wayback Machine (b) на Портале Естественных НаукАрхивная копия от 26 ноября 2009 на Wayback Machine (b)
- ↑ Ordering the Elements in the Periodic TableАрхивная копия от 4 марта 2016 на Wayback Machine (b) , Royal Chemical Society
- ↑ Moseley H. G. J. (b) XCIII. The high-frequency spectra of the elements (англ.) // Philosophical Magazine (b) , Series 6. — 1913. — Vol. 26, no. 156. — P. 1024. — doi (b) :10.1080/14786441308635052. Архивировано 22 января 2010 года.
- 1 2 Scerri E. A tale of seven elements (англ.). — Oxford University Press, 2013. — P. 47. — ISBN 978-0-19-539131-2.
- ↑ Petrucci R. H., Harwood W. S., Herring F. G. General Chemistry (англ.). — 8th ed.. — Upper Saddle River, N.J.: Prentice Hall, 2002. — P. 41.
- ↑ Chadwick J. Existence of a Neutron (англ.) // Proceedings of the Royal Society A. — 1932. — Vol. 136, no. 830. — P. 692—708. — doi (b) :10.1098/rspa.1932.0112. — Bibcode (b) : 1932RSPSA.136..692C.
- ↑ General Chemistry Online: FAQ: Atoms, elements, and ions: Why is atomic number called «Z»? Why is mass number called «A»?. antoine.frostburg.edu. Дата обращения: 8 марта 2019. Архивировано 16 января 2000 года.
- ↑ Origin of symbol ZАрхивная копия от 16 января 2000 на Wayback Machine (b) . frostburg.edu
- ↑ Остров Стабильности за пределами таблицы Менделеева. Дата обращения: 29 ноября 2019. Архивировано 21 ноября 2018 года.
Графическим отображением периодического закона является Периодическая система химических элементов. Известно более (700) форм периодической таблицы. Официальным по решению Международного союза химиков является её полудлинный вариант.
Рис. (1). Периодическая система химических элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Ломаная линия обозначает границу между металлами и неметаллами.
Последовательность расположения элементов не всегда совпадает с возрастанием атомной массы. Есть несколько исключений из правила. Так, относительная атомная масса аргона больше атомной массы калия, в теллура — больше, чем йода.
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Период — горизонтальный ряд химических элементов, начинающийся щелочным металлом (или водородом) и заканчивающийся инертным (благородным) газом.
В таблице семь периодов. В каждом содержится определённое число элементов:
(1)-й период — (2) элемента,
(2)-й период — (8) элементов,
(3)-й период — (8) элементов,
(4)-й период — (18) элементов,
(5)-й период — (18) элементов,
(6)-й период — (32) элемента ((18 + 14)),
(7)-й период — (32) элемента ((18 + 14)).
Три первых периода называют малыми периодами, остальные — большими. И в малых, и в больших периодах происходит постепенное ослабление металлических свойств и усиление неметаллических, только в больших периодах оно происходит более плавно.
Элементы с порядковыми номерами (58)–(71) (лантаноиды) и (90)–(103) (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы
IIIB
группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Восьмой период появится в Периодической таблице, когда будут открыты новые элементы.
Группа — вертикальный столбец химических элементов, имеющих сходные свойства.
В Периодической таблице (18) групп, пронумерованных арабскими цифрами. Часто используют нумерацию римскими цифрами с добавлением букв (A) или (B). В таком случае групп (8).
Группы (A) начинаются элементами малых периодов, включают также и элементы больших периодов; содержат и металлы, и неметаллы. В коротком варианте Периодической таблицы это главные подгруппы.
Группы (B) содержат элементы больших периодов, и это только металлы. В коротком варианте Периодической таблицы это побочные подгруппы.
Число элементов в группах:
IA,
VIIIA
— по (7) элементов;
IIA —
VIIA
— по (6) элементов;
— (32) элемента ((4 + 14) лантаноидов (+ 14) актиноидов);
VIIIB — (12) элементов;
IB,
IIB
,
IVB
—
VIIB
— по (4) элемента.
Количественный состав групп будет изменяться по мере добавления в таблицу новых элементов.
Римский номер группы, как правило, показывает высшую валентность в оксидах. Но для некоторых элементов это правило не выполняется. Так, фтор не бывает семивалентным, а кислород — шестивалентным. Не проявляют валентность, равную номеру группы, гелий, неон и аргон — эти элементы не образуют соединений с кислородом. Медь бывает двухвалентной, а золото — трёхвалентным, хотя это элементы первой группы.
Некоторые группы (A) получили особые названия:
— щелочные металлы (
Li
,
Na
,
K
,
Rb
,
Cs
,
Fr
);
(кроме бериллия и магния) — щелочноземельные металлы (
Ca
,
Sr
,
Ba
,
Ra
);
— галогены (
F
,
Cl
,
Br
,
I
,
At
);
— благородные, или инертные, газы (
He
,
Ne
,
Ar
,
Kr
,
Xe
,
Rn
,
Og
).
Источники:
Рис. 1. Периодическая система химических элементов © ЯКласс
