 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cadmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (KAD-mee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery bluish-gray metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cd) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cadmium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Kr] 4d10 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 594.22 K (321.07 °C, 609.93 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1040 K (767 °C, 1413 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.65 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.996 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 6.21 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 99.87 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.020 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, +1, +2 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 144±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 158 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of cadmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2310 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 30.8 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 96.6 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 72.7 nΩ⋅m (at 22 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −19.8×10−6 cm3/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 19 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 42 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 203–220 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-43-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Karl Samuel Leberecht Hermann and Friedrich Stromeyer (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by | Friedrich Stromeyer (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of cadmium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Cadmium is a chemical element with the symbol Cd and atomic number 48. This soft, silvery-white metal is chemically similar to the two other stable metals in group 12, zinc and mercury. Like zinc, it demonstrates oxidation state +2 in most of its compounds, and like mercury, it has a lower melting point than the transition metals in groups 3 through 11. Cadmium and its congeners in group 12 are often not considered transition metals, in that they do not have partly filled d or f electron shells in the elemental or common oxidation states. The average concentration of cadmium in Earth’s crust is between 0.1 and 0.5 parts per million (ppm). It was discovered in 1817 simultaneously by Stromeyer and Hermann, both in Germany, as an impurity in zinc carbonate.
Cadmium occurs as a minor component in most zinc ores and is a byproduct of zinc production. Cadmium was used for a long time as a corrosion-resistant plating on steel, and cadmium compounds are used as red, orange and yellow pigments, to color glass, and to stabilize plastic. Cadmium use is generally decreasing because it is toxic (it is specifically listed in the European Restriction of Hazardous Substances Directive[4]) and nickel-cadmium batteries have been replaced with nickel-metal hydride and lithium-ion batteries. One of its few new uses is in cadmium telluride solar panels.
Although cadmium has no known biological function in higher organisms, a cadmium-dependent carbonic anhydrase has been found in marine diatoms.
Characteristics[edit]
Physical properties[edit]
Cadmium is a soft, malleable, ductile, silvery-white divalent metal. It is similar in many respects to zinc but forms complex compounds.[5] Unlike most other metals, cadmium is resistant to corrosion and is used as a protective plate on other metals. As a bulk metal, cadmium is insoluble in water[6] and is not flammable; however, in its powdered form it may burn and release toxic fumes.[7]
Chemical properties[edit]
Although cadmium usually has an oxidation state of +2, it also exists in the +1 state. Cadmium and its congeners are not always considered transition metals, in that they do not have partly filled d or f electron shells in the elemental or common oxidation states.[8] Cadmium burns in air to form brown amorphous cadmium oxide (CdO); the crystalline form of this compound is a dark red which changes color when heated, similar to zinc oxide. Hydrochloric acid, sulfuric acid, and nitric acid dissolve cadmium by forming cadmium chloride (CdCl2), cadmium sulfate (CdSO4), or cadmium nitrate (Cd(NO3)2). The oxidation state +1 can be produced by dissolving cadmium in a mixture of cadmium chloride and aluminium chloride, forming the Cd22+ cation, which is similar to the Hg22+ cation in mercury(I) chloride.[5]
- Cd + CdCl2 + 2 AlCl3 → Cd2(AlCl4)2
The structures of many cadmium complexes with nucleobases, amino acids, and vitamins have been determined.[9]
Isotopes[edit]
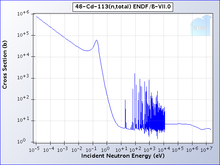
The cadmium-113 total cross section clearly showing the cadmium cut-off
Naturally occurring cadmium is composed of eight isotopes. Two of them are radioactive, and three are expected to decay but have not done so under laboratory conditions. The two natural radioactive isotopes are 113Cd (beta decay, half-life is 7.7×1015 y) and 116Cd (two-neutrino double beta decay, half-life is 2.9×1019 y). The other three are 106Cd, 108Cd (both double electron capture), and 114Cd (double beta decay); only lower limits on these half-lives have been determined. At least three isotopes – 110Cd, 111Cd, and 112Cd – are stable. Among the isotopes that do not occur naturally, the most long-lived are 109Cd with a half-life of 462.6 days, and 115Cd with a half-life of 53.46 hours. All of the remaining radioactive isotopes have half-lives of less than 2.5 hours, and the majority have half-lives of less than 5 minutes. Cadmium has 8 known meta states, with the most stable being 113mCd (t1⁄2 = 14.1 years), 115mCd (t1⁄2 = 44.6 days), and 117mCd (t1⁄2 = 3.36 hours).[10]
The known isotopes of cadmium range in atomic mass from 94.950 u (95Cd) to 131.946 u (132Cd). For isotopes lighter than 112 u, the primary decay mode is electron capture and the dominant decay product is element 47 (silver). Heavier isotopes decay mostly through beta emission producing element 49 (indium).[10]
One isotope of cadmium, 113Cd, absorbs neutrons with high selectivity: With very high probability, neutrons with energy below the cadmium cut-off will be absorbed; those higher than the cut-off will be transmitted. The cadmium cut-off is about 0.5 eV, and neutrons below that level are deemed slow neutrons, distinct from intermediate and fast neutrons.[11]
Cadmium is created via the s-process in low- to medium-mass stars with masses of 0.6 to 10 solar masses, over thousands of years. In that process, a silver atom captures a neutron and then undergoes beta decay.[12]
History[edit]

Cadmium (Latin cadmia, Greek καδμεία meaning «calamine», a cadmium-bearing mixture of minerals that was named after the Greek mythological character Κάδμος, Cadmus, the founder of Thebes) was discovered in contaminated zinc compounds sold in pharmacies in Germany[13] in 1817 by Friedrich Stromeyer.[14] Karl Samuel Leberecht Hermann simultaneously investigated the discoloration in zinc oxide and found an impurity, first suspected to be arsenic, because of the yellow precipitate with hydrogen sulfide. Additionally Stromeyer discovered that one supplier sold zinc carbonate instead of zinc oxide.[4] Stromeyer found the new element as an impurity in zinc carbonate (calamine), and, for 100 years, Germany remained the only important producer of the metal. The metal was named after the Latin word for calamine, because it was found in this zinc ore. Stromeyer noted that some impure samples of calamine changed color when heated but pure calamine did not. He was persistent in studying these results and eventually isolated cadmium metal by roasting and reducing the sulfide. The potential for cadmium yellow as pigment was recognized in the 1840s, but the lack of cadmium limited this application.[15][16][17]
Even though cadmium and its compounds are toxic in certain forms and concentrations, the British Pharmaceutical Codex from 1907 states that cadmium iodide was used as a medication to treat «enlarged joints, scrofulous glands, and chilblains».[18]
In 1907, the International Astronomical Union defined the international ångström in terms of a red cadmium spectral line (1 wavelength = 6438.46963 Å).[19][20] This was adopted by the 7th General Conference on Weights and Measures in 1927. In 1960, the definitions of both the metre and ångström were changed to use krypton.[21]
After the industrial scale production of cadmium started in the 1930s and 1940s, the major application of cadmium was the coating of iron and steel to prevent corrosion; in 1944, 62% and in 1956, 59% of the cadmium in the United States was used for plating.[4][22] In 1956, 24% of the cadmium in the United States was used for a second application in red, orange and yellow pigments from sulfides and selenides of cadmium.[22]
The stabilizing effect of cadmium chemicals like the carboxylates cadmium laurate and cadmium stearate on PVC led to an increased use of those compounds in the 1970s and 1980s. The demand for cadmium in pigments, coatings, stabilizers, and alloys declined as a result of environmental and health regulations in the 1980s and 1990s; in 2006, only 7% of to total cadmium consumption was used for plating, and only 10% was used for pigments.[4]
At the same time, these decreases in consumption were compensated by a growing demand for cadmium for nickel-cadmium batteries, which accounted for 81% of the cadmium consumption in the United States in 2006.[23]
Occurrence[edit]

Cadmium makes up about 0.1 ppm of Earth’s crust. It is much rarer than zinc, which makes up about 65 ppm.[24] No significant deposits of cadmium-containing ores are known. The only cadmium mineral of importance, greenockite (CdS), is nearly always associated with sphalerite (ZnS). This association is caused by geochemical similarity between zinc and cadmium, with no geological process likely to separate them. Thus, cadmium is produced mainly as a byproduct of mining, smelting, and refining sulfidic ores of zinc, and, to a lesser degree, lead and copper. Small amounts of cadmium, about 10% of consumption, are produced from secondary sources, mainly from dust generated by recycling iron and steel scrap. Production in the United States began in 1907,[17] but wide use began after World War I.[25][26]
Metallic cadmium can be found in the Vilyuy River basin in Siberia.[27]
Rocks mined for phosphate fertilizers contain varying amounts of cadmium, resulting in a cadmium concentration of as much as 300 mg/kg in the fertilizers and a high cadmium content in agricultural soils.[28][29] Coal can contain significant amounts of cadmium, which ends up mostly in coal fly ash.[30] Cadmium in soil can be absorbed by crops such as rice. Chinese ministry of agriculture measured in 2002 that 28% of rice it sampled had excess lead and 10% had excess cadmium above limits defined by law. Some plants such as willow trees and poplars have been found to clean both lead and cadmium from soil.[31]
Typical background concentrations of cadmium do not exceed 5 ng/m3 in the atmosphere; 2 mg/kg in soil; 1 μg/L in freshwater and 50 ng/L in seawater.[32] Concentrations of cadmium above 10 μg/L may be stable in water having low total solute concentrations and p H and can be difficult to remove by conventional water treatment processes.[33]
Production[edit]
Cadmium is a common impurity in zinc ores, and it is most often isolated during the production of zinc. Some zinc ores concentrates from zinc sulfate ores contain up to 1.4% of cadmium.[34] In the 1970s, the output of cadmium was 6.5 pounds (2.9 kg) per ton of zinc.[34] Zinc sulfide ores are roasted in the presence of oxygen, converting the zinc sulfide to the oxide. Zinc metal is produced either by smelting the oxide with carbon or by electrolysis in sulfuric acid. Cadmium is isolated from the zinc metal by vacuum distillation if the zinc is smelted, or cadmium sulfate is precipitated from the electrolysis solution.[26][35]
The British Geological Survey reports that in 2001, China was the top producer of cadmium with almost one-sixth of the world’s production, closely followed by South Korea and Japan.[36]
-

History of the world production of cadmium
-

Cadmium production in 2010.
Applications[edit]
Cadmium is a common component of electric batteries, pigments,[37] coatings,[38] and electroplating.[39]
Batteries[edit]

In 2009, 86% of cadmium was used in batteries, predominantly in rechargeable nickel-cadmium batteries. Nickel-cadmium cells have a nominal cell potential of 1.2 V. The cell consists of a positive nickel hydroxide electrode and a negative cadmium electrode plate separated by an alkaline electrolyte (potassium hydroxide).[40] The European Union put a limit on cadmium in electronics in 2004 of 0.01%,[41] with some exceptions, and in 2006 reduced the limit on cadmium content to 0.002%.[42] Another type of battery based on cadmium is the silver-cadmium battery.
Electroplating[edit]

Cadmium electroplating, consuming 6% of the global production, is used in the aircraft industry to reduce corrosion of steel components.[39] This coating is passivated by chromate salts.[38] A limitation of cadmium plating is hydrogen embrittlement of high-strength steels from the electroplating process. Therefore, steel parts heat-treated to tensile strength above 1300 MPa (200 ksi) should be coated by an alternative method (such as special low-embrittlement cadmium electroplating processes or physical vapor deposition).
Titanium embrittlement from cadmium-plated tool residues resulted in banishment of those tools (and the implementation of routine tool testing to detect cadmium contamination) in the A-12/SR-71, U-2, and subsequent aircraft programs that use titanium.[43]
Nuclear fission[edit]
Cadmium is used in the control rods of nuclear reactors, acting as a very effective neutron poison to control neutron flux in nuclear fission.[39] When cadmium rods are inserted in the core of a nuclear reactor, cadmium absorbs neutrons, preventing them from creating additional fission events, thus controlling the amount of reactivity. The pressurized water reactor designed by Westinghouse Electric Company uses an alloy consisting of 80% silver, 15% indium, and 5% cadmium.[39]
Televisions[edit]
QLED TVs have been starting to include cadmium in construction. Some companies have been looking to reduce the environmental impact of human exposure and pollution of the material in televisions during production.[44]
Anticancer drugs[edit]
Complexes based on heavy metals have great potential for the treatment of a wide variety of cancers but their use is often limited due to toxic side effects. However, scientists are advancing in the field and new promising cadmium complex compounds with reduced toxicity have been discovered.[45]
Compounds[edit]

Cadmium oxide was used in black and white television phosphors and in the blue and green phosphors of color television cathode ray tubes.[46] Cadmium sulfide (CdS) is used as a photoconductive surface coating for photocopier drums.[47]

Various cadmium salts are used in paint pigments, with CdS as a yellow pigment being the most common. Cadmium selenide is a red pigment, commonly called cadmium red. To painters who work with the pigment, cadmium provides the most brilliant and durable yellows, oranges, and reds – so much so that during production, these colors are significantly toned down before they are ground with oils and binders or blended into watercolors, gouaches, acrylics, and other paint and pigment formulations. Because these pigments are potentially toxic, users should use a barrier cream on the hands to prevent absorption through the skin[37] even though the amount of cadmium absorbed into the body through the skin is reported to be less than 1%.[7]
In PVC, cadmium was used as heat, light, and weathering stabilizers.[39][48] Currently, cadmium stabilizers have been completely replaced with barium-zinc, calcium-zinc and organo-tin stabilizers. Cadmium is used in many kinds of solder and bearing alloys, because it has a low coefficient of friction and fatigue resistance.[39] It is also found in some of the lowest-melting alloys, such as Wood’s metal.[49]
Semiconductors[edit]
Cadmium is an element in some semiconductor materials. Cadmium sulfide, cadmium selenide, and cadmium telluride are used in some photodetectors and solar cells. HgCdTe detectors are sensitive to mid-infrared light [39] and used in some motion detectors.
Laboratory uses[edit]

Helium–cadmium lasers are a common source of blue or ultraviolet laser light. Lasers at wavelengths of 325, 354 and 442 nm are made using this gain medium; some models can switch between these wavelengths. They are notably used in fluorescence microscopy as well as various laboratory uses requiring laser light at these wavelengths.[50][51]
Cadmium selenide quantum dots emit bright luminescence under UV excitation (He-Cd laser, for example). The color of this luminescence can be green, yellow or red depending on the particle size. Colloidal solutions of those particles are used for imaging of biological tissues and solutions with a fluorescence microscope.[52]
In molecular biology, cadmium is used to block voltage-dependent calcium channels from fluxing calcium ions, as well as in hypoxia research to stimulate proteasome-dependent degradation of Hif-1α.[53]
Cadmium-selective sensors based on the fluorophore BODIPY have been developed for imaging and sensing of cadmium in cells.[54] One powerful method for monitoring cadmium in aqueous environments involves electrochemistry. By employing a self-assembled monolayer one can obtain a cadmium selective electrode with a ppt-level sensitivity.[55]
Biological role and research[edit]
Cadmium has no known function in higher organisms and is considered toxic.[56] Cadmium is considered an environmental pollutant that causes health hazard to living organisms.[57] Administration of cadmium to cells causes oxidative stress and increases the levels of antioxidants produced by cells to protect against macro molecular damage.[58]
However a cadmium-dependent carbonic anhydrase has been found in some marine diatoms.[59] The diatoms live in environments with very low zinc concentrations and cadmium performs the function normally carried out by zinc in other anhydrases. This was discovered with X-ray absorption near edge structure (XANES) spectroscopy.[59][60]
Cadmium is preferentially absorbed in the kidneys of humans. Up to about 30 mg of cadmium is commonly inhaled throughout human childhood and adolescence.[61] Cadmium is under research regarding its toxicity in humans, potentially elevating risks of cancer, cardiovascular disease, and osteoporosis.[62][63][64][65]
Environment[edit]
The biogeochemistry of cadmium and its release to the environment has been the subject of review, as has the speciation of cadmium in the environment.[66][67]
Safety[edit]
| Hazards | |
|---|---|
| GHS labelling:[68] | |
| Pictograms |    |
| Signal word | Danger |
| Hazard statements | H301, H330, H341, H350, H361fd, H372, H410 |
| Precautionary statements | P201, P202, P260, P264, P273, P304+P340+P310 |
| NFPA 704 (fire diamond) |
4 0 0 |
Individuals and organizations have been reviewing cadmium’s bioinorganic aspects for its toxicity.[69] The most dangerous form of occupational exposure to cadmium is inhalation of fine dust and fumes, or ingestion of highly soluble cadmium compounds.[4] Inhalation of cadmium fumes can result initially in metal fume fever, but may progress to chemical pneumonitis, pulmonary edema, and death.[70]
Cadmium is also an environmental hazard. Human exposure is primarily from fossil fuel combustion, phosphate fertilizers, natural sources, iron and steel production, cement production and related activities, nonferrous metals production, and municipal solid waste incineration.[4] Other sources of cadmium include bread, root crops, and vegetables.[71]

There have been a few instances of general population poisoning as the result of long-term exposure to cadmium in contaminated food and water. Research into an estrogen mimicry that may induce breast cancer is ongoing.[71] In the decades leading up to World War II, mining operations contaminated the Jinzū River in Japan with cadmium and traces of other toxic metals. As a consequence, cadmium accumulated in the rice crops along the riverbanks downstream of the mines. Some members of the local agricultural communities consumed the contaminated rice and developed itai-itai disease and renal abnormalities, including proteinuria and glucosuria.[72] The victims of this poisoning were almost exclusively post-menopausal women with low iron and low body stores of other minerals. Similar general population cadmium exposures in other parts of the world have not resulted in the same health problems because the populations maintained sufficient iron and other mineral levels. Thus, although cadmium is a major factor in the itai-itai disease in Japan, most researchers have concluded that it was one of several factors.[4]
Cadmium is one of six substances banned by the European Union’s Restriction of Hazardous Substances (RoHS) directive, which regulates hazardous substances in electrical and electronic equipment, but allows for certain exemptions and exclusions from the scope of the law.[73]
The International Agency for Research on Cancer has classified cadmium and cadmium compounds as carcinogenic to humans.[74] Although occupational exposure to cadmium is linked to lung and prostate cancer, there is still uncertainty about the carcinogenicity of cadmium in low environmental exposure. Recent data from epidemiological studies suggest that intake of cadmium through diet is associated with a higher risk of endometrial, breast, and prostate cancer as well as with osteoporosis in humans.[75][76][77][78] A recent study has demonstrated that endometrial tissue is characterized by higher levels of cadmium in current and former smoking females.[79]
Cadmium exposure is associated with a large number of illnesses including kidney disease,[80] early atherosclerosis, hypertension, and cardiovascular diseases.[81] Although studies show a significant correlation between cadmium exposure and occurrence of disease in human populations, a molecular mechanism has not yet been identified. One hypothesis holds that cadmium is an endocrine disruptor and some experimental studies have shown that it can interact with different hormonal signaling pathways. For example, cadmium can bind to the estrogen receptor alpha,[82][83] and affect signal transduction along the estrogen and MAPK signaling pathways at low doses.[84][85][86]
The tobacco plant absorbs and accumulates heavy metals such as cadmium from the surrounding soil into its leaves. Following tobacco smoke inhalation, these are readily absorbed into the body of users.[87] Tobacco smoking is the most important single source of cadmium exposure in the general population. An estimated 10% of the cadmium content of a cigarette is inhaled through smoking. Absorption of cadmium through the lungs is more effective than through the gut. As much as 50% of the cadmium inhaled in cigarette smoke may be absorbed.[88]
On average, cadmium concentrations in the blood of smokers is 4 to 5 times greater than non-smokers and in the kidney, 2–3 times greater than in non-smokers. Despite the high cadmium content in cigarette smoke, there seems to be little exposure to cadmium from passive smoking.[89]
In a non-smoking population, food is the greatest source of exposure. High quantities of cadmium can be found in crustaceans, mollusks, offal, frog legs, cocoa solids, bitter and semi-bitter chocolate, seaweed, fungi and algae products. However, grains, vegetables, and starchy roots and tubers are consumed in much greater quantity in the U.S., and are the source of the greatest dietary exposure there.[90] Most plants bio-accumulate metal toxins such as cadmium and when composted to form organic fertilizers, yield a product that often can contain high amounts (e.g., over 0.5 mg) of metal toxins for every kilogram of fertilizer. Fertilizers made from animal dung (e.g., cow dung) or urban waste can contain similar amounts of cadmium. The cadmium added to the soil from fertilizers (rock phosphates or organic fertilizers) become bio-available and toxic only if the soil pH is low (i.e., acidic soils).
Zinc, copper, calcium, and iron ions, and selenium with vitamin C are used to treat cadmium intoxication, though it is not easily reversed.[80]
Regulations[edit]
Because of the adverse effects of cadmium on the environment and human health, the supply and use of cadmium is restricted in Europe under the REACH Regulation.[91]
The EFSA Panel on Contaminants in the Food Chain specifies that 2.5 μg/kg body weight is a tolerable weekly intake for humans.[90] The Joint FAO/WHO Expert Committee on Food Additives has declared 7 μg/kg body weight to be the provisional tolerable weekly intake level.[92] The state of California requires a food label to carry a warning about potential exposure to cadmium on products such as cocoa powder.[93]
The U.S. Occupational Safety and Health Administration (OSHA) has set the permissible exposure limit (PEL) for cadmium at a time-weighted average (TWA) of 0.005 ppm. The National Institute for Occupational Safety and Health (NIOSH) has not set a recommended exposure limit (REL) and has designated cadmium as a known human carcinogen. The IDLH (immediately dangerous to life and health) level for cadmium is 9 mg/m3.[94]
| Lethal dose[95] | Organism | Route | Time |
|---|---|---|---|
| LD50: 225 mg/kg | rat | oral | n/a |
| LD50: 890 mg/kg | mouse | oral | n/a |
| LC50: 25 mg/m3 | rat | n/a | 30 min |
In addition to mercury, the presence of cadmium in some batteries has led to the requirement of proper disposal (or recycling) of batteries.
Product recalls[edit]
In May 2006, a sale of the seats from Arsenal F.C.’s old stadium, Highbury in London, England was cancelled when the seats were discovered to contain trace amounts of cadmium.[96] Reports of high levels of cadmium use in children’s jewelry in 2010 led to a US Consumer Product Safety Commission investigation.[97] The U.S. CPSC issued specific recall notices for cadmium content in jewelry sold by Claire’s[98] and Wal-Mart[99] stores.
In June 2010, McDonald’s voluntarily recalled more than 12 million promotional Shrek Forever After 3D Collectible Drinking Glasses because of the cadmium levels in paint pigments on the glassware.[100] The glasses were manufactured by Arc International, of Millville, NJ, USA.[101]
See also[edit]
- Red List building materials
- Toxic heavy metal
References[edit]
- ^ «Standard Atomic Weights: Cadmium». CIAAW. 2013.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g Morrow, H. (2010). «Cadmium and Cadmium Alloys». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. pp. 1–36. doi:10.1002/0471238961.0301041303011818.a01.pub3. ISBN 978-0-471-23896-6.
- ^ a b
Holleman, A. F.; Wiberg, E.; Wiberg, Nils (1985). «Cadmium». Lehrbuch der Anorganischen Chemie, 91–100 (in German). Walter de Gruyter. pp. 1056–1057. ISBN 978-3-11-007511-3. - ^ «Cadmium 3.2.6 Solubility». PubChem. Retrieved 25 November 2021.
- ^ a b
«Case Studies in Environmental Medicine (CSEM) Cadmium». Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011. Retrieved 30 May 2011. - ^
Cotton, F. A. (1999). «Survey of Transition-Metal Chemistry». Advanced Inorganic Chemistry (6th ed.). John Wiley and Sons. p. 633. ISBN 978-0-471-19957-1. - ^ Carballo, Rosa; Castiñeras, Alfonso; Domínguez-Martin, Alicia; García-Santos, Isabel; Niclós-Guttiérrez, Juan (2013). «Chapter 7. Solid state structures of cadmium complexes with relevance to biological systems». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 145–189. doi:10.1007/978-94-007-5179-8_7. hdl:11093/232. ISBN 978-94-007-5178-1. PMID 23430774.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^
Knoll, G. F. (2000). Radiation Detection and Measurement. Wiley. p. 505. ISBN 978-0-471-07338-3. - ^
Padmanabhan, T. (2001). «Stellar Nucleosynthesis». Theoretical Astrophysics, Volume II: Stars and Stellar Systems. Cambridge University Press. pp. 230–236. ISBN 978-0-521-56631-5. - ^ Rolof (1795). «Wichtige Nachricht für Aerzte und Apoteker – Entdeckung eines Arsenikgehalts in der Zinkblume und des Zinkvitriols in Tartarus vitriolis». Journal des practischen Arzneykunde und Wundarzneykunst (Hufelands Journal) (2 Februar Stück): 110.
- ^
Hermann, C. S. (1818). «Noch ein schreiben über das neue Metall». Annalen der Physik. 59 (5): 113–116. Bibcode:1818AnP….59..113H. doi:10.1002/andp.18180590511.
- ^
Waterston, W.; Burton, J. H. (1844). Cyclopædia of commerce, mercantile law, finance, commercial geography and navigation. H. G. Bohn. p. 122. - ^
Rowbotham, T.; Rowbotham, T. L. (1850). The Art of Landscape Painting in Water Colours. Windsor and Newton. p. 10. - ^ a b
Ayres, R. U.; Ayres, L.; Råde, I. (2003). The Life Cycle of Copper, Its Co-Products and Byproducts. Springer. pp. 135–141. ISBN 978-1-4020-1552-6. - ^
Dunglison, R. (1866). Medical Lexicon: A Dictionary of Medical Science. Henry C. Lea. pp. 159. - ^ «International Angstrom». Science Dictionary. 14 September 2013. Archived from the original on 18 November 2018. Retrieved 24 September 2014.
- ^ «angstrom or ångström». Sizes.com. 28 October 2010. Retrieved 24 September 2014.
- ^
Burdun, G. D. (1958). «On the new determination of the meter». Measurement Techniques. 1 (3): 259–264. doi:10.1007/BF00974680. S2CID 121450003. - ^ a b
Lansche, A. M. (1956). «Cadmium». Minerals Yearbook, Volume I: Metals and Minerals (Except Fuels). United States Geological Survey. Retrieved 21 April 2008. - ^ «USGS Mineral Information: Cadmium». United States Geological Survey. Retrieved 8 August 2009.
- ^
Wedepohl, K. H. (1995). «The composition of the continental crust». Geochimica et Cosmochimica Acta. 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2. - ^
Plachy, J. (1998). «Annual Average Cadmium Price» (PDF). U.S. Geological Survey. pp. 17–19. Archived (PDF) from the original on 16 August 2000. Retrieved 16 June 2010. - ^ a b
Fthenakis, V. M. (2004). «Life cycle impact analysis of cadmium in CdTe PV production». Renewable and Sustainable Energy Reviews. 8 (4): 303–334. doi:10.1016/j.rser.2003.12.001. - ^ Fleischer, M.; Cabri, L. J.; Chao, G. Y.; Pabst, A. (1980). «New Mineral Names» (PDF). American Mineralogist. 65: 1065–1070. Archived (PDF) from the original on 10 October 2022.
- ^ Grant, C. A.; Sheppard, S. C. (2008). «Fertilizer impacts on cadmium availability in agricultural soils and crops». Human and Ecological Risk Assessment. 14 (2): 210–228. doi:10.1080/10807030801934895. S2CID 84548398.
- ^ Jiao, Y.; Grant, C. A.; Bailey, L. D. (2004). «Effects of phosphorus and zinc fertilizer on cadmium uptake and distribution in flax and durum wheat». Journal of the Science of Food and Agriculture. 84 (8): 777–785. doi:10.1002/jsfa.1648.
- ^ Bettinelli, M.; Baroni, U.; Pastorelli, N. (1988). «Determination of arsenic, cadmium, lead, antimony, selenium and thallium in coal fly ash using the stabilised temperature platform furnace and Zeeman-effect background correction». Journal of Analytical Atomic Spectrometry. 3 (7): 1005–1011. doi:10.1039/JA9880301005.
- ^ «The most neglected threat to public health in China is toxic soil». The Economist. 8 June 2017. Retrieved 13 June 2017.
- ^
Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. p. 166. ISBN 978-0-415-85920-2. - ^ Hem, John D. (1972). «Chemistry and occurrence of cadmium and zinc in surface water and groundwater». Water Resources Research. 8 (3): 661–679. Bibcode:1972WRR…..8..661H. doi:10.1029/WR008i003p00661. ISSN 1944-7973.
- ^ a b
Golberg, D. C.; et al. (1969). Trends in Usage of Cadmium: Report. US NRC/NAS/NAE. pp. 1–3. - ^
Scoullos, M. J. (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. pp. 104–116. ISBN 978-1-4020-0224-3. - ^ Hetherington, L. E.; et al. (2008). «Production of Cadmium» (PDF). World Mineral Production 2002–06. British Geological Survey. p. 15. Archived from the original (PDF) on 8 November 2012. Retrieved 15 April 2012.
- ^ a b Buxbaum, Gunter; Pfaff, Gerhard (2005). «Cadmium Pigments». Industrial inorganic pigments. Wiley-VCH. pp. 121–123. ISBN 978-3-527-30363-2.
- ^ a b Smith, C.J.E.; Higgs, M.S.; Baldwin, K.R. (20 April 1999). «Advances to Protective Coatings and their Application to Ageing Aircraft». RTO MP-25. Archived from the original (PDF) on 17 May 2011. Retrieved 29 May 2011.
- ^ a b c d e f g Scoullos, Michael J.; Vonkeman, Gerrit H.; Thornton, Iain; Makuch, Zen (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. ISBN 978-1-4020-0224-3.
- ^ Krishnamurthy, N. (2 July 2013). Engg. Chemistry, 2/e. New York: PHI Learning Private Limited. pp. 82–83. ISBN 978-81-203-3666-7.
- ^ «EUR-Lex — 32011L0065 — EN — EUR-Lex». eur-lex.europa.eu. Archived from the original on 5 March 2016.
- ^ «DIRECTIVE 2006/66/EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL». EUR-lex.europa.eu. 26 September 2006. Retrieved 25 October 2022.
- ^ «CIA – Breaking Through Technological Barriers – Finding The Right Metal (A-12 program)». 1 October 2007. Archived from the original on 9 October 2007.
- ^ Maynard, Andrew. «Are quantum dot TVs – and their toxic ingredients – actually better for the environment?». The Conversation. Retrieved 23 July 2017.
- ^ Abyar, Selda; Khandar, Ali Akbar; Salehi, Roya; Abolfazl Hosseini-Yazdi, Seyed; Alizadeh, Effat; Mahkam, Mehrdad; Jamalpoor, Amer; White, Jonathan M.; Shojaei, Motahhareh; Aizpurua-Olaizola, O.; Masereeuw, Rosalinde (December 2019). «In vitro nephrotoxicity and anticancer potency of newly synthesized cadmium complexes». Scientific Reports. 9 (1): 14686. Bibcode:2019NatSR…914686A. doi:10.1038/s41598-019-51109-9. ISSN 2045-2322. PMC 6789105. PMID 31604983.
- ^ Lee, Ching-Hwa; Hsi, C. S. (2002). «Recycling of Scrap Cathode Ray Tubes». Environmental Science & Technology. 36 (1): 69–75. Bibcode:2002EnST…36…69L. doi:10.1021/es010517q. PMID 11811492.
- ^ Miller, L. S.; Mullin, J. B. (1991). «Crystalline Cadmium Sulfide». Electronic materials: from silicon to organics. Springer. p. 273. ISBN 978-0-306-43655-0.
- ^ Jennings, Thomas C. (2005). «Cadmium Environmental Concerns». PVC handbook. Hanser Verlag. p. 149. ISBN 978-1-56990-379-7.
- ^ Brady, George Stuart; Brady, George S.; Clauser, Henry R.; Vaccari, John A. (2002). Materials handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. McGraw-Hill Professional. p. 425. ISBN 978-0-07-136076-0.
- ^ «Helium-Cadmium Lasers». Olympus. Archived from the original on 15 July 2011. Retrieved 14 May 2011.
- ^ Nambiar, K.R (2006). «Helium-cadmium Laser». Lasers: Principles, Types and Applications. ISBN 978-81-224-1492-9.
- ^ «Cadmium Selenium Testing for Microbial Contaminants». NASA. 10 June 2003. Archived from the original on 25 July 2011. Retrieved 20 November 2009.
- ^ Park J. W., Chun Y. S.; Choi, E.; Kim, G. T.; Choi, H.; Kim, C. H.; Lee, M. J.; Kim, M. S.; Park, J. W. (2000). «Cadmium blocks hypoxia-inducible factor (HIF)-1-mediated response to hypoxia by stimulating the proteasome-dependent degradation of HIF-1alpha». European Journal of Biochemistry. 267 (13): 4198–4204. doi:10.1046/j.1432-1327.2000.01453.x. PMID 10866824.
- ^ Taki, Masayasu (2013). «Chapter 5. Imaging and sensing of cadmium in cells». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 99–115. doi:10.1007/978-94-007-5179-8_5. ISBN 978-94-007-5178-1. PMID 23430772.
- ^ Noyhouzer, Tomer; Mandler, Daniel (17 January 2011). «Determination of low levels of cadmium ions by the under potential deposition on a self-assembled monolayer on gold electrode». Analytica Chimica Acta. 684 (1–2): 1–7. doi:10.1016/j.aca.2010.10.021. PMID 21167979.
- ^ Hogan, C. Michael (2010). Heavy metal. Encyclopedia of Earth. National Council for Science and the Environment. E. Monosson and C. Cleveland (eds.). Washington DC.
- ^ Xu, Liang, Zhang, Fei, Tang, Mingjia, et al. Melatonin confers cadmium tolerance by modulating critical heavy metal chelators and transporters in radish plants. Journal of Pineal Research: Molecular, Biological, Physiological and Clinical Aspects of Melatonin. 2020;69(1):doi:10.1111/jpi.12659.
- ^ Kannan, Muthukumar (2010). «Cadmium-induced oxidative stress in Saccharomyces cerevisiae». Indian J Biochem Biophys. 47 (6): 383–7. PMID 21355423.
- ^ a b Lane, Todd W.; Saito, Mak A.; George, Graham N.; Pickering, Ingrid J.; Prince, Roger C.; Morel, François M. M. (2005). «A cadmium enzyme from a marine diatom» (PDF). Nature. 435 (42): 42. Bibcode:2005Natur.435…42L. doi:10.1038/435042a. PMID 15875011. S2CID 52819760.
- ^ Lane, Todd W.; Morel, F. M. (2000). «A biological function for cadmium in marine diatoms». Proc. Natl. Acad. Sci. 97 (9): 4627–4631. Bibcode:2000PNAS…97.4627L. doi:10.1073/pnas.090091397. PMC 18283. PMID 10781068.
- ^ Perry, HM Jr.; Thind, G. S.; Perry, E. F. (1976). «The biology of cadmium». The Medical Clinics of North America. 60 (4): 759–69. doi:10.1016/S0025-7125(16)31859-4. PMID 775217.
- ^ Luevano, J; Damodaran, C (2014). «A Review of Molecular Events of Cadmium-Induced Carcinogenesis». Journal of Environmental Pathology, Toxicology and Oncology. 33 (3): 183–194. doi:10.1615/jenvironpatholtoxicoloncol.2014011075. PMC 4183964. PMID 25272057.
- ^ Rahim, F; Jalali, A; Tangestani, R (2013). «Breast cancer frequency and exposure to cadmium: A meta-analysis and systematic review» (PDF). Asian Pacific Journal of Cancer Prevention. 14 (7): 4283–7. doi:10.7314/apjcp.2013.14.7.4283. PMID 23991990. Archived (PDF) from the original on 10 October 2022.
- ^ Tellez-Plaza, M; Jones, M. R.; Dominguez-Lucas, A; Guallar, E; Navas-Acien, A (2013). «Cadmium Exposure and Clinical Cardiovascular Disease: A Systematic Review». Current Atherosclerosis Reports. 15 (10): 10.1007/s11883–013–0356–2. doi:10.1007/s11883-013-0356-2. PMC 3858820. PMID 23955722.
- ^ James, K. A.; Meliker, J. R. (2013). «Environmental cadmium exposure and osteoporosis: A review». International Journal of Public Health. 58 (5): 737–45. doi:10.1007/s00038-013-0488-8. PMID 23877535. S2CID 11265947.
- ^
Cullen, Jay T.; Maldonado, Maria T. (2013). «Chapter 2. Biogeochemistry of Cadmium and its Release to the Environment». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 31–62. doi:10.1007/978-94-007-5179-8_2. ISBN 978-94-007-5178-1. PMID 23430769. - ^ Crea, Francesco; Foti, Claudia; Milea, Demetrio; Sammartano, Silvio (2013). «Chapter 3. Speciation of Cadmium in the Environment». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 63–83. doi:10.1007/978-94-007-5179-8_3. ISBN 978-94-007-5178-1. PMID 23430770.
- ^ GHS: «Safety Data Sheet». Sigma-Aldrich. 12 September 2021. Retrieved 22 December 2021.
- ^ Maret, Wolfgang; Moulis, Jean-Marc (2013). «Chapter 1. The Bioinorganic Chemistry of Cadmium in the Context of its Toxicity». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 1–30. doi:10.1007/978-94-007-5179-8_1. ISBN 978-94-007-5178-1. PMID 23430768.
- ^ Hayes, Andrew Wallace (2007). Principles and Methods of Toxicology. Philadelphia: CRC Press. pp. 858–861. ISBN 978-0-8493-3778-9.
- ^ a b Mann, Denise (23 April 2012) Can Heavy Metal in Foods, Cosmetics Spur Breast Cancer Spread? HealthDayBy via Yahoo
- ^ Nogawa, Koji; Kobayashi, E.; Okubo, Y.; Suwazono, Y. (2004). «Environmental cadmium exposure, adverse effects, and preventative measures in Japan». Biometals. 17 (5): 581–587. doi:10.1023/B:BIOM.0000045742.81440.9c. PMID 15688869. S2CID 8053594.
- ^ «European Commission Decision of 12 October 2006 amending, for the purposes of adapting to technical progress, the Annex to Directive 2002/95/EC of the European Parliament and of the Council as regards exemptions for applications of lead and cadmium (notified under document number C(2006) 4790)». Journal of the European Union. 14 October 2006.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (1993) (1993). Beryllium, cadmium, mercury, and exposures in the glass manufacturing industry. Lyon. ISBN 92-832-1258-4. OCLC 29943893.
- ^ Julin, B.; Wolk, A.; Johansson, J. E.; Andersson, S. O.; Andrén, O.; Akesson, A. (2012). «Dietary cadmium exposure and prostate cancer incidence: A population-based prospective cohort study». British Journal of Cancer. 107 (5): 895–900. doi:10.1038/bjc.2012.311. PMC 3425979. PMID 22850555.
- ^ Engström, A.; Michaëlsson, K.; Vahter, M.; Julin, B.; Wolk, A.; Åkesson, A. (2012). «Associations between dietary cadmium exposure and bone mineral density and risk of osteoporosis and fractures among women». Bone. 50 (6): 1372–8. doi:10.1016/j.bone.2012.03.018. PMID 22465267.
- ^ Julin, B.; Wolk, A.; Bergkvist, L.; Bottai, M.; Akesson, A. (2012). «Dietary cadmium exposure and risk of postmenopausal breast cancer: A population-based prospective cohort study». Cancer Research. 72 (6): 1459–66. doi:10.1158/0008-5472.CAN-11-0735. PMID 22422990.
- ^ Akesson, A.; Julin, B.; Wolk, A. (2008). «Long-term dietary cadmium intake and postmenopausal endometrial cancer incidence: A population-based prospective cohort study». Cancer Research. 68 (15): 6435–41. doi:10.1158/0008-5472.CAN-08-0329. PMID 18676869.
- ^ Rzymski, P.; Rzymski, P.; Tomczyk, K.; Niedzielski, P.; Jakubowski, K.; Poniedziałek, B.; Opala, T. (2014). «Metal status in human endometrium: Relation to cigarette smoking and histological lesions». Environmental Research. 132: 328–33. Bibcode:2014ER….132..328R. doi:10.1016/j.envres.2014.04.025. PMID 24834829.
- ^ a b «ARL : Cadmium Toxicity». www.arltma.com. Archived from the original on 9 September 2019. Retrieved 7 July 2016.
- ^ Cadmium Exposure can Induce Early Atherosclerotic Changes Archived 15 March 2012 at the Wayback Machine, Medinews Direct, 7 September 2009
- ^ Fechner, P.; Damdimopoulou, P.; Gauglitz, G. (2011). «Biosensors paving the way to understanding the interaction between cadmium and the estrogen receptor alpha». PLOS ONE. 6 (8): e23048. Bibcode:2011PLoSO…623048F. doi:10.1371/journal.pone.0023048. PMC 3149063. PMID 21829690.
- ^ Stoica, A.; Katzenellenbogen, B. S.; Martin, M. B. (2000). «Activation of estrogen receptor-alpha by the heavy metal cadmium». Molecular Endocrinology. 14 (4): 545–53. doi:10.1210/mend.14.4.0441. PMID 10770491.
- ^ Ali, I.; Penttinen-Damdimopoulou, P. E.; Mäkelä, S. I.; Berglund, M.; Stenius, U.; Akesson, A.; Håkansson, H.; Halldin, K. (2010). «Estrogen-like effects of cadmium in vivo do not appear to be mediated via the classical estrogen receptor transcriptional pathway». Environmental Health Perspectives. 118 (10): 1389–94. doi:10.1289/ehp.1001967. PMC 2957917. PMID 20525538.
- ^ Ali, I.; Damdimopoulou, P.; Stenius, U.; Adamsson, A.; Mäkelä, S. I.; Åkesson, A.; Berglund, M.; Håkansson, H.; Halldin, K. (2012). «Cadmium-induced effects on cellular signaling pathways in the liver of transgenic estrogen reporter mice». Toxicological Sciences. 127 (1): 66–75. doi:10.1093/toxsci/kfs077. PMID 22314386.
- ^ Johnson, M. D.; Kenney, N.; Stoica, A.; Hilakivi-Clarke, L.; Singh, B.; Chepko, G.; Clarke, R.; Sholler, P. F.; Lirio, A. A.; Foss, C.; Reiter, R.; Trock, B.; Paik, S.; Martin, M. B. (2003). «Cadmium mimics the in vivo effects of estrogen in the uterus and mammary gland». Nature Medicine. 9 (8): 1081–4. doi:10.1038/nm902. PMID 12858169. S2CID 39484160.
- ^ Dias, Fábio de S.; Bonsucesso, Josemário S.; Oliveira, Lucas C.; Dos Santos, Walter N.L. (2012). «Preconcentration and determination of copper in tobacco leaves samples by using a minicolumn of sisal fiber (Agave sisalana) loaded with Alizarin fluorine blue by FAAS». Talanta. 89 (1): 276–279. doi:10.1016/j.talanta.2011.12.027. PMID 22284492.
- ^ Friberg, L. (1983). «Cadmium». Annual Review of Public Health. 4: 367–73. doi:10.1146/annurev.pu.04.050183.002055. PMID 6860444.
- ^ Jarup, L. (1998). «Health effects of cadmium exposure – a review of the literature and a risk estimate». Scandinavian Journal of Work, Environment & Health. 24: 11–51. PMID 9569444.
- ^ a b «Cadmium dietary exposure in the European population – European Food Safety Authority». www.efsa.europa.eu. 18 January 2012.
- ^ EUR-Lex. Eur-lex.europa.eu (18 April 2011). Retrieved on 5 June 2011.
- ^ «JECFA Evaluations-CADMIUM-«. www.inchem.org.
- ^ such as seen on the organic cocoa powder marketed by Better Body Foods, for example
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0087». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Cadmium compounds (as Cd)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Toxic fears hit Highbury auction». BBC Sport. 10 May 2006. Retrieved 29 November 2010.
- ^ «U.S. to Develop Safety Standards for Toxic Metals». Business Week. 12 January 2010. Retrieved 12 January 2010.
- ^ «Claire’s Recalls Children’s Metal Charm Bracelets Due to High Levels of Cadmium». U.S. Consumer Product Safety Commission. 10 May 2010. Archived from the original on 31 May 2010. Retrieved 5 June 2010.
- ^ «FAF Inc. Recalls Children’s Necklaces Sold Exclusively at Walmart Stores Due to High Levels of Cadmium». U.S. Consumer Product Safety Commission. 29 January 2010. Archived from the original on 27 May 2010. Retrieved 5 June 2010.
- ^ Neuman, William (4 June 2010). «McDonald’s Recalls 12 Million ‘Shrek’ Glasses». The New York Times. Retrieved 5 June 2010.
- ^ «McDonald’s Recalls Movie Themed Drinking Glasses Due to Potential Cadmium Risk». U.S. Consumer Product Safety Commission. 4 June 2010. Archived from the original on 7 June 2010. Retrieved 5 June 2010.
Further reading[edit]
- Hartwig, Andrea (2013). «Chapter 15. Cadmium and cancer». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 491–507. doi:10.1007/978-94-007-5179-8_15. ISBN 978-94-007-5178-1. PMID 23430782.
External links[edit]
![]()
Look up cadmium in Wiktionary, the free dictionary.
![]()
Wikimedia Commons has media related to Cadmium.
![]()
- Cadmium at The Periodic Table of Videos (University of Nottingham)
- ATSDR Case Studies in Environmental Medicine: Cadmium Toxicity U.S. Department of Health and Human Services
- National Institute for Occupational Safety and Health – Cadmium Page
- NLM Hazardous Substances Databank – Cadmium, Elemental
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cadmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (KAD-mee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery bluish-gray metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Cd) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cadmium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Kr] 4d10 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 594.22 K (321.07 °C, 609.93 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1040 K (767 °C, 1413 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 8.65 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 7.996 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 6.21 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 99.87 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.020 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −2, +1, +2 (a mildly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 151 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 144±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 158 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of cadmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2310 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 30.8 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 96.6 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 72.7 nΩ⋅m (at 22 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −19.8×10−6 cm3/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 19 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 42 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 203–220 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-43-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Karl Samuel Leberecht Hermann and Friedrich Stromeyer (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Named by | Friedrich Stromeyer (1817) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of cadmium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Cadmium is a chemical element with the symbol Cd and atomic number 48. This soft, silvery-white metal is chemically similar to the two other stable metals in group 12, zinc and mercury. Like zinc, it demonstrates oxidation state +2 in most of its compounds, and like mercury, it has a lower melting point than the transition metals in groups 3 through 11. Cadmium and its congeners in group 12 are often not considered transition metals, in that they do not have partly filled d or f electron shells in the elemental or common oxidation states. The average concentration of cadmium in Earth’s crust is between 0.1 and 0.5 parts per million (ppm). It was discovered in 1817 simultaneously by Stromeyer and Hermann, both in Germany, as an impurity in zinc carbonate.
Cadmium occurs as a minor component in most zinc ores and is a byproduct of zinc production. Cadmium was used for a long time as a corrosion-resistant plating on steel, and cadmium compounds are used as red, orange and yellow pigments, to color glass, and to stabilize plastic. Cadmium use is generally decreasing because it is toxic (it is specifically listed in the European Restriction of Hazardous Substances Directive[4]) and nickel-cadmium batteries have been replaced with nickel-metal hydride and lithium-ion batteries. One of its few new uses is in cadmium telluride solar panels.
Although cadmium has no known biological function in higher organisms, a cadmium-dependent carbonic anhydrase has been found in marine diatoms.
Characteristics[edit]
Physical properties[edit]
Cadmium is a soft, malleable, ductile, silvery-white divalent metal. It is similar in many respects to zinc but forms complex compounds.[5] Unlike most other metals, cadmium is resistant to corrosion and is used as a protective plate on other metals. As a bulk metal, cadmium is insoluble in water[6] and is not flammable; however, in its powdered form it may burn and release toxic fumes.[7]
Chemical properties[edit]
Although cadmium usually has an oxidation state of +2, it also exists in the +1 state. Cadmium and its congeners are not always considered transition metals, in that they do not have partly filled d or f electron shells in the elemental or common oxidation states.[8] Cadmium burns in air to form brown amorphous cadmium oxide (CdO); the crystalline form of this compound is a dark red which changes color when heated, similar to zinc oxide. Hydrochloric acid, sulfuric acid, and nitric acid dissolve cadmium by forming cadmium chloride (CdCl2), cadmium sulfate (CdSO4), or cadmium nitrate (Cd(NO3)2). The oxidation state +1 can be produced by dissolving cadmium in a mixture of cadmium chloride and aluminium chloride, forming the Cd22+ cation, which is similar to the Hg22+ cation in mercury(I) chloride.[5]
- Cd + CdCl2 + 2 AlCl3 → Cd2(AlCl4)2
The structures of many cadmium complexes with nucleobases, amino acids, and vitamins have been determined.[9]
Isotopes[edit]

The cadmium-113 total cross section clearly showing the cadmium cut-off
Naturally occurring cadmium is composed of eight isotopes. Two of them are radioactive, and three are expected to decay but have not done so under laboratory conditions. The two natural radioactive isotopes are 113Cd (beta decay, half-life is 7.7×1015 y) and 116Cd (two-neutrino double beta decay, half-life is 2.9×1019 y). The other three are 106Cd, 108Cd (both double electron capture), and 114Cd (double beta decay); only lower limits on these half-lives have been determined. At least three isotopes – 110Cd, 111Cd, and 112Cd – are stable. Among the isotopes that do not occur naturally, the most long-lived are 109Cd with a half-life of 462.6 days, and 115Cd with a half-life of 53.46 hours. All of the remaining radioactive isotopes have half-lives of less than 2.5 hours, and the majority have half-lives of less than 5 minutes. Cadmium has 8 known meta states, with the most stable being 113mCd (t1⁄2 = 14.1 years), 115mCd (t1⁄2 = 44.6 days), and 117mCd (t1⁄2 = 3.36 hours).[10]
The known isotopes of cadmium range in atomic mass from 94.950 u (95Cd) to 131.946 u (132Cd). For isotopes lighter than 112 u, the primary decay mode is electron capture and the dominant decay product is element 47 (silver). Heavier isotopes decay mostly through beta emission producing element 49 (indium).[10]
One isotope of cadmium, 113Cd, absorbs neutrons with high selectivity: With very high probability, neutrons with energy below the cadmium cut-off will be absorbed; those higher than the cut-off will be transmitted. The cadmium cut-off is about 0.5 eV, and neutrons below that level are deemed slow neutrons, distinct from intermediate and fast neutrons.[11]
Cadmium is created via the s-process in low- to medium-mass stars with masses of 0.6 to 10 solar masses, over thousands of years. In that process, a silver atom captures a neutron and then undergoes beta decay.[12]
History[edit]

Cadmium (Latin cadmia, Greek καδμεία meaning «calamine», a cadmium-bearing mixture of minerals that was named after the Greek mythological character Κάδμος, Cadmus, the founder of Thebes) was discovered in contaminated zinc compounds sold in pharmacies in Germany[13] in 1817 by Friedrich Stromeyer.[14] Karl Samuel Leberecht Hermann simultaneously investigated the discoloration in zinc oxide and found an impurity, first suspected to be arsenic, because of the yellow precipitate with hydrogen sulfide. Additionally Stromeyer discovered that one supplier sold zinc carbonate instead of zinc oxide.[4] Stromeyer found the new element as an impurity in zinc carbonate (calamine), and, for 100 years, Germany remained the only important producer of the metal. The metal was named after the Latin word for calamine, because it was found in this zinc ore. Stromeyer noted that some impure samples of calamine changed color when heated but pure calamine did not. He was persistent in studying these results and eventually isolated cadmium metal by roasting and reducing the sulfide. The potential for cadmium yellow as pigment was recognized in the 1840s, but the lack of cadmium limited this application.[15][16][17]
Even though cadmium and its compounds are toxic in certain forms and concentrations, the British Pharmaceutical Codex from 1907 states that cadmium iodide was used as a medication to treat «enlarged joints, scrofulous glands, and chilblains».[18]
In 1907, the International Astronomical Union defined the international ångström in terms of a red cadmium spectral line (1 wavelength = 6438.46963 Å).[19][20] This was adopted by the 7th General Conference on Weights and Measures in 1927. In 1960, the definitions of both the metre and ångström were changed to use krypton.[21]
After the industrial scale production of cadmium started in the 1930s and 1940s, the major application of cadmium was the coating of iron and steel to prevent corrosion; in 1944, 62% and in 1956, 59% of the cadmium in the United States was used for plating.[4][22] In 1956, 24% of the cadmium in the United States was used for a second application in red, orange and yellow pigments from sulfides and selenides of cadmium.[22]
The stabilizing effect of cadmium chemicals like the carboxylates cadmium laurate and cadmium stearate on PVC led to an increased use of those compounds in the 1970s and 1980s. The demand for cadmium in pigments, coatings, stabilizers, and alloys declined as a result of environmental and health regulations in the 1980s and 1990s; in 2006, only 7% of to total cadmium consumption was used for plating, and only 10% was used for pigments.[4]
At the same time, these decreases in consumption were compensated by a growing demand for cadmium for nickel-cadmium batteries, which accounted for 81% of the cadmium consumption in the United States in 2006.[23]
Occurrence[edit]

Cadmium makes up about 0.1 ppm of Earth’s crust. It is much rarer than zinc, which makes up about 65 ppm.[24] No significant deposits of cadmium-containing ores are known. The only cadmium mineral of importance, greenockite (CdS), is nearly always associated with sphalerite (ZnS). This association is caused by geochemical similarity between zinc and cadmium, with no geological process likely to separate them. Thus, cadmium is produced mainly as a byproduct of mining, smelting, and refining sulfidic ores of zinc, and, to a lesser degree, lead and copper. Small amounts of cadmium, about 10% of consumption, are produced from secondary sources, mainly from dust generated by recycling iron and steel scrap. Production in the United States began in 1907,[17] but wide use began after World War I.[25][26]
Metallic cadmium can be found in the Vilyuy River basin in Siberia.[27]
Rocks mined for phosphate fertilizers contain varying amounts of cadmium, resulting in a cadmium concentration of as much as 300 mg/kg in the fertilizers and a high cadmium content in agricultural soils.[28][29] Coal can contain significant amounts of cadmium, which ends up mostly in coal fly ash.[30] Cadmium in soil can be absorbed by crops such as rice. Chinese ministry of agriculture measured in 2002 that 28% of rice it sampled had excess lead and 10% had excess cadmium above limits defined by law. Some plants such as willow trees and poplars have been found to clean both lead and cadmium from soil.[31]
Typical background concentrations of cadmium do not exceed 5 ng/m3 in the atmosphere; 2 mg/kg in soil; 1 μg/L in freshwater and 50 ng/L in seawater.[32] Concentrations of cadmium above 10 μg/L may be stable in water having low total solute concentrations and p H and can be difficult to remove by conventional water treatment processes.[33]
Production[edit]
Cadmium is a common impurity in zinc ores, and it is most often isolated during the production of zinc. Some zinc ores concentrates from zinc sulfate ores contain up to 1.4% of cadmium.[34] In the 1970s, the output of cadmium was 6.5 pounds (2.9 kg) per ton of zinc.[34] Zinc sulfide ores are roasted in the presence of oxygen, converting the zinc sulfide to the oxide. Zinc metal is produced either by smelting the oxide with carbon or by electrolysis in sulfuric acid. Cadmium is isolated from the zinc metal by vacuum distillation if the zinc is smelted, or cadmium sulfate is precipitated from the electrolysis solution.[26][35]
The British Geological Survey reports that in 2001, China was the top producer of cadmium with almost one-sixth of the world’s production, closely followed by South Korea and Japan.[36]
-

History of the world production of cadmium
-

Cadmium production in 2010.
Applications[edit]
Cadmium is a common component of electric batteries, pigments,[37] coatings,[38] and electroplating.[39]
Batteries[edit]

In 2009, 86% of cadmium was used in batteries, predominantly in rechargeable nickel-cadmium batteries. Nickel-cadmium cells have a nominal cell potential of 1.2 V. The cell consists of a positive nickel hydroxide electrode and a negative cadmium electrode plate separated by an alkaline electrolyte (potassium hydroxide).[40] The European Union put a limit on cadmium in electronics in 2004 of 0.01%,[41] with some exceptions, and in 2006 reduced the limit on cadmium content to 0.002%.[42] Another type of battery based on cadmium is the silver-cadmium battery.
Electroplating[edit]

Cadmium electroplating, consuming 6% of the global production, is used in the aircraft industry to reduce corrosion of steel components.[39] This coating is passivated by chromate salts.[38] A limitation of cadmium plating is hydrogen embrittlement of high-strength steels from the electroplating process. Therefore, steel parts heat-treated to tensile strength above 1300 MPa (200 ksi) should be coated by an alternative method (such as special low-embrittlement cadmium electroplating processes or physical vapor deposition).
Titanium embrittlement from cadmium-plated tool residues resulted in banishment of those tools (and the implementation of routine tool testing to detect cadmium contamination) in the A-12/SR-71, U-2, and subsequent aircraft programs that use titanium.[43]
Nuclear fission[edit]
Cadmium is used in the control rods of nuclear reactors, acting as a very effective neutron poison to control neutron flux in nuclear fission.[39] When cadmium rods are inserted in the core of a nuclear reactor, cadmium absorbs neutrons, preventing them from creating additional fission events, thus controlling the amount of reactivity. The pressurized water reactor designed by Westinghouse Electric Company uses an alloy consisting of 80% silver, 15% indium, and 5% cadmium.[39]
Televisions[edit]
QLED TVs have been starting to include cadmium in construction. Some companies have been looking to reduce the environmental impact of human exposure and pollution of the material in televisions during production.[44]
Anticancer drugs[edit]
Complexes based on heavy metals have great potential for the treatment of a wide variety of cancers but their use is often limited due to toxic side effects. However, scientists are advancing in the field and new promising cadmium complex compounds with reduced toxicity have been discovered.[45]
Compounds[edit]

Cadmium oxide was used in black and white television phosphors and in the blue and green phosphors of color television cathode ray tubes.[46] Cadmium sulfide (CdS) is used as a photoconductive surface coating for photocopier drums.[47]

Various cadmium salts are used in paint pigments, with CdS as a yellow pigment being the most common. Cadmium selenide is a red pigment, commonly called cadmium red. To painters who work with the pigment, cadmium provides the most brilliant and durable yellows, oranges, and reds – so much so that during production, these colors are significantly toned down before they are ground with oils and binders or blended into watercolors, gouaches, acrylics, and other paint and pigment formulations. Because these pigments are potentially toxic, users should use a barrier cream on the hands to prevent absorption through the skin[37] even though the amount of cadmium absorbed into the body through the skin is reported to be less than 1%.[7]
In PVC, cadmium was used as heat, light, and weathering stabilizers.[39][48] Currently, cadmium stabilizers have been completely replaced with barium-zinc, calcium-zinc and organo-tin stabilizers. Cadmium is used in many kinds of solder and bearing alloys, because it has a low coefficient of friction and fatigue resistance.[39] It is also found in some of the lowest-melting alloys, such as Wood’s metal.[49]
Semiconductors[edit]
Cadmium is an element in some semiconductor materials. Cadmium sulfide, cadmium selenide, and cadmium telluride are used in some photodetectors and solar cells. HgCdTe detectors are sensitive to mid-infrared light [39] and used in some motion detectors.
Laboratory uses[edit]

Helium–cadmium lasers are a common source of blue or ultraviolet laser light. Lasers at wavelengths of 325, 354 and 442 nm are made using this gain medium; some models can switch between these wavelengths. They are notably used in fluorescence microscopy as well as various laboratory uses requiring laser light at these wavelengths.[50][51]
Cadmium selenide quantum dots emit bright luminescence under UV excitation (He-Cd laser, for example). The color of this luminescence can be green, yellow or red depending on the particle size. Colloidal solutions of those particles are used for imaging of biological tissues and solutions with a fluorescence microscope.[52]
In molecular biology, cadmium is used to block voltage-dependent calcium channels from fluxing calcium ions, as well as in hypoxia research to stimulate proteasome-dependent degradation of Hif-1α.[53]
Cadmium-selective sensors based on the fluorophore BODIPY have been developed for imaging and sensing of cadmium in cells.[54] One powerful method for monitoring cadmium in aqueous environments involves electrochemistry. By employing a self-assembled monolayer one can obtain a cadmium selective electrode with a ppt-level sensitivity.[55]
Biological role and research[edit]
Cadmium has no known function in higher organisms and is considered toxic.[56] Cadmium is considered an environmental pollutant that causes health hazard to living organisms.[57] Administration of cadmium to cells causes oxidative stress and increases the levels of antioxidants produced by cells to protect against macro molecular damage.[58]
However a cadmium-dependent carbonic anhydrase has been found in some marine diatoms.[59] The diatoms live in environments with very low zinc concentrations and cadmium performs the function normally carried out by zinc in other anhydrases. This was discovered with X-ray absorption near edge structure (XANES) spectroscopy.[59][60]
Cadmium is preferentially absorbed in the kidneys of humans. Up to about 30 mg of cadmium is commonly inhaled throughout human childhood and adolescence.[61] Cadmium is under research regarding its toxicity in humans, potentially elevating risks of cancer, cardiovascular disease, and osteoporosis.[62][63][64][65]
Environment[edit]
The biogeochemistry of cadmium and its release to the environment has been the subject of review, as has the speciation of cadmium in the environment.[66][67]
Safety[edit]
| Hazards | |
|---|---|
| GHS labelling:[68] | |
| Pictograms |    |
| Signal word | Danger |
| Hazard statements | H301, H330, H341, H350, H361fd, H372, H410 |
| Precautionary statements | P201, P202, P260, P264, P273, P304+P340+P310 |
| NFPA 704 (fire diamond) |
4 0 0 |
Individuals and organizations have been reviewing cadmium’s bioinorganic aspects for its toxicity.[69] The most dangerous form of occupational exposure to cadmium is inhalation of fine dust and fumes, or ingestion of highly soluble cadmium compounds.[4] Inhalation of cadmium fumes can result initially in metal fume fever, but may progress to chemical pneumonitis, pulmonary edema, and death.[70]
Cadmium is also an environmental hazard. Human exposure is primarily from fossil fuel combustion, phosphate fertilizers, natural sources, iron and steel production, cement production and related activities, nonferrous metals production, and municipal solid waste incineration.[4] Other sources of cadmium include bread, root crops, and vegetables.[71]

There have been a few instances of general population poisoning as the result of long-term exposure to cadmium in contaminated food and water. Research into an estrogen mimicry that may induce breast cancer is ongoing.[71] In the decades leading up to World War II, mining operations contaminated the Jinzū River in Japan with cadmium and traces of other toxic metals. As a consequence, cadmium accumulated in the rice crops along the riverbanks downstream of the mines. Some members of the local agricultural communities consumed the contaminated rice and developed itai-itai disease and renal abnormalities, including proteinuria and glucosuria.[72] The victims of this poisoning were almost exclusively post-menopausal women with low iron and low body stores of other minerals. Similar general population cadmium exposures in other parts of the world have not resulted in the same health problems because the populations maintained sufficient iron and other mineral levels. Thus, although cadmium is a major factor in the itai-itai disease in Japan, most researchers have concluded that it was one of several factors.[4]
Cadmium is one of six substances banned by the European Union’s Restriction of Hazardous Substances (RoHS) directive, which regulates hazardous substances in electrical and electronic equipment, but allows for certain exemptions and exclusions from the scope of the law.[73]
The International Agency for Research on Cancer has classified cadmium and cadmium compounds as carcinogenic to humans.[74] Although occupational exposure to cadmium is linked to lung and prostate cancer, there is still uncertainty about the carcinogenicity of cadmium in low environmental exposure. Recent data from epidemiological studies suggest that intake of cadmium through diet is associated with a higher risk of endometrial, breast, and prostate cancer as well as with osteoporosis in humans.[75][76][77][78] A recent study has demonstrated that endometrial tissue is characterized by higher levels of cadmium in current and former smoking females.[79]
Cadmium exposure is associated with a large number of illnesses including kidney disease,[80] early atherosclerosis, hypertension, and cardiovascular diseases.[81] Although studies show a significant correlation between cadmium exposure and occurrence of disease in human populations, a molecular mechanism has not yet been identified. One hypothesis holds that cadmium is an endocrine disruptor and some experimental studies have shown that it can interact with different hormonal signaling pathways. For example, cadmium can bind to the estrogen receptor alpha,[82][83] and affect signal transduction along the estrogen and MAPK signaling pathways at low doses.[84][85][86]
The tobacco plant absorbs and accumulates heavy metals such as cadmium from the surrounding soil into its leaves. Following tobacco smoke inhalation, these are readily absorbed into the body of users.[87] Tobacco smoking is the most important single source of cadmium exposure in the general population. An estimated 10% of the cadmium content of a cigarette is inhaled through smoking. Absorption of cadmium through the lungs is more effective than through the gut. As much as 50% of the cadmium inhaled in cigarette smoke may be absorbed.[88]
On average, cadmium concentrations in the blood of smokers is 4 to 5 times greater than non-smokers and in the kidney, 2–3 times greater than in non-smokers. Despite the high cadmium content in cigarette smoke, there seems to be little exposure to cadmium from passive smoking.[89]
In a non-smoking population, food is the greatest source of exposure. High quantities of cadmium can be found in crustaceans, mollusks, offal, frog legs, cocoa solids, bitter and semi-bitter chocolate, seaweed, fungi and algae products. However, grains, vegetables, and starchy roots and tubers are consumed in much greater quantity in the U.S., and are the source of the greatest dietary exposure there.[90] Most plants bio-accumulate metal toxins such as cadmium and when composted to form organic fertilizers, yield a product that often can contain high amounts (e.g., over 0.5 mg) of metal toxins for every kilogram of fertilizer. Fertilizers made from animal dung (e.g., cow dung) or urban waste can contain similar amounts of cadmium. The cadmium added to the soil from fertilizers (rock phosphates or organic fertilizers) become bio-available and toxic only if the soil pH is low (i.e., acidic soils).
Zinc, copper, calcium, and iron ions, and selenium with vitamin C are used to treat cadmium intoxication, though it is not easily reversed.[80]
Regulations[edit]
Because of the adverse effects of cadmium on the environment and human health, the supply and use of cadmium is restricted in Europe under the REACH Regulation.[91]
The EFSA Panel on Contaminants in the Food Chain specifies that 2.5 μg/kg body weight is a tolerable weekly intake for humans.[90] The Joint FAO/WHO Expert Committee on Food Additives has declared 7 μg/kg body weight to be the provisional tolerable weekly intake level.[92] The state of California requires a food label to carry a warning about potential exposure to cadmium on products such as cocoa powder.[93]
The U.S. Occupational Safety and Health Administration (OSHA) has set the permissible exposure limit (PEL) for cadmium at a time-weighted average (TWA) of 0.005 ppm. The National Institute for Occupational Safety and Health (NIOSH) has not set a recommended exposure limit (REL) and has designated cadmium as a known human carcinogen. The IDLH (immediately dangerous to life and health) level for cadmium is 9 mg/m3.[94]
| Lethal dose[95] | Organism | Route | Time |
|---|---|---|---|
| LD50: 225 mg/kg | rat | oral | n/a |
| LD50: 890 mg/kg | mouse | oral | n/a |
| LC50: 25 mg/m3 | rat | n/a | 30 min |
In addition to mercury, the presence of cadmium in some batteries has led to the requirement of proper disposal (or recycling) of batteries.
Product recalls[edit]
In May 2006, a sale of the seats from Arsenal F.C.’s old stadium, Highbury in London, England was cancelled when the seats were discovered to contain trace amounts of cadmium.[96] Reports of high levels of cadmium use in children’s jewelry in 2010 led to a US Consumer Product Safety Commission investigation.[97] The U.S. CPSC issued specific recall notices for cadmium content in jewelry sold by Claire’s[98] and Wal-Mart[99] stores.
In June 2010, McDonald’s voluntarily recalled more than 12 million promotional Shrek Forever After 3D Collectible Drinking Glasses because of the cadmium levels in paint pigments on the glassware.[100] The glasses were manufactured by Arc International, of Millville, NJ, USA.[101]
See also[edit]
- Red List building materials
- Toxic heavy metal
References[edit]
- ^ «Standard Atomic Weights: Cadmium». CIAAW. 2013.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g Morrow, H. (2010). «Cadmium and Cadmium Alloys». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. pp. 1–36. doi:10.1002/0471238961.0301041303011818.a01.pub3. ISBN 978-0-471-23896-6.
- ^ a b
Holleman, A. F.; Wiberg, E.; Wiberg, Nils (1985). «Cadmium». Lehrbuch der Anorganischen Chemie, 91–100 (in German). Walter de Gruyter. pp. 1056–1057. ISBN 978-3-11-007511-3. - ^ «Cadmium 3.2.6 Solubility». PubChem. Retrieved 25 November 2021.
- ^ a b
«Case Studies in Environmental Medicine (CSEM) Cadmium». Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011. Retrieved 30 May 2011. - ^
Cotton, F. A. (1999). «Survey of Transition-Metal Chemistry». Advanced Inorganic Chemistry (6th ed.). John Wiley and Sons. p. 633. ISBN 978-0-471-19957-1. - ^ Carballo, Rosa; Castiñeras, Alfonso; Domínguez-Martin, Alicia; García-Santos, Isabel; Niclós-Guttiérrez, Juan (2013). «Chapter 7. Solid state structures of cadmium complexes with relevance to biological systems». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 145–189. doi:10.1007/978-94-007-5179-8_7. hdl:11093/232. ISBN 978-94-007-5178-1. PMID 23430774.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^
Knoll, G. F. (2000). Radiation Detection and Measurement. Wiley. p. 505. ISBN 978-0-471-07338-3. - ^
Padmanabhan, T. (2001). «Stellar Nucleosynthesis». Theoretical Astrophysics, Volume II: Stars and Stellar Systems. Cambridge University Press. pp. 230–236. ISBN 978-0-521-56631-5. - ^ Rolof (1795). «Wichtige Nachricht für Aerzte und Apoteker – Entdeckung eines Arsenikgehalts in der Zinkblume und des Zinkvitriols in Tartarus vitriolis». Journal des practischen Arzneykunde und Wundarzneykunst (Hufelands Journal) (2 Februar Stück): 110.
- ^
Hermann, C. S. (1818). «Noch ein schreiben über das neue Metall». Annalen der Physik. 59 (5): 113–116. Bibcode:1818AnP….59..113H. doi:10.1002/andp.18180590511.
- ^
Waterston, W.; Burton, J. H. (1844). Cyclopædia of commerce, mercantile law, finance, commercial geography and navigation. H. G. Bohn. p. 122. - ^
Rowbotham, T.; Rowbotham, T. L. (1850). The Art of Landscape Painting in Water Colours. Windsor and Newton. p. 10. - ^ a b
Ayres, R. U.; Ayres, L.; Råde, I. (2003). The Life Cycle of Copper, Its Co-Products and Byproducts. Springer. pp. 135–141. ISBN 978-1-4020-1552-6. - ^
Dunglison, R. (1866). Medical Lexicon: A Dictionary of Medical Science. Henry C. Lea. pp. 159. - ^ «International Angstrom». Science Dictionary. 14 September 2013. Archived from the original on 18 November 2018. Retrieved 24 September 2014.
- ^ «angstrom or ångström». Sizes.com. 28 October 2010. Retrieved 24 September 2014.
- ^
Burdun, G. D. (1958). «On the new determination of the meter». Measurement Techniques. 1 (3): 259–264. doi:10.1007/BF00974680. S2CID 121450003. - ^ a b
Lansche, A. M. (1956). «Cadmium». Minerals Yearbook, Volume I: Metals and Minerals (Except Fuels). United States Geological Survey. Retrieved 21 April 2008. - ^ «USGS Mineral Information: Cadmium». United States Geological Survey. Retrieved 8 August 2009.
- ^
Wedepohl, K. H. (1995). «The composition of the continental crust». Geochimica et Cosmochimica Acta. 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2. - ^
Plachy, J. (1998). «Annual Average Cadmium Price» (PDF). U.S. Geological Survey. pp. 17–19. Archived (PDF) from the original on 16 August 2000. Retrieved 16 June 2010. - ^ a b
Fthenakis, V. M. (2004). «Life cycle impact analysis of cadmium in CdTe PV production». Renewable and Sustainable Energy Reviews. 8 (4): 303–334. doi:10.1016/j.rser.2003.12.001. - ^ Fleischer, M.; Cabri, L. J.; Chao, G. Y.; Pabst, A. (1980). «New Mineral Names» (PDF). American Mineralogist. 65: 1065–1070. Archived (PDF) from the original on 10 October 2022.
- ^ Grant, C. A.; Sheppard, S. C. (2008). «Fertilizer impacts on cadmium availability in agricultural soils and crops». Human and Ecological Risk Assessment. 14 (2): 210–228. doi:10.1080/10807030801934895. S2CID 84548398.
- ^ Jiao, Y.; Grant, C. A.; Bailey, L. D. (2004). «Effects of phosphorus and zinc fertilizer on cadmium uptake and distribution in flax and durum wheat». Journal of the Science of Food and Agriculture. 84 (8): 777–785. doi:10.1002/jsfa.1648.
- ^ Bettinelli, M.; Baroni, U.; Pastorelli, N. (1988). «Determination of arsenic, cadmium, lead, antimony, selenium and thallium in coal fly ash using the stabilised temperature platform furnace and Zeeman-effect background correction». Journal of Analytical Atomic Spectrometry. 3 (7): 1005–1011. doi:10.1039/JA9880301005.
- ^ «The most neglected threat to public health in China is toxic soil». The Economist. 8 June 2017. Retrieved 13 June 2017.
- ^
Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. p. 166. ISBN 978-0-415-85920-2. - ^ Hem, John D. (1972). «Chemistry and occurrence of cadmium and zinc in surface water and groundwater». Water Resources Research. 8 (3): 661–679. Bibcode:1972WRR…..8..661H. doi:10.1029/WR008i003p00661. ISSN 1944-7973.
- ^ a b
Golberg, D. C.; et al. (1969). Trends in Usage of Cadmium: Report. US NRC/NAS/NAE. pp. 1–3. - ^
Scoullos, M. J. (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. pp. 104–116. ISBN 978-1-4020-0224-3. - ^ Hetherington, L. E.; et al. (2008). «Production of Cadmium» (PDF). World Mineral Production 2002–06. British Geological Survey. p. 15. Archived from the original (PDF) on 8 November 2012. Retrieved 15 April 2012.
- ^ a b Buxbaum, Gunter; Pfaff, Gerhard (2005). «Cadmium Pigments». Industrial inorganic pigments. Wiley-VCH. pp. 121–123. ISBN 978-3-527-30363-2.
- ^ a b Smith, C.J.E.; Higgs, M.S.; Baldwin, K.R. (20 April 1999). «Advances to Protective Coatings and their Application to Ageing Aircraft». RTO MP-25. Archived from the original (PDF) on 17 May 2011. Retrieved 29 May 2011.
- ^ a b c d e f g Scoullos, Michael J.; Vonkeman, Gerrit H.; Thornton, Iain; Makuch, Zen (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. ISBN 978-1-4020-0224-3.
- ^ Krishnamurthy, N. (2 July 2013). Engg. Chemistry, 2/e. New York: PHI Learning Private Limited. pp. 82–83. ISBN 978-81-203-3666-7.
- ^ «EUR-Lex — 32011L0065 — EN — EUR-Lex». eur-lex.europa.eu. Archived from the original on 5 March 2016.
- ^ «DIRECTIVE 2006/66/EC OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL». EUR-lex.europa.eu. 26 September 2006. Retrieved 25 October 2022.
- ^ «CIA – Breaking Through Technological Barriers – Finding The Right Metal (A-12 program)». 1 October 2007. Archived from the original on 9 October 2007.
- ^ Maynard, Andrew. «Are quantum dot TVs – and their toxic ingredients – actually better for the environment?». The Conversation. Retrieved 23 July 2017.
- ^ Abyar, Selda; Khandar, Ali Akbar; Salehi, Roya; Abolfazl Hosseini-Yazdi, Seyed; Alizadeh, Effat; Mahkam, Mehrdad; Jamalpoor, Amer; White, Jonathan M.; Shojaei, Motahhareh; Aizpurua-Olaizola, O.; Masereeuw, Rosalinde (December 2019). «In vitro nephrotoxicity and anticancer potency of newly synthesized cadmium complexes». Scientific Reports. 9 (1): 14686. Bibcode:2019NatSR…914686A. doi:10.1038/s41598-019-51109-9. ISSN 2045-2322. PMC 6789105. PMID 31604983.
- ^ Lee, Ching-Hwa; Hsi, C. S. (2002). «Recycling of Scrap Cathode Ray Tubes». Environmental Science & Technology. 36 (1): 69–75. Bibcode:2002EnST…36…69L. doi:10.1021/es010517q. PMID 11811492.
- ^ Miller, L. S.; Mullin, J. B. (1991). «Crystalline Cadmium Sulfide». Electronic materials: from silicon to organics. Springer. p. 273. ISBN 978-0-306-43655-0.
- ^ Jennings, Thomas C. (2005). «Cadmium Environmental Concerns». PVC handbook. Hanser Verlag. p. 149. ISBN 978-1-56990-379-7.
- ^ Brady, George Stuart; Brady, George S.; Clauser, Henry R.; Vaccari, John A. (2002). Materials handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. McGraw-Hill Professional. p. 425. ISBN 978-0-07-136076-0.
- ^ «Helium-Cadmium Lasers». Olympus. Archived from the original on 15 July 2011. Retrieved 14 May 2011.
- ^ Nambiar, K.R (2006). «Helium-cadmium Laser». Lasers: Principles, Types and Applications. ISBN 978-81-224-1492-9.
- ^ «Cadmium Selenium Testing for Microbial Contaminants». NASA. 10 June 2003. Archived from the original on 25 July 2011. Retrieved 20 November 2009.
- ^ Park J. W., Chun Y. S.; Choi, E.; Kim, G. T.; Choi, H.; Kim, C. H.; Lee, M. J.; Kim, M. S.; Park, J. W. (2000). «Cadmium blocks hypoxia-inducible factor (HIF)-1-mediated response to hypoxia by stimulating the proteasome-dependent degradation of HIF-1alpha». European Journal of Biochemistry. 267 (13): 4198–4204. doi:10.1046/j.1432-1327.2000.01453.x. PMID 10866824.
- ^ Taki, Masayasu (2013). «Chapter 5. Imaging and sensing of cadmium in cells». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 99–115. doi:10.1007/978-94-007-5179-8_5. ISBN 978-94-007-5178-1. PMID 23430772.
- ^ Noyhouzer, Tomer; Mandler, Daniel (17 January 2011). «Determination of low levels of cadmium ions by the under potential deposition on a self-assembled monolayer on gold electrode». Analytica Chimica Acta. 684 (1–2): 1–7. doi:10.1016/j.aca.2010.10.021. PMID 21167979.
- ^ Hogan, C. Michael (2010). Heavy metal. Encyclopedia of Earth. National Council for Science and the Environment. E. Monosson and C. Cleveland (eds.). Washington DC.
- ^ Xu, Liang, Zhang, Fei, Tang, Mingjia, et al. Melatonin confers cadmium tolerance by modulating critical heavy metal chelators and transporters in radish plants. Journal of Pineal Research: Molecular, Biological, Physiological and Clinical Aspects of Melatonin. 2020;69(1):doi:10.1111/jpi.12659.
- ^ Kannan, Muthukumar (2010). «Cadmium-induced oxidative stress in Saccharomyces cerevisiae». Indian J Biochem Biophys. 47 (6): 383–7. PMID 21355423.
- ^ a b Lane, Todd W.; Saito, Mak A.; George, Graham N.; Pickering, Ingrid J.; Prince, Roger C.; Morel, François M. M. (2005). «A cadmium enzyme from a marine diatom» (PDF). Nature. 435 (42): 42. Bibcode:2005Natur.435…42L. doi:10.1038/435042a. PMID 15875011. S2CID 52819760.
- ^ Lane, Todd W.; Morel, F. M. (2000). «A biological function for cadmium in marine diatoms». Proc. Natl. Acad. Sci. 97 (9): 4627–4631. Bibcode:2000PNAS…97.4627L. doi:10.1073/pnas.090091397. PMC 18283. PMID 10781068.
- ^ Perry, HM Jr.; Thind, G. S.; Perry, E. F. (1976). «The biology of cadmium». The Medical Clinics of North America. 60 (4): 759–69. doi:10.1016/S0025-7125(16)31859-4. PMID 775217.
- ^ Luevano, J; Damodaran, C (2014). «A Review of Molecular Events of Cadmium-Induced Carcinogenesis». Journal of Environmental Pathology, Toxicology and Oncology. 33 (3): 183–194. doi:10.1615/jenvironpatholtoxicoloncol.2014011075. PMC 4183964. PMID 25272057.
- ^ Rahim, F; Jalali, A; Tangestani, R (2013). «Breast cancer frequency and exposure to cadmium: A meta-analysis and systematic review» (PDF). Asian Pacific Journal of Cancer Prevention. 14 (7): 4283–7. doi:10.7314/apjcp.2013.14.7.4283. PMID 23991990. Archived (PDF) from the original on 10 October 2022.
- ^ Tellez-Plaza, M; Jones, M. R.; Dominguez-Lucas, A; Guallar, E; Navas-Acien, A (2013). «Cadmium Exposure and Clinical Cardiovascular Disease: A Systematic Review». Current Atherosclerosis Reports. 15 (10): 10.1007/s11883–013–0356–2. doi:10.1007/s11883-013-0356-2. PMC 3858820. PMID 23955722.
- ^ James, K. A.; Meliker, J. R. (2013). «Environmental cadmium exposure and osteoporosis: A review». International Journal of Public Health. 58 (5): 737–45. doi:10.1007/s00038-013-0488-8. PMID 23877535. S2CID 11265947.
- ^
Cullen, Jay T.; Maldonado, Maria T. (2013). «Chapter 2. Biogeochemistry of Cadmium and its Release to the Environment». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 31–62. doi:10.1007/978-94-007-5179-8_2. ISBN 978-94-007-5178-1. PMID 23430769. - ^ Crea, Francesco; Foti, Claudia; Milea, Demetrio; Sammartano, Silvio (2013). «Chapter 3. Speciation of Cadmium in the Environment». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 63–83. doi:10.1007/978-94-007-5179-8_3. ISBN 978-94-007-5178-1. PMID 23430770.
- ^ GHS: «Safety Data Sheet». Sigma-Aldrich. 12 September 2021. Retrieved 22 December 2021.
- ^ Maret, Wolfgang; Moulis, Jean-Marc (2013). «Chapter 1. The Bioinorganic Chemistry of Cadmium in the Context of its Toxicity». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 1–30. doi:10.1007/978-94-007-5179-8_1. ISBN 978-94-007-5178-1. PMID 23430768.
- ^ Hayes, Andrew Wallace (2007). Principles and Methods of Toxicology. Philadelphia: CRC Press. pp. 858–861. ISBN 978-0-8493-3778-9.
- ^ a b Mann, Denise (23 April 2012) Can Heavy Metal in Foods, Cosmetics Spur Breast Cancer Spread? HealthDayBy via Yahoo
- ^ Nogawa, Koji; Kobayashi, E.; Okubo, Y.; Suwazono, Y. (2004). «Environmental cadmium exposure, adverse effects, and preventative measures in Japan». Biometals. 17 (5): 581–587. doi:10.1023/B:BIOM.0000045742.81440.9c. PMID 15688869. S2CID 8053594.
- ^ «European Commission Decision of 12 October 2006 amending, for the purposes of adapting to technical progress, the Annex to Directive 2002/95/EC of the European Parliament and of the Council as regards exemptions for applications of lead and cadmium (notified under document number C(2006) 4790)». Journal of the European Union. 14 October 2006.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (1993) (1993). Beryllium, cadmium, mercury, and exposures in the glass manufacturing industry. Lyon. ISBN 92-832-1258-4. OCLC 29943893.
- ^ Julin, B.; Wolk, A.; Johansson, J. E.; Andersson, S. O.; Andrén, O.; Akesson, A. (2012). «Dietary cadmium exposure and prostate cancer incidence: A population-based prospective cohort study». British Journal of Cancer. 107 (5): 895–900. doi:10.1038/bjc.2012.311. PMC 3425979. PMID 22850555.
- ^ Engström, A.; Michaëlsson, K.; Vahter, M.; Julin, B.; Wolk, A.; Åkesson, A. (2012). «Associations between dietary cadmium exposure and bone mineral density and risk of osteoporosis and fractures among women». Bone. 50 (6): 1372–8. doi:10.1016/j.bone.2012.03.018. PMID 22465267.
- ^ Julin, B.; Wolk, A.; Bergkvist, L.; Bottai, M.; Akesson, A. (2012). «Dietary cadmium exposure and risk of postmenopausal breast cancer: A population-based prospective cohort study». Cancer Research. 72 (6): 1459–66. doi:10.1158/0008-5472.CAN-11-0735. PMID 22422990.
- ^ Akesson, A.; Julin, B.; Wolk, A. (2008). «Long-term dietary cadmium intake and postmenopausal endometrial cancer incidence: A population-based prospective cohort study». Cancer Research. 68 (15): 6435–41. doi:10.1158/0008-5472.CAN-08-0329. PMID 18676869.
- ^ Rzymski, P.; Rzymski, P.; Tomczyk, K.; Niedzielski, P.; Jakubowski, K.; Poniedziałek, B.; Opala, T. (2014). «Metal status in human endometrium: Relation to cigarette smoking and histological lesions». Environmental Research. 132: 328–33. Bibcode:2014ER….132..328R. doi:10.1016/j.envres.2014.04.025. PMID 24834829.
- ^ a b «ARL : Cadmium Toxicity». www.arltma.com. Archived from the original on 9 September 2019. Retrieved 7 July 2016.
- ^ Cadmium Exposure can Induce Early Atherosclerotic Changes Archived 15 March 2012 at the Wayback Machine, Medinews Direct, 7 September 2009
- ^ Fechner, P.; Damdimopoulou, P.; Gauglitz, G. (2011). «Biosensors paving the way to understanding the interaction between cadmium and the estrogen receptor alpha». PLOS ONE. 6 (8): e23048. Bibcode:2011PLoSO…623048F. doi:10.1371/journal.pone.0023048. PMC 3149063. PMID 21829690.
- ^ Stoica, A.; Katzenellenbogen, B. S.; Martin, M. B. (2000). «Activation of estrogen receptor-alpha by the heavy metal cadmium». Molecular Endocrinology. 14 (4): 545–53. doi:10.1210/mend.14.4.0441. PMID 10770491.
- ^ Ali, I.; Penttinen-Damdimopoulou, P. E.; Mäkelä, S. I.; Berglund, M.; Stenius, U.; Akesson, A.; Håkansson, H.; Halldin, K. (2010). «Estrogen-like effects of cadmium in vivo do not appear to be mediated via the classical estrogen receptor transcriptional pathway». Environmental Health Perspectives. 118 (10): 1389–94. doi:10.1289/ehp.1001967. PMC 2957917. PMID 20525538.
- ^ Ali, I.; Damdimopoulou, P.; Stenius, U.; Adamsson, A.; Mäkelä, S. I.; Åkesson, A.; Berglund, M.; Håkansson, H.; Halldin, K. (2012). «Cadmium-induced effects on cellular signaling pathways in the liver of transgenic estrogen reporter mice». Toxicological Sciences. 127 (1): 66–75. doi:10.1093/toxsci/kfs077. PMID 22314386.
- ^ Johnson, M. D.; Kenney, N.; Stoica, A.; Hilakivi-Clarke, L.; Singh, B.; Chepko, G.; Clarke, R.; Sholler, P. F.; Lirio, A. A.; Foss, C.; Reiter, R.; Trock, B.; Paik, S.; Martin, M. B. (2003). «Cadmium mimics the in vivo effects of estrogen in the uterus and mammary gland». Nature Medicine. 9 (8): 1081–4. doi:10.1038/nm902. PMID 12858169. S2CID 39484160.
- ^ Dias, Fábio de S.; Bonsucesso, Josemário S.; Oliveira, Lucas C.; Dos Santos, Walter N.L. (2012). «Preconcentration and determination of copper in tobacco leaves samples by using a minicolumn of sisal fiber (Agave sisalana) loaded with Alizarin fluorine blue by FAAS». Talanta. 89 (1): 276–279. doi:10.1016/j.talanta.2011.12.027. PMID 22284492.
- ^ Friberg, L. (1983). «Cadmium». Annual Review of Public Health. 4: 367–73. doi:10.1146/annurev.pu.04.050183.002055. PMID 6860444.
- ^ Jarup, L. (1998). «Health effects of cadmium exposure – a review of the literature and a risk estimate». Scandinavian Journal of Work, Environment & Health. 24: 11–51. PMID 9569444.
- ^ a b «Cadmium dietary exposure in the European population – European Food Safety Authority». www.efsa.europa.eu. 18 January 2012.
- ^ EUR-Lex. Eur-lex.europa.eu (18 April 2011). Retrieved on 5 June 2011.
- ^ «JECFA Evaluations-CADMIUM-«. www.inchem.org.
- ^ such as seen on the organic cocoa powder marketed by Better Body Foods, for example
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0087». National Institute for Occupational Safety and Health (NIOSH).
- ^ «Cadmium compounds (as Cd)». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Toxic fears hit Highbury auction». BBC Sport. 10 May 2006. Retrieved 29 November 2010.
- ^ «U.S. to Develop Safety Standards for Toxic Metals». Business Week. 12 January 2010. Retrieved 12 January 2010.
- ^ «Claire’s Recalls Children’s Metal Charm Bracelets Due to High Levels of Cadmium». U.S. Consumer Product Safety Commission. 10 May 2010. Archived from the original on 31 May 2010. Retrieved 5 June 2010.
- ^ «FAF Inc. Recalls Children’s Necklaces Sold Exclusively at Walmart Stores Due to High Levels of Cadmium». U.S. Consumer Product Safety Commission. 29 January 2010. Archived from the original on 27 May 2010. Retrieved 5 June 2010.
- ^ Neuman, William (4 June 2010). «McDonald’s Recalls 12 Million ‘Shrek’ Glasses». The New York Times. Retrieved 5 June 2010.
- ^ «McDonald’s Recalls Movie Themed Drinking Glasses Due to Potential Cadmium Risk». U.S. Consumer Product Safety Commission. 4 June 2010. Archived from the original on 7 June 2010. Retrieved 5 June 2010.
Further reading[edit]
- Hartwig, Andrea (2013). «Chapter 15. Cadmium and cancer». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 491–507. doi:10.1007/978-94-007-5179-8_15. ISBN 978-94-007-5178-1. PMID 23430782.
External links[edit]
![]()
Look up cadmium in Wiktionary, the free dictionary.
![]()
Wikimedia Commons has media related to Cadmium.
![]()
- Cadmium at The Periodic Table of Videos (University of Nottingham)
- ATSDR Case Studies in Environmental Medicine: Cadmium Toxicity U.S. Department of Health and Human Services
- National Institute for Occupational Safety and Health – Cadmium Page
- NLM Hazardous Substances Databank – Cadmium, Elemental
Кадмий в таблице менделеева занимает 48 место, в 5 периоде.
| Символ | Cd |
| Номер | 48 |
| Атомный вес | 112.4140000 |
| Латинское название | Cadmium |
| Русское название | Кадмий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кадмия
Cd: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10
Короткая запись:
Cd: [Kr]5s2 4d10
Одинаковую электронную конфигурацию имеют
атом кадмия и
In+1, Sn+2, Sb+3, Te+4, I+5, Xe+6
Порядок заполнения оболочек атома кадмия (Cd) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Кадмий имеет 48 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
Степень окисления кадмия
Атомы кадмия в соединениях имеют степени окисления 2, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кадмия
Валентность Cd
Атомы кадмия в соединениях проявляют валентность II, I.
Валентность кадмия характеризует способность атома Cd к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cd
Квантовые числа определяются последним электроном в конфигурации,
для атома Cd эти числа имеют значение N = 4, L = 2, Ml = 2, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Cd:
Eo = 868 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Cd в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
| Кадмий | |
|---|---|
| Мягкий ковкий серебристо-серый металл | |
 Элементарный кадмий | |
| Название, символ, номер | Кадмий / Cadmium (Cd), 48 |
| Атомная масса (молярная масса) | 112,411(8) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 |
| Радиус атома | 154 пм |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+2e) 97 пм |
| Электроотрицательность | 1,69 (шкала Полинга) |
| Электродный потенциал | −0,403 |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 867,2 (8,99) кДж/моль (эВ) |
| Плотность (при н. у.) | 8,65 г/см³ |
| Температура плавления | 594,1 K |
| Температура кипения | 1038 K |
| Уд. теплота плавления | 6,11 кДж/моль |
| Уд. теплота испарения | 59,1 кДж/моль |
| Молярная теплоёмкость | 26,0 Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,979 c=5,618 Å |
| Отношение c/a | 1,886 |
| Температура Дебая | 209 K |
| Теплопроводность | (300 K) 96,9 Вт/(м·К) |
| Номер CAS | 7440-43-9 |
Кадмий — элемент двенадцатой группы (в устаревшей классификации — побочной подгруппы второй группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 48. Обозначается символом Cd (лат. Cadmium). Простое вещество кадмий при нормальных условиях — мягкий ковкий тягучий переходный металл серебристо-белого цвета. Устойчив в сухом воздухе, во влажном на его поверхности образуется плёнка оксида, препятствующая дальнейшему окислению металла. Кадмий и его соединения ядовиты.
Содержание
- 1 История открытия
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Нахождение в продуктах
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Сплавы
- 7.2 Защитные покрытия
- 7.3 Химические источники тока
- 7.4 Пигменты
- 7.5 Цена
- 7.6 Другие сферы применения
- 7.7 Ограничение применения
- 8 Физиологическое действие
- 8.1 Механизм токсического действия
- 9 Изотопы

История открытия
Открыт немецким профессором Ф. Штромейером в 1817 году. Провизоры Магдебурга при изучении оксида цинка ZnO заподозрили в нём примесь мышьяка. Штромейер выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий.
Происхождение названия
Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии.
Нахождение в природе
Среднее содержание кадмия в земной коре — 130 мг/т, в морской воде — 0,11 мкг/л. Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Известно всего лишь 6 кадмиевых минералов. Весьма редкими минералами кадмия являются гринокит CdS (77,8 % Cd), хоулиит (то же), отавит CdCO3, монтепонит CdO (87,5 % Cd), кадмоселит CdSe (47 % Cd), ксантохроит CdS(H2O)х (77,2 % Cd). Основная масса кадмия рассеяна в большом числе минералов (более 50), преимущественно в сульфидах цинка, свинца, меди, железа, марганца и ртути. Максимальная концентрация отмечена в минералах цинка и, прежде всего, в сфалерите (до 5 %). В большинстве же случаев содержание кадмия в сфалерите не превышает 0,4—0,6 %. В других сульфидах, например, в станине содержание кадмия — 0,003—0,2 %, в галените — 0,005—0,02 %, в халькопирите — 0,006—0,12 %; из этих сульфидов кадмий обычно не извлекается.
Кадмий не образует самостоятельных месторождений, а входит в состав руд месторождений других металлов. Относительно высоко содержание кадмия в рудах среднетемпературных свинцово-цинковых и частично медно-колчеданных месторождений.
Почва содержит 0,06 мг/кг, глина — 0,3 мг/кг.
Нахождение в продуктах
ПДК кадмия в воде согласно СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения» — 1 мкг/л
Ископаемый уголь, древесный уголь, ПЭТ тара, древесные гранулы пеллеты (до 0,5 мг/кг), рыба (0,2 мг/кг), какао-порошок (0,5 мг/кг), почки животных (1 мг/кг), рис (0,06 мг/кг), сигарета (0,002 мг/кг), пшеничный хлеб (0,03 мг/кг), маргарин (0,042 мг/кг), говядина/свинина (0,016 мг/кг), креветки (1,2 мг/кг)
Получение
Единственный минерал, который представляет интерес в получении кадмия — гринокит, так называемая «кадмиевая обманка». Его добывают вместе со сфалеритом при разработке цинковых руд. В ходе переработки кадмий концентрируется в побочных продуктах процесса, откуда его потом извлекают. В настоящее время производится около 20000 тонн кадмия в год.
Физические свойства
Кадмий — серебристо-белый мягкий металл с гексагональной решёткой. Температура плавления — 321 °C, температура кипения — 770 °C. Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллы металла (так же трещит и пруток олова); любые примеси в металле уничтожают этот эффект. Кадмий твёрже олова, но мягче цинка — его можно резать ножом. При нагревании выше 80 °C кадмий теряет упругость до такой степени, что его можно истолочь в порошок.

Химические свойства
Кадмий расположен в одной группе периодической системы с цинком и ртутью, занимая промежуточное место между ними, поэтому некоторые химические свойства этих элементов сходны. На воздухе кадмий устойчив и не утрачивает металлического блеска. Вступает в реакцию с кислородом лишь при нагревании до 350 °C с образованием оксида кадмия CdO. Сульфиды и оксиды этих элементов практически нерастворимы в воде. С углеродом кадмий не взаимодействует и карбидов не образует. Вступает в реакции с кислотами-неокислителями выделяя водород: Cd + H2SO4(20%) ⟶ CdSO4 + H2
Сплавы
Кадмий используется как компонент твёрдых припоев (сплавов на основе серебра, меди, цинка) для снижения их температуры плавления. Около 10 % производимого кадмия — компонент ювелирных и легкоплавких сплавов. Сплав кадмия с золотом имеет зеленоватый цвет.
Защитные покрытия
40 % производимого кадмия используется для нанесения антикоррозионных покрытий на металлы. Кадмирование стальных деталей даёт большую устойчивость против коррозии, особенно в морской воде.
Кадмирование — это электролитическая процедура нанесения кадмиевых покрытий на поверхность металлоизделий. Кадмием покрывают высокоуглеродистые, инструментальные и нержавеющие стали, а кадмирование хлористо-аммонийное наносят на высокопрочные стали.
Химические источники тока
Около 20 % кадмия идёт на изготовление кадмиевых электродов, применяемых в аккумуляторах (никель-кадмиевых и серебряно-кадмиевых), нормальных элементах Вестона, в резервных батареях (свинцово-кадмиевый элемент, ртутно-кадмиевый элемент) и др.
Пигменты
Около 20 % кадмия используется для производства неорганических красящих веществ (сульфиды и селениды, смешанные соли, например, сульфид кадмия — кадмий лимонный).
Цена
Цена на кадмий в августе 2011 года составила примерно $3 за 1 кг.
Другие сферы применения
- Сульфид кадмия применяется для производства плёночных солнечных батарей с КПД около 10—16 %, а также как очень хороший термоэлектрический материал.
- Кадмий используется как компонент полупроводниковых материалов и люминофоров.
- Кадмий очень хорошо захватывает тепловые нейтроны (среднее сечение радиационного захвата тепловых нейтронов изотопом 114Cd составляет 20600 барн). Поэтому кадмий служит для изготовления регулирующих стержней для атомных реакторов и в качестве защиты от нейтронов. Иногда эти свойства используются в экспериментальных моделях противоопухолевой терапии (нейтрон-захватная терапия).
- Фтороборат кадмия — важный флюс, применяемый для пайки алюминия и других металлов.
- Теплопроводность кадмия вблизи абсолютного нуля — наивысшая среди всех металлов, поэтому кадмий иногда применяется для криогенной техники.
- Экранирование гамма-спектрометров от естественного радиационного фона: «свинцовый домик», в котором располагается спектрометрический датчик, выстилается изнутри медным и кадмиевым слоями для экранирования паразитного излучения свинца, искажающего гамма-спектр измеряемого вещества.
Ограничение применения
В 2016 году принят Технический регламент Евразийского экономического союза «Об ограничении применения опасных веществ в изделиях электротехники и радиоэлектроники» (ТР ЕАЭС 037/2016), по которому содержание кадмия в изделиях электротехники и радиоэлектроники не должно превышать 0,01 % по весу однородного материала (Приложение N 2). В Европе действует аналогичная норма (Директива 2002/95/EC).
Физиологическое действие

Кадмий и все его соединения ядовиты. Особенно опасным случаем является вдыхание паров его оксида (CdO). Вдыхание в течение 1 минуты воздуха с содержанием 2,5 г/м3 оксида кадмия, или 30 секунд при концентрации 5 г/м3 является смертельным. Кадмий является канцерогеном.
В качестве первой помощи при остром кадмиевом отравлении рекомендуется свежий воздух, полный покой, предотвращение охлаждения. При раздражении дыхательных путей — тёплое молоко с содой, ингаляции 2%-ным раствором NaHCO3. При упорном кашле — кодеин, дионин, горчичники на грудную клетку, необходима врачебная помощь. Противоядием при отравлении, вызванном приёмом внутрь кадмиевых солей, служит альбумин с карбонатом натрия.
- Острая токсичность
Пары кадмия, все его соединения токсичны, что связано, в частности, с его способностью связывать серосодержащие ферменты и аминокислоты.
Симптомы острого отравления кадмием — рвота и судороги.
- Хроническая токсичность
Кадмий — кумулятивный яд (способен накапливаться в организме).
- Санитарно-экологические нормативы
В питьевой воде ПДК для кадмия 0,001 мг/дм³ (СанПиН 2.1.4.1074-01).
Механизм токсического действия
Механизм токсического действия кадмия заключается, по-видимому, в связывании карбоксильных, аминных и особенно сульфгидрильных групп белковых молекул, в результате чего угнетается активность ферментных систем. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Кадмий в норме в небольших количествах присутствуют в организме здорового человека. Кадмий легко накапливается в быстроразмножающихся клетках (например, в опухолевых или половых). Он связывается с цитоплазматическим и ядерным материалом клеток и повреждает их. Он изменяет активность многих гормонов и ферментов. Это обусловлено его способностью связывать сульфгидрильные (-SH) группы.

Изотопы
Из восьми природных изотопов кадмия шесть стабильны, для двух изотопов обнаружена слабая радиоактивность. Это 113Cd (изотопная распространённость 12,22 %, бета-распад с периодом полураспада 7,7⋅1015 лет) и 116Cd (изотопная распространённость 7,49 %, двойной бета-распад с периодом полураспада 3,0⋅1019 лет).
| Соединения кадмия |
|---|
|
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Электрохимический ряд активности металлов |
|---|
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
| Группа | 12 | Температура плавления | 321,069 ° С, 609,924 ° F, 594,219 К |
| Период | 5 | Точка кипения | 767 ° С, 1413 ° F, 1040 К |
| Блокировать | d | Плотность (г см -3 ) | 8,69 |
| Атомный номер | 48 | Относительная атомная масса | 112,414 |
| Состояние при 20 ° C | Твердый | Ключевые изотопы | 114 кд |
| Электронная конфигурация | [Kr] 4д 1 0 5с 2 | Количество CAS | 7440-43-9 |
Использование и свойства элемента Кадмий
Объяснение изображения
Кадмий естественным образом встречается в земной коре. Изображение включает алхимический символ, когда-то использовавшийся для обозначения «земных» элементов на фоне проекции Земли.
Внешность
Кадмий — это серебристый металл с голубоватым оттенком на поверхности.
Использует
Кадмий — это яд, который, как известно, вызывает врожденные дефекты и рак. В результате есть шаги по ограничению его использования.80% производимого в настоящее время кадмия используется в никель-кадмиевых аккумуляторных батареях. Однако они постепенно выводятся из эксплуатации и заменяются никель-металлогидридными батареями.Кадмий часто использовали для гальваники стали и защиты ее от коррозии. Он до сих пор используется для защиты критических компонентов самолетов и нефтяных платформ.Среди других применений кадмия в прошлом — люминофоры в цветных телевизорах с электронно-лучевой трубкой, а также желтые, оранжевые и красные пигменты. Кадмий поглощает нейтроны и поэтому используется в стержнях ядерных реакторов для управления делением атомов.
Биологическая роль
Кадмий токсичен, канцероген и тератогенен (нарушает развитие эмбриона или плода). В среднем мы принимаем всего 0,05 миллиграмма в день. Но он накапливается в организме, и поэтому в среднем мы храним около 50 миллиграммов.До того, как опасность кадмия была полностью осознана, сварщики и другие металлисты рисковали заболеть. В 1966 году некоторые сварщики, работавшие на мосту на Северной дороге, заболели от вдыхания паров кадмия.
Природное изобилие
Единственный минерал, содержащий значительное количество кадмия, — это гринкит (сульфид кадмия). Он также присутствует в небольшом количестве в сфалерите. Почти весь коммерчески производимый кадмий получается как побочный продукт рафинирования цинка.
Химические свойства
| Атомный радиус, несвязанный (Å) | 2,18 | Ковалентный радиус (Å) | 1,40 |
| Сродство к электрону (кДж моль -1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | 1,69 |
| Энергия ионизационной (кДж моль -1 ) | 1- й 867,7722- й 1631,4043- й3616,274 чт -5 чт -6 чт -7 чт -8 чт- |
Состояния окисления и изотопы Кадмий
| Общие состояния окисления | 2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 106 кд | 105,906 | 1,25 | > 1,9 × 10 19 лет | ЕС, ЕС | |
| 108 кд | 107,904 | 0,89 | > 4,1 х 10 17 лет | ЕС ЕС | |
| 110 Кд | 109,903 | 12,49 | — | — | |
| 111 кд | 110,904 | 12,8 | — | — | |
| 112 кд | 111,903 | 24,13 | — | — | |
| 113 кд | 112,904 | 12,22 | 8,04 × 10 15 лет | β-β- | |
| 114 кд | 113,903 | 28,73 | > 1,3 × 10 18 лет | β-β- | |
| 116 кд | 115,905 | 7,49 | 3,8 × 10 19 лет | β-β- |
Данные о давлении и температуре
| Удельная теплоемкость (Дж кг −1 K −1 ) | 231 | Модуль Юнга (ГПа) | 49,9 | |||||||
| Модуль сдвига (ГПа) | 19,2 | Объемный модуль (ГПа) | 41,6 | |||||||
| Давление газа | ||||||||||
| Температура (K) | 400600800100012001400160018002000 г.22002400 | |||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 г. | 2200 | 2400 |
| Давление (Па) | 0,0002818,2——— | |||||||||
| 0,00028 | 18,2 | — | — | — | — | — | — | — | — | — |
Этот метал не особо «раскручен». Кадмий полезен промышленности, но опасен для человека.

Содержание
- Что представляет собой
- История открытия
- Нахождение в природе
- Технология получения
- Физико-химические характеристики
- Где используется
- Промышленность
- Другие отрасли
- Ограничения
- Биологическое воздействие
- Токсичность
- Нормы
- Опасность отравления
Что представляет собой
Кадмий – элемент таблицы Менделеева №48:
- Мягкое, ковкое вещество серовато-серебристого цвета с голубоватостью.
- Относится к металлам тяжелой группы.
- Структура кристаллической решетки – гексагональ.
- Состоит из восьми изотопов, два из которых слаборадиоактивны, остальные стабильны.
Международное, научное обозначение и формула – Cadmium (Cd).
История открытия
«Отцами» элемента в историю науки вошли немецкие аптекари и химик Фридрих Штромейер.
В 1817 году провизоры, исследуя оксид цинка, усмотрели в его составе характеристики, присущие мышьяку. Штромейер провел по их просьбе цикл реакций. Конечным продуктом оказался не мышьяк, а новый серебристый металл.
Его окрестили кадмием – по названию местной цинкосодержащей руды.
Кадм – персонаж древнегреческой мифологии, легендарный основатель и царь Фив.
Нахождение в природе
Кадмиевых месторождений на планете не найдено: редкий элемент рассеян в толще земной коры, воде, воздухе.
Тонна земной коры содержит 130 мг кадмия, литр морской воды – 0,00011 мг.
Вторая форма нахождения металла в природе – шесть собственных минералов.
Чаще кадмий сопровождает другие минералы (полсотни). Так его и добывают – попутно с другими рудами. Особенно богаты цинковые (здесь кадмий есть всегда), свинцовые, медные залежи.
Технология получения
- Кадмий добывают из цинковых руд. Металл извлекают из побочных продуктов. Здесь он аккумулируется во время переработки руды.
- Второй способ получения – из медно-свинцовой пыли. На пыль воздействуют серной кислотой, затем водой выщелачивают сульфид кадмия. Чистый металл получают электролизом либо восстанавливая цинком.

Физико-химические характеристики
Кадмий как металл проявляет типичные характеристики: без проблем куется, тянется, полируется.
По твердости располагается между оловом и цинком. Режется ножом.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ка́дмий / Cadmium (Cd), 48 |
| Атомная масса (молярная масса) | 112,411(8) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 |
| Радиус атома | 154 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+2e) 97 пм |
| Электроотрицательность | 1,69 (шкала Полинга) |
| Электродный потенциал | −0,403 |
| Степени окисления | -2; +1; +2 |
| Энергия ионизации (первый электрон) | 867,2 (8,99) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,65 г/см³ |
| Температура плавления | 594,1 K (321 °C) |
| Температура кипения | 1038 K (764,85 °C) |
| Уд. теплота плавления | 6,11 кДж/моль |
| Уд. теплота испарения | 59,1 кДж/моль |
| Молярная теплоёмкость | 26,0 Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,979 c=5,618 Å |
| Отношение c/a | 1,886 |
| Температура Дебая | 209 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 96,9 Вт/(м·К) |
| Номер CAS | 7440-43-9 |
При нагреве свыше 80°C легко становится порошком.
При изгибе палочки из чистого кадмия слышно потрескивание. По этому признаку его легко отличить от других металлов (кроме олова).
Химические свойства также стандартны:
- В сухом микроклимате горение, взаимодействие с галогенами, серой возможно только при высоких температурах.
- Во влажной атмосфере покрывается пленкой.
- С растворенными щелочами не взаимодействует.

По физическим, химическим свойствам сходен с цинком и ртутью. Главный недостаток кадмия – токсичность.
Где используется
Токсичность ограничивает, но не обнуляет достоинства металла. Его используют во всех сегментах, кроме пищепрома.
Промышленность
Здесь нашлось применение металлу как самостоятельной единице и компонента сплавов:
- Антикоррозийные покрытия. Кадмирование обеспечивает самое прочное, цепкое соединение с основой. Применяется в экстремальных условиях: морская вода, тропики, щелочная среда.
- Производство батарей, аккумуляторов для ракет.
- Легирующая добавка к сплавам. Сплавы с кадмием пластичны, стойки к износу. Из них делают провода для линий электропередач, припои, подшипники для начинки морских и воздушных лайнеров. Сплавы используются при пайке стекла, металла, в огнетушителях.
- Компонент полупроводников, пленок солнечных батарей.
Соли металла становятся пигментами (желтый цвет). Но это приветствуется не всегда.
Coca-Cola изъяла с рынка США более 20 тысяч стаканов со своим логотипом. Причина – наличие кадмия в составе краски.
Важнейшая сфера применения – атомный комплекс:
- Кадмиевые стержни регулируют работу реактора.
- Из него состоят экраны, отсекающие нейтронное излучение.
В лабораториях металл используется как реактив.

Другие отрасли
Хорошая теплопроводность в условиях запредельно низких температур сделала металл незаменимым в криотехнике.
Ювелиры добавляют кадмий к золоту, чтобы получить зеленоватые оттенки.
Полезное свойство вещества аккумулироваться раковыми клетками используется в противоопухолевой терапии.
Ежегодное глобальное производство металла исчисляется 20 тысячами тонн.
Цена тонны кадмия на мировых рынках – $2,8-2,9 тыс.
Ограничения
Согласно Техническому регламенту Евразийского экономического союза и директиве Евросоюза, в изделиях сегмента электротехники и радиоэлектроники должно быть не более 0,01 % массовой доли кадмия.
Биологическое воздействие
Микродозы кадмия есть в биологических организмах: вещество содействует метаболизму.
Токсичность
Однако металл, его растворимые соединения токсичны:
- Наиболее ядовиты пары, запыленный, задымленный воздух.
- Вещество накапливается человеческим организмом, растениями, грибами.
- Тяжелый металл, его соединения провоцируют онкологию, угнетают работу гормональной, кровеносной, центральной нервной систем. Разрушаются кости.
По действию на организм напоминает ртуть, цинк, но токсичность вдвое-втрое превышает цинковую.
Кадмий классифицирован как вещество 2-го класса опасности. 7,50 г металла в кубометре воздуха убивают за двадцать секунд.
Нормы
Наличие металла в воде, продуктах питания регулируется санитарными стандартами РФ (мкг/кг):
- говядина, свинина – 16;
- хлеб – 30;
- рис – 60;
- рыба – 200;
- какао – 500;
- субпродукты – 1000.
Литр питьевой воды не может содержать более 0,001 мг кадмия.
Опасность отравления
Кадмиевая интоксикация актуальна для жителей мегаполисов и работников металлургических предприятий.
Симптомы отравления: расстройство ЖКТ (диарея, рвота), гастроэнтерит, почечные боли. Далее следует нервное возбуждение, судороги, обморок, паралич, остановка дыхания, смерть.
Отравление требует неотложной медицинской помощи.
Профессиональное заболевание работников металлургических предприятий – хроническое отравление. Опознается по резкому истощению, ожирению печени, сердечной мышцы, воспалению почек.
При работе обязательно использование защитных средств.
Содержание
- История открытия
- Происхождение названия
- Нахождение в природе
- Нахождение в продуктах
- Получение
- Физические свойства
- Химические свойства
- Сплавы
- Защитные покрытия
- Химические источники тока
- Пигменты
- Цена
- Другие сферы применения
- Ограничение применения
- Физиологическое действие
- Механизм токсического действия
- Изотопы
Кадмий — элемент двенадцатой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 48. Обозначается символом Cd. Простое вещество кадмий при нормальных условиях — мягкий ковкий тягучий переходный металл серебристо-белого цвета. Устойчив в сухом воздухе, во влажном на его поверхности образуется плёнка оксида, препятствующая дальнейшему окислению металла. Кадмий и многие его соединения ядовиты.
| Кадмий | |||
|---|---|---|---|
| ← Серебро | Индий → | |||
| |||
| Внешний вид простого вещества | |||
| Мягкий ковкий серебристо-серый металл | |||
 Элементарный кадмий | |||
| Свойства атома | |||
| Название, символ, номер | Ка́дмий / Cadmium (Cd), 48 | ||
| Атомная масса (молярная масса) | 112,411(8) а. е. м. (г/моль) | ||
| Электронная конфигурация | [Kr] 4d10 5s2 | ||
| Радиус атома | 154 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 148 пм | ||
| Радиус иона | (+2e) 97 пм | ||
| Электроотрицательность | 1,69 (шкала Полинга) | ||
| Электродный потенциал | −0,403 | ||
| Степени окисления | 2 | ||
| Энергия ионизации (первый электрон) | 867,2 (8,99) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 8,65 г/см³ | ||
| Температура плавления | 594,1 K (321 °C) | ||
| Температура кипения | 1038 K (764,85 °C) | ||
| Уд. теплота плавления | 6,11 кДж/моль | ||
| Уд. теплота испарения | 59,1 кДж/моль | ||
| Молярная теплоёмкость | 26,0 Дж/(K·моль) | ||
| Молярный объём | 13,1 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | гексагональная | ||
| Параметры решётки | a=2,979 c=5,618 Å | ||
| Отношение c/a | 1,886 | ||
| Температура Дебая | 209 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 96,9 Вт/(м·К) | ||
| Номер CAS | 7440-43-9 |
История открытия
Открыт немецким профессором Ф. Штромейером в 1817 году. Провизоры Магдебурга при изучении оксида цинка ZnO заподозрили в нём примесь мышьяка. Штромейер выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий.
Происхождение названия
Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии.
Нахождение в природе
Среднее содержание кадмия в земной коре — 130 мг/т, в морской воде — 0,11 мкг/л. Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Известно всего лишь 6 кадмиевых минералов. Весьма редкими минералами кадмия являются гринокит CdS (77,8 % Cd), хоулиит (то же), отавит CdCO3, монтепонит CdO (87,5 % Cd), кадмоселит CdSe (47 % Cd), ксантохроит CdS(H2O)х (77,2 % Cd). Основная масса кадмия рассеяна в большом числе минералов (более 50), преимущественно в сульфидах цинка, свинца, меди, железа, марганца и ртути. Максимальная концентрация отмечена в минералах цинка и, прежде всего, в сфалерите (до 5 %). В большинстве же случаев содержание кадмия в сфалерите не превышает 0,4—0,6 %. В других сульфидах, например, в станине содержание кадмия — 0,003—0,2 %, в галените — 0,005—0,02 %, в халькопирите — 0,006—0,12 %; из этих сульфидов кадмий обычно не извлекается.
Кадмий не образует самостоятельных месторождений, а входит в состав руд месторождений других металлов. Относительно высоко содержание кадмия в рудах среднетемпературных свинцово-цинковых и частично медно-колчеданных месторождений.
Почва содержит 0,06 мг/кг, глина — 0,3 мг/кг.
Нахождение в продуктах
ПДК кадмия в воде согласно СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения» — 1 мкг/л
Ископаемый уголь, древесный уголь, ПЭТ тара, древесные гранулы пеллеты (до 0,5 мг/кг), рыба (0,2 мг/кг), какао-порошок (0,5 мг/кг), почки животных (1 мг/кг), рис (0,06 мг/кг), сигарета (0,002 мг/кг), пшеничный хлеб (0,03 мг/кг), маргарин (0,042 мг/кг), говядина/свинина (0,016 мг/кг), креветки (1,2 мг/кг)
Получение
Единственный минерал, который представляет интерес в получении кадмия — гринокит, так называемая «кадмиевая обманка». Его добывают вместе со сфалеритом при разработке цинковых руд. В ходе переработки кадмий концентрируется в побочных продуктах процесса, откуда его потом извлекают. В настоящее время производится около 20000 тонн кадмия в год.
Физические свойства
Кадмий — серебристо-белый мягкий металл с гексагональной решёткой. Температура плавления — 321 °C, температура кипения — 770 °C. Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллы металла (так же трещит и пруток олова); любые примеси в металле уничтожают этот эффект. Кадмий твёрже олова, но мягче цинка — его можно резать ножом. При нагревании выше 80 °C кадмий теряет упругость до такой степени, что его можно истолочь в порошок.
Химические свойства
Кадмий расположен в одной группе периодической системы с цинком и ртутью, занимая промежуточное место между ними, поэтому некоторые химические свойства этих элементов сходны. На воздухе кадмий устойчив и не утрачивает металлического блеска. Вступает в реакцию с кислородом лишь при нагревании до 350 °C с образованием оксида кадмия . Сульфиды и оксиды этих элементов практически нерастворимы в воде. С углеродом кадмий не взаимодействует и карбидов не образует. Вступает в реакции с кислотами-неокислителями выделяя водород:
Сплавы
Кадмий используется как компонент твёрдых припоев (сплавов на основе серебра, меди, цинка) для снижения их температуры плавления. Около 10 % производимого кадмия — компонент ювелирных и легкоплавких сплавов. Сплав кадмия с золотом имеет зеленоватый цвет.
Защитные покрытия
40 % производимого кадмия используется для нанесения антикоррозионных покрытий на металлы. Кадмирование стальных деталей даёт большую устойчивость против коррозии, особенно в морской воде.
Кадмирование — это электролитическая процедура нанесения кадмиевых покрытий на поверхность металлоизделий. Кадмием покрывают высокоуглеродистые, инструментальные и нержавеющие стали, а кадмирование хлористо-аммонийное наносят на высокопрочные стали.
Химические источники тока
Около 20 % кадмия идёт на изготовление кадмиевых электродов, применяемых в аккумуляторах (никель-кадмиевых и серебряно-кадмиевых), нормальных элементах Вестона, в резервных батареях (свинцово-кадмиевый элемент, ртутно-кадмиевый элемент) и др.
Пигменты
Около 20 % кадмия используется для производства неорганических красящих веществ (сульфиды и селениды, смешанные соли, например, сульфид кадмия — кадмий лимонный).
Цена
Цена на кадмий в августе 2011 года составила примерно $3 за 1 кг.
Другие сферы применения
- Сульфид кадмия применяется для производства плёночных солнечных батарей с КПД около 10—16 %, а также как очень хороший термоэлектрический материал.
- Кадмий используется как компонент полупроводниковых материалов и люминофоров.
- Кадмий очень хорошо захватывает тепловые нейтроны (среднее сечение радиационного захвата тепловых нейтронов изотопом 114Cd составляет 20600 барн). Поэтому кадмий служит для изготовления регулирующих стержней для атомных реакторов и в качестве защиты от нейтронов. Иногда эти свойства используются в экспериментальных моделях противоопухолевой терапии (нейтрон-захватная терапия).
- Фтороборат кадмия — важный флюс, применяемый для пайки алюминия и других металлов.
- Теплопроводность кадмия вблизи абсолютного нуля — наивысшая среди всех металлов, поэтому кадмий иногда применяется для криогенной техники.
- Экранирование гамма-спектрометров от естественного радиационного фона: «свинцовый домик», в котором располагается спектрометрический датчик, выстилается изнутри медным и кадмиевым слоями для экранирования паразитного излучения свинца, искажающего гамма-спектр измеряемого вещества.
Ограничение применения
В 2016 году принят Технический регламент Евразийского экономического союза «Об ограничении применения опасных веществ в изделиях электротехники и радиоэлектроники» (ТР ЕАЭС 037/2016), по которому содержание кадмия в изделиях электротехники и радиоэлектроники не должно превышать 0,01 % по весу однородного материала (Приложение N 2). В Европейском союзе действует аналогичная директива RoHS, существенно ограничивающая использование кадмия.
Физиологическое действие
![]()
Кадмий и многие его соединения ядовиты (в больших концентрациях). Особенно опасным случаем является вдыхание паров его оксида (CdO). Вдыхание в течение 1 минуты воздуха с содержанием 2,5 г/м3 оксида кадмия, или 30 секунд при концентрации 5 г/м3 является смертельным. Кадмий является канцерогеном.
В качестве первой помощи при остром кадмиевом отравлении рекомендуется свежий воздух, полный покой, предотвращение охлаждения. При раздражении дыхательных путей — тёплое молоко с содой, ингаляции 2%-ным раствором NaHCO3. При упорном кашле — кодеин, дионин, горчичники на грудную клетку, необходима врачебная помощь. Противоядием при отравлении, вызванном приёмом внутрь кадмиевых солей, служит альбумин с карбонатом натрия.
- Острая токсичность
Пары кадмия, многие его соединения токсичны, что связано, в частности, с его способностью связывать серосодержащие ферменты и аминокислоты.
Симптомы острого отравления кадмием — рвота и судороги.
- Хроническая токсичность
Кадмий — кумулятивный яд (способен накапливаться в организме).
- Санитарно-экологические нормативы
В питьевой воде ПДК для кадмия 0,001 мг/дм³ (СанПиН 2.1.4.1074-01).
Механизм токсического действия
Механизм токсического действия кадмия заключается, по-видимому, в связывании карбоксильных, аминных и особенно сульфгидрильных групп белковых молекул, в результате чего угнетается активность ферментных систем. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Кадмий в норме в небольших количествах присутствует в организме здорового человека. Кадмий легко накапливается в быстроразмножающихся клетках (например, в опухолевых или половых). Он связывается с цитоплазматическим и ядерным материалом клеток и повреждает их. Он изменяет активность многих гормонов и ферментов. Это обусловлено его способностью связывать сульфгидрильные (-SH) группы.
Изотопы
Из восьми природных изотопов кадмия шесть стабильны, для двух изотопов обнаружена слабая радиоактивность. Это 113Cd (изотопная распространённость 12,22 %, бета-распад с периодом полураспада 7,7⋅1015 лет) и 116Cd (изотопная распространённость 7,49 %, двойной бета-распад с периодом полураспада 3,0⋅1019 лет).




