Not to be confused with Indium.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (i-RID-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ir) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d7 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 2719 K (2446 °C, 4435 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 4403 K (4130 °C, 7466 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 22.56 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 19 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 41.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 564 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.10 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8, +9[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 136 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 141±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of iridium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4825 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 6.4 µm/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 147 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 47.1 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +25.6 × 10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 528 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 210 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 320 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1760–2200 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 1670 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-88-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of iridium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Iridium is a chemical element with the symbol Ir and atomic number 77. A very hard, brittle, silvery-white transition metal of the platinum group, it is considered the second-densest naturally occurring metal (after osmium) with a density of 22.56 g/cm3 (0.815 lb/cu in) as defined by experimental X-ray crystallography.[a] It is one of the most corrosion-resistant metals, even at temperatures as high as 2,000 °C (3,630 °F). However, corrosion-resistance is not quantifiable in absolute terms; although only certain molten salts and halogens are corrosive to solid iridium, finely divided iridium dust is much more reactive and can be flammable, whereas gold dust is not flammable but can be attacked by substances that iridium resists, such as aqua regia.
Iridium was discovered in 1803 among insoluble impurities in natural platinum. Smithson Tennant, the primary discoverer, named it after the Greek goddess Iris, personification of the rainbow, because of the striking and diverse colors of its salts. Iridium is one of the rarest elements in Earth’s crust, with annual production and consumption of only 3 tonnes (6.6 thousand pounds). 191Ir and 193Ir are the only two naturally occurring isotopes of iridium, as well as the only stable isotopes; the latter is the more abundant.
The dominant uses of iridium are the metal itself and its alloys, as in high-performance spark plugs, crucibles for recrystallization of semiconductors at high temperatures, and electrodes for the production of chlorine in the chloralkali process. Important compounds of iridium are chlorides and iodides in industrial catalysis. Iridium is a component of some OLEDs.
Iridium is found in meteorites in much higher abundance than in the Earth’s crust.[7] For this reason, the unusually high abundance of iridium in the clay layer at the Cretaceous–Paleogene boundary gave rise to the Alvarez hypothesis that the impact of a massive extraterrestrial object caused the extinction of dinosaurs and many other species 66 million years ago, now known to be produced by the impact that formed the Chicxulub crater. Similarly, an iridium anomaly in core samples from the Pacific Ocean suggested the Eltanin impact of about 2.5 million years ago.[8]
It is thought that the total amount of iridium in the planet Earth is much higher than that observed in crustal rocks, but as with other platinum-group metals, the high density and tendency of iridium to bond with iron caused most iridium to descend below the crust when the planet was young and still molten.
Characteristics[edit]
Physical properties[edit]

A member of the platinum group metals, iridium is white, resembling platinum, but with a slight yellowish cast. Because of its hardness, brittleness, and very high melting point, solid iridium is difficult to machine, form, or work; thus powder metallurgy is commonly employed instead.[9] It is the only metal to maintain good mechanical properties in air at temperatures above 1,600 °C (2,910 °F).[10] It has the 10th highest boiling point among all elements and becomes a superconductor at temperatures below 0.14 K (−273.010 °C; −459.418 °F).[11]
Iridium’s modulus of elasticity is the second-highest among the metals, being surpassed only by osmium.[10] This, together with a high shear modulus and a very low figure for Poisson’s ratio (the relationship of longitudinal to lateral strain), indicate the high degree of stiffness and resistance to deformation that have rendered its fabrication into useful components a matter of great difficulty. Despite these limitations and iridium’s high cost, a number of applications have developed where mechanical strength is an essential factor in some of the extremely severe conditions encountered in modern technology.[10]
The measured density of iridium is only slightly lower (by about 0.12%) than that of osmium, the densest metal known.[12][13] Some ambiguity occurred regarding which of the two elements was denser, due to the small size of the difference in density and difficulties in measuring it accurately,[14] but, with increased accuracy in factors used for calculating density, X-ray crystallographic data yielded densities of 22.56 g/cm3 (0.815 lb/cu in) for iridium and 22.59 g/cm3 (0.816 lb/cu in) for osmium.[15]
Iridium is extremely brittle, to the point of being hard to weld because the heat-affected zone cracks, but it can be made more ductile by addition of small quantities of titanium and zirconium (0.2% of each apparently works well).[16]—
The Vickers hardness of pure platinum is 56 HV, whereas platinum with 50% of iridium can reach over 500 HV.[17][18]
Chemical properties[edit]
Iridium is the most corrosion-resistant metal known:[19] it is not attacked by acids, including aqua regia. In the presence of oxygen, it reacts with cyanide salts.[20] Traditional oxidants also react, including the halogens and oxygen[21] at higher temperatures.[22] Iridium also reacts directly with sulfur at atmospheric pressure to yield iridium disulfide.[23]
Isotopes[edit]
Iridium has two naturally occurring, stable isotopes, 191Ir and 193Ir, with natural abundances of 37.3% and 62.7%, respectively.[24] At least 37 radioisotopes have also been synthesized, ranging in mass number from 164 to 202. 192Ir, which falls between the two stable isotopes, is the most stable radioisotope, with a half-life of 73.827 days, and finds application in brachytherapy[25] and in industrial radiography, particularly for nondestructive testing of welds in steel in the oil and gas industries; iridium-192 sources have been involved in a number of radiological accidents. Three other isotopes have half-lives of at least a day—188Ir, 189Ir, and 190Ir.[24] Isotopes with masses below 191 decay by some combination of β+ decay, α decay, and (rare) proton emission, with the exception of 189Ir, which decays by electron capture. Synthetic isotopes heavier than 191 decay by β− decay, although 192Ir also has a minor electron capture decay path.[24] All known isotopes of iridium were discovered between 1934 and 2008, with the most recent discoveries being 200–202Ir.[26]
At least 32 metastable isomers have been characterized, ranging in mass number from 164 to 197. The most stable of these is 192m2Ir, which decays by isomeric transition with a half-life of 241 years,[24] making it more stable than any of iridium’s synthetic isotopes in their ground states. The least stable isomer is 190m3Ir with a half-life of only 2 μs.[24] The isotope 191Ir was the first one of any element to be shown to present a Mössbauer effect. This renders it useful for Mössbauer spectroscopy for research in physics, chemistry, biochemistry, metallurgy, and mineralogy.[27]
Chemistry[edit]
| Oxidation states[b] | |
|---|---|
| −3 | [Ir(CO) 3]3− |
| −1 | [Ir(CO)3(PPh3)]1− |
| 0 | Ir4(CO)12 |
| +1 | [IrCl(CO)(PPh3)2] |
| +2 | Ir(C5H5)2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir4F20 |
| +6 | IrF 6 |
| +7 | [Ir(O2)O2]+ |
| +8 | IrO4 |
| +9 | [IrO4]+[2] |
Oxidation states[edit]
Iridium forms compounds in oxidation states between −3 and +9, but the most common oxidation states are +1, +3, and +4.[9] Well-characterized compounds containing iridium in the +6 oxidation state include IrF6 and the oxides Sr2MgIrO6 and Sr2CaIrO6.[9][28] iridium(VIII) oxide (IrO4) was generated under matrix isolation conditions at 6 K in argon.[29] The highest oxidation state (+9), which is also the highest recorded for any element, is found in gaseous [IrO4]+.[2]
Binary compounds[edit]
Iridium does not form binary hydrides. Only one binary oxide is well-characterized: iridium dioxide, IrO
2. It is a blue black solid that adopts the fluorite structure.[9] A sesquioxide, Ir
2O
3, has been described as a blue-black powder, which is oxidized to IrO
2 by HNO
3.[21] The corresponding disulfides, diselenides, sesquisulfides, and sesquiselenides are known, as well as IrS
3.[9]
Binary trihalides, IrX
3, are known for all of the halogens.[9] For oxidation states +4 and above, only the tetrafluoride, pentafluoride and hexafluoride are known.[9] Iridium hexafluoride, IrF
6, is a volatile yellow solid, composed of octahedral molecules. It decomposes in water and is reduced to IrF
4.[9] Iridium pentafluoride is also a strong oxidant, but it is a tetramer, Ir
4F
20, formed by four corner-sharing octahedra.[9]
Complexes[edit]

The coordination complexes of iridium are extensive.
Iridium in its complexes is always low-spin). Ir(III) and Ir(IV) generally form octahedral complexes.[9] Polyhydride complexes are known for the +5 and +3 oxidation states.[30] One example is IrH5(PiPr3)2.[31] The ternary hydride Mg
6Ir
2H
11 is believed to contain both the IrH4−
5 and the 18-electron IrH5−
4 anion.[32]
Iridium also oxyanions with oxidation states +4 and +5. K
2IrO
3 and KIrO
3 can be prepared from the reaction of potassium oxide or potassium superoxide with iridium at high temperatures. Such solids are not soluble in conventional solvents.[33]
As for many elements, the chlorides are key complexes. Hexachloroiridic (IV) acid, H
2IrCl
6, and its ammonium salt are the most common iridium compounds from an industrial and preparative perspectives.[34] They are intermediates in the purification of iridium and used as precursors for most other iridium compounds, as well as in the preparation of anode coatings. The IrCl2−
6 ion has an intense dark brown color, and can be readily reduced to the lighter-colored IrCl3−
6 and vice versa.[34] Iridium trichloride, IrCl
3, which can be obtained in anhydrous form from direct oxidation of iridium powder by chlorine at 650 °C,[34] or in hydrated form by dissolving Ir
2O
3 in hydrochloric acid, is often used as a starting material for the synthesis of other Ir(III) compounds.[9] Another compound used as a starting material is ammonium hexachloroiridate(III), (NH
4)
3IrCl
6.
In the presence of air, iridium metal dissolves in molten alkali-metal cyanides to produce the Ir(CN)3−
6 (hexacyanoiridate) ion.
Organoiridium chemistry[edit]

Organoiridium compounds contain iridium–carbon bonds. Early studies identified the very stable tetrairidium dodecacarbonyl, Ir
4(CO)
12.[9] In this compound, each of the iridium atoms is bonded to the other three, forming a tetrahedral cluster. The discovery of Vaska’s complex (IrCl(CO)[P(C
6H
5)
3]
2) opened the door for oxidative addition reactions, a process fundamental to useful reactions. For example, Crabtree’s catalyst, a homogeneous catalyst for hydrogenation reactions.[35][36]

Iridium complexes played a pivotal role in the development of Carbon–hydrogen bond activation (C–H activation), which promises to allow functionalization of hydrocarbons, which are traditionally regarded as unreactive.[39]
History[edit]
Platinum group[edit]

The Greek goddess Iris, after whom iridium was named.
The discovery of iridium is intertwined with that of platinum and the other metals of the platinum group.
The first European reference to platinum appears in 1557 in the writings of the Italian humanist Julius Caesar Scaliger as a description of an unknown noble metal found between Darién and Mexico, «which no fire nor any Spanish artifice has yet been able to liquefy».[40] From their first encounters with platinum, the Spanish generally saw the metal as a kind of impurity in gold, and it was treated as such. It was often simply thrown away, and there was an official decree forbidding the adulteration of gold with platinum impurities.[41]


Antonio de Ulloa is credited in European history with the discovery of platinum.
In 1735, Antonio de Ulloa and Jorge Juan y Santacilia saw Native Americans mining platinum while the Spaniards were travelling through Colombia and Peru for eight years. Ulloa and Juan found mines with the whitish metal nuggets and took them home to Spain. Antonio de Ulloa returned to Spain and established the first mineralogy lab in Spain and was the first to systematically study platinum, which was in 1748. His historical account of the expedition included a description of platinum as being neither separable nor calcinable. Ulloa also anticipated the discovery of platinum mines. After publishing the report in 1748, Ulloa did not continue to investigate the new metal. In 1758, he was sent to superintend mercury mining operations in Huancavelica.[40]
In 1741, Charles Wood,[42] a British metallurgist, found various samples of Colombian platinum in Jamaica, which he sent to William Brownrigg for further investigation.
In 1750, after studying the platinum sent to him by Wood, Brownrigg presented a detailed account of the metal to the Royal Society, stating that he had seen no mention of it in any previous accounts of known minerals.[43] Brownrigg also made note of platinum’s extremely high melting point and refractoriness toward borax.[clarification needed] Other chemists across Europe soon began studying platinum, including Andreas Sigismund Marggraf,[44] Torbern Bergman, Jöns Jakob Berzelius, William Lewis, and Pierre Macquer. In 1752, Henrik Scheffer published a detailed scientific description of the metal, which he referred to as «white gold», including an account of how he succeeded in fusing platinum ore with the aid of arsenic. Scheffer described platinum as being less pliable than gold, but with similar resistance to corrosion.[40]
Discovery[edit]
Chemists who studied platinum dissolved it in aqua regia (a mixture of hydrochloric and nitric acids) to create soluble salts. They always observed a small amount of a dark, insoluble residue.[10] Joseph Louis Proust thought that the residue was graphite.[10] The French chemists Victor Collet-Descotils, Antoine François, comte de Fourcroy, and Louis Nicolas Vauquelin also observed the black residue in 1803, but did not obtain enough for further experiments.[10]
In 1803, British scientist Smithson Tennant (1761–1815) analyzed the insoluble residue and concluded that it must contain a new metal. Vauquelin treated the powder alternately with alkali and acids[19] and obtained a volatile new oxide, which he believed to be of this new metal—which he named ptene, from the Greek word πτηνός ptēnós, «winged».[45][46] Tennant, who had the advantage of a much greater amount of residue, continued his research and identified the two previously undiscovered elements in the black residue, iridium and osmium.[10][19] He obtained dark red crystals (probably of Na
2[IrCl
6]·nH
2O) by a sequence of reactions with sodium hydroxide and hydrochloric acid.[46] He named iridium after Iris (Ἶρις), the Greek winged goddess of the rainbow and the messenger of the Olympian gods, because many of the salts he obtained were strongly colored.[c][47] Discovery of the new elements was documented in a letter to the Royal Society on June 21, 1804.[10][48]
Metalworking and applications[edit]
British scientist John George Children was the first to melt a sample of iridium in 1813 with the aid of «the greatest galvanic battery that has ever been constructed» (at that time).[10] The first to obtain high-purity iridium was Robert Hare in 1842. He found it had a density of around 21.8 g/cm3 (0.79 lb/cu in) and noted the metal is nearly immalleable and very hard. The first melting in appreciable quantity was done by Henri Sainte-Claire Deville and Jules Henri Debray in 1860. They required burning more than 300 litres (79 US gal) of pure O
2 and H
2 gas for each 1 kilogram (2.2 lb) of iridium.[10]
These extreme difficulties in melting the metal limited the possibilities for handling iridium. John Isaac Hawkins was looking to obtain a fine and hard point for fountain pen nibs, and in 1834 managed to create an iridium-pointed gold pen. In 1880, John Holland and William Lofland Dudley were able to melt iridium by adding phosphorus and patented the process in the United States; British company Johnson Matthey later stated they had been using a similar process since 1837 and had already presented fused iridium at a number of World Fairs.[10] The first use of an alloy of iridium with ruthenium in thermocouples was made by Otto Feussner in 1933. These allowed for the measurement of high temperatures in air up to 2,000 °C (3,630 °F).[10]
In Munich, Germany in 1957 Rudolf Mössbauer, in what has been called one of the «landmark experiments in twentieth-century physics»,[49] discovered the resonant and recoil-free emission and absorption of gamma rays by atoms in a solid metal sample containing only 191Ir.[50] This phenomenon, known as the Mössbauer effect resulted in the awarding of the Nobel Prize in Physics in 1961, at the age 32, just three years after he published his discovery.[51]
Occurrence[edit]
Along with all elements having atomic weights higher than that of iron, iridium is only naturally formed by the r-process (rapid neutron capture) in supernovae and neutron star mergers.[52][53]
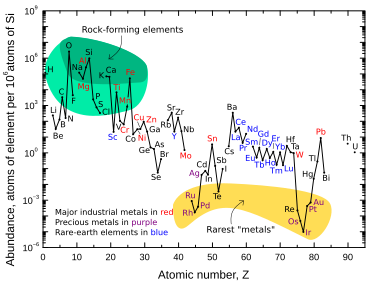
Iridium is one of the least abundant elements in Earth’s crust.

Iridium is one of the nine least abundant stable elements in Earth’s crust, having an average mass fraction of 0.001 ppm in crustal rock; platinum is 10 times more abundant, gold is 40 times more abundant, and silver and mercury are 80 times more abundant.[9] Tellurium is about as abundant as iridium.[9] In contrast to its low abundance in crustal rock, iridium is relatively common in meteorites, with concentrations of 0.5 ppm or more.[55] The overall concentration of iridium on Earth is thought to be much higher than what is observed in crustal rocks, but because of the density and siderophilic («iron-loving») character of iridium, it descended below the crust and into Earth’s core when the planet was still molten.[34]
Iridium is found in nature as an uncombined element or in natural alloys; especially the iridium–osmium alloys, osmiridium (osmium-rich), and iridosmium (iridium-rich).[19] In the nickel and copper deposits, the platinum group metals occur as sulfides (i.e. (Pt,Pd)S), tellurides (i.e. PtBiTe), antimonides (PdSb), and arsenides (i.e. PtAs
2). In all of these compounds, platinum is exchanged by a small amount of iridium and osmium. As with all of the platinum group metals, iridium can be found naturally in alloys with raw nickel or raw copper.[56] A number of iridium-dominant minerals, with iridium as the species-forming element, are known. They are exceedingly rare and often represent the iridium analogues of the above-given ones. The examples are irarsite and cuproiridsite, to mention some.[57][58][59] Within Earth’s crust, iridium is found at highest concentrations in three types of geologic structure: igneous deposits (crustal intrusions from below), impact craters, and deposits reworked from one of the former structures. The largest known primary reserves are in the Bushveld igneous complex in South Africa,[60] (near the largest known impact structure, the Vredefort impact structure) though the large copper–nickel deposits near Norilsk in Russia, and the Sudbury Basin (also an impact crater) in Canada are also significant sources of iridium. Smaller reserves are found in the United States.[60] Iridium is also found in secondary deposits, combined with platinum and other platinum group metals in alluvial deposits. The alluvial deposits used by pre-Columbian people in the Chocó Department of Colombia are still a source for platinum-group metals. As of 2003, world reserves have not been estimated.[19]
Marine oceanography[edit]
Iridium is found within marine organisms, sediments, and the water column. The abundance of iridium in seawater[61] and organisms[62] is relatively low, as it does not readily form chloride complexes.[62] The abundance in organisms is about 20 parts per trillion, or about five orders of magnitude less than in sedimentary rocks at the Cretaceous–Paleogene (K–T) boundary.[62] The concentration of iridium in seawater and marine sediment is sensitive to marine oxygenation, seawater temperature, and various geological and biological processes.[63]
Iridium in sediments can come from cosmic dust, volcanoes, precipitation from seawater, microbial processes, or hydrothermal vents,[63] and its abundance can be strongly indicative of the source.[64][63] It tends to associate with other ferrous metals in manganese nodules.[61] Iridium is one of the characteristic elements of extraterrestrial rocks, and, along with osmium, can be used as a tracer element for meteoritic material in sediment.[65][66] For example core samples from the Pacific Ocean with elevated iridium levels suggested the Eltanin impact of about 2.5 million years ago.[8]
Some of the mass extinctions, such as the Cretaceous extinction, can be identified by anomalously high concentrations of iridium in sediment, and these can be linked to major asteroid impacts.[67]
Cretaceous–Paleogene boundary presence[edit]

The Cretaceous–Paleogene boundary of 66 million years ago, marking the temporal border between the Cretaceous and Paleogene periods of geological time, was identified by a thin stratum of iridium-rich clay.[68] A team led by Luis Alvarez proposed in 1980 an extraterrestrial origin for this iridium, attributing it to an asteroid or comet impact.[68] Their theory, known as the Alvarez hypothesis, is now widely accepted to explain the extinction of the non-avian dinosaurs. A large buried impact crater structure with an estimated age of about 66 million years was later identified under what is now the Yucatán Peninsula (the Chicxulub crater).[69][70] Dewey M. McLean and others argue that the iridium may have been of volcanic origin instead, because Earth’s core is rich in iridium, and active volcanoes such as Piton de la Fournaise, in the island of Réunion, are still releasing iridium.[71][72]
Production[edit]
| Year | Consumption (tonnes) | Price (USD)[73] |
|---|---|---|
| 2001 | 2.6 | $415.25/ozt ($13.351/g) |
| 2002 | 2.5 | $294.62/ozt ($9.472/g) |
| 2003 | 3.3 | $93.02/ozt ($2.991/g) |
| 2004 | 3.60 | $185.33/ozt ($5.958/g) |
| 2005 | 3.86 | $169.51/ozt ($5.450/g) |
| 2006 | 4.08 | $349.45/ozt ($11.235/g) |
| 2007 | 3.70 | $444.43/ozt ($14.289/g) |
| 2008 | 3.10 | $448.34/ozt ($14.414/g) |
| 2009 | 2.52 | $420.4/ozt ($13.52/g) |
| 2010 | 10.40 | $642.15/ozt ($20.646/g) |
| 2011 | 9.36 | $1,035.87/ozt ($33.304/g) |
| 2012 | 5.54 | $1,066.23/ozt ($34.280/g) |
| 2013 | 6.16 | $826.45/ozt ($26.571/g) |
| 2014 | 6.1 | $556.19/ozt ($17.882/g) |
| 2015 | 7.81 | $544/ozt ($17.5/g) |
| 2016 | 7.71 | $586.90/ozt ($18.869/g) |
| 2017 | n.d. | $908.35/ozt ($29.204/g) |
| 2018 | n.d. | $1,293.27/ozt ($41.580/g) |
| 2019 | n.d. | $1,485.80/ozt ($47.770/g) |
| 2020 | n.d. | $1,633.51/ozt ($52.519/g) |
| 2021 | n.d. | $5,400.00/ozt ($173.614/g) |
Worldwide production of iridium is about 7,500 kilograms (16,500 lb).[74] The price is high and varying (see table). Illustrative factors that affect the price include oversupply of Ir crucibles[73][75]
and changes in LED technology.[76]
Platinum metals occur together as dilute ores. Iridium is one of the rarer platinum metals: for every 190 tonnes of platinum obtained from ores, only 7.5 tonnes of iridium is isolated.[77] To separate the metals, they must first be brought into solution. Two methods for rendering Ir-containing ores soluble are (i) fusion of the solid with sodium peroxide followed by extraction of the resulting glass in aqua regia and (ii) extraction of the solid with a mixture of chlorine with hydrochloric acid.[34][60] From soluble extracts, iridium is separated by precipitating solid ammonium hexachloroiridate ((NH
4)
2IrCl
6) or by extracting IrCl2−
6 with organic amines.[78] The first method is similar to the procedure Tennant and Wollaston used for their original separation. The second method can be planned as continuous liquid–liquid extraction and is therefore more suitable for industrial scale production. In either case, the product, an iridium chloride salt, is reduced with hydrogen, yielding the metal as a powder or sponge, which is amenable to powder metallurgy techniques.[79][80] Iridium is also obtained commercially as a by-product from nickel and copper mining and processing. During electrorefining of copper and nickel, noble metals such as silver, gold and the platinum group metals as well as selenium and tellurium settle to the bottom of the cell as anode mud, which forms the starting point for their extraction.[73]
Applications[edit]
The main areas of use of iridium are electrodes for producing chlorine and other aggressive products, OLEDs, crucibles, catalysts (e.g. acetic acid), and ignition tips for spark plugs.[77]
Ir metal and alloys[edit]
Resistance to heat and corrosion are the bases for several uses of iridium and its alloys.
Owing to its high melting point, hardness, and corrosion resistance, iridium is used to make crucibles. Such crucibles are used in the Czochralski process to produce oxide single-crystals (such as sapphires) for use in computer memory devices and in solid state lasers.[82][83] The crystals, such as gadolinium gallium garnet and yttrium gallium garnet, are grown by melting pre-sintered charges of mixed oxides under oxidizing conditions at temperatures up to 2,100 °C (3,810 °F).[10]
Certain long-life aircraft engine parts are made of an iridium alloy, and an iridium–titanium alloy is used for deep-water pipes because of its corrosion resistance.[19] Iridium is used for multi-pored spinnerets, through which a plastic polymer melt is extruded to form fibers, such as rayon.[84] Osmium–iridium is used for compass bearings and for balances.[10]
Because of their resistance to arc erosion, iridium alloys are used by some manufacturers for electrical contacts for spark plugs,[82][85] and iridium-based spark plugs are particularly used in aviation.
Catalysis[edit]
Iridium compounds are used as catalysts in the Cativa process for carbonylation of methanol to produce acetic acid.[86][87]
Iridium complexes are often active for asymmetric hydrogenation both by traditional hydrogenation.[88] and transfer hydrogenation.[89] This property is the basis of the industrial route to the chiral herbicide (S)-metolachlor. As practiced by Syngenta on the scale of 10,000 tons/year, the complex [[ [Ir(COD)Cl]2 in the presence of Josiphos ligands.[90]
Medical imaging[edit]
The radioisotope iridium-192 is one of the two most important sources of energy for use in industrial γ-radiography for non-destructive testing of metals.[91][92] Additionally, 192Ir is used as a source of gamma radiation for the treatment of cancer using brachytherapy, a form of radiotherapy where a sealed radioactive source is placed inside or next to the area requiring treatment. Specific treatments include high-dose-rate prostate brachytherapy, biliary duct brachytherapy, and intracavitary cervix brachytherapy.[19] iridium-192 is normally produced by neutron activation of isotop iridium-191 in natural-abundance iridium metal [93]
Photocatalysis and OLEDs[edit]
Iridium complexes are key components of white OLEDs. Similar complexes are used in photocatalysis.[94]
Scientific[edit]

An alloy of 90% platinum and 10% iridium was used in 1889 to construct the International Prototype Metre and kilogram mass, kept by the International Bureau of Weights and Measures near Paris.[19] The meter bar was replaced as the definition of the fundamental unit of length in 1960 by a line in the atomic spectrum of krypton,[d][95] but the kilogram prototype remained the international standard of mass until 20 May 2019, when the kilogram was redefined in terms of the Planck constant.[96]
Historical[edit]
Iridium–osmium alloys were used in fountain pen nib tips. The first major use of iridium was in 1834 in nibs mounted on gold.[10] Since 1944, the famous Parker 51 fountain pen was fitted with a nib tipped by a ruthenium and iridium alloy (with 3.8% iridium). The tip material in modern fountain pens is still conventionally called «iridium», although there is seldom any iridium in it; other metals such as ruthenium, osmium, and tungsten have taken its place.[97]
An iridium–platinum alloy was used for the touch holes or vent pieces of cannon. According to a report of the Paris Exhibition of 1867, one of the pieces being exhibited by Johnson and Matthey «has been used in a Whitworth gun for more than 3000 rounds, and scarcely shows signs of wear yet. Those who know the constant trouble and expense which are occasioned by the wearing of the vent-pieces of cannon when in active service, will appreciate this important adaptation».[98]
The pigment iridium black, which consists of very finely divided iridium, is used for painting porcelain an intense black; it was said that «all other porcelain black colors appear grey by the side of it».[99]
Precautions[edit]
|
| This section needs to be updated. Please help update this article to reflect recent events or newly available information. (January 2023) |
Iridium in bulk metallic form is not biologically important or hazardous to health due to its lack of reactivity with tissues; there are only about 20 parts per trillion of iridium in human tissue.[19] Like most metals, finely divided iridium powder can be hazardous to handle, as it is an irritant and may ignite in air.[60] By 2015 very little is known about the toxicity of iridium compounds,[100] primarily because it is used so rarely that few people come in contact with it and those who do only with very small amounts. However, soluble salts, such as the iridium halides, could be hazardous due to elements other than iridium or due to iridium itself.[25] At the same time, most iridium compounds are insoluble, which makes absorption into the body difficult.[19]
A radioisotope of iridium, 192
Ir, is dangerous, like other radioactive isotopes. The only reported injuries related to iridium concern accidental exposure to radiation from 192
Ir used in brachytherapy.[25] High-energy gamma radiation from 192
Ir can increase the risk of cancer. External exposure can cause burns, radiation poisoning, and death. Ingestion of 192Ir can burn the linings of the stomach and the intestines.[101] 192Ir, 192mIr, and 194mIr tend to deposit in the liver, and can pose health hazards from both gamma and beta radiation.[55]
Notes[edit]
- ^ At room temperature and standard atmospheric pressure, iridium has been calculated to have a density of 22.65 g/cm3 (0.818 lb/cu in), 0.04 g/cm3 (0.0014 lb/cu in) higher than osmium measured the same way.[5] Still, the experimental X-ray crystallography value is considered to be the most accurate, and as such iridium is considered to be the second densest element.[6]
- ^ Most common oxidation states of iridium are in bold. The right column lists one representative compound for each oxidation state.
- ^ Iridium literally means «of rainbows».
- ^ The definition of the meter was changed again in 1983. The meter is currently defined as the distance traveled by light in a vacuum during a time interval of 1⁄299,792,458 of a second.
References[edit]
- ^ «Standard Atomic Weights: Iridium». CIAAW. 2017.
- ^ a b c Wang, Guanjun; Zhou, Mingfei; Goettel, James T.; Schrobilgen, Gary G.; Su, Jing; Li, Jun; Schlöder, Tobias; Riedel, Sebastian (2014). «Identification of an iridium-containing compound with a formal oxidation state of IX». Nature. 514 (7523): 475–477. Bibcode:2014Natur.514..475W. doi:10.1038/nature13795. PMID 25341786. S2CID 4463905.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Helmenstine, Anne Marie (May 6, 2022). «What is the Densest Element on the Periodic Table?». Thoughtco.com. Retrieved October 9, 2022.
- ^ Arblaster, J. W. (1989). «Densities of Osmium and Iridium Recalculations Based upon a Review of the Latest Crystallographic Data». Platinum Metals Rev. 33 (1): 14–16.
- ^ Becker, Luann (2002). «Repeated Blows» (PDF). Scientific American. 286 (3): 77–83. Bibcode:2002SciAm.286c..76B. doi:10.1038/scientificamerican0302-76. PMID 11857903. Retrieved January 19, 2016.
- ^ a b Kyte, Frank T.; Zhiming Zhou; John T. Wasson (1981). «High noble metal concentrations in a late Pliocene sediment». Nature. 292 (5822): 417–420. Bibcode:1981Natur.292..417K. doi:10.1038/292417a0. ISSN 0028-0836. S2CID 4362591.
- ^ a b c d e f g h i j k l m n Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth–Heinemann. pp. 1113–1143, 1294. ISBN 978-0-7506-3365-9. OCLC 213025882.
- ^ a b c d e f g h i j k l m n o Hunt, L. B. (1987). «A History of Iridium». Platinum Metals Review. 31 (1): 32–41.
- ^ Kittel, C. (2004). Introduction to Solid State Physics (7th ed.). Wiley-India. ISBN 978-81-265-1045-0.
- ^ Arblaster, J. W. (1995). «Osmium, the Densest Metal Known». Platinum Metals Review. 39 (4): 164. Archived from the original on 2011-09-27. Retrieved 2008-10-02.
- ^ Cotton, Simon (1997). Chemistry of Precious Metals. Springer-Verlag New York, LLC. p. 78. ISBN 978-0-7514-0413-5.
- ^ Lide, D. R. (1990). CRC Handbook of Chemistry and Physics (70th ed.). Boca Raton (FL):CRC Press. ISBN 9780849304712.
- ^ Arblaster, J. W. (1989). «Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data» (PDF). Platinum Metals Review. 33 (1): 14–16. Archived from the original on 2012-02-07. Retrieved 2008-09-17.
- ^ US 3293031A, Cresswell, Peter & Rhys, David, published 20/12/1966
- ^ Darling, A. S. (1960). «Iridium Platinum Alloys — A Critical Review Of Their Constitution And Properties». Platinum Metals Review. 4 (1): 18–26. Reviewed in «Iridium–Platinum Alloys». Nature. 186 (4720): 211. 1960. Bibcode:1960Natur.186Q.211.. doi:10.1038/186211a0. S2CID 4211238.
- ^ Biggs, T.; Taylor, S. S.; van der Lingen, E. (2005). «The Hardening of Platinum Alloys for Potential Jewellery Application». Platinum Metals Review. 49 (1): 2–15. doi:10.1595/147106705X24409.
- ^ a b c d e f g h i j Emsley, J. (2003). «Iridium». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 201–204. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2011). Nature’s Building Blocks: An A–Z Guide to the Elements (New ed.). New York: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ a b Perry, D. L. (1995). Handbook of Inorganic Compounds. CRC Press. pp. 203–204. ISBN 978-1439814611.
- ^ Lagowski, J. J., ed. (2004). Chemistry Foundations and Applications. Vol. 2. Thomson Gale. pp. 250–251. ISBN 978-0028657233.
- ^
Munson, Ronald A. (February 1968). «The Synthesis of Iridium Disulfide and Nickel diarsenide having the Pyrite Structure» (PDF). Inorganic Chemistry. 7 (2): 389–390. doi:10.1021/ic50060a047. - ^ a b c d e Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b c Mager Stellman, J. (1998). «Iridium». Encyclopaedia of Occupational Health and Safety. International Labour Organization. pp. 63.19. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Robinson, R.; Thoennessen, M. (2012). «Discovery of tantalum, rhenium, osmium, and iridium isotopes». Atomic Data and Nuclear Data Tables. 98 (5): 911–932. arXiv:1109.0526. Bibcode:2012ADNDT..98..911R. doi:10.1016/j.adt.2011.09.003. S2CID 53992437.
- ^ Chereminisoff, N. P. (1990). Handbook of Ceramics and Composites. CRC Press. p. 424. ISBN 978-0-8247-8006-7.
- ^ Jung, D.; Demazeau, Gérard (1995). «High Oxygen Pressure and the Preparation of New Iridium (VI) Oxides with Perovskite Structure: Sr
2MIrO
6 (M = Ca, Mg)». Journal of Solid State Chemistry. 115 (2): 447–455. Bibcode:1995JSSCh.115..447J. doi:10.1006/jssc.1995.1158. - ^ Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S. (2009). «Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII». Angewandte Chemie International Edition. 48 (42): 7879–7883. doi:10.1002/anie.200902733. PMID 19593837.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry (1st ed.). Academic Press. ISBN 978-0-12-352651-9. OCLC 47901436.
- ^ Esteruelas, Miguel A.; López, Ana M.; Oliván, Montserrat (2016). «Polyhydrides of Platinum Group Metals: Nonclassical Interactions and σ-Bond Activation Reactions». Chemical Reviews. 116 (15): 8770–8847. doi:10.1021/acs.chemrev.6b00080. PMID 27268136.
- ^ Černý, R.; Joubert, J.-M.; Kohlmann, H.; Yvon, K. (2002). «Mg
6Ir
2H
11, a new metal hydride containing saddle-like IrH5−
4 and square-pyramidal IrH4−
5 hydrido complexes». Journal of Alloys and Compounds. 340 (1–2): 180–188. doi:10.1016/S0925-8388(02)00050-6. - ^ Gulliver, D. J.; Levason, W. (1982). «The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states». Coordination Chemistry Reviews. 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- ^ a b c d e Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; et al. (2002). «Platinum group metals and compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a21_075. ISBN 978-3527306732.
- ^ Crabtree, R. H. (1979). «Iridium compounds in catalysis». Accounts of Chemical Research. 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Crabtree, R. H. (2005). The Organometallic Chemistry of the Transition Metals (PDF). Wiley. ISBN 978-0471662563. OCLC 224478241. Archived from the original (PDF) on 2012-11-19.
- ^ Janowicz, A. H.; Bergman, R. G. (1982). «Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H → M(R)(H)». Journal of the American Chemical Society. 104 (1): 352–354. doi:10.1021/ja00365a091.
- ^ Hoyano, J. K.; Graham, W. A. G. (1982). «Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex». Journal of the American Chemical Society. 104 (13): 3723–3725. doi:10.1021/ja00377a032.
- ^ Hartwig, John F. (2011). «Regioselectivity of the Borylation of Alkanes and Arenes». Chemical Society Reviews. 40 (4): 1992–2002. doi:10.1039/c0cs00156b. PMID 21336364.
- ^ a b c Weeks, Mary Elvira (1932). «The discovery of the elements. VIII. The platinum metals». Journal of Chemical Education. American Chemical Society (ACS). 9 (6): 1017–1034. Bibcode:1932JChEd…9.1017W. doi:10.1021/ed009p1017. ISSN 0021-9584.Weeks, M. E. (1968). Discovery of the Elements (7th ed.). Journal of Chemical Education. pp. 385–407. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Donald McDonald, Leslie B. Hunt (1982). A History of Platinum and its Allied Metals. Johnson Matthey Plc. pp. 7–8. ISBN 978-0-905118-83-3.
- ^ Dixon, Joshua; Brownrigg, William (1801). The literary life of William Brownrigg. To which are added an account of the coal mines near Whitehaven: And Observations on the means of preventing epidemic fevers. p. 52. Archived from the original on 24 March 2017.
- ^ Watson, Wm; Brownrigg, William (1749). «Several Papers concerning a New Semi-Metal, Called Platina; Communicated to the Royal Society by Mr. Wm. Watson F. R. S». Philosophical Transactions. 46 (491–496): 584–596. Bibcode:1749RSPT…46..584W. doi:10.1098/rstl.1749.0110. S2CID 186213277.
- ^ Marggraf, Andreas Sigismund (1760). Versuche mit dem neuen mineralischen Körper Platina del pinto genannt. Archived from the original on 24 March 2017.
- ^ Thomson, T. (1831). A System of Chemistry of Inorganic Bodies. Vol. 1. Baldwin & Cradock, London; and William Blackwood, Edinburgh. p. 693.
- ^ a b Griffith, W. P. (2004). «Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries». Platinum Metals Review. 48 (4): 182–189. doi:10.1595/147106704×4844.
- ^ Weeks, M. E. (1968). Discovery of the Elements (7th ed.). Journal of Chemical Education. pp. 414–418. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Tennant, S. (1804). «On Two Metals, Found in the Black Powder Remaining after the Solution of Platina». Philosophical Transactions of the Royal Society of London. 94: 411–418. doi:10.1098/rstl.1804.0018. JSTOR 107152.
- ^ Trigg, G. L. (1995). «Recoilless Emission and Absorption of Radiation». Landmark Experiments in Twentieth Century Physics. Courier Dover Publications. pp. 179–190. ISBN 978-0-486-28526-9. OCLC 31409781.
- ^ Mössbauer, R. L. (1958). «Gammastrahlung in Ir191«. Zeitschrift für Physik A (in German). 151 (2): 124–143. Bibcode:1958ZPhy..151..124M. doi:10.1007/BF01344210. S2CID 121129342.
- ^ Waller, I. (1964). «The Nobel Prize in Physics 1961: presentation speech». Nobel Lectures, Physics 1942–1962. Elsevier.
- ^ «History/Origin of Chemicals». NASA. Retrieved 1 January 2013.
- ^ Chen, Hsin-Yu; Vitale, Salvatore; Foucart, Francois (2021-10-01). «The Relative Contribution to Heavy Metals Production from Binary Neutron Star Mergers and Neutron Star–Black Hole Mergers». The Astrophysical Journal Letters. American Astronomical Society. 920 (1): L3. arXiv:2107.02714. Bibcode:2021ApJ…920L…3C. doi:10.3847/2041-8213/ac26c6. hdl:1721.1/142310. ISSN 2041-8205. S2CID 238198587.
- ^ Scott, E. R. D.; Wasson, J. T.; Buchwald, V. F. (1973). «The chemical classification of iron meteorites—VII. A reinvestigation of irons with Ge concentrations between 25 and 80 ppm». Geochimica et Cosmochimica Acta. 37 (8): 1957–1983. Bibcode:1973GeCoA..37.1957S. doi:10.1016/0016-7037(73)90151-8.
- ^ a b «Iridium» (PDF). Human Health Fact Sheet. Argonne National Laboratory. 2005. Archived from the original (PDF) on March 4, 2012. Retrieved 2008-09-20.
- ^ Xiao, Z.; Laplante, A. R. (2004). «Characterizing and recovering the platinum group minerals—a review». Minerals Engineering. 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ «Cuproiridsite CuIr2S4» (PDF). Hanbook of mineralogy.org. Retrieved 3 March 2022.
- ^ Vitaly A. Stepanov; Valentina E. Kungurova; Vitaly I. Gvozdev (2010). «Irasite Discovery in Copper-Nickel Ores of Shanuch Deposit (KAMCHATKA)» (PDF). New Data on Minerals. 45: 23. Retrieved 3 March 2022.
- ^ Garuti, Giorgio; Gazzotti, Moreno; Torres-Ruiz, Jose (1995). «Iridium, Rhodium, and Platinum Sulfides in Chromitites from the Ultramafic Massifs of Finero, Italy, and Ojen, Spain» (PDF). The Canadian Mineralogist. 33: 509–520. Retrieved 2 November 2022.
- ^ a b c d Seymour, R. J.; O’Farrelly, J. I. (2012). «Platinum-Group Metals». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub3. ISBN 978-0471238966.
- ^ a b Goldberg, Hodge; Kay, V; Stallard, M; Koide, M (1986). «Some comparative marine chemistries of platinum and iridium». Applied Geochemistry. 1 (2): 227–232. Bibcode:1986ApGC….1..227G. doi:10.1016/0883-2927(86)90006-5.
- ^ a b c Wells, Boothe (1988). «Iridium in marine organisms». Geochimica et Cosmochimica Acta. 52 (6): 1737–1739. Bibcode:1988GeCoA..52.1737W. doi:10.1016/0016-7037(88)90242-6.
- ^ a b c Sawlowicz, Z (1993). «Iridium and other platinum-group elements as geochemical markers in sedimentary environments». Palaeogeography, Palaeoclimatology, Palaeoecology. 104 (4): 253–270. Bibcode:1993PPP…104..253S. doi:10.1016/0031-0182(93)90136-7.
- ^ Crocket, Macdougall; Harriss, R (1973). «Gold, palladium and iridium in marine sediments». Geochimica et Cosmochimica Acta. 37 (12): 2547–2556. Bibcode:1973GeCoA..37.2547C. doi:10.1016/0016-7037(73)90264-0.
- ^ Peucker-Ehrenbrink, B (2001). «Iridium and Osmium as Tracers of Extraterrestrial Matter in Marine Sediments». Accretion of Extraterrestrial Matter Throughout Earth’s History. pp. 163–178. doi:10.1007/978-1-4419-8694-8_10. ISBN 978-1-4613-4668-5.
- ^ Barker, J; Edward, A (1968). «Accretion rate of cosmic matter from iridium and osmium contents of deep-sea sediments». Geochimica et Cosmochimica Acta. 32 (6): 627–645. Bibcode:1968GeCoA..32..627B. doi:10.1016/0016-7037(68)90053-7.
- ^ Colodner, D; Edmond, J (1992). «Post-depositional mobility of platinum, iridium and rhenium in marine sediments». Nature. 358 (6385): 402–404. Bibcode:1992Natur.358..402C. doi:10.1038/358402a0. S2CID 37386975.
- ^ a b Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. (1980). «Extraterrestrial cause for the Cretaceous–Tertiary extinction» (PDF). Science. 208 (4448): 1095–1108. Bibcode:1980Sci…208.1095A. CiteSeerX 10.1.1.126.8496. doi:10.1126/science.208.4448.1095. PMID 17783054. S2CID 16017767.
- ^ Hildebrand, A. R.; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). «Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico». Geology. 19 (9): 867–871. Bibcode:1991Geo….19..867H. doi:10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2.
- ^ Frankel, C. (1999). The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions. Cambridge University Press. ISBN 978-0-521-47447-4. OCLC 40298401.
- ^ Ryder, G.; Fastovsky, D. E.; Gartner, S. (1996). The Cretaceous-Tertiary Event and Other Catastrophes in Earth History. Geological Society of America. p. 47. ISBN 978-0-8137-2307-5.
- ^ Toutain, J.-P.; Meyer, G. (1989). «Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)». Geophysical Research Letters. 16 (12): 1391–1394. Bibcode:1989GeoRL..16.1391T. doi:10.1029/GL016i012p01391.
- ^ a b c Platinum-Group Metals. U.S. Geological Survey Mineral Commodity Summaries
- ^ Singerling, Sheryl A.; Schulte, Ruth F. (August 2021). «Platinum-Group Metals». 2018 Minerals Yearbook (PDF). USGS. p. 57.11.
- ^ Hagelüken, C. (2006). «Markets for the catalysts metals platinum, palladium, and rhodium» (PDF). Metall. 60 (1–2): 31–42. Archived from the original (PDF) on March 4, 2009.
- ^
«Platinum 2013 Interim Review» (PDF). Platinum Today. Johnson Matthey. Retrieved 2014-01-10. - ^ a b Ryan, Marge (2022-11-16). «Recycling and thrifting: the answer to the iridium question in electrolyser growth».
- ^ Gilchrist, Raleigh (1943). «The Platinum Metals». Chemical Reviews. 32 (3): 277–372. doi:10.1021/cr60103a002. S2CID 96640406.
- ^ Ohriner, E. K. (2008). «Processing of Iridium and Iridium Alloys». Platinum Metals Review. 52 (3): 186–197. doi:10.1595/147106708X333827.
- ^ Hunt, L. B.; Lever, F. M. (1969). «Platinum Metals: A Survey of Productive Resources to industrial Uses» (PDF). Platinum Metals Review. 13 (4): 126–138. Archived from the original (PDF) on 2008-10-29. Retrieved 2008-10-01.
- ^ «Mineral Yearbook 2020 tables-only release». USGS.
- ^ a b Handley, J. R. (1986). «Increasing Applications for Iridium». Platinum Metals Review. 30 (1): 12–13.
- ^ Crookes, W. (1908). «On the Use of Iridium Crucibles in Chemical Operations». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 80 (541): 535–536. Bibcode:1908RSPSA..80..535C. doi:10.1098/rspa.1908.0046. JSTOR 93031.
- ^ Egorova, R. V.; Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T. (1979). «Spinnerets for viscose rayon cord yarn». Fibre Chemistry. 10 (4): 377–378. doi:10.1007/BF00543390. S2CID 135705244.
- ^ Graff, Muriel; Kempf, Bernd; Breme, Jürgen (2005-12-23). «Iridium Alloy for Spark Plug Electrodes». Materials for Transportation Technology. Weinheim, FRG: Wiley-VCH Verlag GmbH & Co. KGaA. pp. 1–8. doi:10.1002/3527606025.ch1. ISBN 9783527301249.
- ^ Cheung, H.; Tanke, R. S.; Torrence, G. P. (2000). «Acetic acid». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a01_045. ISBN 978-3527306732.
- ^ Jones, Jane H. (2000). «The cativa™ process for the manufacture of acetic acid». Platinum Metals Review. 44 (3): 94–105.
- ^ Roseblade, S. J.; Pfaltz, A. (2007). «Iridium-catalyzed asymmetric hydrogenation of olefins». Accounts of Chemical Research. 40 (12): 1402–1411. doi:10.1021/ar700113g. PMID 17672517.
- ^ Ikariya, Takao; Blacker, A. John (2007). «Asymmetric Transfer Hydrogenation of Ketones with Bifunctional Transition Metal-Based Molecular Catalysts†». Accounts of Chemical Research. 40 (12): 1300–1308. doi:10.1021/ar700134q. PMID 17960897.
- ^ Matthias Beller, Hans-Ulrich Blaser, ed. (2012). Organometallics as Catalysts in the Fine Chemical Industry. Topics in Organometallic Chemistry. Vol. 42. Berlin, Heidelberg: Springer. ISBN 978-3-642-32832-9.
- ^ Halmshaw, R. (1954). «The use and scope of Iridium 192 for the radiography of steel». British Journal of Applied Physics. 5 (7): 238–243. Bibcode:1954BJAP….5..238H. doi:10.1088/0508-3443/5/7/302.
- ^ Hellier, Chuck (2001). Handbook of Nondestructive Evlaluation. The McGraw-Hill Companies. ISBN 978-0-07-028121-9.
- ^ Jean Pouliot; Luc Beaulieu (2010). «13 — Modern Principles of Brachytherapy Physics: From 2-D to 3-D to Dynamic Planning and Delivery». In Richard T. Hoppe; Theodore Locke Phillips; Mack Roach (eds.). Leibel and Phillips Textbook of Radiation Oncology (3rd ed.). W.B. Saunders. pp. 224–244. doi:10.1016/B978-1-4160-5897-7.00013-5. ISBN 9781416058977.
- ^ Ulbricht, Christoph; Beyer, Beatrice; Friebe, Christian; Winter, Andreas; Schubert, Ulrich S. (2009). «Recent Developments in the Application of Phosphorescent Iridium(III) Complex Systems». Advanced Materials. 21 (44): 4418–4441. Bibcode:2009AdM….21.4418U. doi:10.1002/adma.200803537. S2CID 96268110.
- ^ Penzes, W. B. (2001). «Time Line for the Definition of the Meter». National Institute for Standards and Technology. Retrieved 2008-09-16.
- ^ General section citations: Recalibration of the U.S. National Prototype Kilogram, R. S. Davis, Journal of Research of the National Bureau of Standards, 90, No. 4, July–August 1985 (5.5 MB PDF Archived 2017-02-01 at the Wayback Machine); and The Kilogram and Measurements of Mass and Force, Z. J. Jabbour et al., J. Res. Natl. Inst. Stand. Technol. 106, 2001, 25–46 (3.5 MB PDF)
- ^ Mottishaw, J. (1999). «Notes from the Nib Works—Where’s the Iridium?». The PENnant. XIII (2).
- ^ Crookes, W., ed. (1867). «The Paris Exhibition». The Chemical News and Journal of Physical Science. XV: 182.
- ^ Pepper, J. H. (1861). The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements. Routledge, Warne, and Routledge. p. 455.
- ^ Iavicoli, Ivo; Leso, Veruscka (2015). «Iridium». Handbook on the Toxicology of Metals. pp. 855–878. doi:10.1016/B978-0-444-59453-2.00040-8. ISBN 9780444594532.
- ^ «Radioisotope Brief: Iridium-192 (Ir-192)» (PDF). Radiation Emergencies. Centers for Disease Control and Prevention. 2004-08-18. Retrieved 2008-09-20.
External links[edit]
![]()
Wikimedia Commons has media related to Iridium.
![]()
Look up iridium in Wiktionary, the free dictionary.
- Iridium at The Periodic Table of Videos (University of Nottingham)
- Iridium in Encyclopædia Britannica
Not to be confused with Indium.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (i-RID-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ir) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d7 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 2719 K (2446 °C, 4435 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 4403 K (4130 °C, 7466 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 22.56 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 19 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 41.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 564 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.10 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8, +9[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 136 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 141±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of iridium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4825 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 6.4 µm/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 147 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 47.1 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +25.6 × 10−6 cm3/mol (298 K)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 528 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 210 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 320 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hardness | 1760–2200 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 1670 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-88-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Main isotopes of iridium
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Iridium is a chemical element with the symbol Ir and atomic number 77. A very hard, brittle, silvery-white transition metal of the platinum group, it is considered the second-densest naturally occurring metal (after osmium) with a density of 22.56 g/cm3 (0.815 lb/cu in) as defined by experimental X-ray crystallography.[a] It is one of the most corrosion-resistant metals, even at temperatures as high as 2,000 °C (3,630 °F). However, corrosion-resistance is not quantifiable in absolute terms; although only certain molten salts and halogens are corrosive to solid iridium, finely divided iridium dust is much more reactive and can be flammable, whereas gold dust is not flammable but can be attacked by substances that iridium resists, such as aqua regia.
Iridium was discovered in 1803 among insoluble impurities in natural platinum. Smithson Tennant, the primary discoverer, named it after the Greek goddess Iris, personification of the rainbow, because of the striking and diverse colors of its salts. Iridium is one of the rarest elements in Earth’s crust, with annual production and consumption of only 3 tonnes (6.6 thousand pounds). 191Ir and 193Ir are the only two naturally occurring isotopes of iridium, as well as the only stable isotopes; the latter is the more abundant.
The dominant uses of iridium are the metal itself and its alloys, as in high-performance spark plugs, crucibles for recrystallization of semiconductors at high temperatures, and electrodes for the production of chlorine in the chloralkali process. Important compounds of iridium are chlorides and iodides in industrial catalysis. Iridium is a component of some OLEDs.
Iridium is found in meteorites in much higher abundance than in the Earth’s crust.[7] For this reason, the unusually high abundance of iridium in the clay layer at the Cretaceous–Paleogene boundary gave rise to the Alvarez hypothesis that the impact of a massive extraterrestrial object caused the extinction of dinosaurs and many other species 66 million years ago, now known to be produced by the impact that formed the Chicxulub crater. Similarly, an iridium anomaly in core samples from the Pacific Ocean suggested the Eltanin impact of about 2.5 million years ago.[8]
It is thought that the total amount of iridium in the planet Earth is much higher than that observed in crustal rocks, but as with other platinum-group metals, the high density and tendency of iridium to bond with iron caused most iridium to descend below the crust when the planet was young and still molten.
Characteristics[edit]
Physical properties[edit]

A member of the platinum group metals, iridium is white, resembling platinum, but with a slight yellowish cast. Because of its hardness, brittleness, and very high melting point, solid iridium is difficult to machine, form, or work; thus powder metallurgy is commonly employed instead.[9] It is the only metal to maintain good mechanical properties in air at temperatures above 1,600 °C (2,910 °F).[10] It has the 10th highest boiling point among all elements and becomes a superconductor at temperatures below 0.14 K (−273.010 °C; −459.418 °F).[11]
Iridium’s modulus of elasticity is the second-highest among the metals, being surpassed only by osmium.[10] This, together with a high shear modulus and a very low figure for Poisson’s ratio (the relationship of longitudinal to lateral strain), indicate the high degree of stiffness and resistance to deformation that have rendered its fabrication into useful components a matter of great difficulty. Despite these limitations and iridium’s high cost, a number of applications have developed where mechanical strength is an essential factor in some of the extremely severe conditions encountered in modern technology.[10]
The measured density of iridium is only slightly lower (by about 0.12%) than that of osmium, the densest metal known.[12][13] Some ambiguity occurred regarding which of the two elements was denser, due to the small size of the difference in density and difficulties in measuring it accurately,[14] but, with increased accuracy in factors used for calculating density, X-ray crystallographic data yielded densities of 22.56 g/cm3 (0.815 lb/cu in) for iridium and 22.59 g/cm3 (0.816 lb/cu in) for osmium.[15]
Iridium is extremely brittle, to the point of being hard to weld because the heat-affected zone cracks, but it can be made more ductile by addition of small quantities of titanium and zirconium (0.2% of each apparently works well).[16]—
The Vickers hardness of pure platinum is 56 HV, whereas platinum with 50% of iridium can reach over 500 HV.[17][18]
Chemical properties[edit]
Iridium is the most corrosion-resistant metal known:[19] it is not attacked by acids, including aqua regia. In the presence of oxygen, it reacts with cyanide salts.[20] Traditional oxidants also react, including the halogens and oxygen[21] at higher temperatures.[22] Iridium also reacts directly with sulfur at atmospheric pressure to yield iridium disulfide.[23]
Isotopes[edit]
Iridium has two naturally occurring, stable isotopes, 191Ir and 193Ir, with natural abundances of 37.3% and 62.7%, respectively.[24] At least 37 radioisotopes have also been synthesized, ranging in mass number from 164 to 202. 192Ir, which falls between the two stable isotopes, is the most stable radioisotope, with a half-life of 73.827 days, and finds application in brachytherapy[25] and in industrial radiography, particularly for nondestructive testing of welds in steel in the oil and gas industries; iridium-192 sources have been involved in a number of radiological accidents. Three other isotopes have half-lives of at least a day—188Ir, 189Ir, and 190Ir.[24] Isotopes with masses below 191 decay by some combination of β+ decay, α decay, and (rare) proton emission, with the exception of 189Ir, which decays by electron capture. Synthetic isotopes heavier than 191 decay by β− decay, although 192Ir also has a minor electron capture decay path.[24] All known isotopes of iridium were discovered between 1934 and 2008, with the most recent discoveries being 200–202Ir.[26]
At least 32 metastable isomers have been characterized, ranging in mass number from 164 to 197. The most stable of these is 192m2Ir, which decays by isomeric transition with a half-life of 241 years,[24] making it more stable than any of iridium’s synthetic isotopes in their ground states. The least stable isomer is 190m3Ir with a half-life of only 2 μs.[24] The isotope 191Ir was the first one of any element to be shown to present a Mössbauer effect. This renders it useful for Mössbauer spectroscopy for research in physics, chemistry, biochemistry, metallurgy, and mineralogy.[27]
Chemistry[edit]
| Oxidation states[b] | |
|---|---|
| −3 | [Ir(CO) 3]3− |
| −1 | [Ir(CO)3(PPh3)]1− |
| 0 | Ir4(CO)12 |
| +1 | [IrCl(CO)(PPh3)2] |
| +2 | Ir(C5H5)2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir4F20 |
| +6 | IrF 6 |
| +7 | [Ir(O2)O2]+ |
| +8 | IrO4 |
| +9 | [IrO4]+[2] |
Oxidation states[edit]
Iridium forms compounds in oxidation states between −3 and +9, but the most common oxidation states are +1, +3, and +4.[9] Well-characterized compounds containing iridium in the +6 oxidation state include IrF6 and the oxides Sr2MgIrO6 and Sr2CaIrO6.[9][28] iridium(VIII) oxide (IrO4) was generated under matrix isolation conditions at 6 K in argon.[29] The highest oxidation state (+9), which is also the highest recorded for any element, is found in gaseous [IrO4]+.[2]
Binary compounds[edit]
Iridium does not form binary hydrides. Only one binary oxide is well-characterized: iridium dioxide, IrO
2. It is a blue black solid that adopts the fluorite structure.[9] A sesquioxide, Ir
2O
3, has been described as a blue-black powder, which is oxidized to IrO
2 by HNO
3.[21] The corresponding disulfides, diselenides, sesquisulfides, and sesquiselenides are known, as well as IrS
3.[9]
Binary trihalides, IrX
3, are known for all of the halogens.[9] For oxidation states +4 and above, only the tetrafluoride, pentafluoride and hexafluoride are known.[9] Iridium hexafluoride, IrF
6, is a volatile yellow solid, composed of octahedral molecules. It decomposes in water and is reduced to IrF
4.[9] Iridium pentafluoride is also a strong oxidant, but it is a tetramer, Ir
4F
20, formed by four corner-sharing octahedra.[9]
Complexes[edit]

The coordination complexes of iridium are extensive.
Iridium in its complexes is always low-spin). Ir(III) and Ir(IV) generally form octahedral complexes.[9] Polyhydride complexes are known for the +5 and +3 oxidation states.[30] One example is IrH5(PiPr3)2.[31] The ternary hydride Mg
6Ir
2H
11 is believed to contain both the IrH4−
5 and the 18-electron IrH5−
4 anion.[32]
Iridium also oxyanions with oxidation states +4 and +5. K
2IrO
3 and KIrO
3 can be prepared from the reaction of potassium oxide or potassium superoxide with iridium at high temperatures. Such solids are not soluble in conventional solvents.[33]
As for many elements, the chlorides are key complexes. Hexachloroiridic (IV) acid, H
2IrCl
6, and its ammonium salt are the most common iridium compounds from an industrial and preparative perspectives.[34] They are intermediates in the purification of iridium and used as precursors for most other iridium compounds, as well as in the preparation of anode coatings. The IrCl2−
6 ion has an intense dark brown color, and can be readily reduced to the lighter-colored IrCl3−
6 and vice versa.[34] Iridium trichloride, IrCl
3, which can be obtained in anhydrous form from direct oxidation of iridium powder by chlorine at 650 °C,[34] or in hydrated form by dissolving Ir
2O
3 in hydrochloric acid, is often used as a starting material for the synthesis of other Ir(III) compounds.[9] Another compound used as a starting material is ammonium hexachloroiridate(III), (NH
4)
3IrCl
6.
In the presence of air, iridium metal dissolves in molten alkali-metal cyanides to produce the Ir(CN)3−
6 (hexacyanoiridate) ion.
Organoiridium chemistry[edit]

Organoiridium compounds contain iridium–carbon bonds. Early studies identified the very stable tetrairidium dodecacarbonyl, Ir
4(CO)
12.[9] In this compound, each of the iridium atoms is bonded to the other three, forming a tetrahedral cluster. The discovery of Vaska’s complex (IrCl(CO)[P(C
6H
5)
3]
2) opened the door for oxidative addition reactions, a process fundamental to useful reactions. For example, Crabtree’s catalyst, a homogeneous catalyst for hydrogenation reactions.[35][36]

Iridium complexes played a pivotal role in the development of Carbon–hydrogen bond activation (C–H activation), which promises to allow functionalization of hydrocarbons, which are traditionally regarded as unreactive.[39]
History[edit]
Platinum group[edit]

The Greek goddess Iris, after whom iridium was named.
The discovery of iridium is intertwined with that of platinum and the other metals of the platinum group.
The first European reference to platinum appears in 1557 in the writings of the Italian humanist Julius Caesar Scaliger as a description of an unknown noble metal found between Darién and Mexico, «which no fire nor any Spanish artifice has yet been able to liquefy».[40] From their first encounters with platinum, the Spanish generally saw the metal as a kind of impurity in gold, and it was treated as such. It was often simply thrown away, and there was an official decree forbidding the adulteration of gold with platinum impurities.[41]


Antonio de Ulloa is credited in European history with the discovery of platinum.
In 1735, Antonio de Ulloa and Jorge Juan y Santacilia saw Native Americans mining platinum while the Spaniards were travelling through Colombia and Peru for eight years. Ulloa and Juan found mines with the whitish metal nuggets and took them home to Spain. Antonio de Ulloa returned to Spain and established the first mineralogy lab in Spain and was the first to systematically study platinum, which was in 1748. His historical account of the expedition included a description of platinum as being neither separable nor calcinable. Ulloa also anticipated the discovery of platinum mines. After publishing the report in 1748, Ulloa did not continue to investigate the new metal. In 1758, he was sent to superintend mercury mining operations in Huancavelica.[40]
In 1741, Charles Wood,[42] a British metallurgist, found various samples of Colombian platinum in Jamaica, which he sent to William Brownrigg for further investigation.
In 1750, after studying the platinum sent to him by Wood, Brownrigg presented a detailed account of the metal to the Royal Society, stating that he had seen no mention of it in any previous accounts of known minerals.[43] Brownrigg also made note of platinum’s extremely high melting point and refractoriness toward borax.[clarification needed] Other chemists across Europe soon began studying platinum, including Andreas Sigismund Marggraf,[44] Torbern Bergman, Jöns Jakob Berzelius, William Lewis, and Pierre Macquer. In 1752, Henrik Scheffer published a detailed scientific description of the metal, which he referred to as «white gold», including an account of how he succeeded in fusing platinum ore with the aid of arsenic. Scheffer described platinum as being less pliable than gold, but with similar resistance to corrosion.[40]
Discovery[edit]
Chemists who studied platinum dissolved it in aqua regia (a mixture of hydrochloric and nitric acids) to create soluble salts. They always observed a small amount of a dark, insoluble residue.[10] Joseph Louis Proust thought that the residue was graphite.[10] The French chemists Victor Collet-Descotils, Antoine François, comte de Fourcroy, and Louis Nicolas Vauquelin also observed the black residue in 1803, but did not obtain enough for further experiments.[10]
In 1803, British scientist Smithson Tennant (1761–1815) analyzed the insoluble residue and concluded that it must contain a new metal. Vauquelin treated the powder alternately with alkali and acids[19] and obtained a volatile new oxide, which he believed to be of this new metal—which he named ptene, from the Greek word πτηνός ptēnós, «winged».[45][46] Tennant, who had the advantage of a much greater amount of residue, continued his research and identified the two previously undiscovered elements in the black residue, iridium and osmium.[10][19] He obtained dark red crystals (probably of Na
2[IrCl
6]·nH
2O) by a sequence of reactions with sodium hydroxide and hydrochloric acid.[46] He named iridium after Iris (Ἶρις), the Greek winged goddess of the rainbow and the messenger of the Olympian gods, because many of the salts he obtained were strongly colored.[c][47] Discovery of the new elements was documented in a letter to the Royal Society on June 21, 1804.[10][48]
Metalworking and applications[edit]
British scientist John George Children was the first to melt a sample of iridium in 1813 with the aid of «the greatest galvanic battery that has ever been constructed» (at that time).[10] The first to obtain high-purity iridium was Robert Hare in 1842. He found it had a density of around 21.8 g/cm3 (0.79 lb/cu in) and noted the metal is nearly immalleable and very hard. The first melting in appreciable quantity was done by Henri Sainte-Claire Deville and Jules Henri Debray in 1860. They required burning more than 300 litres (79 US gal) of pure O
2 and H
2 gas for each 1 kilogram (2.2 lb) of iridium.[10]
These extreme difficulties in melting the metal limited the possibilities for handling iridium. John Isaac Hawkins was looking to obtain a fine and hard point for fountain pen nibs, and in 1834 managed to create an iridium-pointed gold pen. In 1880, John Holland and William Lofland Dudley were able to melt iridium by adding phosphorus and patented the process in the United States; British company Johnson Matthey later stated they had been using a similar process since 1837 and had already presented fused iridium at a number of World Fairs.[10] The first use of an alloy of iridium with ruthenium in thermocouples was made by Otto Feussner in 1933. These allowed for the measurement of high temperatures in air up to 2,000 °C (3,630 °F).[10]
In Munich, Germany in 1957 Rudolf Mössbauer, in what has been called one of the «landmark experiments in twentieth-century physics»,[49] discovered the resonant and recoil-free emission and absorption of gamma rays by atoms in a solid metal sample containing only 191Ir.[50] This phenomenon, known as the Mössbauer effect resulted in the awarding of the Nobel Prize in Physics in 1961, at the age 32, just three years after he published his discovery.[51]
Occurrence[edit]
Along with all elements having atomic weights higher than that of iron, iridium is only naturally formed by the r-process (rapid neutron capture) in supernovae and neutron star mergers.[52][53]

Iridium is one of the least abundant elements in Earth’s crust.

Iridium is one of the nine least abundant stable elements in Earth’s crust, having an average mass fraction of 0.001 ppm in crustal rock; platinum is 10 times more abundant, gold is 40 times more abundant, and silver and mercury are 80 times more abundant.[9] Tellurium is about as abundant as iridium.[9] In contrast to its low abundance in crustal rock, iridium is relatively common in meteorites, with concentrations of 0.5 ppm or more.[55] The overall concentration of iridium on Earth is thought to be much higher than what is observed in crustal rocks, but because of the density and siderophilic («iron-loving») character of iridium, it descended below the crust and into Earth’s core when the planet was still molten.[34]
Iridium is found in nature as an uncombined element or in natural alloys; especially the iridium–osmium alloys, osmiridium (osmium-rich), and iridosmium (iridium-rich).[19] In the nickel and copper deposits, the platinum group metals occur as sulfides (i.e. (Pt,Pd)S), tellurides (i.e. PtBiTe), antimonides (PdSb), and arsenides (i.e. PtAs
2). In all of these compounds, platinum is exchanged by a small amount of iridium and osmium. As with all of the platinum group metals, iridium can be found naturally in alloys with raw nickel or raw copper.[56] A number of iridium-dominant minerals, with iridium as the species-forming element, are known. They are exceedingly rare and often represent the iridium analogues of the above-given ones. The examples are irarsite and cuproiridsite, to mention some.[57][58][59] Within Earth’s crust, iridium is found at highest concentrations in three types of geologic structure: igneous deposits (crustal intrusions from below), impact craters, and deposits reworked from one of the former structures. The largest known primary reserves are in the Bushveld igneous complex in South Africa,[60] (near the largest known impact structure, the Vredefort impact structure) though the large copper–nickel deposits near Norilsk in Russia, and the Sudbury Basin (also an impact crater) in Canada are also significant sources of iridium. Smaller reserves are found in the United States.[60] Iridium is also found in secondary deposits, combined with platinum and other platinum group metals in alluvial deposits. The alluvial deposits used by pre-Columbian people in the Chocó Department of Colombia are still a source for platinum-group metals. As of 2003, world reserves have not been estimated.[19]
Marine oceanography[edit]
Iridium is found within marine organisms, sediments, and the water column. The abundance of iridium in seawater[61] and organisms[62] is relatively low, as it does not readily form chloride complexes.[62] The abundance in organisms is about 20 parts per trillion, or about five orders of magnitude less than in sedimentary rocks at the Cretaceous–Paleogene (K–T) boundary.[62] The concentration of iridium in seawater and marine sediment is sensitive to marine oxygenation, seawater temperature, and various geological and biological processes.[63]
Iridium in sediments can come from cosmic dust, volcanoes, precipitation from seawater, microbial processes, or hydrothermal vents,[63] and its abundance can be strongly indicative of the source.[64][63] It tends to associate with other ferrous metals in manganese nodules.[61] Iridium is one of the characteristic elements of extraterrestrial rocks, and, along with osmium, can be used as a tracer element for meteoritic material in sediment.[65][66] For example core samples from the Pacific Ocean with elevated iridium levels suggested the Eltanin impact of about 2.5 million years ago.[8]
Some of the mass extinctions, such as the Cretaceous extinction, can be identified by anomalously high concentrations of iridium in sediment, and these can be linked to major asteroid impacts.[67]
Cretaceous–Paleogene boundary presence[edit]

The Cretaceous–Paleogene boundary of 66 million years ago, marking the temporal border between the Cretaceous and Paleogene periods of geological time, was identified by a thin stratum of iridium-rich clay.[68] A team led by Luis Alvarez proposed in 1980 an extraterrestrial origin for this iridium, attributing it to an asteroid or comet impact.[68] Their theory, known as the Alvarez hypothesis, is now widely accepted to explain the extinction of the non-avian dinosaurs. A large buried impact crater structure with an estimated age of about 66 million years was later identified under what is now the Yucatán Peninsula (the Chicxulub crater).[69][70] Dewey M. McLean and others argue that the iridium may have been of volcanic origin instead, because Earth’s core is rich in iridium, and active volcanoes such as Piton de la Fournaise, in the island of Réunion, are still releasing iridium.[71][72]
Production[edit]
| Year | Consumption (tonnes) | Price (USD)[73] |
|---|---|---|
| 2001 | 2.6 | $415.25/ozt ($13.351/g) |
| 2002 | 2.5 | $294.62/ozt ($9.472/g) |
| 2003 | 3.3 | $93.02/ozt ($2.991/g) |
| 2004 | 3.60 | $185.33/ozt ($5.958/g) |
| 2005 | 3.86 | $169.51/ozt ($5.450/g) |
| 2006 | 4.08 | $349.45/ozt ($11.235/g) |
| 2007 | 3.70 | $444.43/ozt ($14.289/g) |
| 2008 | 3.10 | $448.34/ozt ($14.414/g) |
| 2009 | 2.52 | $420.4/ozt ($13.52/g) |
| 2010 | 10.40 | $642.15/ozt ($20.646/g) |
| 2011 | 9.36 | $1,035.87/ozt ($33.304/g) |
| 2012 | 5.54 | $1,066.23/ozt ($34.280/g) |
| 2013 | 6.16 | $826.45/ozt ($26.571/g) |
| 2014 | 6.1 | $556.19/ozt ($17.882/g) |
| 2015 | 7.81 | $544/ozt ($17.5/g) |
| 2016 | 7.71 | $586.90/ozt ($18.869/g) |
| 2017 | n.d. | $908.35/ozt ($29.204/g) |
| 2018 | n.d. | $1,293.27/ozt ($41.580/g) |
| 2019 | n.d. | $1,485.80/ozt ($47.770/g) |
| 2020 | n.d. | $1,633.51/ozt ($52.519/g) |
| 2021 | n.d. | $5,400.00/ozt ($173.614/g) |
Worldwide production of iridium is about 7,500 kilograms (16,500 lb).[74] The price is high and varying (see table). Illustrative factors that affect the price include oversupply of Ir crucibles[73][75]
and changes in LED technology.[76]
Platinum metals occur together as dilute ores. Iridium is one of the rarer platinum metals: for every 190 tonnes of platinum obtained from ores, only 7.5 tonnes of iridium is isolated.[77] To separate the metals, they must first be brought into solution. Two methods for rendering Ir-containing ores soluble are (i) fusion of the solid with sodium peroxide followed by extraction of the resulting glass in aqua regia and (ii) extraction of the solid with a mixture of chlorine with hydrochloric acid.[34][60] From soluble extracts, iridium is separated by precipitating solid ammonium hexachloroiridate ((NH
4)
2IrCl
6) or by extracting IrCl2−
6 with organic amines.[78] The first method is similar to the procedure Tennant and Wollaston used for their original separation. The second method can be planned as continuous liquid–liquid extraction and is therefore more suitable for industrial scale production. In either case, the product, an iridium chloride salt, is reduced with hydrogen, yielding the metal as a powder or sponge, which is amenable to powder metallurgy techniques.[79][80] Iridium is also obtained commercially as a by-product from nickel and copper mining and processing. During electrorefining of copper and nickel, noble metals such as silver, gold and the platinum group metals as well as selenium and tellurium settle to the bottom of the cell as anode mud, which forms the starting point for their extraction.[73]
Applications[edit]
The main areas of use of iridium are electrodes for producing chlorine and other aggressive products, OLEDs, crucibles, catalysts (e.g. acetic acid), and ignition tips for spark plugs.[77]
Ir metal and alloys[edit]
Resistance to heat and corrosion are the bases for several uses of iridium and its alloys.
Owing to its high melting point, hardness, and corrosion resistance, iridium is used to make crucibles. Such crucibles are used in the Czochralski process to produce oxide single-crystals (such as sapphires) for use in computer memory devices and in solid state lasers.[82][83] The crystals, such as gadolinium gallium garnet and yttrium gallium garnet, are grown by melting pre-sintered charges of mixed oxides under oxidizing conditions at temperatures up to 2,100 °C (3,810 °F).[10]
Certain long-life aircraft engine parts are made of an iridium alloy, and an iridium–titanium alloy is used for deep-water pipes because of its corrosion resistance.[19] Iridium is used for multi-pored spinnerets, through which a plastic polymer melt is extruded to form fibers, such as rayon.[84] Osmium–iridium is used for compass bearings and for balances.[10]
Because of their resistance to arc erosion, iridium alloys are used by some manufacturers for electrical contacts for spark plugs,[82][85] and iridium-based spark plugs are particularly used in aviation.
Catalysis[edit]
Iridium compounds are used as catalysts in the Cativa process for carbonylation of methanol to produce acetic acid.[86][87]
Iridium complexes are often active for asymmetric hydrogenation both by traditional hydrogenation.[88] and transfer hydrogenation.[89] This property is the basis of the industrial route to the chiral herbicide (S)-metolachlor. As practiced by Syngenta on the scale of 10,000 tons/year, the complex [[ [Ir(COD)Cl]2 in the presence of Josiphos ligands.[90]
Medical imaging[edit]
The radioisotope iridium-192 is one of the two most important sources of energy for use in industrial γ-radiography for non-destructive testing of metals.[91][92] Additionally, 192Ir is used as a source of gamma radiation for the treatment of cancer using brachytherapy, a form of radiotherapy where a sealed radioactive source is placed inside or next to the area requiring treatment. Specific treatments include high-dose-rate prostate brachytherapy, biliary duct brachytherapy, and intracavitary cervix brachytherapy.[19] iridium-192 is normally produced by neutron activation of isotop iridium-191 in natural-abundance iridium metal [93]
Photocatalysis and OLEDs[edit]
Iridium complexes are key components of white OLEDs. Similar complexes are used in photocatalysis.[94]
Scientific[edit]

An alloy of 90% platinum and 10% iridium was used in 1889 to construct the International Prototype Metre and kilogram mass, kept by the International Bureau of Weights and Measures near Paris.[19] The meter bar was replaced as the definition of the fundamental unit of length in 1960 by a line in the atomic spectrum of krypton,[d][95] but the kilogram prototype remained the international standard of mass until 20 May 2019, when the kilogram was redefined in terms of the Planck constant.[96]
Historical[edit]
Iridium–osmium alloys were used in fountain pen nib tips. The first major use of iridium was in 1834 in nibs mounted on gold.[10] Since 1944, the famous Parker 51 fountain pen was fitted with a nib tipped by a ruthenium and iridium alloy (with 3.8% iridium). The tip material in modern fountain pens is still conventionally called «iridium», although there is seldom any iridium in it; other metals such as ruthenium, osmium, and tungsten have taken its place.[97]
An iridium–platinum alloy was used for the touch holes or vent pieces of cannon. According to a report of the Paris Exhibition of 1867, one of the pieces being exhibited by Johnson and Matthey «has been used in a Whitworth gun for more than 3000 rounds, and scarcely shows signs of wear yet. Those who know the constant trouble and expense which are occasioned by the wearing of the vent-pieces of cannon when in active service, will appreciate this important adaptation».[98]
The pigment iridium black, which consists of very finely divided iridium, is used for painting porcelain an intense black; it was said that «all other porcelain black colors appear grey by the side of it».[99]
Precautions[edit]
|
| This section needs to be updated. Please help update this article to reflect recent events or newly available information. (January 2023) |
Iridium in bulk metallic form is not biologically important or hazardous to health due to its lack of reactivity with tissues; there are only about 20 parts per trillion of iridium in human tissue.[19] Like most metals, finely divided iridium powder can be hazardous to handle, as it is an irritant and may ignite in air.[60] By 2015 very little is known about the toxicity of iridium compounds,[100] primarily because it is used so rarely that few people come in contact with it and those who do only with very small amounts. However, soluble salts, such as the iridium halides, could be hazardous due to elements other than iridium or due to iridium itself.[25] At the same time, most iridium compounds are insoluble, which makes absorption into the body difficult.[19]
A radioisotope of iridium, 192
Ir, is dangerous, like other radioactive isotopes. The only reported injuries related to iridium concern accidental exposure to radiation from 192
Ir used in brachytherapy.[25] High-energy gamma radiation from 192
Ir can increase the risk of cancer. External exposure can cause burns, radiation poisoning, and death. Ingestion of 192Ir can burn the linings of the stomach and the intestines.[101] 192Ir, 192mIr, and 194mIr tend to deposit in the liver, and can pose health hazards from both gamma and beta radiation.[55]
Notes[edit]
- ^ At room temperature and standard atmospheric pressure, iridium has been calculated to have a density of 22.65 g/cm3 (0.818 lb/cu in), 0.04 g/cm3 (0.0014 lb/cu in) higher than osmium measured the same way.[5] Still, the experimental X-ray crystallography value is considered to be the most accurate, and as such iridium is considered to be the second densest element.[6]
- ^ Most common oxidation states of iridium are in bold. The right column lists one representative compound for each oxidation state.
- ^ Iridium literally means «of rainbows».
- ^ The definition of the meter was changed again in 1983. The meter is currently defined as the distance traveled by light in a vacuum during a time interval of 1⁄299,792,458 of a second.
References[edit]
- ^ «Standard Atomic Weights: Iridium». CIAAW. 2017.
- ^ a b c Wang, Guanjun; Zhou, Mingfei; Goettel, James T.; Schrobilgen, Gary G.; Su, Jing; Li, Jun; Schlöder, Tobias; Riedel, Sebastian (2014). «Identification of an iridium-containing compound with a formal oxidation state of IX». Nature. 514 (7523): 475–477. Bibcode:2014Natur.514..475W. doi:10.1038/nature13795. PMID 25341786. S2CID 4463905.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Helmenstine, Anne Marie (May 6, 2022). «What is the Densest Element on the Periodic Table?». Thoughtco.com. Retrieved October 9, 2022.
- ^ Arblaster, J. W. (1989). «Densities of Osmium and Iridium Recalculations Based upon a Review of the Latest Crystallographic Data». Platinum Metals Rev. 33 (1): 14–16.
- ^ Becker, Luann (2002). «Repeated Blows» (PDF). Scientific American. 286 (3): 77–83. Bibcode:2002SciAm.286c..76B. doi:10.1038/scientificamerican0302-76. PMID 11857903. Retrieved January 19, 2016.
- ^ a b Kyte, Frank T.; Zhiming Zhou; John T. Wasson (1981). «High noble metal concentrations in a late Pliocene sediment». Nature. 292 (5822): 417–420. Bibcode:1981Natur.292..417K. doi:10.1038/292417a0. ISSN 0028-0836. S2CID 4362591.
- ^ a b c d e f g h i j k l m n Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth–Heinemann. pp. 1113–1143, 1294. ISBN 978-0-7506-3365-9. OCLC 213025882.
- ^ a b c d e f g h i j k l m n o Hunt, L. B. (1987). «A History of Iridium». Platinum Metals Review. 31 (1): 32–41.
- ^ Kittel, C. (2004). Introduction to Solid State Physics (7th ed.). Wiley-India. ISBN 978-81-265-1045-0.
- ^ Arblaster, J. W. (1995). «Osmium, the Densest Metal Known». Platinum Metals Review. 39 (4): 164. Archived from the original on 2011-09-27. Retrieved 2008-10-02.
- ^ Cotton, Simon (1997). Chemistry of Precious Metals. Springer-Verlag New York, LLC. p. 78. ISBN 978-0-7514-0413-5.
- ^ Lide, D. R. (1990). CRC Handbook of Chemistry and Physics (70th ed.). Boca Raton (FL):CRC Press. ISBN 9780849304712.
- ^ Arblaster, J. W. (1989). «Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data» (PDF). Platinum Metals Review. 33 (1): 14–16. Archived from the original on 2012-02-07. Retrieved 2008-09-17.
- ^ US 3293031A, Cresswell, Peter & Rhys, David, published 20/12/1966
- ^ Darling, A. S. (1960). «Iridium Platinum Alloys — A Critical Review Of Their Constitution And Properties». Platinum Metals Review. 4 (1): 18–26. Reviewed in «Iridium–Platinum Alloys». Nature. 186 (4720): 211. 1960. Bibcode:1960Natur.186Q.211.. doi:10.1038/186211a0. S2CID 4211238.
- ^ Biggs, T.; Taylor, S. S.; van der Lingen, E. (2005). «The Hardening of Platinum Alloys for Potential Jewellery Application». Platinum Metals Review. 49 (1): 2–15. doi:10.1595/147106705X24409.
- ^ a b c d e f g h i j Emsley, J. (2003). «Iridium». Nature’s Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 201–204. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2011). Nature’s Building Blocks: An A–Z Guide to the Elements (New ed.). New York: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ a b Perry, D. L. (1995). Handbook of Inorganic Compounds. CRC Press. pp. 203–204. ISBN 978-1439814611.
- ^ Lagowski, J. J., ed. (2004). Chemistry Foundations and Applications. Vol. 2. Thomson Gale. pp. 250–251. ISBN 978-0028657233.
- ^
Munson, Ronald A. (February 1968). «The Synthesis of Iridium Disulfide and Nickel diarsenide having the Pyrite Structure» (PDF). Inorganic Chemistry. 7 (2): 389–390. doi:10.1021/ic50060a047. - ^ a b c d e Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b c Mager Stellman, J. (1998). «Iridium». Encyclopaedia of Occupational Health and Safety. International Labour Organization. pp. 63.19. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Robinson, R.; Thoennessen, M. (2012). «Discovery of tantalum, rhenium, osmium, and iridium isotopes». Atomic Data and Nuclear Data Tables. 98 (5): 911–932. arXiv:1109.0526. Bibcode:2012ADNDT..98..911R. doi:10.1016/j.adt.2011.09.003. S2CID 53992437.
- ^ Chereminisoff, N. P. (1990). Handbook of Ceramics and Composites. CRC Press. p. 424. ISBN 978-0-8247-8006-7.
- ^ Jung, D.; Demazeau, Gérard (1995). «High Oxygen Pressure and the Preparation of New Iridium (VI) Oxides with Perovskite Structure: Sr
2MIrO
6 (M = Ca, Mg)». Journal of Solid State Chemistry. 115 (2): 447–455. Bibcode:1995JSSCh.115..447J. doi:10.1006/jssc.1995.1158. - ^ Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S. (2009). «Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII». Angewandte Chemie International Edition. 48 (42): 7879–7883. doi:10.1002/anie.200902733. PMID 19593837.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry (1st ed.). Academic Press. ISBN 978-0-12-352651-9. OCLC 47901436.
- ^ Esteruelas, Miguel A.; López, Ana M.; Oliván, Montserrat (2016). «Polyhydrides of Platinum Group Metals: Nonclassical Interactions and σ-Bond Activation Reactions». Chemical Reviews. 116 (15): 8770–8847. doi:10.1021/acs.chemrev.6b00080. PMID 27268136.
- ^ Černý, R.; Joubert, J.-M.; Kohlmann, H.; Yvon, K. (2002). «Mg
6Ir
2H
11, a new metal hydride containing saddle-like IrH5−
4 and square-pyramidal IrH4−
5 hydrido complexes». Journal of Alloys and Compounds. 340 (1–2): 180–188. doi:10.1016/S0925-8388(02)00050-6. - ^ Gulliver, D. J.; Levason, W. (1982). «The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states». Coordination Chemistry Reviews. 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- ^ a b c d e Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; et al. (2002). «Platinum group metals and compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a21_075. ISBN 978-3527306732.
- ^ Crabtree, R. H. (1979). «Iridium compounds in catalysis». Accounts of Chemical Research. 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Crabtree, R. H. (2005). The Organometallic Chemistry of the Transition Metals (PDF). Wiley. ISBN 978-0471662563. OCLC 224478241. Archived from the original (PDF) on 2012-11-19.
- ^ Janowicz, A. H.; Bergman, R. G. (1982). «Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H → M(R)(H)». Journal of the American Chemical Society. 104 (1): 352–354. doi:10.1021/ja00365a091.
- ^ Hoyano, J. K.; Graham, W. A. G. (1982). «Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex». Journal of the American Chemical Society. 104 (13): 3723–3725. doi:10.1021/ja00377a032.
- ^ Hartwig, John F. (2011). «Regioselectivity of the Borylation of Alkanes and Arenes». Chemical Society Reviews. 40 (4): 1992–2002. doi:10.1039/c0cs00156b. PMID 21336364.
- ^ a b c Weeks, Mary Elvira (1932). «The discovery of the elements. VIII. The platinum metals». Journal of Chemical Education. American Chemical Society (ACS). 9 (6): 1017–1034. Bibcode:1932JChEd…9.1017W. doi:10.1021/ed009p1017. ISSN 0021-9584.Weeks, M. E. (1968). Discovery of the Elements (7th ed.). Journal of Chemical Education. pp. 385–407. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Donald McDonald, Leslie B. Hunt (1982). A History of Platinum and its Allied Metals. Johnson Matthey Plc. pp. 7–8. ISBN 978-0-905118-83-3.
- ^ Dixon, Joshua; Brownrigg, William (1801). The literary life of William Brownrigg. To which are added an account of the coal mines near Whitehaven: And Observations on the means of preventing epidemic fevers. p. 52. Archived from the original on 24 March 2017.
- ^ Watson, Wm; Brownrigg, William (1749). «Several Papers concerning a New Semi-Metal, Called Platina; Communicated to the Royal Society by Mr. Wm. Watson F. R. S». Philosophical Transactions. 46 (491–496): 584–596. Bibcode:1749RSPT…46..584W. doi:10.1098/rstl.1749.0110. S2CID 186213277.
- ^ Marggraf, Andreas Sigismund (1760). Versuche mit dem neuen mineralischen Körper Platina del pinto genannt. Archived from the original on 24 March 2017.
- ^ Thomson, T. (1831). A System of Chemistry of Inorganic Bodies. Vol. 1. Baldwin & Cradock, London; and William Blackwood, Edinburgh. p. 693.
- ^ a b Griffith, W. P. (2004). «Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries». Platinum Metals Review. 48 (4): 182–189. doi:10.1595/147106704×4844.
- ^ Weeks, M. E. (1968). Discovery of the Elements (7th ed.). Journal of Chemical Education. pp. 414–418. ISBN 978-0-8486-8579-9. OCLC 23991202.
- ^ Tennant, S. (1804). «On Two Metals, Found in the Black Powder Remaining after the Solution of Platina». Philosophical Transactions of the Royal Society of London. 94: 411–418. doi:10.1098/rstl.1804.0018. JSTOR 107152.
- ^ Trigg, G. L. (1995). «Recoilless Emission and Absorption of Radiation». Landmark Experiments in Twentieth Century Physics. Courier Dover Publications. pp. 179–190. ISBN 978-0-486-28526-9. OCLC 31409781.
- ^ Mössbauer, R. L. (1958). «Gammastrahlung in Ir191«. Zeitschrift für Physik A (in German). 151 (2): 124–143. Bibcode:1958ZPhy..151..124M. doi:10.1007/BF01344210. S2CID 121129342.
- ^ Waller, I. (1964). «The Nobel Prize in Physics 1961: presentation speech». Nobel Lectures, Physics 1942–1962. Elsevier.
- ^ «History/Origin of Chemicals». NASA. Retrieved 1 January 2013.
- ^ Chen, Hsin-Yu; Vitale, Salvatore; Foucart, Francois (2021-10-01). «The Relative Contribution to Heavy Metals Production from Binary Neutron Star Mergers and Neutron Star–Black Hole Mergers». The Astrophysical Journal Letters. American Astronomical Society. 920 (1): L3. arXiv:2107.02714. Bibcode:2021ApJ…920L…3C. doi:10.3847/2041-8213/ac26c6. hdl:1721.1/142310. ISSN 2041-8205. S2CID 238198587.
- ^ Scott, E. R. D.; Wasson, J. T.; Buchwald, V. F. (1973). «The chemical classification of iron meteorites—VII. A reinvestigation of irons with Ge concentrations between 25 and 80 ppm». Geochimica et Cosmochimica Acta. 37 (8): 1957–1983. Bibcode:1973GeCoA..37.1957S. doi:10.1016/0016-7037(73)90151-8.
- ^ a b «Iridium» (PDF). Human Health Fact Sheet. Argonne National Laboratory. 2005. Archived from the original (PDF) on March 4, 2012. Retrieved 2008-09-20.
- ^ Xiao, Z.; Laplante, A. R. (2004). «Characterizing and recovering the platinum group minerals—a review». Minerals Engineering. 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ «Cuproiridsite CuIr2S4» (PDF). Hanbook of mineralogy.org. Retrieved 3 March 2022.
- ^ Vitaly A. Stepanov; Valentina E. Kungurova; Vitaly I. Gvozdev (2010). «Irasite Discovery in Copper-Nickel Ores of Shanuch Deposit (KAMCHATKA)» (PDF). New Data on Minerals. 45: 23. Retrieved 3 March 2022.
- ^ Garuti, Giorgio; Gazzotti, Moreno; Torres-Ruiz, Jose (1995). «Iridium, Rhodium, and Platinum Sulfides in Chromitites from the Ultramafic Massifs of Finero, Italy, and Ojen, Spain» (PDF). The Canadian Mineralogist. 33: 509–520. Retrieved 2 November 2022.
- ^ a b c d Seymour, R. J.; O’Farrelly, J. I. (2012). «Platinum-Group Metals». Kirk Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub3. ISBN 978-0471238966.
- ^ a b Goldberg, Hodge; Kay, V; Stallard, M; Koide, M (1986). «Some comparative marine chemistries of platinum and iridium». Applied Geochemistry. 1 (2): 227–232. Bibcode:1986ApGC….1..227G. doi:10.1016/0883-2927(86)90006-5.
- ^ a b c Wells, Boothe (1988). «Iridium in marine organisms». Geochimica et Cosmochimica Acta. 52 (6): 1737–1739. Bibcode:1988GeCoA..52.1737W. doi:10.1016/0016-7037(88)90242-6.
- ^ a b c Sawlowicz, Z (1993). «Iridium and other platinum-group elements as geochemical markers in sedimentary environments». Palaeogeography, Palaeoclimatology, Palaeoecology. 104 (4): 253–270. Bibcode:1993PPP…104..253S. doi:10.1016/0031-0182(93)90136-7.
- ^ Crocket, Macdougall; Harriss, R (1973). «Gold, palladium and iridium in marine sediments». Geochimica et Cosmochimica Acta. 37 (12): 2547–2556. Bibcode:1973GeCoA..37.2547C. doi:10.1016/0016-7037(73)90264-0.
- ^ Peucker-Ehrenbrink, B (2001). «Iridium and Osmium as Tracers of Extraterrestrial Matter in Marine Sediments». Accretion of Extraterrestrial Matter Throughout Earth’s History. pp. 163–178. doi:10.1007/978-1-4419-8694-8_10. ISBN 978-1-4613-4668-5.
- ^ Barker, J; Edward, A (1968). «Accretion rate of cosmic matter from iridium and osmium contents of deep-sea sediments». Geochimica et Cosmochimica Acta. 32 (6): 627–645. Bibcode:1968GeCoA..32..627B. doi:10.1016/0016-7037(68)90053-7.
- ^ Colodner, D; Edmond, J (1992). «Post-depositional mobility of platinum, iridium and rhenium in marine sediments». Nature. 358 (6385): 402–404. Bibcode:1992Natur.358..402C. doi:10.1038/358402a0. S2CID 37386975.
- ^ a b Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. (1980). «Extraterrestrial cause for the Cretaceous–Tertiary extinction» (PDF). Science. 208 (4448): 1095–1108. Bibcode:1980Sci…208.1095A. CiteSeerX 10.1.1.126.8496. doi:10.1126/science.208.4448.1095. PMID 17783054. S2CID 16017767.
- ^ Hildebrand, A. R.; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). «Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico». Geology. 19 (9): 867–871. Bibcode:1991Geo….19..867H. doi:10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2.
- ^ Frankel, C. (1999). The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions. Cambridge University Press. ISBN 978-0-521-47447-4. OCLC 40298401.
- ^ Ryder, G.; Fastovsky, D. E.; Gartner, S. (1996). The Cretaceous-Tertiary Event and Other Catastrophes in Earth History. Geological Society of America. p. 47. ISBN 978-0-8137-2307-5.
- ^ Toutain, J.-P.; Meyer, G. (1989). «Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)». Geophysical Research Letters. 16 (12): 1391–1394. Bibcode:1989GeoRL..16.1391T. doi:10.1029/GL016i012p01391.
- ^ a b c Platinum-Group Metals. U.S. Geological Survey Mineral Commodity Summaries
- ^ Singerling, Sheryl A.; Schulte, Ruth F. (August 2021). «Platinum-Group Metals». 2018 Minerals Yearbook (PDF). USGS. p. 57.11.
- ^ Hagelüken, C. (2006). «Markets for the catalysts metals platinum, palladium, and rhodium» (PDF). Metall. 60 (1–2): 31–42. Archived from the original (PDF) on March 4, 2009.
- ^
«Platinum 2013 Interim Review» (PDF). Platinum Today. Johnson Matthey. Retrieved 2014-01-10. - ^ a b Ryan, Marge (2022-11-16). «Recycling and thrifting: the answer to the iridium question in electrolyser growth».
- ^ Gilchrist, Raleigh (1943). «The Platinum Metals». Chemical Reviews. 32 (3): 277–372. doi:10.1021/cr60103a002. S2CID 96640406.
- ^ Ohriner, E. K. (2008). «Processing of Iridium and Iridium Alloys». Platinum Metals Review. 52 (3): 186–197. doi:10.1595/147106708X333827.
- ^ Hunt, L. B.; Lever, F. M. (1969). «Platinum Metals: A Survey of Productive Resources to industrial Uses» (PDF). Platinum Metals Review. 13 (4): 126–138. Archived from the original (PDF) on 2008-10-29. Retrieved 2008-10-01.
- ^ «Mineral Yearbook 2020 tables-only release». USGS.
- ^ a b Handley, J. R. (1986). «Increasing Applications for Iridium». Platinum Metals Review. 30 (1): 12–13.
- ^ Crookes, W. (1908). «On the Use of Iridium Crucibles in Chemical Operations». Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. 80 (541): 535–536. Bibcode:1908RSPSA..80..535C. doi:10.1098/rspa.1908.0046. JSTOR 93031.
- ^ Egorova, R. V.; Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T. (1979). «Spinnerets for viscose rayon cord yarn». Fibre Chemistry. 10 (4): 377–378. doi:10.1007/BF00543390. S2CID 135705244.
- ^ Graff, Muriel; Kempf, Bernd; Breme, Jürgen (2005-12-23). «Iridium Alloy for Spark Plug Electrodes». Materials for Transportation Technology. Weinheim, FRG: Wiley-VCH Verlag GmbH & Co. KGaA. pp. 1–8. doi:10.1002/3527606025.ch1. ISBN 9783527301249.
- ^ Cheung, H.; Tanke, R. S.; Torrence, G. P. (2000). «Acetic acid». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a01_045. ISBN 978-3527306732.
- ^ Jones, Jane H. (2000). «The cativa™ process for the manufacture of acetic acid». Platinum Metals Review. 44 (3): 94–105.
- ^ Roseblade, S. J.; Pfaltz, A. (2007). «Iridium-catalyzed asymmetric hydrogenation of olefins». Accounts of Chemical Research. 40 (12): 1402–1411. doi:10.1021/ar700113g. PMID 17672517.
- ^ Ikariya, Takao; Blacker, A. John (2007). «Asymmetric Transfer Hydrogenation of Ketones with Bifunctional Transition Metal-Based Molecular Catalysts†». Accounts of Chemical Research. 40 (12): 1300–1308. doi:10.1021/ar700134q. PMID 17960897.
- ^ Matthias Beller, Hans-Ulrich Blaser, ed. (2012). Organometallics as Catalysts in the Fine Chemical Industry. Topics in Organometallic Chemistry. Vol. 42. Berlin, Heidelberg: Springer. ISBN 978-3-642-32832-9.
- ^ Halmshaw, R. (1954). «The use and scope of Iridium 192 for the radiography of steel». British Journal of Applied Physics. 5 (7): 238–243. Bibcode:1954BJAP….5..238H. doi:10.1088/0508-3443/5/7/302.
- ^ Hellier, Chuck (2001). Handbook of Nondestructive Evlaluation. The McGraw-Hill Companies. ISBN 978-0-07-028121-9.
- ^ Jean Pouliot; Luc Beaulieu (2010). «13 — Modern Principles of Brachytherapy Physics: From 2-D to 3-D to Dynamic Planning and Delivery». In Richard T. Hoppe; Theodore Locke Phillips; Mack Roach (eds.). Leibel and Phillips Textbook of Radiation Oncology (3rd ed.). W.B. Saunders. pp. 224–244. doi:10.1016/B978-1-4160-5897-7.00013-5. ISBN 9781416058977.
- ^ Ulbricht, Christoph; Beyer, Beatrice; Friebe, Christian; Winter, Andreas; Schubert, Ulrich S. (2009). «Recent Developments in the Application of Phosphorescent Iridium(III) Complex Systems». Advanced Materials. 21 (44): 4418–4441. Bibcode:2009AdM….21.4418U. doi:10.1002/adma.200803537. S2CID 96268110.
- ^ Penzes, W. B. (2001). «Time Line for the Definition of the Meter». National Institute for Standards and Technology. Retrieved 2008-09-16.
- ^ General section citations: Recalibration of the U.S. National Prototype Kilogram, R. S. Davis, Journal of Research of the National Bureau of Standards, 90, No. 4, July–August 1985 (5.5 MB PDF Archived 2017-02-01 at the Wayback Machine); and The Kilogram and Measurements of Mass and Force, Z. J. Jabbour et al., J. Res. Natl. Inst. Stand. Technol. 106, 2001, 25–46 (3.5 MB PDF)
- ^ Mottishaw, J. (1999). «Notes from the Nib Works—Where’s the Iridium?». The PENnant. XIII (2).
- ^ Crookes, W., ed. (1867). «The Paris Exhibition». The Chemical News and Journal of Physical Science. XV: 182.
- ^ Pepper, J. H. (1861). The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements. Routledge, Warne, and Routledge. p. 455.
- ^ Iavicoli, Ivo; Leso, Veruscka (2015). «Iridium». Handbook on the Toxicology of Metals. pp. 855–878. doi:10.1016/B978-0-444-59453-2.00040-8. ISBN 9780444594532.
- ^ «Radioisotope Brief: Iridium-192 (Ir-192)» (PDF). Radiation Emergencies. Centers for Disease Control and Prevention. 2004-08-18. Retrieved 2008-09-20.
External links[edit]
![]()
Wikimedia Commons has media related to Iridium.
![]()
Look up iridium in Wiktionary, the free dictionary.
- Iridium at The Periodic Table of Videos (University of Nottingham)
- Iridium in Encyclopædia Britannica
Иридий в таблице менделеева занимает 77 место, в 6 периоде.
| Символ | Ir |
| Номер | 77 |
| Атомный вес | 192.2170000 |
| Латинское название | Iridium |
| Русское название | Иридий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема иридия
Ir: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7
Короткая запись:
Ir: [Xe]6s2 4f14 5d7
Порядок заполнения оболочек атома иридия (Ir) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Иридий имеет 77 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
7 электронов на 5d-подуровне
Степень окисления иридия
Атомы иридия в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы иридия
Валентность Ir
Атомы иридия в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность иридия характеризует способность атома Ir к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ir
Квантовые числа определяются последним электроном в конфигурации,
для атома Ir эти числа имеют значение N = 5, L = 2, Ml = -1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Ir:
Eo = 880 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Ir в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
химический элемент с атомным номером 77
Химический элемент с атомным номером 77
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иридий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серебристо-белый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std ( Ir) | 192.217 (2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иридий в периодической таблице | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Конфигурация электронов | [Xe ] 4f 5d 6s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 2719 K (2446 ° C, 4435 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 4403 K (4130 ° C, 7466 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 22, 56 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 19 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 41,12 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 564 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,10 Дж / ( моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8, + 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 136 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 141 ± 6 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | изначальное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированный кубический (fcc)  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 4825 м / с (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 6,4 мкм / (м · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 147 Вт / (м · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 47,1 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | парамагнитное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное восприимчивость | + 25,6 · 10 см / моль (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 528 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 210 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 320 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 1760–2200 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 1670 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439- 88-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие и первое выделение | Смитсон Теннант (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы иридия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Иридий — это химический элемент с символом Irи атомным номером 77. Очень твердый, хрупкий, серебристо-белый переходный металл из платиновой группы, иридий считается вторым по плотности металлом (после осмия ) с плотностью 22,56 г / см, как определено экспериментальной рентгеновской кристаллографией. Однако при комнатной температуре и стандартном атмосферном давлении иридий был рассчитан так, чтобы иметь плотность 22,65 г / см, что на 0,04 г / см выше, чем у осмия, измеренного таким же образом. Не менее, экспериментальное значение рентгеновской кристаллографии считается наиболее точным, поскольку такой иридий считается вторым по плотности. Это наиболее коррозионностойкий металл даже при температуре до 2000 ° C. Хотя только некоторые расплавленные соли и галогены вызывают коррозию твердого иридия, мелкодисперсная иридиевая пыль гораздо более реактивна и может воспламеняться.
Иридий был открыт в 1803 году среди нерастворимых примесей в природной платине. Смитсон Теннант, главный первооткрыватель, назвал иридиум в честь греческой богини Ирис, олицетворения радуги, из-за ярких и разнообразных цветов ее солей. Иридий — один из самых редких элементов в земной коре, с годовым производством и потреблением всего три тонны. Ir и Ir являются единственными двумя встречами в природе изотопами иридия, а также единственными стабильными изотопами ; последняя более многочисленна.
Наиболее важными используемыми соединениями иридия являются соли и кислоты, которые он образует с хлором, хотя иридий также образует ряд металлоорганических соединений, используемых в промышленности катализ и в исследованиях. Металлический иридий используется, когда требуется высокая коррозионная стойкость при высоких температурах, например, в высокоэффективных свечах зажигания, тиглях для перекристаллизации полупроводников при высоких температурах и в электродах для производства хлора. в хлорщелочном процессе. Радиоизотопы иридия используются в некоторых радиоизотопных термоэлектрических генераторах.
Иридий содержат в метеоритах в гораздо большем количестве, чем в земной коре. По этой причине необычно высокое содержание иридия в глинистом слое на граница мела и палеогена породило гипотезу Альвареса о том, что удар массивного внеземного объекта вызвал исчезновение других видов 66 миллионов лет назад. Точно так же иридиевая аномалия в образцах керна из Тихого океана свидетельствует о ударе Элтанина примерно 2,5 миллиона лет назад.
Считается, что общее иридия на планете Земля намного выше, чем в породах земной коры, но, как и в случае других металлами, платиновой группы, высокая плотность и тенденция Связь иридия с железом заставила большую часть иридия опускаться ниже коры, когда планета была молодой и все еще расплавленной.
Содержание
- 1 Характеристики
- 1.1 Физические свойства
- 1.2 Химические свойства
- 1.3 Соединения
- 1.4 Изотопы
- 2 История
- 2.1 Платиновая группа
- 2.2 Discovery
- 2.3 Металлообработка и применение
- 3 Происхождение
- 3.1 Граница между меловым периодом и палеогеном
- 4 Производство
- 5 Области применения
- 5.1 Промышленное и медицинское
- 5.2 Научное
- 5.3 Историческое
- 6 Меры предосторожности
- 7 Примечания
- 8 Ссылки
- 9 Внешние ссылки
Характеристики
Физические свойства
 Одна тройская унция (31,1035 грам ) из дугового плавления иридия
Одна тройская унция (31,1035 грам ) из дугового плавления иридия
Член платиновой группы металлов, иридий белый, напоминает платину, но с легким желтоватым оттенком. Из-за его твердости, хрупкости и очень высокой точки плавления твердый иридий трудно обрабатывать, формировать или обрабатывать; таким образом, вместо этого обычно используется порошковая металлургия. Это единственный металл, который сохраняет хорошие механические свойства на воздухе при температуре выше 1600 ° C (2910 ° F). Он имеет 10-е место по самой высокой температуре кипения среди всех элементов и становится сверхпроводником при температурех ниже 0,14 K.
. Модуль упругости иридия является вторым по величине среди металлы, уступая только осмию. Это вместе с высоким модулем сдвига и очень низкой величиной для коэффициента Пуассона (отношение продольной и поперечной деформации ) указывает на высокую степень жесткость и сопротивление деформации, из-за которых изготовление из него полезных компонентов стало проблемой. Несмотря на эти ограничения и стоимость иридия, разработан ряд приложений, в которых механическая прочность является важным фактором в некоторых из тяжелых условий, встречающихся в современной технологии.
Измеренная плотность иридия. лишь немного ниже (примерно на 0,12%), чем у осмия, из известных металлов. Возникла некоторая неоднозначность относительно того, какой из двух элементов был более плотным, из-за небольшого размера разницы в плотности и трудностей с ее точным измерением, но с повышенными коэффициентами, используемыми для расчета плотности, рентгеновский кристаллографический данные показали плотность 22,56 г / см для иридия и 22,59 г / см для осмия.
Химические свойства
Иридий является наиболее коррозионно-стойким из известных металлов: он не подвергается воздействию любых кислота, царская водка, расплавленные металлы или силикаты при высоких температурах. Однако он может подвергаться воздействию некоторых расплавленных солей, таких как цианид натрия и цианид калия, а также кислород и галогены (особенно фтор ) при более высоких температурах. Иридий также непосредственно реагирует с серой при атмосферном давлении с образованием дисульфида иридия.
Соединения
| Степени окисления | |
|---|---|
| −3 | [Ir (CO). 3]. |
| −1 | [Ir (CO). 3(PPh. 3)]. |
| 0 | Ir. 4(CO). 12 |
| +1 | [Ir (CO) Cl (PPh. 3). 2] |
| +2 | IrCl. 2 |
| +3 | IrCl. 3 |
| +4 | IrO. 2 |
| +5 | Ir. 4F. 20 |
| +6 | IrF. 6 |
| +7 | ) [(η. -O. 2) IrO. 2]. |
| +8 | ) IrO. 4 |
| +9 | [IrO. 4]. |
Иридий образует соединения в степенях окисления от −3 до +9; наиболее распространенными степенями окисления являются +3 и +4. Но включает IrF. 6 и два смешанных оксида Sr. 2MgIrO. 6и Sr. 2CaIrO. 6. Кроме того, в 2009 году сообщалось, что иридий (VIII) оксид (IrO. 4) был получен в условиях матричной изоляции (6 K в Ar) УФ-облучением иридий-пероксокомплекса. Однако ожидается, что этот вид не будет стабильным в виде твердого вещества при более высоких температурах. 9), которая также является наивысшей из зарегистрированных для любого элемента ента, известна только для одного катиона, IrO. 4; он известен как газовая фаза и представляет собой не образовании каких-либо солей.
Диоксид иридия, IrO. 2, сине-черное твердое вещество, является единственным хорошо охарактеризованным оксидом иридия. полуторный оксид, Ir. 2O. 3описан как сине-черный порошок, который окисляется до IrO. 2с помощью HNO. 3. Соответствующие дисульфиды, диселениды, сесквисульфиды и сесквиселениды известны, и также сообщалось о IrS. 3. Иридий также образует иридаты со степенями окисления +4 и +5, такие как K. 2IrO. 3и KIrO. 3, которые могут быть получены по реакции оксида калия или калия. супероксид с иридием при высоких температурах.
Хотя бинарные гидриды иридия, Ir. xH. yне известны, известны комплексы, содержащие IrH. 5и IrH. 6, где иридий имеет степень окисления + 1 и +3 соответственно. Полагают, что тройной гидрид Mg. 6Ir. 2H. 11содержит как IrH. 5, так и анион IrH. 4с 18 электронами.
Моногалогениды или дигалогениды неизвестны, тогда как тригалогениды IrX. 3не известны все галогены. Для степеней окисления +4 и выше известны только тетрафторид, пентафторид и гексафторид. Гексафторид иридия, IrF. 6, представляет собой летучее и высокоактивное твердое вещество желтого цвета, состоящее из октаэдрических молекул. Он разлагается в воде и восстанавливается до IrF. 4, кристаллического твердого вещества, под действием иридиевой черноты. Пентафторид иридия имеет аналогичные свойства, но на самом деле это тетрамер, Ir. 4F. 20, образованный четырьмя октаэдрами с общими углами. Металлический иридий растворяется в расплавленных цианидах щелочных металлов с образованием Ir (CN). 6(гексацианоиридат).
 Комплекс Васьки
Комплекс Васьки
Гексахлоридовая (IV) кислота, H. 2IrCl. 6, и ее аммониевая соль являются наиболее важными соединениями иридия с промышленной точки зрения. Они участвуют в очистке иридии и используются в качестве трансляций для других соединений и других соединений, а также участвуют в обеспечении покрытий анодов. Ион IrCl. 6имеет интенсивный темно-коричневый цвет и может быть легко восстановлен до более светлого IrCl. 6и наоборот. Трихлорид иридия, IrCl. 3, который может быть получен в безводной форме в результате прямого окисления иридиевого порошка хлором при 650 ° C или в гидратированной форме путем растворения Ir. 2O. 3в соляной кислоте часто используется в качестве исходного материала для синтеза других соединений Ir (III). Другим соединением, используемым в качестве исходного материала, является гексахлориридат (III) аммония, (NH. 4). 3IrCl. 6. Комплексы иридия (III) являются диамагнитными (низкоспиновыми ) и обычно имеют октаэдрическую молекулярную геометрию.
Органоиридиевые соединения содержат связи иридий– углерод, где металл обычно находится в более низких степенях окисления. Например, в тетраиридии проявляет нулевая степень окисления. додекакарбонил., Ir. 4(CO). 12, который является наиболее стабильным и распространенным бинарным карбонилом иридия. В этом соединении каждого из элементов иридия связана с тремя другими, образуют тетраэдрический кластер. Одним из них комплекс Васьки, IrCl (CO) [P (C. 6H. 5). 3]. 2) обладает необычным свойством связывания с молекулами. дикислорода, О. 2. Другой — катализатор Крэбтри, гомогенный катализатор для эффекта гидрирования. соединения бот h квадратные плоские, d комплексы, всего 16 валентных электронов, что составляет их реакционную способность.
светодиод на основе иридия материал был задокументирован и оказался намного ярче, чем DPA или PPV, поэтому может стать средством гибкого освещения OLED в будущем.
Изотопы
Иридий содержит два встречающихся в природе стабильных изотопа, Ir и Ir, с естественным содержанием 37,3% и 62,7% соответственно. Также было синтезировано не менее 37 радиоизотопов с диапазоном массового числа от 164 до 202. Ir, который находится между двумя стабильными изотопами, является наиболее стабильным. радиоизотоп с периодом полураспада 73 827 дней, который нашел применение в брахитерапии и в промышленности радиографии, особенно для неразрушающего сварных швов стали в масле. и газовая промышленность; Источники иридия-192 были вовлечены в ряд радиологических аварий. Три других изотопа имеют период полураспада не менее суток — Ir, Ir и Ir. Изотопы с массой ниже 191 распадаются в результате некоторых комбинаций β-распада, α-распада и (редко) испускания протона, за исключением Ir, который распадается на захват электронов. Синтетические изотопы тяжелее 191 распадаются в результате β-распада, хотя Ir также имеет небольшой путь распада электронного захвата. Все известные изотопы иридия были открыты между 1934 и 2008 годами, причем самыми последними открытиями являются Ir.
Было охтеризовано по крайней мере 32 метастабильных изомера, в диапазоне массовых чисел от 164 до 197. Наиболее стабильным из них является Ir, распадается в результате изомерного перехода с периодом полураспада 241 год, что делает его более стабильным, чем любой из синтетических изотопов иридия в их основных состояниях. Наименее стабильным изомером является Ir с периодом полураспада всего 2 мкс. Изотоп Ir был первым из всех элементов, показавших эффект Мёссбауэра. Это делает его полезным для мессбауэровской спектроскопии для исследований в области физики, химии, биохимии, металлургии и минералогии.
История
Платиновая группа
 Греческая богиня Ирис, в честь которого был назван иридий.
Греческая богиня Ирис, в честь которого был назван иридий.
Открытие иридия неразрывно связано с открытием платины и других металлов платиновой группы. Самородная платина, использованная древние эфиопы и южноамериканские культуры, всегда содержала небольшое количество других металлов платиновой группы, включая иридий. Платина попала в Европу как («сильверетта»), найденная в 17 веке испанскими завоевателями в регионе, ныне известном как департамент Чоко в Колумбии. Открытие того, что этот металл не является сплавом известных элементов, а представляет собой отдельный новый элемент, произошло только в 1748 году.
Discovery
Химики, изучавшие платину, растворили ее в воде. regia (смесь соляной и азотной кислоты ) для создания растворимых солей. Они всегда наблюдали небольшое количество темного нерастворимого осадка. Джозеф Луи Пруст думал, что это был графит. Французские химики Виктор Колле-Дескотиль, Антуан Франсуа, граф де Фуркрой и Луи Николя Воклен также наблюдали черный остаток в 1803 году, но не получили достаточно для дальнейших экспериментов.
В 1803 году британский ученый Смитсон Теннант (1761–1815) проанализировал нерастворимый остаток и пришел к выводу, что он должен содержать новый металл. Воклен обработал порошок поочередно щелочью и кислотами и получил новый летучий оксид, который, как он полагал, был из этого нового металла, который он назвал птеном от греческого слова πτηνός ptēnós, «крылатый». Теннант, который имел преимущество в гораздо большем количестве остатков, продолжил свои исследования и идентифицировал два ранее неоткрытых элемента в черном остатке, иридий и осмий. Он получил темно-красные кристаллы (вероятно, Na. 2[IrCl. 6] · nH. 2O) последовательностью реакций с гидроксидом натрия и соляной кислотой. Он назвал иридий в честь Ирис (Ἶρις), греческой крылатой богини радуги и посланницы олимпийских богов, потому что многие из солей, которые он добыл, были сильно окрашены. Об открытии новых элементов было задокументировано в письме Королевскому обществу от 21 июня 1804 года.
Металлообработка и приложения
Британский ученый Джон Джордж Чайлд был первым, кто расплавил образец иридия в 1813 году с помощью «величайшейгальванической батареи, которая когда-либо была построена »(в то время). Первым, кто получил иридий высокой чистоты, был Роберт Хейр в 1842 году. Он обнаружил, что его плотность составляет около 21,8 г / см, и отметил, что металл почти неплавкий и очень твердый. Первая плавка в заметном количестве была произведена Анри Сент-Клер Девиль и Жюлем Анри Дебре в 1860 году. Им потребовалось сжечь более 300 литров чистого O. 2и H <895.>газа на каждый килограмм иридия.
Эти крайние трудности при плавлении металла ограничивают возможности обращения с иридием. Джон Исаак Хокинс искал тонкий и твердый наконечник для перьев авторучки, и в 1834 году ему удалось создать золотую ручку с иридиевым наконечником. В 1880 году Джон Холланд и Уильям Лофланд Дадли смогли расплавить иридий, добавив фосфор, и запатентовали этот процесс в США; Британская компания Johnson Matthey позже заявила, что они использовали аналогичный с 1837 года и уже представили плавленый иридий на ряде Всемирных ярмарок. Первое использование сплава иридия с рутением в термопарах было сделано Отто Фойсснером в 1933 году. Это позволяет измерять высокие температуры воздуха до 2000 ° C (3630 ° F).
В Мюнхене, Германия, в 1957 году Рудольф Мёссбауэр в так называемом «знаменательном эксперименте в физике двадцатого века» обнаружил резонансное излучение без отдачи. и поглощение гамма-лучей атомами в твердом металлическом образце, содержащем только Ir. Это явление, известное как эффект Мёссбауэра (с которым тех пор наблюдалось для других ядер, таких как Fe ), и получившее развитие как мессбауэровская спектроскопия, стало важным вкладом в исследования в области физики, химии, биохимии, металлургии и минералогии. Мёссбауэр получил Нобелевскую премию по физике в 1961 году в возрасте 32 лет, всего через три года после публикации своего открытия. В 1986 г. Рудольф Мёссбауэр был удостоен за свои достижения медалей Альберта Эйнштейна и Эллиота Крессона.
Возникновение
 Иридий — один из наименее распространенных элементов в земной коре.
Иридий — один из наименее распространенных элементов в земной коре.  Метеорит Уилламетт, шестой по величине метеорит, обнаруженный в мире, содержит 4,7 части на иридия.
Метеорит Уилламетт, шестой по величине метеорит, обнаруженный в мире, содержит 4,7 части на иридия.
Иридий — один из девяти наименования распространенных стабильных элементов в земной коре, имеющий среднюю миллионную долю 0,001 частей на в породах земной коры; платины в 10 раз больше, золота в 40 раз больше, а серебра и ртути в 80 раз больше. Теллур почти так же богат, как иридий. В его небольшом количестве в породах земной коры, иридий относительно часто встречается отличие в метеоритах с содержаниемми 0,5 ppm или более. Считается, что общая иридия на Земле намного выше, чем то, что наблюдается в породах земной коры, но из-за плотности и сидерофильного («железолюбивого») характера иридия он опустился ниже коры. и в ядро Земли, когда планета еще была расплавленной.
Иридий встречается в природе как несвязанный элемент или в природе сплавх ; особенно сплавы иридий-осмий, осмиридий (богатый осмием) и иридосмий (богатый иридием). В месторождениях никеля и меди металлы платиновой группы встречаются в виде сульфидов (т.е. (Pt, Pd) S), теллуридов (т.е. PtBiTe), антимонидов (PdSb) и арсенидов (т.е. PtAs. 2). Во всех этих соединенийх платина заменена небольшой первой иридия и осмия. Как и все металлы платиновой группы, иридий естественным образом в соединении с сырым никелем или сыройью. Известен ряд минералов с преобладанием иридия, в том числе иридий как видообразующий элемент. Они крайне редки и часто представляют собой иридиевые аналоги вышеперечисленных. Примерами являются ирарсит и купроиридсит, если укрепить некоторые.
В земной коре иридий находится в самых высоких технологиях в трех типах логических структур: магматические отложения (интрузии коры снизу), ударные кратеры и отложения, переработанные из одно из бывших построек. Самые большие известные первичные запасы находятся в магматическом комплексе Бушвельд в Южной Африке (рядом с самым известным ударным кратером, кратером Вредефорт ), хотя и большая медная — месторождение никеля Норильска в России и Бассейн Садбери (также ударный кратер) в Канаде также являются значительными источниками иридия. Меньшие запасы находятся в США. Иридий также используются группы вторичных металлов в сочетании с другими металлами платиновой в аллювиальных месторождениях. Аллювиальные месторождения, используемые доколумбовыми людьми в департаменте Чоко в Колумбии, все еще средства металлов платиновой группы. По состоянию на 2003 год мировые запасы не подсчитывались.
Наличие границы мела и палеогена
 Красная стрелка указывает на границу мела и палеогена.
Красная стрелка указывает на границу мела и палеогена.
граница мела и палеогена 66 миллионов лет назад, отмечая временную границу между меловым и палеогеновым периодами геологического времени, был идентифицирован тонким слоем из глины, богатой иридием. Группа во главе с Луисом Альваресом предложила в 1980 году внеземное происхождение этого иридия, приписав его удару астероиду или комете. Их теория, известная как гипотеза Альвареса, сейчас широко используется для объяснения исчезновения нептичьих динозавров. Позднее под полуостровом Юкатан (кратер Чиксулуб ) была обнаружена крупная погребенная структура ударного кратера с предполагаемым возрастом около 66 миллионов лет. Дьюи М. Маклин и другие утверждают, что иридий мог иметь вулканическое происхождение, потому что ядро Земли богато иридием, а действующие вулканы, такие как Питон де Ла Фурнез, на острове Реюньон, все еще производят иридий.
Производство
| Год | Потребление. (тонны) | Цена. (USD / ozt ) |
|---|---|---|
| 2001 | 2,6 | 415,25 |
| 2002 | 2,5 | 294,62 |
| 2003 | 3,3 | 93,02 |
| 2004 | 3.60 | 185,33 |
| 2005 | 3,86 | 169,51 |
| 2006 | 4,08 | 349,45 |
| 2007 | 3,70 | 444,43 |
| 2008 | 3.10 | 448,34 |
| 2009 | 2,52 | 420,4 |
| 2010 | 10,40 | 642,15 |
В 2019 году мировое производство иридия составило 242000 унций (6860 кг).
Иридий также коммерчески добывается как побочный продукт из никеля и меди <339 Во время избрать при рафинировании меди и никеля, благородных металлов, таких как серебро, золото и металлы платиновой группы, а также селен и теллур оседают на дно электролизер как анодный шлам, который является отправной точкой для их извлечения. Чтобы отделить металлы, их сначала нужно растворить. Доступны несколько методов разделения в зависимости от природы смесей; два типа способов — слияние с пероксидом натрия с последующим растворением в царской водке и растворением в смесях хлора с соляной кислотой.
После смеси раствор, иридий отделяют от других металлов платиновой группы осаждением гексахлориридата аммония ((NH. 4). 2IrCl. 6) или экстракцией IrCl. 6органическими аминами. Второй метод можно спланировать как непрерывную жидкостно-жидкостную экстракцию, и он больше подходит для производства в промышленных масштабах, в любом случае продукт восстанавливается с использованием водорода, давая металл в виде порошка или губки, которую можно обрабатывать с использованием методов порошковой металлургии.
Цены на иридий колебались в значительном диапазоне. При относительно небольшом объеме на мировом рынке (по сравнению с другими промышле) нными металлами, такими как алюминий или медь ), цена иридия сильно реагирует на нестабильность производства, спроса, спекуляции, накопления запасов и политики в странах-производителях. Используемое для промышленного выращивания монокристаллов вещество с редкими свойствами, на его цену повлияли изменения в современной технологии: использование этого метода в период с 2001 по 2003 год было с избытком тиглей из Ir. Аналогичным образом, цены выше 1000 долларов США за период с 2010 по 2014 годы объясняются установкой оборудования для производства монокристалла сапфира, используемого в светодиодной подсветке для телевизоров.
Применения
Спрос на иридий вырос с 2,5 тонны в 2009 году до 10,4 тонны в 2010 году, в основном из-за того, что приложения, связанные с электроникой, выросли с 0,2 до 6 тонн — иридиевые тигли обычно используется для выращивания высококачественных монокристаллов, спрос на которые резко возрос. Прогнозируется, что это увеличение потребления иридия прекратится из-за накопления запасов тиглей, как это произошло ранее в 2000-х годах. Другие основные области применения включают свечи зажигания, на которые в 2007 году израсходовано 0,78 тонны иридия, электроды для хлорно-щелочного процесса (1,1 т в 2007 году) и химических катализаторов (0,75 т в 2007 году).
Промышленные и медицина
 Молекулярная структура Ir (mppy). 3
Молекулярная структура Ir (mppy). 3
Высокая температура плавления, твердость и коррозионная стойкость иридия и его сплавов большинства определяет его применений. Иридий (или иногда сплавы платины или осмия) и в основном иридиевые сплавы имеют низкий износ, например, для многопористых фильер, которые через расплав пластичного полимера экструдируется с образованием волокон, таких как район. Осмий-иридий используется для подшипников компаса и весов.
Их устойчивость к дуговой эрозии делает иридиевые сплавы идеальными для электрических контактов для электрических контактов свечей зажигания и на основе иридия свечи зажигания используются в авиации.
Чистый иридий очень хрупок, до такой степени, что его трудно сваривать из-за трещин в зоне термического влияния, но его можно сделать более пластичным, добавив небольшие количества титана и цирконий (0,2% каждого, по-видимому, работает хорошо).
Коррозия и жаропрочность делают иридий важный легирующий агентом. Некоторые электрические детали авиационных двигателей долговлены из сплава иридия, а сплав иридий — титан используется для изготовления глубоководных труб из-за его коррозионной стойкости. Иридий также используется в качестве упрочняющего агента в платиновых сплавах. Твердость по Виккерсу чистой платины составляет 56 HV, тогда как платина с 50% иридия может достичь более 500 HV.
Устройства, которые должны выдерживать высокие температуры, часто изготавливаются из иридия. Например, высокотемпературные тигли из иридия используются в процессе Чохральского для производства оксидных монокристаллов (таких как сапфиры ) для использования в компьютерной памяти. устройств и в твердотельных лазерах. Кристаллы, такие как гадолиний-галлий-гранат и иттрий-галлиевый гранат, выращивают путем плавления предварительно спеченных зарядов смешанных оксидов в окислительных условиях при температурах до 2100 ° C.
Соединения иридия являются используются в качестве катализаторов в процессе Cativa для карбонилирования метанола с получением уксусной кислоты.
Радиоизотоп иридий-192 является одним из двух наиболее важных источников энергии для использования в промышленной γ-радиографии для неразрушающего контроля металлов. Кроме того, Ir используется в качестве источника гамма-излучения для лечения рака с помощью брахитерапии, формы лучевой терапии, при которой герметичный радиоактивный источник размещается внутри или рядом с областью, требующей лечения.. Специфические методы лечения включают брахитерапию простаты с высокой мощностью дозы, брахитерапию желчных протоков и внутриполостную брахитерапию шейки матки.
В феврале 2019 года ученые-медики объявили, что иридий присоединяется к альбумину, создавая Фотосенсибилизированная молекула может проникать в раковые клетки и после облучения светом (процесс, называемый фотодинамической терапией ) разрушать раковые клетки.
Иридий является хороший катализатор разложения гидразина (на горячий азот и аммиак), который используется на практике в ракетных двигателях малой тяги; Подробнее об этом в статье Ракета-носитель.
Scientific
 International Prototype Meter bar
International Prototype Meter bar
Сплав 90% платины и 10% иридия был использован в 1889 году для создания International Prototype Meter и килограмм масса, хранимая Международным бюро мер и весов около Парижа. Метровая полоса была заменена в качестве определения фундаментальной единицы длины в 1960 году линией в атомном спектре из криптона, но килограммовый прототип остался международным стандартом массы до 20 мая 2019 года, когда килограмм был переопределен в терминах постоянной Планка.
Иридий часто используется в качестве покрытия для непроводящих материалов при подготовке к наблюдению в растровых электронных микроскопах (SEM). Добавление слоя иридия толщиной 2-20 нм помогает особенно органическим материалам выдерживать повреждения электронным пучком и снижает накопление статического заряда в целевой области фокальной точки пучка SEM. Покрытие из иридия также увеличивает отношение сигнал / шум, связанное с вторичной электронной эмиссией, что важно для использования SEM для анализа рентгеновского спектрографического состава. В то время как другие металлы могут использоваться для покрытия объектов для использования в сканирующем электронном микроскопе, иридий является предпочтительным покрытием, когда образцы будут изучены с широким диапазоном параметров изображения.
Иридий использовался в радиоизотопных термоэлектрических генераторах беспилотных космических аппаратов, таких как Вояджер, Викинг, Пионер, Кассини, Галилео и Новые горизонты. Иридий был выбран для инкапсуляции топлива плутоний-238 в генераторе, поскольку он может выдерживать рабочие температуры до 2000 ° C и обладает большой прочностью.
Другое применение касается рентгеновских лучей. оптика, особенно рентгеновские телескопы. Зеркала рентгеновской обсерватории Чандра покрыты слоем иридия толщиной 60 нм. Иридий оказался лучшим выбором для отражения рентгеновских лучей после испытаний никеля, золота и платины. Слой иридия, который должен быть гладким с помощью до нескольких элементов, нанесен путем нанесения паров иридия в высоком вакууме на базовый слой из хрома.
Иридий используется в частицах . физика для производства антипротонов, формы антивещества. Антипротоны путем выстрела пучка высокой плотности в цель преобразования, которая должна быть изготовлена из материала очень высокой плотности. Хотя вместо него можно использовать вольфрам, иридий обладает преимуществом лучшей устойчивости к ударным волнам, вызванным повышением температуры из-за падающего луча.
 Окислительная добавка к углеводородам в иридийорганическая химия
Окислительная добавка к углеводородам в иридийорганическая химия
Активация углеродно-водородной связи (активация C — H) — это область исследований технологии, расщепляющих углеродно-водородные связи, которые традиционно считались инертными. Первые сообщения об успехе в активации связей C — H в насыщенных углеводородов, опубликованных в 1982 году, использовали металлоорганические комплексы иридия, которые подвергаются окислительному присоединению с углеводородом.
Комплексы иридия исследуются в качестве катализаторов для асимметричного гидрирования. Эти катализаторы используются в синтезе природных продуктов и способны энантиоселективно гидрогенизировать некоторые сложные субстраты, такие как нефункционализированные алкены (генерируется только один из двух типов энантиомеров ).
Иридий образует различные формы сов
Исторический

Иридий-осмиевые сплавы использовались в перьевой ручке наконечники перьев., Представляющие фундаментальный интерес при сборе триплетов. Впервые иридий широко использовался в 1834 году в перьях, закрепленных на золоте. С 1944 года знаменитая перьевая ручка Parker 51 оснащалась наконечником с рутениемвым наконечником. И сплав иридия (с 3,8% иридия) Материал наконечника современных перьевых ручек до сих пор условно называется «иридий», хотя иридий в нем редко бывает; другие металлы, такие как рутений, осмий и вольфрам заняли его место.
Иридий-платиновый сплав использовался для сенсорных отверстий или в орудия пушки. Согласно отчету Парижской выставки 1867 г., одно из экспонатов, выставленных Джонсоном и Матти «, было использовано в ружье Витворта более 3000 патронов и почти не видно. Пока нет признаков износа. Те, кто знает о постоянных проблемах и расходах, связанных с
Пигмент иридиевый черный, который состоит из очень мелкодисперсного иридия, используется для окрашивания фарфора в насыщенный черный цвет, было сказано, что «все фарфоровые черные цвета» кажутся серыми рядом с ним ».
Меры предосторожности
Иридий в металлической форме не является биологически важным или опасным для здоровья из-за отсутствия реактивности с тканями; в тканях человека только около 20 Известно, что токсическими соединениями иридия очень мало, в первую очередь, используется токсическим соединением металлов, мелкодисперсный порошок иридия может быть опасен при обращении, поскольку он является токсическим соединением на воздухе. редко. Однако растворимые соли, такие как галогениды иридия, могут быть опасными из-за элементов, отличных от иридия, или из-за самого иридия. В то же время большинство соединений иридия нерастворимы, что затрудняет всасывание в организм.
Радиоизотоп иридия. Ир опасен, как и другие радиоактивные изотопы. Единственные зарегистрированные травмы, связанные с иридием, касаются случайного облучения от. Ir, используемого в брахитерапии. Гамма-излучение высокой энергии от. Ir может увеличить риск рака. Внешнее воздействие может вызвать ожоги, радиационное отравление и смерть. Проглатывание Ir может вызвать ожог слизистой оболочки желудка и кишечника. Ir, Ir и Ir имеют тенденцию откладываться в печени и представляют опасность для здоровья как из-за гамма, так и бета излучение.
Примечания
Ссылки
Внешние ссылки
| На Викискладе есть средства массовой информации, связанные с Иридиум. |
| Искать иридий в Викисловаре, бесплатный словарь. |
- Иридиум в Периодическая таблица видео (Университет Ноттингема)
- Иридиум в Британской энциклопедии
| 77 | Иридий |
| Ir 192,217 | |
| 4f145d76s2 |
Иридий
(лат. Iridium, обозначается знаком
Ir
) — химический элемент с атомным номером 77 в периодической системе химических элементов Д. И. Менделеева. Иридий — очень твёрдый, тугоплавкий, серебристо-белый переходный металл платиновой группы, обладающий высокой плотностью и сравнимый по этому параметру только с осмием (плотности Os и Ir практически равны с учётом погрешности теоретических расчётов). Имеет высокую коррозионную стойкость даже при температуре 2000 °C. В земных породах встречается крайне редко, поэтому высокая концентрация иридия в образцах породы является индикатором космического (метеоритного) происхождения последних.
Нахождение в природе
Содержание иридия в земной коре ничтожно мало (10−7 % по массе). Он встречается гораздо реже золота и платины. Встречается вместе с осмием, родием, рением и рутением. Относится к наименее распространённым элементам. Иридий относительно часто встречается в метеоритах. Не исключено, что реальное содержание металла на планете гораздо выше: его высокая плотность и высокое сродство к железу (сидерофильность) могли привести к смещению иридия вглубь Земли, в ядро планеты, в процессе её формирования из протопланетного диска. Небольшое количество иридия было обнаружено в фотосфере Солнца.
Иридий содержится в таких минералах, как невьянскит, сысертскит и ауросмирид.
История открытия Иридия
Минерал существует в чистом виде, но первые упоминания об изотопном металле связаны с падением на Землю железоникелевого метеорита. Столкновение с Землёй метеорита произошло 65 млн лет назад, в эпоху трицерапторов и дипладоков. В Земле упавший объект оставил след, последствия которого видны и сегодня. Образовался кратер в 180 километров глубиной, пыль, поднявшаяся из-за нарушения земной коры и падения метеорита, заставила Землю пребывать во мгле 14 дней, случились извержения вулканов на территории Азии, Индостана и Мадагаскара.
Некоторые учёные предполагают, что именно этот металл погубил всех динозавров и других крупных ящеров, из-за того, что начал выделять токсин при соприкосновении с хлором и земным ядром. Как известно, металл плавится при 2300 градусов по Цельсию.
Так, он лежал в Земле все 65 млн лет, пока его не обнаружили по случайности люди, искавшие платину и нашедшие её на месте старого кратера.
Как земной элемент, иридий был обнаружен в 1804 году, учёным С. Теннатом. В результате проведения процедур по изучению платиновых минералов и выявления в них осмия, был обнаружен иридий.
Вот так Юкатанская катастрофа привела к тому, что в периодической таблице появился Иридий.
Добыча иридия
При высокой ценности металла, его количество на нашей планете ничтожно мало. Даже ценная платина не может посоревноваться с его редкостью. В природе в виде самородков чаще всего встречается с примесями других металлов, среди которых рутений, осмий, палладий или платина. В сочетании с этими металлами иридий образует ауросмириды, невьянскиты, осмиридий, сысертскиты. Россыпи иридия можно встретить в местах добычи меди и никеля. Также возможна его добыча из золотых россыпей.
Передовыми странами добытчиками считаются Канада, США, ЮАР, остров Тасмания, Новая Гвинея. Главный поставщик иридия на мировой рынок – ЮАР.
Большую роль в добыче металла играет то, сколько иридия производит ЮАР, а также рост или падение спроса на металл.

Где добывают иридий
Места добычи:
- Канада;
- Калимантан;
- США;
- ЮАР;
- Россия;
- Новая Гвинея.
Встречается в природе в складчатых областях перидотовых серпентинитов. Находят россыпные месторождения. Часто встречается в виде твердых растворов в сочетании с осмием — осмистый иридий. По оценкам специалистов, в земной коре находится очень редко. Потому считают (в подтверждение астероидной теории), что высокое содержание металла в рудах сигнализирует об их метеоритном происхождении.
Самый редкий и богатый иридием минерал — родистый невьянскит. Иридия в нем более 11%. Содержится в сысертските, в ауросмириде.
Места добычи
Химический элемент встречается в сплавовом виде в складчатых земных породах гор России, перетонитовых породах, расположенных в ЮАР, Кении, Южной Америке и т. д.
Где есть платина, там есть и иридий.
О характеристиках металла, как химического элемента:
ХарактеристикаОбозначение, значение
| Иридий обозначается символом | Ir |
| Номер в таблице Менделеева | 77 |
| Вес атома | 192,22 а.е.м. |
| Степени окисления | От 1 до 6 (5 не входит) |
| Плотность при комнатной температуре | 22,7 г/см^3 |
| Плотность в жидком состоянии | 19,39 г/см^3 |
| Плавление | При 2300 градусов по Цельсию |
| Кипение жидкого иридия | При 45 градусах Цельсия |
| Имеет кристаллическую решётку | Гранецентрированного куба |
Элемент встречается разных цветов, самый распространённый – белый – KIrF6, лимонный – IrF5, золотой – K3IrCl6, светло-зелёный – Na3IrBr6, розовый – Cs3IrI6, малиновый – Na2IrBr6, тёмно-синий – IrI3. Разнообразие цветов обусловлено наличием в иридии различных солей.
Кстати, название своё металл получил за счёт этого разноцветия. Ирида – это богиня радуги в греческой мифологии.
Получение
Основной источник получения иридия — анодные шламы медно-никелевого производства. Из концентрата металлов платиновой группы отделяют Au, Pd, Pt и др. Остаток, содержащий Ru, Os и Ir, сплавляют с KNO3 и КОН, плав выщелачивают водой, раствор окисляют Сl2, отгоняют OsO4 и RuO4, а осадок, содержащий иридий, сплавляют с Na2O2 и NaOH, плав обрабатывают царской водкой и раствором NH4Cl, осаждая иридий в виде (NH4)2[IrCl6], который затем прокаливают, получая металлический Ir. Перспективен метод извлечения иридия из растворов экстракцией гексахлороиридатов высшими алифатическими аминами. Для отделения иридия от неблагородных металлов перспективно использование ионного обмена. Для извлечения иридия из минералов группы осмистого иридия минералы сплавляют с ВаО2, обрабатывают соляной кислотой и царской водкой, отгоняют OsO4 и осаждают иридий в виде (NH4)2[IrCl6].
Как добыть иридий
В год все добытчики на Земле получают от 3 до 10 тонн (по разным данным).

Проблемой добычи иридия являются большие потери металла при переработке руд. Ведь чисто иридиевых руд, позволяющих промышленную добычу иридия, почти нет. Основная часть металла добывается при переработке медно-никелевых руд, где спутники — металлы платиновой группы.
В основном металл получают из шламов медно-никелевых руд. В процессе их добычи платиноиды попадают в технологические растворы, отходы производства.
Технология добычи иридия (как других платиноидов) состоит из нескольких этапов извлечения этих металлов. Это концентрирование, обработка щелочами, очистка от примесей.
Свойства иридия
Физические свойства иридия достаточно внушительны. Это очень твердый, тяжелый металл, плохо поддающийся механической обработке. Температура плавления составляет 24660С, имеет достаточно высокую температуру кипения 44280С. Его твердость обуславливается плотностью-22,65 г/см3. При нагревании и обычной температуре он устойчив, при температуре до 1000С на все известные кислоты не реагирует. В присутствии хлоридов щелочных металлов при температуре 600-9000С порошок иридия может раствориться хлорированием. Вступает во взаимосвязь с F2, когда температура достигает 4500С. Свойства иридия не играют никакой биологической роли, он не является токсичным металлом, хотя некоторые его соединения очень ядовиты.
Показатели иридия:
- сплавы иридия с вольфрамом и торием используют, как металл для термоэлектрических генераторов; с другими металлами изготавливают топливные баки для космических аппаратов, термопар, термоэмиссионных катодов;
- в автомобильной промышленности применяют в свечах зажигания, что позволяет долго использовать их, хотя они и дорогие;
- находит свое применение в изготовлении перьев для чернильных ручек, на золотых перьях;
- иридий-192 успешно применяют в дефектоскопии, там, где генерирующие источники не могут быть применены, например, во взрывоопасной среде;
- интересно, что из иридия изготовлен эталон килограмма, так как сплав иридия с платиной обладает механической прочностью и не окисляется;
- находит применение в ювелирной промышленности, но цена неимоверно высока на такие украшения;
- изготавливают лабораторные тигли, чтобы проводить опыты с фтором, а также его агрессивными соединениями;
- делают высокопрочные, жаростойкие мундштуки для выдувания стекла.
Свойства и особенности
- Имеет три синтетических изотопа (191,192,193). Каждый изотоп встречается в сплавовом иридии одиночно и отвечает за какие-либо особенности металла, которые отразятся на его будущем применении.
- Не встречается в чистом виде в природных условиях. Только с каким-либо элементом, как примесь.
- Используется для усиления металлических конструкций и сплавов. У иридия есть свойство укреплять и усиливать те соединения (физические и химические), в которые он добавляется.
- Не теряет своих качеств при смешивании с другими химическими элементами, множественной переплавке и т. д.
- В природе есть вид иридия, в котором смешаны два изотопа – 191 и 193. Такой изотопный металл считается самым крепким и долговечным.
- Иридий высоко инертен, считается драгоценным металлом.

- Иридий не окисляется при взаимодействии с солевыми остатками, кислотами, воздухом и высокими температурами. Как такового окисления не происходит. Но могут случаться впрыски иридия в незначительном количестве, в виде оксида металла IrO2. При температуре более 1300 градусов по Цельсию иридий не сразу же плавится, выделяя частично оксид IrO3.
- Металл плохо поддаётся обработкам. Реакция достаточная для обработки иридия, его перегонка и придание формы происходит при красном световом излучении.
- Металл воспроизводят искусственно, однако, по государственным нормам. Большое количество требуется для строительства дорог и создания механизмов автомобилей, но в ювелирной промышленности иридий не часто используется.
- В зависимости от того, с каким металлом сплавлен иридий, зависит и его цена. К примеру, если он был найден, как примесь к золоту или платине, то основной будет цена золота за грамм плюс процентная стоимость иридия, в зависимости от его содержания в сплаве. Обычно это значение равняется – 10%.
- Высокая цена, от 940 рублей за 1 грамм иридия, обусловлена тем, что процесс отшелушивания, отделения и дальнейшей обработки металла трудоёмок. В ближайшем будущем стоимость за 1 грамм вырастет, скорее всего, с 1719 рублей до 2500 рублей.
- Иридий нетоксичен, не играет никакой важной биологической роли, но в природе встречается смертельно опасный вид иридия – IrF6 (гексафторид). Гексафторид вызывает мгновенное удушение при вдыхании паров.
Физические свойства
Иридий — тяжёлый серебристо-белый металл, из-за своей твердости плохо поддающийся механической обработке. Температура плавления — 2739 K (2466 °C), кипит при 4701 K (4428 °C). Кристаллическая структура — кубическая гранецентрированная с периодом а0=0,38387 нм; электрическое сопротивление — 5,3⋅10−8Ом·м (при 0 °C), и 2⋅10−7Ом·м (при 2300 °C); коэффициент линейного расширения — 6,5⋅10−6 град; модуль нормальной упругости — 538 ГПа; плотность при 20 °С — 22,65 г/см³, жидкого иридия — 19,39 г/см³ (2466 °С).
Изотопный состав
Природный иридий встречается в виде смеси из двух стабильных изотопов: 191Ir (содержание 37,3 %) и 193Ir (62,7 %). Искусственными методами получены радиоактивные изотопы иридия с массовыми числами 164-199, а также множество ядерных изомеров. Распространение получил искусственный 192Ir.
Свойства химические и физические
Иридий — металл твердый и одновременно хрупкий.

Химические и физические свойства:
- Обладает высокой плотностью — до 22650 кг/м3.
- Степень окисления в соединениях чаще всего +3, +4, редко +1, +2, +5 и +6.
- Температура плавления 2466 °C.
- Кипение иридия начинается при 4428 °C.
- Химически стойкий металл (при нормальных условиях); не реагирует со щелочами и кислотами, даже с «царской водкой».
- Цвет металла серебристо-белый.
При нагреве реагирует с галогенами (фтор, хлор, бром) и кислородом.
| Свойства атома | |
| Название, символ, номер | Иридий / Iridium (Ir), 77 |
| Атомная масса (молярная масса) | 192,217(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d7 6s2 |
| Радиус атома | 136 пм |
| Химические свойства | |
| Ковалентный радиус | 127 пм |
| Радиус иона | (+4e) 68 пм |
| Электроотрицательность | 2,20 (шкала Полинга) |
| Электродный потенциал | Ir←Ir3+ 1,00 В |
| Степени окисления | 9, 7, 8, 6, 4, 3, 2, 1, 0, −1, −3 |
| Энергия ионизации (первый электрон) | 868,1 (9,00) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 22,65/22,56±0,01[2][3][4] г/см³ |
| Температура плавления | 2739 K (2466 °C, 4471 °F)[2] |
| Температура кипения | 4701 K (4428 °C, 8002 °F)[2] |
| Уд. теплота плавления | 26,0 кДж/моль |
| Уд. теплота испарения | 610 кДж/моль |
| Молярная теплоёмкость | 25,1[5] Дж/(K·моль) |
| Молярный объём | 8,54 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,840 Å |
| Температура Дебая | 430,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 147 Вт/(м·К) |
| Номер CAS | 7439-88-5 |
Рекомендуем: ВОЛЬФРАМ — самый тугоплавкий металл
Кристаллическая решетка гранецентрированная, кубическая.
Химические свойства
Иридий устойчив на воздухе при обычной температуре и нагревании, при прокаливании порошка в токе кислорода при 600—1000 °C образует в незначительном количестве IrO2. Выше 1200 °C частично испаряется в виде IrO3. Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями. Свежеосажденная иридиевая чернь частично растворяется в царской водке с образованием смеси соединений Ir(III) и Ir(IV). Порошок иридия может быть растворён хлорированием в присутствии хлоридов щелочных металлов при 600—900 °C или спеканием с Na2O2 или BaO2 с последующим растворением в кислотах. Иридий взаимодействует с F2 при 400—450 °C, а c Cl2 и S при температуре красного каления.
Степень окисления иридия
Атомы иридия в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы иридия
6+Ir 5+Ir 4+Ir 3+Ir 2+Ir 1+Ir
Ir 01-Ir
Валентность Ir
Атомы иридия в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность иридия характеризует способность атома Ir к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ir
Квантовые числа определяются последним электроном в конфигурации, для атома Ir эти числа имеют значение N = 5, L = 2, Ml = -1, Ms = -½
Соединения трёхвалентного иридия
- Ir2O3 — твёрдое тёмно-синее вещество. Малорастворим в воде и этаноле. Растворяется в серной кислоте. Получают при лёгком прокаливании сульфида иридия (III).
- IrCl3 — летучее соединение оливково-зелёного цвета. Плотность — 5,30 г/см³. Малорастворим в воде, щелочах и кислотах. При 765 °C разлагается на IrCl2 и хлор, при 773 °C на IrCl и хлор, а выше 798 °C — на составные элементы. Получают действием хлора на нагретый до 600 °C иридий.
- IrBr3 — оливково-зелёные кристаллы. Растворяется в воде, мало растворим в спирте. Дегидратируется при нагревании до 105—120 °C. При сильном нагревании разлагается на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой.
- Ir2S3 — твёрдое коричневое вещество. Разлагается на элементы при нагревании выше 1050 °C. Мало растворим в воде. Растворяется в азотной кислоте и растворе сульфида калия. Получают действием сероводорода на хлорид иридия (III) или нагреванием порошкообразного металлического иридия с серой при температуре не выше 1050 °C в вакууме.
Соединения четырёхвалентного иридия
- IrO2 — чёрные тетрагональные кристаллы с решёткой типа рутила. Плотность — 3,15 г/см³. Малорастворим в воде, этаноле и кислотах. Восстанавливается до металла водородом. Термически диссоциирует на элементы при нагревании. Получают нагреванием порошкообразного иридия на воздухе или в кислороде при 700 °C, нагреванием IrO2*nН2О.
- IrF4 — жёлтая маслянистая жидкость, разлагающаяся на воздухе и гидролизующаяся водой. tпл 106 °C. Получают нагреванием IrF6 с порошком иридия при 150 °C.
- IrCl4— гигроскопичное коричневое твёрдое вещество. Растворяется в холодной воде и разлагается тёплой (водой). Получают нагреванием (600—700 °C) металлического иридия с хлором при повышенном давлении.
- IrBr4 — расплывающееся на воздухе синее вещество. Растворяется в этаноле; в воде (с разложением), диссоциирует при нагревании на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой при низкой температуре.
- IrS2 — твёрдое коричневое вещество. Малорастворим в воде. Получают пропусканием сероводорода через растворы солей иридия (IV) или нагреванием порошкообразного металлического иридия с серой без доступа воздуха в вакууме.
Соединения шестивалентного иридия
- IrF6 — жёлтые тетрагональные кристаллы. tпл 44 °C, tкип 53 °C, плотность — 6,0 г/см³. Под действием металлического иридия превращается в IrF4, восстанавливается водородом до металлического иридия. Получают нагреванием иридия в атмосфере фтора в трубке из флюорита. Очень сильный окислитель, способный окислить даже воду:
2IrF6 + 10H2O = 2Ir(OH)4 + 12HF + O2, или NO: NO + IrF6 = NO+[IrF6]-
- IrS3 — серый, малорастворимый в воде порошок. Получают нагреванием порошкообразного металлического иридия с избытком серы в вакууме. Строго говоря. не является соединением шестивалетного иридия, так как содержит связь S-S.
- Ir(OH)4 (IrO2*2H2O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir2O3*nН2О выпадает при нейтрализации щёлочью хлороиридатов (III) и легко окисляется на воздухе до IrO2. Практически нерастворим в воде.
Радуга металла
Открыл металл и дал ему название англичанин С. Теннант, химик. Производя опыты с самородной платиной, химик исследовал и растворы, оставшиеся от опытов. И не зря — в них он обнаружил разноцветные соли неизвестного элемента.
Иридий назвали в честь радуги (по-гречески iris ) — многоцветного чуда.
Это не о цвете металла, это о разнообразии цветов иридиевых солей:
- K3IrCl6, IrF6 — золотисто-желтые кристаллы;
- KIrF6 — белые кристаллы;
- Ir2O3 — синие, сине-черные кристаллы:
- IrCl2 — зеленые кристаллы;
- Na2IrBr6 — малиновый цвет.
Есть соединения иридия, окрашенные в оливковый, коричневый, розовый, золотистый цвета.
Особенности
Сразу стоит сказать, что иридий — это металл. Потому он имеет все те свойства, которые типичны и для иных металлов. Такой химический элемент обозначается сочетанием латинских символов Ir. В таблице Менделеева он занимает 77 клетку. Открытие иридия произошло в 1803 году, в рамках того же исследования, при котором английский ученый Теннант выделил и осмий.
Исходным сырьем для получения таких элементов послужила руда платины, доставленная из Южной Америки. Первоначально металлы выделили в виде осадка, который «не брала» «царская водка». Исследование показало наличие нескольких ранее неизвестных веществ. Свое словесное обозначение элемент получил потому, что его соли выглядят, как будто переливающиеся радугой.
Содержание иридия в природе исключительно мало, и это одно из самых редких веществ на Земле.

Химически чистый иридий не имеет никакого радужного окраса. Зато для него характерен довольно привлекательный серебристо-белый цвет. Токсические свойства не подтверждены. Однако отдельные соединения иридия могут представлять опасность для человека. Особенно ядовит фторид этого элемента.
Производством и аффинажем иридия занимается ряд российских и зарубежных предприятий. Почти весь выпуск этого металла — продукт побочной обработки платинового сырья. Хотя иридий и не пурпурный, он содержит в природном виде 2 изотопа. 191-й и 193-й элементы стабильны. Но выраженные радиоактивные свойства зато имеет ряд искусственно получаемых изотопов, их период полураспада невелик.

Применение
Особый интерес в качестве источника электроэнергии вызывает его ядерный изомер иридий-192m2 (период полураспада 241 год).
Сплавы с W и Th — материалы термоэлектрических генераторов, с Hf — материалы для топливных баков в космических аппаратах, с Rh, Re, W — материалы для термопар, эксплуатируемых выше 2000 °C, с La и Се — материалы термоэмиссионных катодов.
Иридий используется также для изготовления перьев для ручек. Небольшой шарик из иридия можно встретить на кончиках перьев и чернильных стержней, особенно хорошо его видно на золотых перьях, где он отличается по цвету от самого пера.
Иридий в палеонтологии и геологии является индикатором слоя, который сформировался сразу после падения метеоритов.
Иридий, наряду с медью и платиной, применяется в свечах зажигания двигателей внутреннего сгорания (ДВС) в качестве материала для изготовления электродов, делая такие свечи наиболее долговечными (100—160 тыс. км пробега автомобиля) и снижая требования к напряжению искрообразования. Первой компанией, которая стала использовать иридий, улучшив благодаря этому качество свечей зажигания, стала японская компания NGK. Изначально использовался в авиации и гоночных автомобилях, затем, по мере снижения стоимости продукции, стал употребляться и на массовых автомобилях. В настоящее время такие свечи доступны для большинства двигателей, однако являются наиболее дорогими.
Иридий-192 является радионуклидом с периодом полураспада 74 суток, широко применяемым в дефектоскопии, особенно в условиях, когда генерирующие источники не могут быть использованы (взрывоопасные среды, отсутствие питающего напряжения нужной мощности).
Платиноиридиевый сплав обладает большой механической прочностью, не окисляется. Из этого сплава, в частности, изготовлен эталон килограмма.
В 2013 году иридий впервые в мире был применён в изготовлении официальных монет Национальным банком Руанды, который выпустил монету из чистого металла 999-й пробы. Иридиевая монета была выпущена номиналом 10 руандийских франков.
Промышленность
Свойства металла обусловили сферы применения промышленным комплексом:
- Из иридия делают посуду, оборудование, катализаторы для предприятий химического комплекса.
- В иридиевых тиглях выращивают монокристаллы.
- У автопрома это материал электродов (с медью и платиной) свечей зажигания. Они служат дольше, используются для элитных автомобилей.
- Сплавы иридия с рутением содержат электрогенераторы, термопары для измерения температур до 2000°C.
- Это индикатор качества сварных швов изделий из стали и сплавов алюминия.
Из платиново-иридиевого сплава изготовлены эталоны килограмма и метра (находятся в Париже).
Космические перспективы открыло третье тысячелетие:
- Компания American Elements создала технологию отливки бесшовных иридиевых колец для использования на спутниках, космических аппаратах (2006 год).
- Металл присутствует в дисплеях компьютеров, телевизоров, айфонов, других гаджетов на основе органических светодиодов (технология OLED).
Как источник энергии рассматривается ядерный изомер иридия-192 со временем «жизни» более 240 лет.
Медицина
Из сплава платины с иридием изготовлен хирургический инструментарий, детали кардиостимуляторов.
Это базис для развития ядерной медицины. Радионуклидное сырье получают на ядерных реакторах, циклотронах. 90% уходит на экспорт.
Россия входит в мировую топ-пятерку производителей сырьевых медицинских изотопов.
Иридий-192 задействован при дефектоскопии и онкологами (гамма-нож).
Сказочные перспективы иридия в медицине
В кардиостимуляторах применяется сплав иридий-платина.
Онкологи используют изотоп иридия Ir-192 как источник гамма-излучения. Его применяют для лечения рака груди и предстательной железы (на ранних стадиях болезни).
Разработаны методы лечения эпилепсии, болезни Паркинсона, шизофрении с помощью введения иридиевых электродов в мозг. Радужные перспективы для создания протезов глаза и слухового аппарата открывает метод вживления микроэлектродов.
Ювелирное дело
Ювелиры ценят металл за прочность, используя в сплаве с платиной.
Американская компания Smithson Tennant первой наладила производство ювелирных украшений из иридия. Иридиевые обручальные кольца позиционируются ею как вечные в буквальном смысле: бессильны даже концентрированная кислота и время. Им не требуется особый уход и условия хранения.
Украшения из сплавов с добавлением иридия и через десятилетия выглядят как купленные только что.
Драгоценности с иридием (даже обручальные кольца) не изнашиваются, всегда выглядят как новенькие. Это преимущество особо важно для изделий, испытывающих повышенные нагрузки (обручальные кольца, перстни, браслеты).
Другие сферы
Иридий почитают геологи и палеонтологи: это маркер возраста слоев земной коры и вымерших организмов.
Единственную в мире монету – проба иридия 999 – выпустил в 2013 году Национальный Банк Руанды (государство на востоке Африки). Номинал составил 10 местных франков.
До 1980-х годов шариком из иридиевых сплавов снабжали перья авторучек класса люкс, включая легендарный Parker 51. Это атрибут элиты и аксессуар фаната роскоши Джеймса Бонда.
Платиновые металлы – родий, палладий, осмий, иридий, рутений
Платиновые металлы, серебристо-белые и тугоплавкие, наряду с серебром и золотом, из-за красивого внешнего вида и высокой химической стойкости, относят к благородными металлами.
К платиновым металлами, или платиноидам относятся: рутений, родий, палладий, осмий и иридий.
Палладий и родий в 1803 году обнаружил в самородной платине английский ученый У. Х. Волластон. Палладий получил свое название от малой планеты (астероида) Паллады (открытой в 1802), а родий (от греч. rhodon – роза) назван по розовато-красному цвету его солей.
В 1804 году английский химик Смитсон Теннант в остатке после растворения самородной платины в царской водке открыл иридий (название от разнообразия окраски его соединений, от греч. iridos радужный) и осмий (названный так из-за резкого запаха его оксида, греч. osme – запах).
А в 1844 году К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной платины в Петербургском монетном дворе открыл еще один платиновый металл – рутений (от лат. Ruthenia – Россия).
Платиновые металлы принадлежат к наиболее редким элементам, их среднее содержание в земной коре крайне мало.
Самые редкие в земной коре – рутений и иридий (1·10-7% по массе), наиболее распространен осмий (5·10-6%).
Но что весьма интересно – весьма высоко среднее содержание платиноидов в каменных метеоритах (10-4 – 10-5 % по массе).
Платиновые металлы встречаются на Земле в основном в самородном виде, известны и немногочисленные соединения с серой, мышьяком и сурьмой.
Основным источником получения платиновых металлов служат сульфидные медно-никелевые руды, месторождения которых находятся в России (Норильск, Красноярский край), Канаде, ЮАР и других странах. Цена на палладий составляет около 200-300 долларов за килограмм
Иридий применяют в основном в виде сплава с платиной (до 10% иридия). Из платино-иридиевого сплава сделаны международные эталоны метра и килограмма. Из него также изготовляют тигли, в которых выращивают кристаллы для лазеров, из сплава иридия и осмия делают опоры для стрелок компасов и других приборов.
Из чистого иридия изготовляют тигли для кристаллов для лазера и полудрагоценные камни, используют для иридирования поверхностей ювелирных изделий («иридистое золото»), вследствие чего они приобретают светло-серый, очень блестящий оттенок.
Мировое производство иридия около 1000 кг в год, основные страны-производители – ЮАР, Канада, Россия. Стоимость иридия на мировом рынке около 200 долларов за грамм,
Родий способен сорбировать водород, является важным катализатором, ускоряющим химические реакции, также он входит в состав сплавов, обладающих высокой твердостью и стойкостью против истирания и окисления. Благодаря своей высокой отражающей способности (80% лучей видимой части спектра), а также высокой стойкостью против окисления является хорошим материалом для покрытия рефлекторов прожекторов и зеркал точных приборов. Из сплавов родий-платина изготовляют лабораторную и заводскую аппаратуру, проволоку для термоэлектрических пирометров. В ювелирном производстве родий используют в качестве защитно-декоративного покрытия родием ювелирных изделий из золота и серебра.
Родий имеет очень светлую окраску, и по виду напоминает серебро, но, в отличие от него, не темнеет на воздухе и поэтому родирование (покрытие слоем родия) применяется для защиты серебряных изделий от потемнения.
Родий входит в состав платиновых ювелирных сплавов (на территории России применяется лишь одна марка сплава платина – родий 950 пробы).
Цена родия составляет около 6500 долларов за тройскую унцию (31.1035 грамма).
Палладий применяется как катализатор на многих химические производствах, используется для изготовления специальной химической посуды, стойких к коррозии деталей высокоточных приборов, в производстве медицинских инструментов, деталей кардиостимуляторов, лекарств, а также служит для изготовления ювелирных изделий и для протезирования зубов.
Сплав золото-палладий, так называемое «белое золото», широко используются в ювелирном деле.
Палладий даже в незначительном количестве (1%) способен резко изменить цвет золота в серебристо-белый.
В состав «белого золота» 750-й пробы могут входить 75% золота, 7% серебра, 14% палладия и 4% никеля.
Основные сплавы палладия с серебром, применяемые в ювелирном деле имеют пробу 500 и 850 (они наиболее технологичны и привлекательны). Помимо стандартных сплавов палладия в ювелирном производстве иногда используются декоративные соединения палладия с индием, образующие широкую цветовую гамму – от золотистого до сиреневого. Но изделия из них – пока большая редкость.
В России применяют следующие сплавы палладия: ПД-250 (24.5% палладия и 72.1% серебра), ПД-190 (18.5% палладия и 78% серебра), ПД-150 (14.5% палладия и 84.1% серебра) и ПД-140 (13.5% палладия и 53.9% серебра).
В мире добывается не более 300 тонн палладия, примерно 140 тонн добывает Россия, 86 тонн США и Канада, остальные страны – 9 тонн. Стоимость палладия – около 5 долларов за грамм.
Осмий очень твердый металл, поэтому, при создании сплавов с наивысшей износостойкостью, в их состав вводят осмий.
Кончики перьев дорогих авторучек (в частности знаменитый «Parker») изготовляют из сплава осмия и иридия.
Из сплавов осмия и иридия изготовляют режущие кромки хирургических инструментов, резцов для художественной обработки слоновой кости.
Осмистый иридий и иридистый осмий – хорошо известные минералы (соответственно невьянскит и сысертскит): в первом преобладает иридий, во втором –осмий. Иногда эти минералы встречаются самостоятельно, но чаще входят в состав самородной платины.
Одно достоинство осмия – тугоплавкость, температура его плавления около 30000С.
На нужды химии расходуется почти половина мировой добычи осмия. Но следует помнить, что безобидные на вид бледно-желтые кристаллы четырехокиси осмия – сильный яд, раздражающий кожу и слизистые оболочки, вредно действующий на глаза. Кроме сильного и неприятного запаха, это соединение очень токсично токсично! Предельно допустимая концентрация (ПДК) четырёхокиси осмия в воздухе составляет 0.002 мг/м3, что всего в пять раз меньше ПДК для синильной кислоты (0.01 мг/м3).
Цена осмия весьма высока – от $15,000 до $40,000 за грамм. Всего в мире ежегодно добывают примерно 600 килограмм осмия.
Рутений применяют для повышения коррозионной стойкости титана, как катализатор, в качестве жаропрочных материалов в аэрокосмической технике. В ювелирном деле рутений применяется для изготовления так называемого «черного золота»: для придания золотым сплавам чёрного цвета, поверхность ювелирного изделия покрывают слоем чёрного родия или рутения гальваническим методом, причём цвет покрытий варьирует в диапазоне от серого и тёмно-серого до чёрного.
Платиноиды встречаются и в живых организмах, и представлены главным образом рутением, а также изотопами рутения и родия.
Морские и пресноводные водоросли интенсивно концентрируют радиоактивные изотопы рутения (в сотни и тысячи раз, по сравнению со средой), ракообразные – в десятки и сотни, моллюски – до десятков, рыбы и головастики лягушек – от единиц до сотен.
Радиоактивный изотоп рутения-106 интенсивно мигрирует в почве, накопляясь в корнях наземных растений.
У наземных млекопитающих радиоактивные изотопы рутения всасываются через пищеварительный тракт, проникают в легкие, отлагаются в почках, печени, мышцах, скелете, и являются составной частью радиоактивного загрязнения биосферы.
А.А. Каздым Кандидат геолого-минералогических наук Академик Международной Академии наук, Член Российского минералогического общества и кристаллографического общества России

Интернет-газета «Континент»
Биологическая роль
Не играет никакой биологической роли. Металлический иридий неядовит, но некоторые соединения иридия, например, его гексафторид (IrF6), очень ядовиты.
Иридий – 77 элемент таблицы Менделеева
Атомная масса элемента №77 равна 192,2. В таблице Менделеева он находится между осмием и платиной. И в природе он встречается главным образом в виде осмистого иридия – частого спутника самородной платины. Самородного иридия в природе нет.
Иридий – серебристо-белый металл, очень твердый, тяжелый и прочный. По данным , это самый тяжелый элемент: его плотность 22,65 г/см3, а плотность его постоянного спутника – осмия, второго по тяжести 22,61 г/см3. Правда, большинство исследователей придерживаются иной точки зрения: они считают, что иридий все-таки немного легче осмия.
Естественное свойство иридия (он же платиноид!) – высокая коррозионная стойкость. На него не действуют кислоты ни при нормальной, ни при повышенной температуре. Даже знаменитой царской водке монолитный иридий «не по зубам». Только расплавленные щелочи и перекись натрия вызывают окисление элемента №77.
Иридий стоек к действию галогенов. Он реагирует с ними с большим трудом и только при повышенной температуре. Хлор образует с иридием четыре хлорида: IrCl, IrCl2, IrCl3 и IrCl4. Треххлористый иридий получается легче всего из порошка иридия, помещенного в струю хлора при 600°C. Единственное галоидное соединение, в котором иридий шестивалентен, – это фторид IrF6. Тонкоизмельченный иридий окисляется при 1000°C и в струе кислорода, причем в зависимости от условий могут получаться несколько соединений разного состава.
Как и все металлы платиновой группы, иридий образует комплексные соли. Среди них есть и соли с комплексными катионами, например [Ir(NН3)6]Cl3 и соли с комплексными анионами, например K3[IrCl3] · 3H2O. Как комплексообразователь иридий похож на своих соседей по таблице Менделеева.
Чистый иридий получают из самородного осмистого иридия и из остатков платиновых руд (после того как из них извлечены платина, осмий, палладий и рутений). О технологии получения иридия распространяться не будем, отослав читателя к статьям «Родий», «Осмий» и «Платина».
Иридий получают в виде порошка, который затем прессуют в полуфабрикаты и сплавляют или же порошок переплавляют в электрических печах в атмосфере аргона. Чистый иридий в горячем состоянии можно ковать, однако при обычной температуре он хрупок и не поддается никакой обработке.
Как получают
О том, что этот металл встречается только в сплавах, мы уже сказали. Но каким образом возможно получить иридий? Источником породы является анодный шлам медноникелевого производства. Продукт – шлам насыщают, после чего, под действием «царской водки», переводят из состояния твёрдого в жидкое, в виде соединений хлорида H2[PtCl6].
В результате химики получают жидкую смесь металлов и добавляют в неё хлорид аммония NH4Cl. После чего производят выведение осадка из платины, а потом получают комплекс иридия (NH4)2[IrCl6]. (NH4)2[IrCl6] прокаливают при помощи кислорода и азота. На выходе получаете металлический иридий.
Искусственный иридий
Иридий, как и многие другие металлы крайне редкий, но очень ценный и широко используемый металл. Спрос на такие металлы только нарастает, а их количество природе уменьшается и к большому сожалению человечества не возобновляется. В связи с этим в мире большие обороты набирает искусственный синтез драгоценных металлов. Для этого создаются целые компании и лаборатории. Самой передовой и успешной технологией искусственного синтеза драгметаллов, которую только начинают внедрять является холодная ядерная трансмутация. Этот способ признан в мире и сегодня с его помощью синтезируется искусственная платина. Над остальными металлами проводятся работы. На территории России искусственным синтезом занимается .
Интересные факты
Соли иридия очень разнообразны по окраске. Так, в зависимости от числа присоединившихся атомов хлора, соединение может иметь медно-красный, темный зеленый, оливковый или коричневый цвета. Дифторид иридия окрашен в желтый тон. Соединения с озоном и бромом имеют синюю окраску. У чистого иридия коррозионная стойкость очень велика даже при нагреве до 2000 градусов.
В породах земного происхождения концентрация иридиевых соединений очень невелика. Серьезно повышается она только в породах метеоритного происхождения. Такой критерий позволяет исследователям установить важные факты о различных геологических структурах. Всего на земле производится лишь несколько тонн иридия.
Модуль Юнга (он же модуль продольной упругости) у этого металла — на втором месте среди известных веществ (больше — только у графена).

- https://chem.ru/iridij.html
- https://mysamocvet.ru/metally/iridij/
- https://ProDragmetally.ru/dragotsennye-metally/iridij.html
- https://himsnab-spb.ru/article/ps/ir/
- https://metallsmaster.ru/iridij/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Ir
- https://TheMineral.ru/metally/iridij
- https://vplate.ru/metally-i-splavy/vse-ob-iridii/
- https://jgems.ru/metally/iridij
- https://calcsbox.com/post/iridium.html
| |||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
| |||
| Свойства атома | |||
| Имя, символ, номер | Иридий / Iridium (Ir), 77 | ||
| Атомная масса (молярная масса) | 192,22 а. е. м. (г/моль) | ||
| Электронная конфигурация | [Xe] 4f14 5d7 6s2 | ||
| Радиус атома | 136 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 127 пм | ||
| Радиус иона | (+4e) 68 пм | ||
| Электроотрицательность | 2,20 (шкала Полинга) | ||
| Электродный потенциал | Ir←Ir3+ 1,00 В | ||
| Степени окисления | 6, 4, 3, 2, 1, 0, −1 | ||
| Энергия ионизации (первый электрон) | 868,1 (9,00) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 22.56±0.01[1][2] г/см³ | ||
| Температура плавления | 2447 K | ||
| Температура кипения | 4380 K | ||
| Теплота плавления | 26,0 кДж/моль | ||
| Теплота испарения | 610 кДж/моль | ||
| Молярная теплоёмкость | 25,1[3] Дж/(K·моль) | ||
| Молярный объём | 8,54 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | кубическая | ||
| Параметры решётки | 3,840 Å | ||
| Температура Дебая | 430,00 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 147 Вт/(м·К) |
Ири́дий — химический элемент с атомным номером 77 в периодической системе, обозначается символом Ir (лат. Iridium). Иридий — очень твёрдый, тугоплавкий, серебристо-белый переходный металл платиновой группы, обладающий высокой плотностью и сравнимый по этому параметру только с осмием (плотности Os и Ir практически равны с учётом расчетной погрешности)[4]. Имеет высокую коррозионную стойкость даже при температуре 2000 °C.
Содержание
- 1 История
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 5.1 Соединения двухвалентного иридия
- 5.2 Соединения трёхвалентного иридия
- 5.3 Соединения четырёхвалентного иридия
- 5.4 Соединения шестивалентного иридия
- 6 Применение
- 7 Биологическая роль
- 8 Стоимость
- 9 Интересные факты
- 10 См. также
- 11 Примечания
- 12 Литература
- 13 Ссылки
История
Иридий был открыт в 1803 году английским химиком С. Теннантом одновременно с осмием[5], которые в качестве примесей присутствовали в природной платине, доставленной из Южной Америки. Название (др.-греч. ἶρις — радуга) получил благодаря разнообразной окраске своих солей.
Нахождение в природе
Содержание иридия в земной коре ничтожно мало (10−7 масс. %). Он встречается гораздо реже золота и платины. Встречается вместе с родием, рением и рутением. Относится к наименее распространённым элементам. Иридий относительно часто встречается в метеоритах. Не исключено, что реальное содержание металла на планете гораздо выше: его высокая плотность и высокое сродство к железу (сидерофильность) могли привести к смещению иридия вглубь Земли, в ядро планеты, в процессе её формирования из расплава.
Иридий содержится в таких минералах, как невьянскит, сысертскит и ауросмирид.
Месторождения
Коренные месторождения осмистого иридия расположены в основном в перидотитовых серпентинитах складчатых областей (в ЮАР, Канаде, США, на Новой Гвинее)[6].
Получение
Основной источник получения иридия — анодные шламы медно-никелевого производства. Из концентрата металлов платиновой группы отделяют Au, Pd, Pt и др. Остаток, содержащий Ru, Os и иридий, сплавляют с KNO3 и КОН, сплав выщелачивают водой, раствор окисляют O2, отгоняют OsO4 и RuO4, а осадок, содержащий иридий, сплавляют с Na2O2 и NaOH, сплав обрабатывают царской водкой и раствором NH4Cl, осаждая иридий в виде комплексного соединения (NH4)2[IrCl6], который затем прокаливают, получая металл — иридий. Перспективен метод извлечения иридия из растворов экстракцией гексахлороиридатов высшими алифатическими аминами. Для отделения иридия от неблагородных металлов перспективно использование ионного обмена. Для извлечения иридия из минералов группы осмистого иридия минералы сплавляют с оксидом бария, обрабатывают соляной кислотой и царской водкой, отгоняют OsO4 и осаждают иридий в виде (NH4)2[IrCl6].
Физические свойства
Тяжёлый серебристо-белый металл, из-за своей твердости плохо поддающийся механической обработке. Кристаллическая структура — кубическая гранецентрированная с периодом а0=0,38387 нм; электрическое сопротивление — 5,3·10−8Ом·м (при 0 °C); коэффициент линейного расширения — 6,5·10−6 град; модуль нормальной упругости — 52,029·106 кг/мм²; плотность — 22,65 г/см³.
Стабильными являются изотопы 191Ir и 193Ir. Период полураспада 192Ir — 74 дня.
Химические свойства
Иридий устойчив на воздухе при обычной температуре и нагревании, при прокаливании порошка в токе кислорода при 600—1000 °C образует в незначительном количестве IrO2. Выше 1200 °C частично испаряется в виде IrO3. Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями. Свежеосажденная иридиевая чернь частично растворяется в царской водке с образованием смеси соединений Ir(III) и Ir(IV). Порошок иридия может быть растворён хлорированием в присутствии хлоридов щелочных металлов при 600—900 °C или спеканием с Na2O2 или BaO2 с последующим растворением в кислотах. Иридий взаимодействует с F2 при 400—450 °C, а c Cl2 и S при температуре красного каления.
Соединения двухвалентного иридия
- IrCl2 — блестящие тёмно-зелёные кристаллы. Плохо растворяется в кислотах и щёлочах. При нагревании до 773 °C разлагается на IrCl и хлор, а выше 798 °C — на составные элементы. Получают нагреванием металлического иридия или IrCl3 в токе хлора при 763 °C.
- IrS — блестящее тёмно-синее твёрдое вещество. Мало растворим в воде и кислотах. Растворяется в сульфиде калия. Получают нагреванием металлического иридия в парах серы.
Соединения трёхвалентного иридия
- Ir2O3 — твёрдое тёмно-синее вещество. Малорастворим в воде и этаноле. Растворяется в серной кислоте. Получают при лёгком прокаливании сульфида иридия (III).
- IrCl3 — летучее соединение оливково-зелёного цвета. Плотность — 5,30 г/см³. Малорастворим в воде, щелочах и кислотах. При 765 °C разлагается на IrCl2 и хлор, при 773 °C на IrCl и хлор, а выше 798 °C — на составные элементы. Получают действием хлора на нагретый до 600 °C иридий.
- IrBr3 — оливково-зелёные кристаллы. Растворяется в воде, мало растворим в спирте. Дегидратируется при нагревании до 105—120 °C. При сильном нагревании разлагается на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой.
- Ir2S3 — твёрдое коричневое вещество. Разлагается на элементы при нагревании выше 1050 °C. Мало растворим в воде. Растворяется в азотной кислоте и растворе сульфида калия. Получают действием сероводорода на хлорид иридия (III) или нагреванием порошкообразного металлического иридия с серой при температуре не выше 1050 °C в вакууме.
Соединения четырёхвалентного иридия
- IrO2 — чёрные тетрагональные кристаллы с решёткой типа рутила. Плотность — 3,15 г/см³. Малорастворим в воде, этаноле и кислотах. Восстанавливается до металла водородом. Термически диссоциирует на элементы при нагревании. Получают нагреванием порошкообразного иридия на воздухе или в кислороде при 700 °C, нагреванием IrO2*nН2О.
- IrF4 — жёлтая маслянистая жидкость, разлагающаяся на воздухе и гидролизующаяся водой. tпл 106 °C. Получают нагреванием IrF6 с порошком иридия при 150 °C.
- IrCl4— гигроскопичное коричневое твёрдое вещество. Растворяется в холодной воде и разлагается тёплой (водой). Получают нагреванием (600—700 °C) металлического иридия с хлором при повышенном давлении.
- IrBr4 — расплывающееся на воздухе синее вещество. Растворяется в этаноле; в воде (с разложением), диссоциирует при нагревании на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой при низкой температуре.
- IrS2 — твёрдое коричневое вещество. Малорастворим в воде. Получают пропусканием сероводорода через растворы солей иридия (IV) или нагреванием порошкообразного металлического иридия с серой без доступа воздуха в вакууме.
- править] Соединения шестивалентного иридия
- IrF6 — жёлтые тетрагональные кристаллы. tпл 44 °C, tкип 53 °C, плотность — 6,0 г/см³. Под действием металлического иридия превращается в IrF4, восстанавливается водородом до металлического иридия. Получают нагреванием иридия в атмосфере фтора в трубке из флюорита. Сильный окислитель, реагирует с водой и монооксидом азота:
- IrS3 — серый, малорастворимый в воде порошок. Получают нагреванием порошкообразного металлического иридия с избытком серы в вакууме. Строго говоря, не является соединением шестивалетного иридия, так как содержит связь S-S.
Применение
Особый интерес в качестве источника электроэнергии вызывает его ядерный изомер иридий-192m2 (имеющий период полураспада 241 год).
Сплавы с W и Th — материалы термоэлектрических генераторов, с Hf — материалы для топливных баков в космических аппаратах, с Rh, Re, W — материалы для термопар, эксплуатируемых выше 2000 °C, с La и Се — материалы термоэмиссионных катодов.
Иридий используется также для изготовления перьев для ручек. Небольшой шарик из иридия можно встретить на кончиках перьев и чернильных стержней, особенно хорошо его видно на золотых перьях, где он отличается по цвету от самого пера.
Иридий в палеонтологии и геологии является индикатором слоя, который сформировался сразу после падения метеоритов.
Иридий, наряду с медью и платиной, применяется в свечах зажигания двигателей внутреннего сгорания (ДВС) в качестве материала для изготовления электродов, делая такие свечи наиболее долговечными (100—160 тыс. км пробега автомобиля) и снижая требования к напряжению искрообразования. Изначально использовался в авиации и гоночных автомобилях, затем, по мере снижения стоимости продукции, стал употребляться и на массовых автомобилях. В настоящее время такие свечи доступны для большинства двигателей, однако являясь наиболее дорогими.
Иридий-192 является радионуклидом с периодом полураспада 74 сут, широко применяемым в дефектоскопии, особенно в условиях, когда генерирующие источники не могут быть использованы (взрывоопасные среды, отсутствие питающего напряжения нужной мощности)[7].
Биологическая роль
Не играет никакой биологической роли. Металлический иридий нетоксичен, но некоторые соединения иридия, например, его гексафторид (IrF6), очень ядовиты.
Стоимость
Цена на иридий на мировом рынке в мае-июне 2012 — около 35 долларов США за 1 грамм (1085 долларов за тройскую унцию)[8] .
Интересные факты
Иридий — металл, который не взаимодействует с кислотами и их смесями (например, царской водкой) как при нормальной, так и при повышенной температурах[9].
См. также
- Металлы платиновой группы
Примечания
- ↑ Theoretical calculation gave the following results (The lattice parameters, densities and atomic volumes of the platinum metals. Crabtree, Robert H. Sterling Chem. Lab., Yale Univ., New Haven, CT, USA. Journal of the Less-Common Metals (1979), 64(1), P7-P9. )
- ↑ Arblaster, J. W. (1989). «Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data» (PDF). Platinum Metals Review 33 (1): 14–16.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 272. — 671 с. — 100 000 экз.
- ↑ Этот результат получен путём теоретических расчётов. см. The lattice parameters, densities and atomic volumes of the platinum metals. Crabtree, Robert H. Sterling Chem. Lab., Yale Univ., New Haven, CT, USA. Journal of the Less-Common Metals (1979), 64(1), стр. 7-9.
- ↑ Hunt, L. B. (1987). «A History of Iridium». Platinum Metals Review 31 (1): 32–41.
- ↑ Осмистый иридий — статья из Большой советской энциклопедии (3-е издание)
- ↑ Иридий в популярной библиотеке химических элементов
- ↑ eBullionGuide.com Iridium Price History (англ.). Архивировано из первоисточника 22 июня 2012. Проверено 20 июня 2012.
- ↑ Книга рекордов Гиннесса для химических веществ
Литература
- Большая советская энциклопедия
- Химическая энциклопедия под ред. И. Л. Кнулянца. Т.2, стр.271.
Ссылки

Иридий на Викискладе? - Иридий на Webelements
- Иридий в Популярной библиотеке химических элементов
- Свойства иридия
Соединения иридия
Бромид иридия(III) (IrBr3) • Бромид иридия(IV) (IrBr4) • Гексахлороиридат(III) натрия (Na3[IrCl6]) • Гексахлороиридат(IV) аммония ((NH4)2[IrCl6]) • Гексахлороиридат(IV) водорода (H2[IrCl6]) • Гидроксид иридия(III) (Ir(OH)3) • Гидроксид иридия(IV) (Ir(OH)4) • Додекакарбонил иридия (Ir4(CO)12) • Иодид иридия(III) (IrI3) • Иодид иридия(IV) (IrI4) • Оксид иридия(III) (Ir2O3) • Оксид иридия(IV) (IrO2) • Октакарбонил иридия (Ir2(CO)8) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфид иридия(II) (IrS) • Сульфид иридия(III) (Ir2S3) • Сульфид иридия(IV) (IrS2) • Сульфид иридия(VI) (IrS3) • Фторид иридия(IV) (IrF4) • Фторид иридия(VI) (IrF6) • Хлорид иридия(I) (IrCl) • Хлорид иридия(II) (IrCl2) • Хлорид иридия(III) (IrCl3) • Хлорид иридия(IV) (IrCl4) •

Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Fl Uup Lv Uus Uuo Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Другие металлы Металлоиды Другие неметаллы Галогены Инертные газы  Электрохимический ряд активности металлов
Электрохимический ряд активности металловEu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Элементы расположены в порядке возрастания стандартного электродного потенциала.
Что представляет собой
Иридий – это серебристо-белый блестящий металл, платиноид.
Элемент таблицы Менделеева под номером 77, международное наименование – Iridium (Ir).
Очень твердый (6,5 по Моосу), тугоплавкий, плотный. Устойчив к коррозии даже при запредельных температурах.
Иридий – один из двух самых твердых и редких металлов. Его содержание в земной коре в 10 раз меньше платины, в 40 раз меньше золота. По массе это одна миллионная доля процента.
Ювелирами, финансистами причислен к благородным.
Особенности
Сразу стоит сказать, что иридий — это металл. Потому он имеет все те свойства, которые типичны и для иных металлов. Такой химический элемент обозначается сочетанием латинских символов Ir. В таблице Менделеева он занимает 77 клетку. Открытие иридия произошло в 1803 году, в рамках того же исследования, при котором английский ученый Теннант выделил и осмий.
Исходным сырьем для получения таких элементов послужила руда платины, доставленная из Южной Америки. Первоначально металлы выделили в виде осадка, который «не брала» «царская водка». Исследование показало наличие нескольких ранее неизвестных веществ. Свое словесное обозначение элемент получил потому, что его соли выглядят, как будто переливающиеся радугой.
Содержание иридия в природе исключительно мало, и это одно из самых редких веществ на Земле.

Химически чистый иридий не имеет никакого радужного окраса. Зато для него характерен довольно привлекательный серебристо-белый цвет. Токсические свойства не подтверждены. Однако отдельные соединения иридия могут представлять опасность для человека. Особенно ядовит фторид этого элемента.
Производством и аффинажем иридия занимается ряд российских и зарубежных предприятий. Почти весь выпуск этого металла — продукт побочной обработки платинового сырья. Хотя иридий и не пурпурный, он содержит в природном виде 2 изотопа. 191-й и 193-й элементы стабильны. Но выраженные радиоактивные свойства зато имеет ряд искусственно получаемых изотопов, их период полураспада невелик.

История открытия
История открытия иридия связана с именем британского химика Смитсона Теннанта. Исследуя платиновую руду с копей Южной Америки (1803 год), он пытался выделить чистый металл. Воздействуя на руду царской водкой, получил нерастворимый остаток. Здесь обнаружились неизвестные науке вещества. Это были иридий и осмий.

Название пришло само собой. Теннанта впечатлила радужность оттенков солей нового металла, и он назвал его иридием.
Иридой звали древнегреческую богиню радуги.
Ученого избрали членом Лондонского королевского общества, в 1804 году за открытие осмия и иридия удостоили медали Копли – высшей награды общества.
Как получают
О том, что этот металл встречается только в сплавах, мы уже сказали. Но каким образом возможно получить иридий? Источником породы является анодный шлам медноникелевого производства. Продукт – шлам насыщают, после чего, под действием «царской водки», переводят из состояния твёрдого в жидкое, в виде соединений хлорида H2[PtCl6].
В результате химики получают жидкую смесь металлов и добавляют в неё хлорид аммония NH4Cl. После чего производят выведение осадка из платины, а потом получают комплекс иридия (NH4)2[IrCl6]. (NH4)2[IrCl6] прокаливают при помощи кислорода и азота. На выходе получаете металлический иридий.
Физико-химические характеристики
Иридий выглядит подобно любому металлу платинового семейства. Устойчив к коррозии больше золота и платины, до 100°C инертен к кислотам, кислотным сочетаниям.
| Свойства атома | |
| Название, символ, номер | Иридий / Iridium (Ir), 77 |
| Атомная масса (молярная масса) | 192,217(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d7 6s2 |
| Радиус атома | 136 пм |
| Химические свойства | |
| Ковалентный радиус | 127 пм |
| Радиус иона | (+4e) 68 пм |
| Электроотрицательность | 2,20 (шкала Полинга) |
| Электродный потенциал | Ir←Ir3+ 1,00 В |
| Степени окисления | 9, 7, 8, 6, 4, 3, 2, 1, 0, −1, −3 |
| Энергия ионизации (первый электрон) | 868,1 (9,00) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 22,65/22,56±0,01 г/см³ |
| Температура плавления | 2739 K (2466 °C, 4471 °F) |
| Температура кипения | 4701 K (4428 °C, 8002 °F) |
| Уд. теплота плавления | 26,0 кДж/моль |
| Уд. теплота испарения | 610 кДж/моль |
| Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| Молярный объём | 8,54 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,840 Å |
| Температура Дебая | 430,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 147 Вт/(м·К) |
| Номер CAS | 7439-88-5 |
Не токсичен, но шестивалентный фторид ядовит. Этот недостаток учитывают на предприятиях, которые используют иридиевое сырье.
Физические свойства
Иридий — тяжёлый серебристо-белый металл, из-за своей твердости плохо поддающийся механической обработке. Температура плавления — 2739 K (2466 °C), кипит при 4701 K (4428 °C). Кристаллическая структура — кубическая гранецентрированная с периодом а0=0,38387 нм; электрическое сопротивление — 5,3⋅10−8Ом·м (при 0 °C), и 2⋅10−7Ом·м (при 2300 °C); коэффициент линейного расширения — 6,5⋅10−6 град; модуль нормальной упругости — 538 ГПа; плотность при 20 °С — 22,65 г/см³, жидкого иридия — 19,39 г/см³ (2466 °С).
Изотопный состав
Природный иридий встречается в виде смеси из двух стабильных изотопов: 191Ir (содержание 37,3 %) и 193Ir (62,7 %). Искусственными методами получены радиоактивные изотопы иридия с массовыми числами 164-199, а также множество ядерных изомеров. Распространение получил искусственный 192Ir.
Металл в природе
Чистый иридий не встречается в природе. Почти всегда это комбинация с осмием, поэтому у профессионалов в ходу термины «осмистый иридий», «осмиридиевые сплавы».
Коренные залежи осмистого иридия есть в нескольких регионах планеты: Россия, Канада, США, ЮАР, Папуа-Новая Гвинея.

Другие спутники металла иридия в руде – родий и рутений.
На местах добычи используется закрытый (шахтный) способ.
Совокупный мировой объем добычи металла за год – три – десять тонн.
Ученые полагают: происхождение металла таково, что главные залежи нужно искать глубже:
- Земное ядро. Туда металл увлекло железо при образовании планеты.
- Метеориты.
- Кости динозавров. Они насыщены иридием, что косвенно подтверждает гипотезу о гибели животных из-за метеорита, врезавшегося в Землю 65 млн. лет назад.
Спектроскопический анализ выявил следы иридия в короне Солнца.
Существуют природные изотопы металла. Синтезирован десяток аналогов с малым периодом полураспада. Самый востребованный под номером 192 (74 суток).
Где добывают иридий
Места добычи:
- Канада;
- Калимантан;
- США;
- ЮАР;
- Россия;
- Новая Гвинея.
Встречается в природе в складчатых областях перидотовых серпентинитов. Находят россыпные месторождения. Часто встречается в виде твердых растворов в сочетании с осмием — осмистый иридий. По оценкам специалистов, в земной коре находится очень редко. Потому считают (в подтверждение астероидной теории), что высокое содержание металла в рудах сигнализирует об их метеоритном происхождении.
Самый редкий и богатый иридием минерал — родистый невьянскит. Иридия в нем более 11%. Содержится в сысертските, в ауросмириде.
Добыча и переработка
Основные объемы иридия извлекают из сульфатных железистых, никелевых руд. Немного дает минералогическая экзотика – невьянскит, уросмирид, сысертскит.
Чистый иридий получают промышленным способом из продуктов переработки медно-никелевых сплавов.
Технология многоэтапная – выделение из концентрата платиноидов, выщелачивание остатка водой, перегонка, воздействие царской водкой. Осадочный иридий прокаливают, получая чистый металл.
Есть другие методы: ионный обмен, экстракция. Все технологии добычи сложны, затратны.
В России добычу иридия ведут предприятия Красноярска, Екатеринбурга, «Норильский Никель».
Интересные факты
Соли иридия очень разнообразны по окраске. Так, в зависимости от числа присоединившихся атомов хлора, соединение может иметь медно-красный, темный зеленый, оливковый или коричневый цвета. Дифторид иридия окрашен в желтый тон. Соединения с озоном и бромом имеют синюю окраску. У чистого иридия коррозионная стойкость очень велика даже при нагреве до 2000 градусов.
В породах земного происхождения концентрация иридиевых соединений очень невелика. Серьезно повышается она только в породах метеоритного происхождения. Такой критерий позволяет исследователям установить важные факты о различных геологических структурах. Всего на земле производится лишь несколько тонн иридия.
Модуль Юнга (он же модуль продольной упругости) у этого металла — на втором месте среди известных веществ (больше — только у графена).

- https://chem.ru/iridij.html
- https://mysamocvet.ru/metally/iridij/
- https://ProDragmetally.ru/dragotsennye-metally/iridij.html
- https://himsnab-spb.ru/article/ps/ir/
- https://metallsmaster.ru/iridij/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Ir
- https://TheMineral.ru/metally/iridij
- https://vplate.ru/metally-i-splavy/vse-ob-iridii/
- https://jgems.ru/metally/iridij
- https://calcsbox.com/post/iridium.html
Сферы применения
Чистый иридий не применяется: слишком дорог и тверд. Но сплавы с ним востребованы от науки и высоких технологий до ювелирного дела.

Промышленность
Свойства металла обусловили сферы применения промышленным комплексом:
- Из иридия делают посуду, оборудование, катализаторы для предприятий химического комплекса.
- В иридиевых тиглях выращивают монокристаллы.
- У автопрома это материал электродов (с медью и платиной) свечей зажигания. Они служат дольше, используются для элитных автомобилей.
- Сплавы иридия с рутением содержат электрогенераторы, термопары для измерения температур до 2000°C.
- Это индикатор качества сварных швов изделий из стали и сплавов алюминия.
Из платиново-иридиевого сплава изготовлены эталоны килограмма и метра (находятся в Париже).
Космические перспективы открыло третье тысячелетие:
- Компания American Elements создала технологию отливки бесшовных иридиевых колец для использования на спутниках, космических аппаратах (2006 год).
- Металл присутствует в дисплеях компьютеров, телевизоров, айфонов, других гаджетов на основе органических светодиодов (технология OLED).
Как источник энергии рассматривается ядерный изомер иридия-192 со временем «жизни» более 240 лет.
Медицина
Из сплава платины с иридием изготовлен хирургический инструментарий, детали кардиостимуляторов.
Это базис для развития ядерной медицины. Радионуклидное сырье получают на ядерных реакторах, циклотронах. 90% уходит на экспорт.
Россия входит в мировую топ-пятерку производителей сырьевых медицинских изотопов.
Иридий-192 задействован при дефектоскопии и онкологами (гамма-нож).
Ювелирное дело
Ювелиры ценят металл за прочность, используя в сплаве с платиной.
Американская компания Smithson Tennant первой наладила производство ювелирных украшений из иридия. Иридиевые обручальные кольца позиционируются ею как вечные в буквальном смысле: бессильны даже концентрированная кислота и время. Им не требуется особый уход и условия хранения.
Украшения из сплавов с добавлением иридия и через десятилетия выглядят как купленные только что.
Драгоценности с иридием (даже обручальные кольца) не изнашиваются, всегда выглядят как новенькие. Это преимущество особо важно для изделий, испытывающих повышенные нагрузки (обручальные кольца, перстни, браслеты).
Другие сферы
Иридий почитают геологи и палеонтологи: это маркер возраста слоев земной коры и вымерших организмов.
Единственную в мире монету – проба иридия 999 – выпустил в 2013 году Национальный Банк Руанды (государство на востоке Африки). Номинал составил 10 местных франков.
До 1980-х годов шариком из иридиевых сплавов снабжали перья авторучек класса люкс, включая легендарный Parker 51. Это атрибут элиты и аксессуар фаната роскоши Джеймса Бонда.
Биологическая роль
Не играет никакой биологической роли. Металлический иридий неядовит, но некоторые соединения иридия, например, его гексафторид (IrF6), очень ядовиты.
Иридий — 77 элемент таблицы Менделеева
Атомная масса элемента №77 равна 192,2. В таблице Менделеева он находится между осмием и платиной. И в природе он встречается главным образом в виде осмистого иридия – частого спутника самородной платины. Самородного иридия в природе нет.
Иридий – серебристо-белый металл, очень твердый, тяжелый и прочный. По данным , это самый тяжелый элемент: его плотность 22,65 г/см3, а плотность его постоянного спутника – осмия, второго по тяжести 22,61 г/см3. Правда, большинство исследователей придерживаются иной точки зрения: они считают, что иридий все-таки немного легче осмия.
Естественное свойство иридия (он же платиноид!) – высокая коррозионная стойкость. На него не действуют кислоты ни при нормальной, ни при повышенной температуре. Даже знаменитой царской водке монолитный иридий «не по зубам». Только расплавленные щелочи и перекись натрия вызывают окисление элемента №77.
Иридий стоек к действию галогенов. Он реагирует с ними с большим трудом и только при повышенной температуре. Хлор образует с иридием четыре хлорида: IrCl, IrCl2, IrCl3 и IrCl4. Треххлористый иридий получается легче всего из порошка иридия, помещенного в струю хлора при 600°C. Единственное галоидное соединение, в котором иридий шестивалентен, – это фторид IrF6. Тонкоизмельченный иридий окисляется при 1000°C и в струе кислорода, причем в зависимости от условий могут получаться несколько соединений разного состава.
Как и все металлы платиновой группы, иридий образует комплексные соли. Среди них есть и соли с комплексными катионами, например [Ir(NН3)6]Cl3 и соли с комплексными анионами, например K3[IrCl3] · 3H2O. Как комплексообразователь иридий похож на своих соседей по таблице Менделеева.
Чистый иридий получают из самородного осмистого иридия и из остатков платиновых руд (после того как из них извлечены платина, осмий, палладий и рутений). О технологии получения иридия распространяться не будем, отослав читателя к статьям «Родий», «Осмий» и «Платина».
Иридий получают в виде порошка, который затем прессуют в полуфабрикаты и сплавляют или же порошок переплавляют в электрических печах в атмосфере аргона. Чистый иридий в горячем состоянии можно ковать, однако при обычной температуре он хрупок и не поддается никакой обработке.
Стоимость[ | ]
Цена на иридий на мировом рынке в 2021 году — около 160 долларов США за 1 грамм[23].
В Российской Федерации за незаконное приобретение, хранение, перевозку, пересылку и сбыт иридия (а равно и других драгоценных металлов золота, серебра, платины, палладия, родия, рутения и осмия[24]) в крупном размере (то есть стоимостью более 2,25 млн руб.[25]) за исключением ювелирных и бытовых изделий и лома таких изделий, предусмотрена уголовная ответственность в виде лишения свободы на срок до 5 лет[26].
Иридий (обозначение — Ir, атомный номер — 77): драгоценный металл, фактически являющийся представителем платиновой группы. Структурно отличается высоким параметром температуры плавления (2443°C), плюс высоким показателем плотности (22,56 г/см3). Металл имеет уникальные характеристики, в частности — механические свойства в условиях высоких температур, хорошую химическую стабильность, стойкость против окислений. Соответственно, очевидным видится применение непосредственно иридия и сплавов для нужд военной, электронной, авиационной, космонавтической и другой промышленности.
Нахождение в природе
Содержание иридия в земной коре ничтожно мало (10−7 % по массе). Он встречается гораздо реже золота и платины. Встречается вместе с осмием, родием, рением и рутением. Относится к наименее распространённым элементам. Иридий относительно часто встречается в метеоритах. Не исключено, что реальное содержание металла на планете гораздо выше: его высокая плотность и высокое сродство к железу (сидерофильность) могли привести к смещению иридия вглубь Земли, в ядро планеты, в процессе её формирования из протопланетного диска. Небольшое количество иридия было обнаружено в фотосфере Солнца.
Иридий содержится в таких минералах, как невьянскит, сысертскит и ауросмирид.
История открытия Иридия
Минерал существует в чистом виде, но первые упоминания об изотопном металле связаны с падением на Землю железоникелевого метеорита. Столкновение с Землёй метеорита произошло 65 млн лет назад, в эпоху трицерапторов и дипладоков. В Земле упавший объект оставил след, последствия которого видны и сегодня. Образовался кратер в 180 километров глубиной, пыль, поднявшаяся из-за нарушения земной коры и падения метеорита, заставила Землю пребывать во мгле 14 дней, случились извержения вулканов на территории Азии, Индостана и Мадагаскара.
Некоторые учёные предполагают, что именно этот металл погубил всех динозавров и других крупных ящеров, из-за того, что начал выделять токсин при соприкосновении с хлором и земным ядром. Как известно, металл плавится при 2300 градусов по Цельсию.
Так, он лежал в Земле все 65 млн лет, пока его не обнаружили по случайности люди, искавшие платину и нашедшие её на месте старого кратера.
Как земной элемент, иридий был обнаружен в 1804 году, учёным С. Теннатом. В результате проведения процедур по изучению платиновых минералов и выявления в них осмия, был обнаружен иридий.
Вот так Юкатанская катастрофа привела к тому, что в периодической таблице появился Иридий.
Добыча иридия
При высокой ценности металла, его количество на нашей планете ничтожно мало. Даже ценная платина не может посоревноваться с его редкостью. В природе в виде самородков чаще всего встречается с примесями других металлов, среди которых рутений, осмий, палладий или платина. В сочетании с этими металлами иридий образует ауросмириды, невьянскиты, осмиридий, сысертскиты. Россыпи иридия можно встретить в местах добычи меди и никеля. Также возможна его добыча из золотых россыпей.
Передовыми странами добытчиками считаются Канада, США, ЮАР, остров Тасмания, Новая Гвинея. Главный поставщик иридия на мировой рынок – ЮАР.
Большую роль в добыче металла играет то, сколько иридия производит ЮАР, а также рост или падение спроса на металл.

Происхождение металла
Иридий – платаноид, являющийся продуктом многофазового ядерного синтезирования элементов. На планете среди других металлов (из 1005) он занимает всего лишь 3%-ое значение, что означает нечастое его обнаружение. Учёные считают, что иридий скрыт в земном ядре или же в расплавленном железоникелевом слое (внешнее ядро).

В земной коре встречается в виде сплава с осмием или платиной.
Места добычи
Химический элемент встречается в сплавовом виде в складчатых земных породах гор России, перетонитовых породах, расположенных в ЮАР, Кении, Южной Америке и т. д.
Где есть платина, там есть и иридий.
О характеристиках металла, как химического элемента:
ХарактеристикаОбозначение, значение
| Иридий обозначается символом | Ir |
| Номер в таблице Менделеева | 77 |
| Вес атома | 192,22 а.е.м. |
| Степени окисления | От 1 до 6 (5 не входит) |
| Плотность при комнатной температуре | 22,7 г/см^3 |
| Плотность в жидком состоянии | 19,39 г/см^3 |
| Плавление | При 2300 градусов по Цельсию |
| Кипение жидкого иридия | При 45 градусах Цельсия |
| Имеет кристаллическую решётку | Гранецентрированного куба |
Элемент встречается разных цветов, самый распространённый – белый – KIrF6, лимонный – IrF5, золотой – K3IrCl6, светло-зелёный – Na3IrBr6, розовый – Cs3IrI6, малиновый – Na2IrBr6, тёмно-синий – IrI3. Разнообразие цветов обусловлено наличием в иридии различных солей.
Кстати, название своё металл получил за счёт этого разноцветия. Ирида – это богиня радуги в греческой мифологии.
Где используют иридий
До недавнего времени к благородному металлу с уникальными свойствами относились с большой осторожностью. Но всего через 70 лет область применения иридия значительно расширилась – теперь его используют не только в химической промышленности, но и в ювелирном деле, других современных отраслях производства.
Например, при изготовлении свечей зажигания, реактивных двигателей, электрических ламп, термически стойкой посуды, тугоплавкого стекла, хирургических инструментов и т.д.

Иридий используют для создания тиглей, в которых выращивают монокристаллы для лазера. Благодаря химической инертности и экстремально высокой температуре плавления такая емкость не реагирует с помещенным в нее содержимым, что позволяет производить продукцию высокого качества.
Ценный иридий входит в состав некоторых прогрессивных лекарственных препаратов, помогающих бороться с развитием раковых опухолей в организме человека, благодаря его особенным радиоактивным изотопам. Физики-атомщики в недалеком будущем видят их как мощный потенциальный источник электроэнергии.
Где бы иридий ни применялся, пусть и в малых количествах, он всегда служит безотказно. Поэтому можно смело утверждать, что наука и промышленность будущего без него не обойдутся.
Получение
Основной источник получения иридия — анодные шламы медно-никелевого производства. Из концентрата металлов платиновой группы отделяют Au, Pd, Pt и др. Остаток, содержащий Ru, Os и Ir, сплавляют с KNO3 и КОН, плав выщелачивают водой, раствор окисляют Сl2, отгоняют OsO4 и RuO4, а осадок, содержащий иридий, сплавляют с Na2O2 и NaOH, плав обрабатывают царской водкой и раствором NH4Cl, осаждая иридий в виде (NH4)2[IrCl6], который затем прокаливают, получая металлический Ir. Перспективен метод извлечения иридия из растворов экстракцией гексахлороиридатов высшими алифатическими аминами. Для отделения иридия от неблагородных металлов перспективно использование ионного обмена. Для извлечения иридия из минералов группы осмистого иридия минералы сплавляют с ВаО2, обрабатывают соляной кислотой и царской водкой, отгоняют OsO4 и осаждают иридий в виде (NH4)2[IrCl6].
Как получают
О том, что этот металл встречается только в сплавах, мы уже сказали. Но каким образом возможно получить иридий? Источником породы является анодный шлам медноникелевого производства. Продукт – шлам насыщают, после чего, под действием «царской водки», переводят из состояния твёрдого в жидкое, в виде соединений хлорида H2[PtCl6].
В результате химики получают жидкую смесь металлов и добавляют в неё хлорид аммония NH4Cl. После чего производят выведение осадка из платины, а потом получают комплекс иридия (NH4)2[IrCl6]. (NH4)2[IrCl6] прокаливают при помощи кислорода и азота. На выходе получаете металлический иридий.
Свойства иридия
Физические свойства иридия достаточно внушительны. Это очень твердый, тяжелый металл, плохо поддающийся механической обработке. Температура плавления составляет 24660С, имеет достаточно высокую температуру кипения 44280С. Его твердость обуславливается плотностью-22,65 г/см3. При нагревании и обычной температуре он устойчив, при температуре до 1000С на все известные кислоты не реагирует. В присутствии хлоридов щелочных металлов при температуре 600-9000С порошок иридия может раствориться хлорированием. Вступает во взаимосвязь с F2, когда температура достигает 4500С. Свойства иридия не играют никакой биологической роли, он не является токсичным металлом, хотя некоторые его соединения очень ядовиты.
Показатели иридия:
- сплавы иридия с вольфрамом и торием используют, как металл для термоэлектрических генераторов; с другими металлами изготавливают топливные баки для космических аппаратов, термопар, термоэмиссионных катодов;
- в автомобильной промышленности применяют в свечах зажигания, что позволяет долго использовать их, хотя они и дорогие;
- находит свое применение в изготовлении перьев для чернильных ручек, на золотых перьях;
- иридий-192 успешно применяют в дефектоскопии, там, где генерирующие источники не могут быть применены, например, во взрывоопасной среде;
- интересно, что из иридия изготовлен эталон килограмма, так как сплав иридия с платиной обладает механической прочностью и не окисляется;
- находит применение в ювелирной промышленности, но цена неимоверно высока на такие украшения;
- изготавливают лабораторные тигли, чтобы проводить опыты с фтором, а также его агрессивными соединениями;
- делают высокопрочные, жаростойкие мундштуки для выдувания стекла.
Свойства и особенности
- Имеет три синтетических изотопа (191,192,193). Каждый изотоп встречается в сплавовом иридии одиночно и отвечает за какие-либо особенности металла, которые отразятся на его будущем применении.
- Не встречается в чистом виде в природных условиях. Только с каким-либо элементом, как примесь.
- Используется для усиления металлических конструкций и сплавов. У иридия есть свойство укреплять и усиливать те соединения (физические и химические), в которые он добавляется.
- Не теряет своих качеств при смешивании с другими химическими элементами, множественной переплавке и т. д.
- В природе есть вид иридия, в котором смешаны два изотопа – 191 и 193. Такой изотопный металл считается самым крепким и долговечным.
- Иридий высоко инертен, считается драгоценным металлом.

- Иридий не окисляется при взаимодействии с солевыми остатками, кислотами, воздухом и высокими температурами. Как такового окисления не происходит. Но могут случаться впрыски иридия в незначительном количестве, в виде оксида металла IrO2. При температуре более 1300 градусов по Цельсию иридий не сразу же плавится, выделяя частично оксид IrO3.
- Металл плохо поддаётся обработкам. Реакция достаточная для обработки иридия, его перегонка и придание формы происходит при красном световом излучении.
- Металл воспроизводят искусственно, однако, по государственным нормам. Большое количество требуется для строительства дорог и создания механизмов автомобилей, но в ювелирной промышленности иридий не часто используется.
- В зависимости от того, с каким металлом сплавлен иридий, зависит и его цена. К примеру, если он был найден, как примесь к золоту или платине, то основной будет цена золота за грамм плюс процентная стоимость иридия, в зависимости от его содержания в сплаве. Обычно это значение равняется – 10%.
- Высокая цена, от 940 рублей за 1 грамм иридия, обусловлена тем, что процесс отшелушивания, отделения и дальнейшей обработки металла трудоёмок. В ближайшем будущем стоимость за 1 грамм вырастет, скорее всего, с 1719 рублей до 2500 рублей.
- Иридий нетоксичен, не играет никакой важной биологической роли, но в природе встречается смертельно опасный вид иридия – IrF6 (гексафторид). Гексафторид вызывает мгновенное удушение при вдыхании паров.
Физические свойства
Иридий — тяжёлый серебристо-белый металл, из-за своей твердости плохо поддающийся механической обработке. Температура плавления — 2739 K (2466 °C), кипит при 4701 K (4428 °C). Кристаллическая структура — кубическая гранецентрированная с периодом а0=0,38387 нм; электрическое сопротивление — 5,3⋅10−8Ом·м (при 0 °C), и 2⋅10−7Ом·м (при 2300 °C); коэффициент линейного расширения — 6,5⋅10−6 град; модуль нормальной упругости — 538 ГПа; плотность при 20 °С — 22,65 г/см³, жидкого иридия — 19,39 г/см³ (2466 °С).
Изотопный состав
Природный иридий встречается в виде смеси из двух стабильных изотопов: 191Ir (содержание 37,3 %) и 193Ir (62,7 %). Искусственными методами получены радиоактивные изотопы иридия с массовыми числами 164-199, а также множество ядерных изомеров. Распространение получил искусственный 192Ir.
Химические свойства
Иридий устойчив на воздухе при обычной температуре и нагревании, при прокаливании порошка в токе кислорода при 600—1000 °C образует в незначительном количестве IrO2. Выше 1200 °C частично испаряется в виде IrO3. Компактный иридий при температурах до 100 °C не реагирует со всеми известными кислотами и их смесями. Свежеосажденная иридиевая чернь частично растворяется в царской водке с образованием смеси соединений Ir(III) и Ir(IV). Порошок иридия может быть растворён хлорированием в присутствии хлоридов щелочных металлов при 600—900 °C или спеканием с Na2O2 или BaO2 с последующим растворением в кислотах. Иридий взаимодействует с F2 при 400—450 °C, а c Cl2 и S при температуре красного каления.
Степень окисления иридия
Атомы иридия в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы иридия
6+Ir 5+Ir 4+Ir 3+Ir 2+Ir 1+Ir
Ir 01-Ir
Валентность Ir
Атомы иридия в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность иридия характеризует способность атома Ir к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ir
Квантовые числа определяются последним электроном в конфигурации, для атома Ir эти числа имеют значение N = 5, L = 2, Ml = -1, Ms = -½
Соединения трёхвалентного иридия
- Ir2O3 — твёрдое тёмно-синее вещество. Малорастворим в воде и этаноле. Растворяется в серной кислоте. Получают при лёгком прокаливании сульфида иридия (III).
- IrCl3 — летучее соединение оливково-зелёного цвета. Плотность — 5,30 г/см³. Малорастворим в воде, щелочах и кислотах. При 765 °C разлагается на IrCl2 и хлор, при 773 °C на IrCl и хлор, а выше 798 °C — на составные элементы. Получают действием хлора на нагретый до 600 °C иридий.
- IrBr3 — оливково-зелёные кристаллы. Растворяется в воде, мало растворим в спирте. Дегидратируется при нагревании до 105—120 °C. При сильном нагревании разлагается на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой.
- Ir2S3 — твёрдое коричневое вещество. Разлагается на элементы при нагревании выше 1050 °C. Мало растворим в воде. Растворяется в азотной кислоте и растворе сульфида калия. Получают действием сероводорода на хлорид иридия (III) или нагреванием порошкообразного металлического иридия с серой при температуре не выше 1050 °C в вакууме.
Соединения четырёхвалентного иридия
- IrO2 — чёрные тетрагональные кристаллы с решёткой типа рутила. Плотность — 3,15 г/см³. Малорастворим в воде, этаноле и кислотах. Восстанавливается до металла водородом. Термически диссоциирует на элементы при нагревании. Получают нагреванием порошкообразного иридия на воздухе или в кислороде при 700 °C, нагреванием IrO2*nН2О.
- IrF4 — жёлтая маслянистая жидкость, разлагающаяся на воздухе и гидролизующаяся водой. tпл 106 °C. Получают нагреванием IrF6 с порошком иридия при 150 °C.
- IrCl4— гигроскопичное коричневое твёрдое вещество. Растворяется в холодной воде и разлагается тёплой (водой). Получают нагреванием (600—700 °C) металлического иридия с хлором при повышенном давлении.
- IrBr4 — расплывающееся на воздухе синее вещество. Растворяется в этаноле; в воде (с разложением), диссоциирует при нагревании на элементы. Получают взаимодействием IrO2 с бромоводородной кислотой при низкой температуре.
- IrS2 — твёрдое коричневое вещество. Малорастворим в воде. Получают пропусканием сероводорода через растворы солей иридия (IV) или нагреванием порошкообразного металлического иридия с серой без доступа воздуха в вакууме.
Соединения шестивалентного иридия
- IrF6 — жёлтые тетрагональные кристаллы. tпл 44 °C, tкип 53 °C, плотность — 6,0 г/см³. Под действием металлического иридия превращается в IrF4, восстанавливается водородом до металлического иридия. Получают нагреванием иридия в атмосфере фтора в трубке из флюорита. Очень сильный окислитель, способный окислить даже воду:
2IrF6 + 10H2O = 2Ir(OH)4 + 12HF + O2, или NO: NO + IrF6 = NO+[IrF6]-
- IrS3 — серый, малорастворимый в воде порошок. Получают нагреванием порошкообразного металлического иридия с избытком серы в вакууме. Строго говоря. не является соединением шестивалетного иридия, так как содержит связь S-S.
- Ir(OH)4 (IrO2*2H2O) образуется при нейтрализации растворов хлороиридатов(IV) в присутствии окислителей. Осадок Ir2O3*nН2О выпадает при нейтрализации щёлочью хлороиридатов (III) и легко окисляется на воздухе до IrO2. Практически нерастворим в воде.
Радуга металла
Открыл металл и дал ему название англичанин С. Теннант, химик. Производя опыты с самородной платиной, химик исследовал и растворы, оставшиеся от опытов. И не зря — в них он обнаружил разноцветные соли неизвестного элемента.
Иридий назвали в честь радуги (по-гречески iris ) — многоцветного чуда.
Это не о цвете металла, это о разнообразии цветов иридиевых солей:
- K3IrCl6, IrF6 — золотисто-желтые кристаллы;
- KIrF6 — белые кристаллы;
- Ir2O3 — синие, сине-черные кристаллы:
- IrCl2 — зеленые кристаллы;
- Na2IrBr6 — малиновый цвет.
Есть соединения иридия, окрашенные в оливковый, коричневый, розовый, золотистый цвета.
Особенности
Сразу стоит сказать, что иридий — это металл. Потому он имеет все те свойства, которые типичны и для иных металлов. Такой химический элемент обозначается сочетанием латинских символов Ir. В таблице Менделеева он занимает 77 клетку. Открытие иридия произошло в 1803 году, в рамках того же исследования, при котором английский ученый Теннант выделил и осмий.
Исходным сырьем для получения таких элементов послужила руда платины, доставленная из Южной Америки. Первоначально металлы выделили в виде осадка, который «не брала» «царская водка». Исследование показало наличие нескольких ранее неизвестных веществ. Свое словесное обозначение элемент получил потому, что его соли выглядят, как будто переливающиеся радугой.
Содержание иридия в природе исключительно мало, и это одно из самых редких веществ на Земле.

Химически чистый иридий не имеет никакого радужного окраса. Зато для него характерен довольно привлекательный серебристо-белый цвет. Токсические свойства не подтверждены. Однако отдельные соединения иридия могут представлять опасность для человека. Особенно ядовит фторид этого элемента.
Производством и аффинажем иридия занимается ряд российских и зарубежных предприятий. Почти весь выпуск этого металла — продукт побочной обработки платинового сырья. Хотя иридий и не пурпурный, он содержит в природном виде 2 изотопа. 191-й и 193-й элементы стабильны. Но выраженные радиоактивные свойства зато имеет ряд искусственно получаемых изотопов, их период полураспада невелик.

Материалы и методика под разработку и оптимизацию
Под проведение экспериментов учёными, как правило, берётся чистый иридий, полученный из цилиндрического стержня посредством электроннолучевой зонной плавки. Уровень чистоты иридия составляет 99,95%. Плотность материала отмечается на уровне 22,37 г/см3, тогда как относительная плотность достигает значения 99%, соответственно.
Микро-твёрдость исследуемых структур должна иметь значения не менее 450. Таблица ниже демонстрирует концентрации примесей, характерных для испытательных образцов иридия. Цилиндрические образцы вырезаются из кованого прутка иридия и обрабатываются до конечных размеров 6 и 9 мм по диаметру и длине, соответственно.
| Химический элемент | Количество частей на миллион (ppm) |
| Платина (Pt) | 30 |
| Рутений (Ru) | 30 |
| Родий (Rh) | 10 |
| Палладий (Pd) | 10 |
| Золото (Au) | 10 |
| Серебро (Ag) | 10 |
| Медь (Cu) | 10 |
| Железо (Fe) | 10 |
| Никель (Ni) | 10 |
| Кремний (Si) | 10 |
Методика тестирования горячим сжатием
Достаточно удачной видится методика под эксперименты с применением тестера «Gleeble-1500D». Тестирование деформационного поведения иридия осуществляется здесь при термическом сжатии в диапазоне температур 1200-1500°C и с учётом диапазона скоростей деформации от 10-1 с-1 – 10-3 с-1.
В условиях вакуума образцы предварительно нагреваются до температуры сжатия с учётом скорости нагрева 20°C/с и выдерживаются при этой температуре в течение времени – 60 с. Затем доводятся до истинной деформации — 0,6.

Температурное отклонение тестера допустимо в пределах 10°C. Деформированные образцы закаливают, чтобы сохранить деформированную при высокой температуре микроструктуру для последующего анализа. Для исследования профиля твёрдости сжатых образцов применяется вольфрамовый индентор, оснащённый сферическим наконечником.
Для уменьшения трения и повышения равномерности деформации в моменты проведения испытаний на термическое сжатие используют листы графита и тантала. Температурно-временная диаграмма испытания на тепловое сжатие представлена картинкой выше.
Характеристика микроструктуры металла иридий
Образцы для микроструктурного анализа вырезаются из центральной области деформированных образцов по направлению сжатия. Далее образцы шлифуются и вытравливаются электролитической технологией с применением 100 мл насыщенного раствора NaCl, содержащего 35 грамм H и 3–5 грамм HCl.

Аппарат, применяемый для электролитической коррозии, показан на картинке выше. Также используются прецизионные инструменты SEM TM4000PLUS , оптическая микроскопия PMG3 производства «Olympus». Посредством этого набора ведётся наблюдение и анализ деформационной микроструктуры.
При помощи информации: MDPI
Применение
Особый интерес в качестве источника электроэнергии вызывает его ядерный изомер иридий-192m2 (период полураспада 241 год).
Сплавы с W и Th — материалы термоэлектрических генераторов, с Hf — материалы для топливных баков в космических аппаратах, с Rh, Re, W — материалы для термопар, эксплуатируемых выше 2000 °C, с La и Се — материалы термоэмиссионных катодов.
Иридий используется также для изготовления перьев для ручек. Небольшой шарик из иридия можно встретить на кончиках перьев и чернильных стержней, особенно хорошо его видно на золотых перьях, где он отличается по цвету от самого пера.
Иридий в палеонтологии и геологии является индикатором слоя, который сформировался сразу после падения метеоритов.
Иридий, наряду с медью и платиной, применяется в свечах зажигания двигателей внутреннего сгорания (ДВС) в качестве материала для изготовления электродов, делая такие свечи наиболее долговечными (100—160 тыс. км пробега автомобиля) и снижая требования к напряжению искрообразования. Первой компанией, которая стала использовать иридий, улучшив благодаря этому качество свечей зажигания, стала японская компания NGK. Изначально использовался в авиации и гоночных автомобилях, затем, по мере снижения стоимости продукции, стал употребляться и на массовых автомобилях. В настоящее время такие свечи доступны для большинства двигателей, однако являются наиболее дорогими.
Иридий-192 является радионуклидом с периодом полураспада 74 суток, широко применяемым в дефектоскопии, особенно в условиях, когда генерирующие источники не могут быть использованы (взрывоопасные среды, отсутствие питающего напряжения нужной мощности).
Платиноиридиевый сплав обладает большой механической прочностью, не окисляется. Из этого сплава, в частности, изготовлен эталон килограмма.
В 2013 году иридий впервые в мире был применён в изготовлении официальных монет Национальным банком Руанды, который выпустил монету из чистого металла 999-й пробы. Иридиевая монета была выпущена номиналом 10 руандийских франков.
Промышленность
Свойства металла обусловили сферы применения промышленным комплексом:
- Из иридия делают посуду, оборудование, катализаторы для предприятий химического комплекса.
- В иридиевых тиглях выращивают монокристаллы.
- У автопрома это материал электродов (с медью и платиной) свечей зажигания. Они служат дольше, используются для элитных автомобилей.
- Сплавы иридия с рутением содержат электрогенераторы, термопары для измерения температур до 2000°C.
- Это индикатор качества сварных швов изделий из стали и сплавов алюминия.
Из платиново-иридиевого сплава изготовлены эталоны килограмма и метра (находятся в Париже).
Космические перспективы открыло третье тысячелетие:
- Компания American Elements создала технологию отливки бесшовных иридиевых колец для использования на спутниках, космических аппаратах (2006 год).
- Металл присутствует в дисплеях компьютеров, телевизоров, айфонов, других гаджетов на основе органических светодиодов (технология OLED).
Как источник энергии рассматривается ядерный изомер иридия-192 со временем «жизни» более 240 лет.
Медицина
Из сплава платины с иридием изготовлен хирургический инструментарий, детали кардиостимуляторов.
Это базис для развития ядерной медицины. Радионуклидное сырье получают на ядерных реакторах, циклотронах. 90% уходит на экспорт.
Россия входит в мировую топ-пятерку производителей сырьевых медицинских изотопов.
Иридий-192 задействован при дефектоскопии и онкологами (гамма-нож).
Сказочные перспективы иридия в медицине
В кардиостимуляторах применяется сплав иридий-платина.
Онкологи используют изотоп иридия Ir-192 как источник гамма-излучения. Его применяют для лечения рака груди и предстательной железы (на ранних стадиях болезни).
Разработаны методы лечения эпилепсии, болезни Паркинсона, шизофрении с помощью введения иридиевых электродов в мозг. Радужные перспективы для создания протезов глаза и слухового аппарата открывает метод вживления микроэлектродов.
Ювелирное дело
Ювелиры ценят металл за прочность, используя в сплаве с платиной.
Американская компания Smithson Tennant первой наладила производство ювелирных украшений из иридия. Иридиевые обручальные кольца позиционируются ею как вечные в буквальном смысле: бессильны даже концентрированная кислота и время. Им не требуется особый уход и условия хранения.
Украшения из сплавов с добавлением иридия и через десятилетия выглядят как купленные только что.
Драгоценности с иридием (даже обручальные кольца) не изнашиваются, всегда выглядят как новенькие. Это преимущество особо важно для изделий, испытывающих повышенные нагрузки (обручальные кольца, перстни, браслеты).
Другие сферы
Иридий почитают геологи и палеонтологи: это маркер возраста слоев земной коры и вымерших организмов.
Единственную в мире монету – проба иридия 999 – выпустил в 2013 году Национальный Банк Руанды (государство на востоке Африки). Номинал составил 10 местных франков.
До 1980-х годов шариком из иридиевых сплавов снабжали перья авторучек класса люкс, включая легендарный Parker 51. Это атрибут элиты и аксессуар фаната роскоши Джеймса Бонда.
Биологическая роль
Не играет никакой биологической роли. Металлический иридий неядовит, но некоторые соединения иридия, например, его гексафторид (IrF6), очень ядовиты.
Иридий — 77 элемент таблицы Менделеева
Атомная масса элемента №77 равна 192,2. В таблице Менделеева он находится между осмием и платиной. И в природе он встречается главным образом в виде осмистого иридия – частого спутника самородной платины. Самородного иридия в природе нет.
Иридий – серебристо-белый металл, очень твердый, тяжелый и прочный. По данным , это самый тяжелый элемент: его плотность 22,65 г/см3, а плотность его постоянного спутника – осмия, второго по тяжести 22,61 г/см3. Правда, большинство исследователей придерживаются иной точки зрения: они считают, что иридий все-таки немного легче осмия.
Естественное свойство иридия (он же платиноид!) – высокая коррозионная стойкость. На него не действуют кислоты ни при нормальной, ни при повышенной температуре. Даже знаменитой царской водке монолитный иридий «не по зубам». Только расплавленные щелочи и перекись натрия вызывают окисление элемента №77.
Иридий стоек к действию галогенов. Он реагирует с ними с большим трудом и только при повышенной температуре. Хлор образует с иридием четыре хлорида: IrCl, IrCl2, IrCl3 и IrCl4. Треххлористый иридий получается легче всего из порошка иридия, помещенного в струю хлора при 600°C. Единственное галоидное соединение, в котором иридий шестивалентен, – это фторид IrF6. Тонкоизмельченный иридий окисляется при 1000°C и в струе кислорода, причем в зависимости от условий могут получаться несколько соединений разного состава.
Как и все металлы платиновой группы, иридий образует комплексные соли. Среди них есть и соли с комплексными катионами, например [Ir(NН3)6]Cl3 и соли с комплексными анионами, например K3[IrCl3] · 3H2O. Как комплексообразователь иридий похож на своих соседей по таблице Менделеева.
Чистый иридий получают из самородного осмистого иридия и из остатков платиновых руд (после того как из них извлечены платина, осмий, палладий и рутений). О технологии получения иридия распространяться не будем, отослав читателя к статьям «Родий», «Осмий» и «Платина».
Иридий получают в виде порошка, который затем прессуют в полуфабрикаты и сплавляют или же порошок переплавляют в электрических печах в атмосфере аргона. Чистый иридий в горячем состоянии можно ковать, однако при обычной температуре он хрупок и не поддается никакой обработке.
Химический состав
В таблице Менделеева элемент называется Iridium, сокращенно Ir. Атомный номер – 77, атомная масса – 192,217 г/моль, переходный металл.
В ряду драгоценных металлов иридий оказался не сразу. Только после тщательного изучения его свойств, его включили в группу благородных.
Металл обладает высокой твердостью, плотностью и тугоплавкостью. Очень устойчив к коррозии. В земной коре встречается нечасто. Обладает гораздо большей химической устойчивостью, чем золото, серебро и платина.
Иридий не поддается воздействию кислорода, как при обычной, так и при повышенной температуре. Окисление может активизироваться только если иридий находится в порошкообразном состоянии. Для этого необходимо воздействие высоких температур в диапазоне 600ᵒС – 1000ᵒС. После рубежа в 1200ᵒС металл начинает испаряться.
Не вступает в реакцию с любыми кислотами при температурах до 100ᵒС.
Не подвержен расщеплению даже под действием «царской водки».
Единственные элементы, которые могут воздействовать на иридий:
- галогены;
- перекись натрия.
Под их воздействием иридий может медленно расщепляться до полного растворения.
Имеет кубическую гранецентрированную кристаллическую решетку. Параметры – 3840 Å.
Искусственный иридий
Иридий, как и многие другие металлы крайне редкий, но очень ценный и широко используемый металл. Спрос на такие металлы только нарастает, а их количество природе уменьшается и к большому сожалению человечества не возобновляется. В связи с этим в мире большие обороты набирает искусственный синтез драгоценных металлов. Для этого создаются целые компании и лаборатории. Самой передовой и успешной технологией искусственного синтеза драгметаллов, которую только начинают внедрять является холодная ядерная трансмутация. Этот способ признан в мире и сегодня с его помощью синтезируется искусственная платина. Над остальными металлами проводятся работы. На территории России искусственным синтезом занимается .
Стоимость[ | ]
Цена на иридий на мировом рынке в 2021 году — около 160 долларов США за 1 грамм[23].
В Российской Федерации за незаконное приобретение, хранение, перевозку, пересылку и сбыт иридия (а равно и других драгоценных металлов золота, серебра, платины, палладия, родия, рутения и осмия[24]) в крупном размере (то есть стоимостью более 2,25 млн руб.[25]) за исключением ювелирных и бытовых изделий и лома таких изделий, предусмотрена уголовная ответственность в виде лишения свободы на срок до 5 лет[26].
Интересные факты
Соли иридия очень разнообразны по окраске. Так, в зависимости от числа присоединившихся атомов хлора, соединение может иметь медно-красный, темный зеленый, оливковый или коричневый цвета. Дифторид иридия окрашен в желтый тон. Соединения с озоном и бромом имеют синюю окраску. У чистого иридия коррозионная стойкость очень велика даже при нагреве до 2000 градусов.
В породах земного происхождения концентрация иридиевых соединений очень невелика. Серьезно повышается она только в породах метеоритного происхождения. Такой критерий позволяет исследователям установить важные факты о различных геологических структурах. Всего на земле производится лишь несколько тонн иридия.
Модуль Юнга (он же модуль продольной упругости) у этого металла — на втором месте среди известных веществ (больше — только у графена).

- https://chem.ru/iridij.html
- https://mysamocvet.ru/metally/iridij/
- https://ProDragmetally.ru/dragotsennye-metally/iridij.html
- https://himsnab-spb.ru/article/ps/ir/
- https://metallsmaster.ru/iridij/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Ir
- https://TheMineral.ru/metally/iridij
- https://vplate.ru/metally-i-splavy/vse-ob-iridii/
- https://jgems.ru/metally/iridij
- https://calcsbox.com/post/iridium.html
Иридий, свойства атома, химические и физические свойства.
Ir 77 Иридий
192,217(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d7 6s2
Иридий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 77. Расположен в 9-й группе (по старой классификации — побочной подгруппе восьмой группы), шестом периоде периодической системы.
Общие сведения
Свойства атома иридия
Химические свойства иридия
Физические свойства иридия
Кристаллическая решётка иридия
Дополнительные сведения
Таблица химических элементов Д.И. Менделеева
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Иридий |
| 102 | Прежнее название | |
| 103 | Латинское название | Iridium |
| 104 | Английское название | Iridium |
| 105 | Символ | Ir |
| 106 | Атомный номер (номер в таблице) | 77 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, драгоценный, цветной металл, металл платиновой группы |
| 109 | Открыт | Смитсон Теннант, Великобритания, 1803 г. |
| 110 | Год открытия | 1803 г. |
| 111 | Внешний вид и пр. | Очень твёрдый, тугоплавкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 4,0·10-8 % |
| 120 | Содержание в морях и океанах (по массе) | |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 2,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000054 % |
| 124 | Содержание в организме человека (по массе) |
Свойства атома иридия:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 192,217(3) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d7 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O15 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 180 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Ir 3+ 82 (6) пм, Ir 4+ 76,5 (6) пм, Ir 5+ 71 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 77 электронов, 77 протонов, 115 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 9-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Химические свойства иридия:
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8, +9 |
| 302 | Валентность | I, II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,2 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 865,19 кДж/моль (8,96702(22) эВ) |
| 305 | Электродный потенциал | Ir3+ + 3e— → Ir, Eo = +1,0 В |
| 306 | Энергия сродства атома к электрону | 150,9086(12) кДж/моль (1,07780(13) эВ) |
Физические свойства иридия:
| 400 | Физические свойства | |
| 401 | Плотность* | 22,56 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 19 г/см3 (при температуре плавления 2446 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2446 °C (2719 K, 4435 °F) |
| 403 | Температура кипения* | 4130 °C (4403 K, 7466 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 41,12 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 564 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,131 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость | 25,1 Дж/(K·моль) |
| 411 | Молярный объём | 8,52 см³/моль |
| 412 | Теплопроводность | 147 Вт/(м·К) (при стандартных условиях), 147 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 6,4 мкм/(М·К) (при 0 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Кристаллическая решётка иридия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,840 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 430 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-88-5 |
Примечание:
* — доступно в платной версии.
Источники:
- https://wikipedia.org
[know]
Таблица химических элементов Д.И. Менделеева
Коэффициент востребованности
1 124




![mathsf{IrF_6 + NO rightarrow NO[IrF_6] }](https://dic.academic.ru/dic.nsf/ruwiki/d4ef437c200c347b7adc73c4fa60aeea.png)

