Бронза представляет собой материал, получаемый путем соединения олова и меди. Помимо данных компонентов, в состав бронзы могут быть добавлены цинк, свинец, марганец, алюминий. Однако содержание меди в таких случаях не меняется, вне зависимости от дополнительных компонентов.
По химическому составу бронза подразделяется на два вида:
- оловянные (в составе преобладает олово);
- безоловянные (данный металл имеется в небольших количествах).
Сплавы также дифференцируются по виду обработки:
- деформируемые (для производства деталей путем давления или штамповки).
- литейные (подходят в качестве литья).
Сплавов, в которые имеются дополнительные компоненты, насчитывается огромное множество. Бронзу можно определить по цвету, на который также влияет наличие примесей. Однако классифицировать бронзу можно благодаря обозначению, которое должно соответствовать принятому стандарту. В технической документации приводятся таблицы, где указываются буквенные обозначение. Таким образом, при проектировании или покупке материалов можно узнать, какой тип бронзы подойдет лучше всего.
В качестве примера рассмотрим обозначение, которое часто встречается в производстве – БрАЖ9-4. «Бр» говорит о том, что в составе справа имеется традиционная бронза. Буквы «А» и «Ж» свидетельствуют о том, что материал изготавливается с использованием алюминия и железа. Для других металлов применяются соответствующие буквенные обозначения.
Разновидности сплавов из бронзы, их применение
Получать бронзу начали еще наши предки. Опытным путем было выяснено, что при изменении компонентов происходит изменение характеристик сплава. В частности, за счет олова изменяется ковкость материала. Если повысить его содержание, то материал становится более твердым. Наибольшие значения этого показателя у бериллиевой бронзы. В процессе закалки она приобретает пластичность. Поэтому ее используют при изготовлении элементов, где требуется определенная упругость. Это мембраны, пружины и рессоры.
Алюминиевая бронза позволяет получать металлические трубы и ленты, которые подвергаются разрезанию. При этом получаемые изделия не подвержены ржавчине даже при воздействии соленой воды.
Бронза с добавлением свинца востребована при производстве подшипников, поскольку способна сопротивляться ударным нагрузкам.
Кремнецинковая бронза позволяет изготавливать детали сложной конфигурации. Этот материал обладает хорошими текучими свойствами, поэтому им можно заполнить различные формы. В то же время такой сплав не имеет склонности к образованию искр.
Периодическая система химических элементов Д. И. Менделеева
| Период | Ряд | Группа | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| 1 | 1 | 1HВодород1,0079 | (H) | 2HeГелий4,0026 | |||||||
| 2 | 2 | 3LiЛитий6,941 | 4BeБериллий9,012 | 5BБор10,811 | 6CУглерод12,011 | 7NАзот14,007 | 8OКислород15,999 | 9FФтор18,998 | 10NeНеон20,18 | ||
| 3 | 3 | 11NaНатрий22,99 | 12MgМагний24,305 | 13AlАлюминий26,982 | 14SiКремний28,086 | 15PФосфор30,974 | 16SСера32,065 | 17ClХлор35,453 | 18ArАргон39,948 | ||
| 4 | 4 | 19KКалий39,098 | 20CaКальций40,078 | 21ScСкандий44,956 | 22TiТитан47,867 | 23VВанадий50,942 | 24CrХром51,996 | 25MnМарганец54,938 | 26FeЖелезо55,845 | 27CoКобальт58,933 | 28NiНикель58,693 |
| 5 | 29CuМедь63,546 | 30ZnЦинк65,409 | 31GaГаллий69,723 | 32GeГерманий72,64 | 33AsМышьяк74,992 | 34SeСелен78,96 | 35BrБром79,904 | 36KrКриптон83,798 | |||
| 5 | 6 | 37RbРубидий85,468 | 38SrСтронций87,62 | 39YИттрий88,906 | 40ZrЦирконий91,224 | 41NbНиобий92,906 | 42MoМолибден95,94 | 43TcТехнеций[98,906] | 44RuРутений101,07 | 45RhРодий102,906 | 46PdПалладий106,42 |
| 7 | 47AgСеребро107,868 | 48CdКадмий112,411 | 49InИндий114,818 | 50SnОлово118,71 | 51SbСурьма121,76 | 52TeТеллур127,60 | 53IИод126,904 | 54XeКсенон131,293 | |||
| 6 | 8 | 55CsЦезий132,905 | 56BaБарий137,327 | 57La*Лантан138,905 | 72HfГафний178,49 | 73TaТантал180,948 | 74WВольфрам183,84 | 75ReРений186,207 | 76OsОсмий190,23 | 77IrИридий192,217 | 78PtПлатина195,084 |
| 9 | 79AuЗолото196,967 | 80HgРтуть200,59 | 81TlТаллий204,383 | 82PbСвинец207,2 | 83BiВисмут208,98 | 84PoПолоний[208,98] | 85AtАстат[209,98] | 86RnРадон[222,02] | |||
| 7 | 10 | 87FrФранций[223,02] | 88RaРадий[226,03] | 89Ac**Актиний[227,03] | 104RfРезерфордий[261,1087] | 105DbДубний[262,1138] | 106SgСиборгий[263,1182] | 107BhБорий[262,1229] | 108HsХассий[265] | 109MtМейтнерий[266] | 110DsДармштадтий[269] |
| 11 | 111RgРентгений[272] | 112CnКоперниций[285] | 113UutУнунтрий[284] | 114FlФлеровий[289] | 115UupУнунпентий[288] | 116LvЛиверморий[293] | 117UusУнунсептий[295] | 118UuoУнуноктий[294] | |||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие соединения с водородом | RH4 | RH3 | H2R | HR |
*Лантаноиды
| 58CeЦерий140,12 | 59PrПразеодим140,91 | 60NdНеодим144,24 | 61PmПрометий[146,9] | 62SmСамарий[150,36] | 63EuЕвропий151,96 | 64GdГадолиний157,25 | 65TbТербий158,93 | 66DyДиспрозий162,50 | 67HoГольмий164,93 | 68ErЭрбий167,26 | 69TmТулий168,93 | 70YbИттербий173,04 | 71LuЛютеций174,97 |
**Актиноиды
| 90ThТорий232,04 | 91PaПротактиний231,04 | 92UУран238,03 | 93NpНептуний[237,05] | 94PuПлутоний[244,06] | 95AmАмериций[243,06] | 96CmКюрий[247,07] | 97BkБерклий[247,07] | 98CfКалифорний[251,08] | 99EsЭйнштейний[252,08] | 100FmФермий[257,1] | 101MdМенделевий[258,1] | 102NoНобелий[259,1] | 103LrЛоуренсий[260,11] |
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Выше приведена «короткая» форма таблицы.
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА
 Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
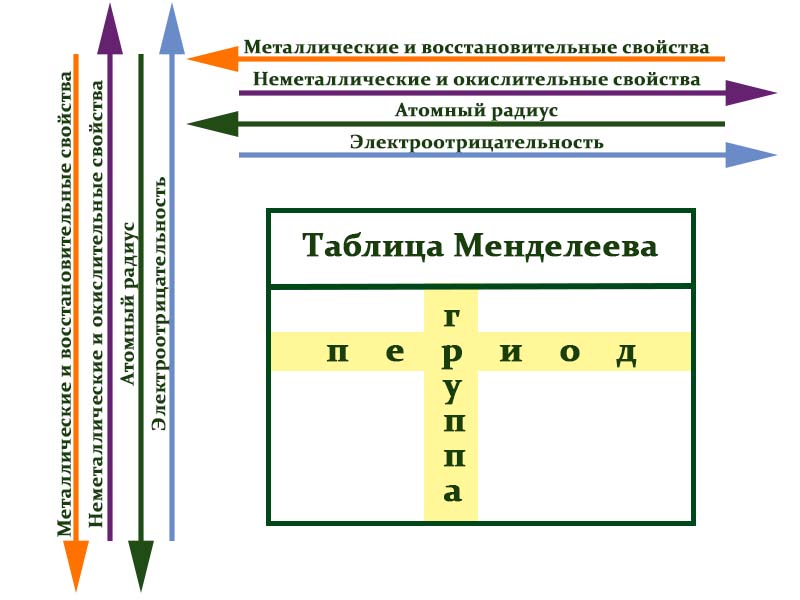
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Список химических элементов по атомным номерам
- Список химических элементов по атомным номерам
-
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
Химические семейства элементов периодической таблицы
Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Лёгкие металлы Полуметаллы Неметаллы Галогены Инертные газы № Название Символ Период,
группаМасса
(г/моль)Плотность
(г/см³)
при 20 °СТемпература
плавления (°C)Температура
кипения (°C)Год
открытияПервооткрыватель 1 Водород H 1, 1 1,00794 (7)* * * 0,084 г/л -259,1 -252,9 1766 Кавендиш 2 Гелий He 1, 18 4,002602 (2)* * 0,17 г/л -272,2 (при 2,5 МПа) -268,9 1895 Рамзай и Клеве 3 Литий Li 2, 1 6,941 (2)* * * * 0,53 180,5 1317 1817 Арфведсон 4 Бериллий Be 2, 2 9,012182 (3) 1,85 1278 2970 1797 Воклен 5 Бор B 2, 13 10,811 (7)* * * 2,46 2300 2550 1808 Дэви и Гей-Люссак 6 Углерод C 2, 14 12,0107 (8)* * 3,51 3550 4827 доисторический период неизвестен 7 Азот N 2, 15 14,0067 (2)* * 1,17 g/l -209,9 -195,8 1772 Резерфорд 8 Кислород O 2, 16 15,9994 (3)* * 1,33 г/л -218,4 -182,9 1774 Пристли и Шееле 9 Фтор F 2, 17 18,9984032 (5) 1,58 г/л -219,6 -188,1 1886 Муассан 10 Неон Ne 2, 18 20,1797 (6)* * 0,84 г/л -248,7 -246,1 1898 Рамзай и Трэверс 11 Натрий Na 3, 1 22,98976928 (2) 0,97 97,8 892 1807 Дэви 12 Магний Mg 3, 2 24,3050 (6) 1,74 648,8 1107 1755 Блэк 13 Алюминий Al 3, 13 26,9815386 (8) 2,70 660,5 2467 1825 Эрстед 14 Кремний Si 3, 14 28,0855 (3)* 2,33 1410 2355 1824 Берцелиус 15 Фосфор P 3, 15 30,973762 (2) 1,82 44 (P4) 280 (P4) 1669 Бранд 16 Сера S 3, 16 32,065 (5)* * 2,06 113 444,7 доисторический период неизвестен 17 Хлор Cl 3, 17 35,453 (2)* * * 2,95 г/л -101 -34,6 1774 Шееле 18 Аргон Ar 3, 18 39,948 (1)* * 1,66 г/л -189,4 -185,9 1894 Рамзай и Рэлей 19 Калий K 4, 1 39,0983 (1) 0,86 63,7 774 1807 Дэви 20 Кальций Ca 4, 2 40,078 (4)* 1,54 839 1487 1808 Дэви 21 Скандий Sc 4, 3 44,955912 (6) 2,99 1539 2832 1879 Нильсон 22 Титан Ti 4, 4 47,867 (1) 4,51 1660 3260 1791 Грегор и Клапрот 23 Ванадий V 4, 5 50,9415 (1) 6,09 1890 3380 1801 дель Рио 24 Хром Cr 4, 6 51,9961 (6) 7,14 1857 2482 1797 Воклен 25 Марганец Mn 4, 7 54,938045 (5) 7,44 1244 2097 1774 Ган 26 Железо Fe 4, 8 55,845 (2) 7,87 1535 2750 доисторический период неизвестен 27 Кобальт Co 4, 9 58,933195 (5) 8,89 1495 2870 1735 Брандт 28 Никель Ni 4, 10 58,6934 (2) 8,91 1453 2732 1751 Кронштедт 29 Медь Cu 4, 11 63,546 (3)* 8,92 1083,5 2595 доисторический период неизвестен 30 Цинк Zn 4, 12 65,409 (4) 7,14 419,6 907 доисторический период неизвестен 31 Галлий Ga 4, 13 69,723 (1) 5,91 29,8 2403 1875 де Буабодран 32 Германий Ge 4, 14 72,64 (1) 5,32 937,4 2830 1886 Винклер 33 Мышьяк As 4, 15 74,92160 (2) 5,72 613 613
(subl.)ca. 1250 Альберт Великий 34 Селен Se 4, 16 78,96 (3)* 4,82 217 685 1817 Берцелиус 35 Бром Br 4, 17 79,904 (1) 3,14 -7,3 58,8 1826 Балар 36 Криптон Kr 4, 18 83,798 (2)* * 3,48 г/л -156,6 -152,3 1898 Рамзай и Трэверс 37 Рубидий Rb 5, 1 85,4678 (3)* 1,53 39 688 1861 Бунзен и Кирхгоф 38 Стронций Sr 5, 2 87,62 (1)* * 2,63 769 1384 1790 Кроуфорд 39 Иттрий Y 5, 3 88,90585 (2) 4,47 1523 3337 1794 Гадолин 40 Цирконий Zr 5, 4 91,224 (2)* 6,51 1852 4377 1789 Клапрот 41 Ниобий Nb 5, 5 92,906 38 (2) 8,58 2468 4927 1801 Хэтчетт 42 Молибден Mo 5, 6 95,94 (2)* 10,28 2617 5560 1778 Шееле 43 Технеций Tc 5, 7 [98,9063]* 11,49 2172 5030 1937 Перрье и Сегре 44 Рутений Ru 5, 8 101,07 (2)* 12,45 2310 3900 1844 Клаус 45 Родий Rh 5, 9 102,90550 (2) 12,41 1966 3727 1803 Уолластон 46 Палладий Pd 5, 10 106,42 (1)* 12,02 1552 3140 1803 Уолластон 47 Серебро Ag 5, 11 107,8682 (2)* 10,49 961,9 2212 доисторический период неизвестен 48 Кадмий Cd 5, 12 112,411 (8)* 8,64 321 765 1817 Штромейер 49 Индий In 5, 13 114,818 (3) 7,31 156,2 2080 1863 Райх и Рихтер 50 Олово Sn 5, 14 118,710 (7)* 7,29 232 2270 доисторический период неизвестен 51 Сурьма Sb 5, 15 121,760 (1)* 6,69 630,7 1750 доисторический период неизвестен 52 Теллур Te 5, 16 127,60 (3)* 6,25 449,6 990 1782 фон Райхенштайн 53 Иод I 5, 17 126,90447 (3) 4,94 113,5 184,4 1811 Куртуа 54 Ксенон Xe 5, 18 131,293 (6)* * 4,49 г/л -111,9 -107 1898 Рамзай и Трэверс 55 Цезий Cs 6, 1 132,9054519 (2) 1,90 28,4 690 1860 Бунзен и Кирхгоф 56 Барий Ba 6, 2 137,327 (7) 3,65 725 1640 1808 Дэви 57 Лантан La 6 138,90547 (7)* 6,16 920 3454 1839 Мосандер 58 Церий Ce 6 140,116 (1)* 6,77 798 3257 1803 фон Хисингер и Берцелиус 59 Празеодим Pr 6 140,90765 (2) 6,48 931 3212 1895 фон Вельсбах 60 Неодим Nd 6 144,242 (3)* 7,00 1010 3127 1895 фон Вельсбах 61 Прометий Pm 6 [146,9151]* 7,22 1080 2730 1945 Маринский и Гленденин 62 Самарий Sm 6 150,36 (2)* 7,54 1072 1778 1879 де Буабодран 63 Европий Eu 6 151,964 (1)* 5,25 822 1597 1901 Демарсе 64 Гадолиний Gd 6 157,25 (3)* 7,89 1311 3233 1880 де Мариньяк 65 Тербий Tb 6 158,92535 (2) 8,25 1360 3041 1843 Мосандер 66 Диспрозий Dy 6 162,500 (1)* 8,56 1409 2335 1886 де Буабодран 67 Гольмий Ho 6 164,93032 (2) 8,78 1470 2720 1878 Соре 68 Эрбий Er 6 167,259 (3)* 9,05 1522 2510 1842 Мосандер 69 Тулий Tm 6 168,93421 (2) 9,32 1545 1727 1879 Клеве 70 Иттербий Yb 6 173,04 (3)* 6,97 824 1193 1878 де Мариньяк 71 Лютеций Lu 6, 3 174,967 (1)* 9,84 1656 3315 1907 Урбэн 72 Гафний Hf 6, 4 178,49 (2) 13,31 2150 5400 1923 Костер и де Хевеши 73 Тантал Ta 6, 5 180,9479 (1) 16,68 2996 5425 1802 Экеберг 74 Вольфрам W 6, 6 183,84 (1) 19,26 3407 5927 1783 Элюяр 75 Рений Re 6, 7 186,207 (1) 21,03 3180 5627 1925 Ноддак, Таке и Берг 76 Осмий Os 6, 8 190,23 (3)* 22,61 3045 5027 1803 Теннант 77 Иридий Ir 6, 9 192,217 (3) 22,65 2410 4130 1803 Теннант 78 Платина Pt 6, 10 195,084 (9) 21,45 1772 3827 1557 Скалигер 79 Золото Au 6, 11 196,966569 (4) 19,32 1064,4 2940 доисторический период неизвестен 80 Ртуть Hg 6, 12 200,59 (2) 13,55 -38,9 356,6 доисторический период неизвестен 81 Таллий Tl 6, 13 204,3833 (2) 11,85 303,6 1457 1861 Крукс 82 Свинец Pb 6, 14 207,2 (1)* * 11,34 327,5 1740 доисторический период неизвестен 83 Висмут Bi 6, 15 208,98040 (1) 9,80 271,4 1560 1753 Жоффруа 84 Полоний Po 6, 16 [208,9824]* 9,20 254 962 1898 Мария и Пьер Кюри 85 Астат At 6, 17 [209,9871]* 302 337 1940 Корсон, Маккензи и Сегре 86 Радон Rn 6, 18 [222,0176]* 9,23 г/л -71 -61,8 1900 Дорн 87 Франций Fr 7, 1 [223,0197]* 1,87 27 677 1939 Перей 88 Радий Ra 7, 2 [226,0254]* 5,50 700 1140 1898 Мария и Пьер Кюри 89 Актиний Ac 7 [227,0278]* 10,07 1047 3197 1899 Дебьерн 90 Торий Th 7 232,03806 (2)* * 11,72 1750 4787 1829 Берцелиус 91 Протактиний Pa 7 231,03588 (2)* 15,37 1554 4030 1917 Содди, Кранстон и Ган 92 Уран U 7 238,02891 (3)* * * 18,97 1132,4 3818 1789 Клапрот 93 Нептуний Np 7 [237,0482]* 20,48 640 3902 1940 Макмиллан и Абелсон 94 Плутоний Pu 7 [244,0642]* 19,74 641 3327 1940 Сиборг 95 Америций Am 7 [243,0614]* 13,67 994 2607 1944 Сиборг 96 Кюрий Cm 7 [247,0703]* 13,51 1340 1944 Сиборг 97 Берклий Bk 7 [247,0703]* 13,25 986 1949 Сиборг 98 Калифорний Cf 7 [251,0796]* 15,1 900 1950 Сиборг 99 Эйнштейний Es 7 [252,0829]* 860 1952 Сиборг 100 Фермий Fm 7 [257,0951]* 1952 Сиборг 101 Менделевий Md 7 [258,0986]* 1955 Сиборг 102 Нобелий No 7 [259,1009]* 1958 Сиборг 103 Лоуренсий Lr 7, 3 [260,1053]* 1961 Гиорсо 104 Резерфордий Rf 7, 4 [261,1087]* 1964/69 Флёров 105 Дубний Db 7, 5 [262,1138]* 1967/70 Флёров 106 Сиборгий Sg 7, 6 [263,1182]* 1974 Флёров 107 Борий Bh 7, 7 [262,1229]* 1976 Оганесян 108 Хассий Hs 7, 8 [265]* 1984 GSI (*) 109 Мейтнерий Mt 7, 9 [266]* 1982 GSI 110 Дармштадтий Ds 7, 10 [269]* 1994 GSI 111 Рентгений Rg 7, 11 [272]* 1994 GSI 112 Унунбий Uub 7, 12 [285]* 1996 GSI 113 Унунтрий Uut 7, 13 [284]* 2004 ОИЯИ (*), LLNL (*) 114 Унунквадий Uuq 7, 14 [289]* 1999 ОИЯИ 115 Унунпентий Uup 7, 15 [288]* 2004 ОИЯИ, LLNL 116 Унунгексий Uuh 7, 16 [292]* 1999 LBNL (*) 117 Унунсептий Uus 7, 17 [295]* ещё не получен ещё не получен 118 Унуноктий Uuo 7, 18 [294]* 2004 ОИЯИ Химические семейства элементов периодической таблицы
Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Лёгкие металлы Полуметаллы Неметаллы Галогены Инертные газы Аббревиатуры
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- ОИЯИ, Объединённый институт ядерных исследований), Дубна, Московская область, Россия( == JINR, (Joint Institute for Nuclear Research,)
- LLNL, Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э.Лоуренса), Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
Примечания
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабильных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Список химических элементов по атомным номерам» в других словарях:
-
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
-
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
-
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
ПСХЭ — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Переодичная система — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система — химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
-
Периодическая система Менделеева — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
 В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
БРОНЗЫ
БРОНЗЫ (франц. ед. ч. bronze), сплавы на основе меди, в к-рых
главным легирующим элементом м. б. любой хим. элемент, за исключением Zn
и Ni. Различают оловянные бронзы (до ~ 19% Sn), алюминиевые (4-11 % А1), бериллиевые
(до ~ 2% Be) и др. Оловянная бронза-древнейший сплав, выплавленный человеком.
Бронзы получают сплавлением меди с легирующими элементами, обычно в электрич.
индукционных печах. По способу обработки бронзы подразделяют на деформируемые
и литейные. Из первых отливают плоские или круглые слитки, к-рые подвергают
горячей и затем холодной обработке давлением (прокатке, прессованию) для
получения листов, лент, прутков и труб. Бронзы плавятся при более низких т-рах,
чем медь; они хорошо заполняют литейную форму.
Легирующие элементы могут образовывать с медью твердый р-р или хим.
соед. (напр., Cu31Sn8, Cu3P). Твердый
раствор из-за искажения атомами легирующих элементов кристаллич. решетки
меди тверже ее. Хим. соед. еще более тверды, но очень хрупки; их объемная
доля в бронзах значительно меньше, чем доля твердого р-ра. Для бронз характерны: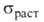
150-600МПа, относительное удлинение 3-10% (литейные) и 20-50% (деформируемые),
твердость по Бринеллю 600-2000 МПа. Нек-рые бронзы подвергают закалке и упрочняющему
старению. Напр., при закалке в воде бронзы, содержащей 2% Be (от т-ры 780°С),
образуется пересыщенный бериллием твердый р-р, а во время старения при
320 °С в течение 2 ч в этом р-ре получаются обогащенные бериллием дисперсные
выделения, близкие по составу к СиВе и обусловливающие высокие мех. св-ва: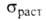
1300МПа, твердость по Бринеллю 3500 МПа.
Бронзы превосходят чистую медь по антикоррозионным св-вам и прочности. Для
многих бронз характерны высокие износостойкость, упругость, вязкость, антифрикционные
св-ва. Они устойчивы на воздухе (в т.ч. морском), в водяном паре, H2SO4,
а алюминиевые бронзы, кроме того, в морской воде, разб. соляной к-те, кремнистые
— во мн. сухих газах (С12, Вr2, H2S, HC1,
SO2, NH3), сточных щелочных средах.
Бронзы используют для изготовления шестерен, направляющих втулок, подшипников
скольжения, арматуры для работы в пресной и морской воде и атмосфере водяного
пара, судовых гребных винтов, пружин, манометрич. трубок, электродов сварочных
аппаратов, дымовых труб и труб для сточных вод, монет, скульптур, колоколов
и др. Особенно широко применяют алюминиевые бронзы, к-рые менее до^ роги, чем
оловянные.см.: также Меди сплавы.
===
Исп. литература для статьи «БРОНЗЫ»: Смрягин А. П., Смирягина Н.А., Белова А. В., Промышленные
цветные металлы и сплавы, 3 изд., М., 1974; Колачев Б. А., Ливанов В. Л.,
Елагин В.И., Металловедение и термическая обработка цветных металлов и
сплавов, 2 изд., M.v 1981. И. И. Новиков.
Страница «БРОНЗЫ» подготовлена по материалам химической энциклопедии.
