Список химических элементов по атомным номерам
- Список химических элементов по атомным номерам
-
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
Химические семейства элементов периодической таблицы
Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Лёгкие металлы Полуметаллы Неметаллы Галогены Инертные газы № Название Символ Период,
группаМасса
(г/моль)Плотность
(г/см³)
при 20 °СТемпература
плавления (°C)Температура
кипения (°C)Год
открытияПервооткрыватель 1 Водород H 1, 1 1,00794 (7)* * * 0,084 г/л -259,1 -252,9 1766 Кавендиш 2 Гелий He 1, 18 4,002602 (2)* * 0,17 г/л -272,2 (при 2,5 МПа) -268,9 1895 Рамзай и Клеве 3 Литий Li 2, 1 6,941 (2)* * * * 0,53 180,5 1317 1817 Арфведсон 4 Бериллий Be 2, 2 9,012182 (3) 1,85 1278 2970 1797 Воклен 5 Бор B 2, 13 10,811 (7)* * * 2,46 2300 2550 1808 Дэви и Гей-Люссак 6 Углерод C 2, 14 12,0107 (8)* * 3,51 3550 4827 доисторический период неизвестен 7 Азот N 2, 15 14,0067 (2)* * 1,17 g/l -209,9 -195,8 1772 Резерфорд 8 Кислород O 2, 16 15,9994 (3)* * 1,33 г/л -218,4 -182,9 1774 Пристли и Шееле 9 Фтор F 2, 17 18,9984032 (5) 1,58 г/л -219,6 -188,1 1886 Муассан 10 Неон Ne 2, 18 20,1797 (6)* * 0,84 г/л -248,7 -246,1 1898 Рамзай и Трэверс 11 Натрий Na 3, 1 22,98976928 (2) 0,97 97,8 892 1807 Дэви 12 Магний Mg 3, 2 24,3050 (6) 1,74 648,8 1107 1755 Блэк 13 Алюминий Al 3, 13 26,9815386 (8) 2,70 660,5 2467 1825 Эрстед 14 Кремний Si 3, 14 28,0855 (3)* 2,33 1410 2355 1824 Берцелиус 15 Фосфор P 3, 15 30,973762 (2) 1,82 44 (P4) 280 (P4) 1669 Бранд 16 Сера S 3, 16 32,065 (5)* * 2,06 113 444,7 доисторический период неизвестен 17 Хлор Cl 3, 17 35,453 (2)* * * 2,95 г/л -101 -34,6 1774 Шееле 18 Аргон Ar 3, 18 39,948 (1)* * 1,66 г/л -189,4 -185,9 1894 Рамзай и Рэлей 19 Калий K 4, 1 39,0983 (1) 0,86 63,7 774 1807 Дэви 20 Кальций Ca 4, 2 40,078 (4)* 1,54 839 1487 1808 Дэви 21 Скандий Sc 4, 3 44,955912 (6) 2,99 1539 2832 1879 Нильсон 22 Титан Ti 4, 4 47,867 (1) 4,51 1660 3260 1791 Грегор и Клапрот 23 Ванадий V 4, 5 50,9415 (1) 6,09 1890 3380 1801 дель Рио 24 Хром Cr 4, 6 51,9961 (6) 7,14 1857 2482 1797 Воклен 25 Марганец Mn 4, 7 54,938045 (5) 7,44 1244 2097 1774 Ган 26 Железо Fe 4, 8 55,845 (2) 7,87 1535 2750 доисторический период неизвестен 27 Кобальт Co 4, 9 58,933195 (5) 8,89 1495 2870 1735 Брандт 28 Никель Ni 4, 10 58,6934 (2) 8,91 1453 2732 1751 Кронштедт 29 Медь Cu 4, 11 63,546 (3)* 8,92 1083,5 2595 доисторический период неизвестен 30 Цинк Zn 4, 12 65,409 (4) 7,14 419,6 907 доисторический период неизвестен 31 Галлий Ga 4, 13 69,723 (1) 5,91 29,8 2403 1875 де Буабодран 32 Германий Ge 4, 14 72,64 (1) 5,32 937,4 2830 1886 Винклер 33 Мышьяк As 4, 15 74,92160 (2) 5,72 613 613
(subl.)ca. 1250 Альберт Великий 34 Селен Se 4, 16 78,96 (3)* 4,82 217 685 1817 Берцелиус 35 Бром Br 4, 17 79,904 (1) 3,14 -7,3 58,8 1826 Балар 36 Криптон Kr 4, 18 83,798 (2)* * 3,48 г/л -156,6 -152,3 1898 Рамзай и Трэверс 37 Рубидий Rb 5, 1 85,4678 (3)* 1,53 39 688 1861 Бунзен и Кирхгоф 38 Стронций Sr 5, 2 87,62 (1)* * 2,63 769 1384 1790 Кроуфорд 39 Иттрий Y 5, 3 88,90585 (2) 4,47 1523 3337 1794 Гадолин 40 Цирконий Zr 5, 4 91,224 (2)* 6,51 1852 4377 1789 Клапрот 41 Ниобий Nb 5, 5 92,906 38 (2) 8,58 2468 4927 1801 Хэтчетт 42 Молибден Mo 5, 6 95,94 (2)* 10,28 2617 5560 1778 Шееле 43 Технеций Tc 5, 7 [98,9063]* 11,49 2172 5030 1937 Перрье и Сегре 44 Рутений Ru 5, 8 101,07 (2)* 12,45 2310 3900 1844 Клаус 45 Родий Rh 5, 9 102,90550 (2) 12,41 1966 3727 1803 Уолластон 46 Палладий Pd 5, 10 106,42 (1)* 12,02 1552 3140 1803 Уолластон 47 Серебро Ag 5, 11 107,8682 (2)* 10,49 961,9 2212 доисторический период неизвестен 48 Кадмий Cd 5, 12 112,411 (8)* 8,64 321 765 1817 Штромейер 49 Индий In 5, 13 114,818 (3) 7,31 156,2 2080 1863 Райх и Рихтер 50 Олово Sn 5, 14 118,710 (7)* 7,29 232 2270 доисторический период неизвестен 51 Сурьма Sb 5, 15 121,760 (1)* 6,69 630,7 1750 доисторический период неизвестен 52 Теллур Te 5, 16 127,60 (3)* 6,25 449,6 990 1782 фон Райхенштайн 53 Иод I 5, 17 126,90447 (3) 4,94 113,5 184,4 1811 Куртуа 54 Ксенон Xe 5, 18 131,293 (6)* * 4,49 г/л -111,9 -107 1898 Рамзай и Трэверс 55 Цезий Cs 6, 1 132,9054519 (2) 1,90 28,4 690 1860 Бунзен и Кирхгоф 56 Барий Ba 6, 2 137,327 (7) 3,65 725 1640 1808 Дэви 57 Лантан La 6 138,90547 (7)* 6,16 920 3454 1839 Мосандер 58 Церий Ce 6 140,116 (1)* 6,77 798 3257 1803 фон Хисингер и Берцелиус 59 Празеодим Pr 6 140,90765 (2) 6,48 931 3212 1895 фон Вельсбах 60 Неодим Nd 6 144,242 (3)* 7,00 1010 3127 1895 фон Вельсбах 61 Прометий Pm 6 [146,9151]* 7,22 1080 2730 1945 Маринский и Гленденин 62 Самарий Sm 6 150,36 (2)* 7,54 1072 1778 1879 де Буабодран 63 Европий Eu 6 151,964 (1)* 5,25 822 1597 1901 Демарсе 64 Гадолиний Gd 6 157,25 (3)* 7,89 1311 3233 1880 де Мариньяк 65 Тербий Tb 6 158,92535 (2) 8,25 1360 3041 1843 Мосандер 66 Диспрозий Dy 6 162,500 (1)* 8,56 1409 2335 1886 де Буабодран 67 Гольмий Ho 6 164,93032 (2) 8,78 1470 2720 1878 Соре 68 Эрбий Er 6 167,259 (3)* 9,05 1522 2510 1842 Мосандер 69 Тулий Tm 6 168,93421 (2) 9,32 1545 1727 1879 Клеве 70 Иттербий Yb 6 173,04 (3)* 6,97 824 1193 1878 де Мариньяк 71 Лютеций Lu 6, 3 174,967 (1)* 9,84 1656 3315 1907 Урбэн 72 Гафний Hf 6, 4 178,49 (2) 13,31 2150 5400 1923 Костер и де Хевеши 73 Тантал Ta 6, 5 180,9479 (1) 16,68 2996 5425 1802 Экеберг 74 Вольфрам W 6, 6 183,84 (1) 19,26 3407 5927 1783 Элюяр 75 Рений Re 6, 7 186,207 (1) 21,03 3180 5627 1925 Ноддак, Таке и Берг 76 Осмий Os 6, 8 190,23 (3)* 22,61 3045 5027 1803 Теннант 77 Иридий Ir 6, 9 192,217 (3) 22,65 2410 4130 1803 Теннант 78 Платина Pt 6, 10 195,084 (9) 21,45 1772 3827 1557 Скалигер 79 Золото Au 6, 11 196,966569 (4) 19,32 1064,4 2940 доисторический период неизвестен 80 Ртуть Hg 6, 12 200,59 (2) 13,55 -38,9 356,6 доисторический период неизвестен 81 Таллий Tl 6, 13 204,3833 (2) 11,85 303,6 1457 1861 Крукс 82 Свинец Pb 6, 14 207,2 (1)* * 11,34 327,5 1740 доисторический период неизвестен 83 Висмут Bi 6, 15 208,98040 (1) 9,80 271,4 1560 1753 Жоффруа 84 Полоний Po 6, 16 [208,9824]* 9,20 254 962 1898 Мария и Пьер Кюри 85 Астат At 6, 17 [209,9871]* 302 337 1940 Корсон, Маккензи и Сегре 86 Радон Rn 6, 18 [222,0176]* 9,23 г/л -71 -61,8 1900 Дорн 87 Франций Fr 7, 1 [223,0197]* 1,87 27 677 1939 Перей 88 Радий Ra 7, 2 [226,0254]* 5,50 700 1140 1898 Мария и Пьер Кюри 89 Актиний Ac 7 [227,0278]* 10,07 1047 3197 1899 Дебьерн 90 Торий Th 7 232,03806 (2)* * 11,72 1750 4787 1829 Берцелиус 91 Протактиний Pa 7 231,03588 (2)* 15,37 1554 4030 1917 Содди, Кранстон и Ган 92 Уран U 7 238,02891 (3)* * * 18,97 1132,4 3818 1789 Клапрот 93 Нептуний Np 7 [237,0482]* 20,48 640 3902 1940 Макмиллан и Абелсон 94 Плутоний Pu 7 [244,0642]* 19,74 641 3327 1940 Сиборг 95 Америций Am 7 [243,0614]* 13,67 994 2607 1944 Сиборг 96 Кюрий Cm 7 [247,0703]* 13,51 1340 1944 Сиборг 97 Берклий Bk 7 [247,0703]* 13,25 986 1949 Сиборг 98 Калифорний Cf 7 [251,0796]* 15,1 900 1950 Сиборг 99 Эйнштейний Es 7 [252,0829]* 860 1952 Сиборг 100 Фермий Fm 7 [257,0951]* 1952 Сиборг 101 Менделевий Md 7 [258,0986]* 1955 Сиборг 102 Нобелий No 7 [259,1009]* 1958 Сиборг 103 Лоуренсий Lr 7, 3 [260,1053]* 1961 Гиорсо 104 Резерфордий Rf 7, 4 [261,1087]* 1964/69 Флёров 105 Дубний Db 7, 5 [262,1138]* 1967/70 Флёров 106 Сиборгий Sg 7, 6 [263,1182]* 1974 Флёров 107 Борий Bh 7, 7 [262,1229]* 1976 Оганесян 108 Хассий Hs 7, 8 [265]* 1984 GSI (*) 109 Мейтнерий Mt 7, 9 [266]* 1982 GSI 110 Дармштадтий Ds 7, 10 [269]* 1994 GSI 111 Рентгений Rg 7, 11 [272]* 1994 GSI 112 Унунбий Uub 7, 12 [285]* 1996 GSI 113 Унунтрий Uut 7, 13 [284]* 2004 ОИЯИ (*), LLNL (*) 114 Унунквадий Uuq 7, 14 [289]* 1999 ОИЯИ 115 Унунпентий Uup 7, 15 [288]* 2004 ОИЯИ, LLNL 116 Унунгексий Uuh 7, 16 [292]* 1999 LBNL (*) 117 Унунсептий Uus 7, 17 [295]* ещё не получен ещё не получен 118 Унуноктий Uuo 7, 18 [294]* 2004 ОИЯИ Химические семейства элементов периодической таблицы
Щелочные металлы Щёлочноземельные металлы Лантаноиды Актиноиды Переходные металлы Лёгкие металлы Полуметаллы Неметаллы Галогены Инертные газы Аббревиатуры
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- ОИЯИ, Объединённый институт ядерных исследований), Дубна, Московская область, Россия( == JINR, (Joint Institute for Nuclear Research,)
- LLNL, Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э.Лоуренса), Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
Примечания
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабильных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Список химических элементов по атомным номерам» в других словарях:
-
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
-
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
-
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
ПСХЭ — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Переодичная система — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система — химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
-
Периодическая система Менделеева — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия

An explanation of the superscripts and subscripts seen in atomic number notation. Atomic number is the number of protons, and therefore also the total positive charge, in the atomic nucleus.

The Rutherford–Bohr model of the hydrogen atom (Z = 1) or a hydrogen-like ion (Z > 1). In this model it is an essential feature that the photon energy (or frequency) of the electromagnetic radiation emitted (shown) when an electron jumps from one orbital to another be proportional to the mathematical square of atomic charge (Z2). Experimental measurement by Henry Moseley of this radiation for many elements (from Z = 13 to 92) showed the results as predicted by Bohr. Both the concept of atomic number and the Bohr model were thereby given scientific credence.
The atomic number or nuclear charge number (symbol Z) of a chemical element is the charge number of an atomic nucleus. For ordinary nuclei, this is equal to the proton number (np) or the number of protons found in the nucleus of every atom of that element. The atomic number can be used to uniquely identify ordinary chemical elements. In an ordinary uncharged atom, the atomic number is also equal to the number of electrons.
For an ordinary atom, the sum of the atomic number Z and the neutron number N gives the atom’s atomic mass number A. Since protons and neutrons have approximately the same mass (and the mass of the electrons is negligible for many purposes) and the mass defect of the nucleon binding is always small compared to the nucleon mass, the atomic mass of any atom, when expressed in unified atomic mass units (making a quantity called the «relative isotopic mass»), is within 1% of the whole number A.
Atoms with the same atomic number but different neutron numbers, and hence different mass numbers, are known as isotopes. A little more than three-quarters of naturally occurring elements exist as a mixture of isotopes (see monoisotopic elements), and the average isotopic mass of an isotopic mixture for an element (called the relative atomic mass) in a defined environment on Earth, determines the element’s standard atomic weight. Historically, it was these atomic weights of elements (in comparison to hydrogen) that were the quantities measurable by chemists in the 19th century.
The conventional symbol Z comes from the German word Zahl ‘number’, which, before the modern synthesis of ideas from chemistry and physics, merely denoted an element’s numerical place in the periodic table, whose order was then approximately, but not completely, consistent with the order of the elements by atomic weights. Only after 1915, with the suggestion and evidence that this Z number was also the nuclear charge and a physical characteristic of atoms, did the word Atomzahl (and its English equivalent atomic number) come into common use in this context.
History[edit]
The periodic table and a natural number for each element[edit]

Loosely speaking, the existence or construction of a periodic table of elements creates an ordering of the elements, and so they can be numbered in order.
Dmitri Mendeleev claimed that he arranged his first periodic tables (first published on March 6, 1869) in order of atomic weight («Atomgewicht»).[1] However, in consideration of the elements’ observed chemical properties, he changed the order slightly and placed tellurium (atomic weight 127.6) ahead of iodine (atomic weight 126.9).[1][2] This placement is consistent with the modern practice of ordering the elements by proton number, Z, but that number was not known or suspected at the time.

A simple numbering based on periodic table position was never entirely satisfactory, however. Besides the case of iodine and tellurium, later several other pairs of elements (such as argon and potassium, cobalt and nickel) were known to have nearly identical or reversed atomic weights, thus requiring their placement in the periodic table to be determined by their chemical properties. However the gradual identification of more and more chemically similar lanthanide elements, whose atomic number was not obvious, led to inconsistency and uncertainty in the periodic numbering of elements at least from lutetium (element 71) onward (hafnium was not known at this time).
The Rutherford-Bohr model and van den Broek[edit]
In 1911, Ernest Rutherford gave a model of the atom in which a central nucleus held most of the atom’s mass and a positive charge which, in units of the electron’s charge, was to be approximately equal to half of the atom’s atomic weight, expressed in numbers of hydrogen atoms. This central charge would thus be approximately half the atomic weight (though it was almost 25% different from the atomic number of gold (Z = 79, A = 197), the single element from which Rutherford made his guess). Nevertheless, in spite of Rutherford’s estimation that gold had a central charge of about 100 (but was element Z = 79 on the periodic table), a month after Rutherford’s paper appeared, Antonius van den Broek first formally suggested that the central charge and number of electrons in an atom was exactly equal to its place in the periodic table (also known as element number, atomic number, and symbolized Z). This proved eventually to be the case.
Moseley’s 1913 experiment[edit]

The experimental position improved dramatically after research by Henry Moseley in 1913.[3] Moseley, after discussions with Bohr who was at the same lab (and who had used Van den Broek’s hypothesis in his Bohr model of the atom), decided to test Van den Broek’s and Bohr’s hypothesis directly, by seeing if spectral lines emitted from excited atoms fitted the Bohr theory’s postulation that the frequency of the spectral lines be proportional to the square of Z.
To do this, Moseley measured the wavelengths of the innermost photon transitions (K and L lines) produced by the elements from aluminum (Z = 13) to gold (Z = 79) used as a series of movable anodic targets inside an x-ray tube.[4] The square root of the frequency of these photons (x-rays) increased from one target to the next in an arithmetic progression. This led to the conclusion (Moseley’s law) that the atomic number does closely correspond (with an offset of one unit for K-lines, in Moseley’s work) to the calculated electric charge of the nucleus, i.e. the element number Z. Among other things, Moseley demonstrated that the lanthanide series (from lanthanum to lutetium inclusive) must have 15 members—no fewer and no more—which was far from obvious from known chemistry at that time.
Missing elements[edit]
After Moseley’s death in 1915, the atomic numbers of all known elements from hydrogen to uranium (Z = 92) were examined by his method. There were seven elements (with Z < 92) which were not found and therefore identified as still undiscovered, corresponding to atomic numbers 43, 61, 72, 75, 85, 87 and 91.[5] From 1918 to 1947, all seven of these missing elements were discovered.[6] By this time, the first four transuranium elements had also been discovered, so that the periodic table was complete with no gaps as far as curium (Z = 96).
The proton and the idea of nuclear electrons[edit]
In 1915, the reason for nuclear charge being quantized in units of Z, which were now recognized to be the same as the element number, was not understood. An old idea called Prout’s hypothesis had postulated that the elements were all made of residues (or «protyles») of the lightest element hydrogen, which in the Bohr-Rutherford model had a single electron and a nuclear charge of one. However, as early as 1907, Rutherford and Thomas Royds had shown that alpha particles, which had a charge of +2, were the nuclei of helium atoms, which had a mass four times that of hydrogen, not two times. If Prout’s hypothesis were true, something had to be neutralizing some of the charge of the hydrogen nuclei present in the nuclei of heavier atoms.
In 1917, Rutherford succeeded in generating hydrogen nuclei from a nuclear reaction between alpha particles and nitrogen gas,[7] and believed he had proven Prout’s law. He called the new heavy nuclear particles protons in 1920 (alternate names being proutons and protyles). It had been immediately apparent from the work of Moseley that the nuclei of heavy atoms have more than twice as much mass as would be expected from their being made of hydrogen nuclei, and thus there was required a hypothesis for the neutralization of the extra protons presumed present in all heavy nuclei. A helium nucleus was presumed to be composed of four protons plus two «nuclear electrons» (electrons bound inside the nucleus) to cancel two of the charges. At the other end of the periodic table, a nucleus of gold with a mass 197 times that of hydrogen was thought to contain 118 nuclear electrons in the nucleus to give it a residual charge of +79, consistent with its atomic number.
The discovery of the neutron makes Z the proton number[edit]
All consideration of nuclear electrons ended with James Chadwick’s discovery of the neutron in 1932. An atom of gold now was seen as containing 118 neutrons rather than 118 nuclear electrons, and its positive nuclear charge now was realized to come entirely from a content of 79 protons. Since Moseley had previously shown that the atomic number Z of an element equals this positive charge, it was now clear that Z is identical to the number of protons of its nuclei.
Chemical properties[edit]
Each element has a specific set of chemical properties as a consequence of the number of electrons present in the neutral atom, which is Z (the atomic number). The configuration of these electrons follows from the principles of quantum mechanics. The number of electrons in each element’s electron shells, particularly the outermost valence shell, is the primary factor in determining its chemical bonding behavior. Hence, it is the atomic number alone that determines the chemical properties of an element; and it is for this reason that an element can be defined as consisting of any mixture of atoms with a given atomic number.
New elements[edit]
The quest for new elements is usually described using atomic numbers. As of 2023, all elements with atomic numbers 1 to 118 have been observed. Synthesis of new elements is accomplished by bombarding target atoms of heavy elements with ions, such that the sum of the atomic numbers of the target and ion elements equals the atomic number of the element being created. In general, the half-life of a nuclide becomes shorter as atomic number increases,[citation needed] though undiscovered nuclides with certain «magic» numbers of protons and neutrons may have relatively longer half-lives and comprise an island of stability.
A hypothetical element composed only of neutrons has also been proposed and would have atomic number 0.
See also[edit]
- Atomic theory
- Chemical element
- Effective atomic number (disambiguation)
- Even and odd atomic nuclei
- Exotic atom
- History of the periodic table
- List of elements by atomic number
- Mass number
- Neutron number
- Neutron–proton ratio
- Prout’s hypothesis
References[edit]
- ^ a b The Periodic Table of Elements, American Institute of Physics
- ^ The Development of the Periodic Table, Royal Society of Chemistry
- ^ Ordering the Elements in the Periodic Table, Royal Chemical Society
- ^ Moseley, H.G.J. (1913). «XCIII.The high-frequency spectra of the elements». Philosophical Magazine. Series 6. 26 (156): 1024–1034. doi:10.1080/14786441308635052. Archived from the original on 22 January 2010.
- ^ Eric Scerri, A tale of seven elements, (Oxford University Press 2013) ISBN 978-0-19-539131-2, p.47
- ^ Scerri chaps. 3–9 (one chapter per element)
- ^ Ernest Rutherford | NZHistory.net.nz, New Zealand history online. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.

An explanation of the superscripts and subscripts seen in atomic number notation. Atomic number is the number of protons, and therefore also the total positive charge, in the atomic nucleus.

The Rutherford–Bohr model of the hydrogen atom (Z = 1) or a hydrogen-like ion (Z > 1). In this model it is an essential feature that the photon energy (or frequency) of the electromagnetic radiation emitted (shown) when an electron jumps from one orbital to another be proportional to the mathematical square of atomic charge (Z2). Experimental measurement by Henry Moseley of this radiation for many elements (from Z = 13 to 92) showed the results as predicted by Bohr. Both the concept of atomic number and the Bohr model were thereby given scientific credence.
The atomic number or nuclear charge number (symbol Z) of a chemical element is the charge number of an atomic nucleus. For ordinary nuclei, this is equal to the proton number (np) or the number of protons found in the nucleus of every atom of that element. The atomic number can be used to uniquely identify ordinary chemical elements. In an ordinary uncharged atom, the atomic number is also equal to the number of electrons.
For an ordinary atom, the sum of the atomic number Z and the neutron number N gives the atom’s atomic mass number A. Since protons and neutrons have approximately the same mass (and the mass of the electrons is negligible for many purposes) and the mass defect of the nucleon binding is always small compared to the nucleon mass, the atomic mass of any atom, when expressed in unified atomic mass units (making a quantity called the «relative isotopic mass»), is within 1% of the whole number A.
Atoms with the same atomic number but different neutron numbers, and hence different mass numbers, are known as isotopes. A little more than three-quarters of naturally occurring elements exist as a mixture of isotopes (see monoisotopic elements), and the average isotopic mass of an isotopic mixture for an element (called the relative atomic mass) in a defined environment on Earth, determines the element’s standard atomic weight. Historically, it was these atomic weights of elements (in comparison to hydrogen) that were the quantities measurable by chemists in the 19th century.
The conventional symbol Z comes from the German word Zahl ‘number’, which, before the modern synthesis of ideas from chemistry and physics, merely denoted an element’s numerical place in the periodic table, whose order was then approximately, but not completely, consistent with the order of the elements by atomic weights. Only after 1915, with the suggestion and evidence that this Z number was also the nuclear charge and a physical characteristic of atoms, did the word Atomzahl (and its English equivalent atomic number) come into common use in this context.
History[edit]
The periodic table and a natural number for each element[edit]

Loosely speaking, the existence or construction of a periodic table of elements creates an ordering of the elements, and so they can be numbered in order.
Dmitri Mendeleev claimed that he arranged his first periodic tables (first published on March 6, 1869) in order of atomic weight («Atomgewicht»).[1] However, in consideration of the elements’ observed chemical properties, he changed the order slightly and placed tellurium (atomic weight 127.6) ahead of iodine (atomic weight 126.9).[1][2] This placement is consistent with the modern practice of ordering the elements by proton number, Z, but that number was not known or suspected at the time.

A simple numbering based on periodic table position was never entirely satisfactory, however. Besides the case of iodine and tellurium, later several other pairs of elements (such as argon and potassium, cobalt and nickel) were known to have nearly identical or reversed atomic weights, thus requiring their placement in the periodic table to be determined by their chemical properties. However the gradual identification of more and more chemically similar lanthanide elements, whose atomic number was not obvious, led to inconsistency and uncertainty in the periodic numbering of elements at least from lutetium (element 71) onward (hafnium was not known at this time).
The Rutherford-Bohr model and van den Broek[edit]
In 1911, Ernest Rutherford gave a model of the atom in which a central nucleus held most of the atom’s mass and a positive charge which, in units of the electron’s charge, was to be approximately equal to half of the atom’s atomic weight, expressed in numbers of hydrogen atoms. This central charge would thus be approximately half the atomic weight (though it was almost 25% different from the atomic number of gold (Z = 79, A = 197), the single element from which Rutherford made his guess). Nevertheless, in spite of Rutherford’s estimation that gold had a central charge of about 100 (but was element Z = 79 on the periodic table), a month after Rutherford’s paper appeared, Antonius van den Broek first formally suggested that the central charge and number of electrons in an atom was exactly equal to its place in the periodic table (also known as element number, atomic number, and symbolized Z). This proved eventually to be the case.
Moseley’s 1913 experiment[edit]

The experimental position improved dramatically after research by Henry Moseley in 1913.[3] Moseley, after discussions with Bohr who was at the same lab (and who had used Van den Broek’s hypothesis in his Bohr model of the atom), decided to test Van den Broek’s and Bohr’s hypothesis directly, by seeing if spectral lines emitted from excited atoms fitted the Bohr theory’s postulation that the frequency of the spectral lines be proportional to the square of Z.
To do this, Moseley measured the wavelengths of the innermost photon transitions (K and L lines) produced by the elements from aluminum (Z = 13) to gold (Z = 79) used as a series of movable anodic targets inside an x-ray tube.[4] The square root of the frequency of these photons (x-rays) increased from one target to the next in an arithmetic progression. This led to the conclusion (Moseley’s law) that the atomic number does closely correspond (with an offset of one unit for K-lines, in Moseley’s work) to the calculated electric charge of the nucleus, i.e. the element number Z. Among other things, Moseley demonstrated that the lanthanide series (from lanthanum to lutetium inclusive) must have 15 members—no fewer and no more—which was far from obvious from known chemistry at that time.
Missing elements[edit]
After Moseley’s death in 1915, the atomic numbers of all known elements from hydrogen to uranium (Z = 92) were examined by his method. There were seven elements (with Z < 92) which were not found and therefore identified as still undiscovered, corresponding to atomic numbers 43, 61, 72, 75, 85, 87 and 91.[5] From 1918 to 1947, all seven of these missing elements were discovered.[6] By this time, the first four transuranium elements had also been discovered, so that the periodic table was complete with no gaps as far as curium (Z = 96).
The proton and the idea of nuclear electrons[edit]
In 1915, the reason for nuclear charge being quantized in units of Z, which were now recognized to be the same as the element number, was not understood. An old idea called Prout’s hypothesis had postulated that the elements were all made of residues (or «protyles») of the lightest element hydrogen, which in the Bohr-Rutherford model had a single electron and a nuclear charge of one. However, as early as 1907, Rutherford and Thomas Royds had shown that alpha particles, which had a charge of +2, were the nuclei of helium atoms, which had a mass four times that of hydrogen, not two times. If Prout’s hypothesis were true, something had to be neutralizing some of the charge of the hydrogen nuclei present in the nuclei of heavier atoms.
In 1917, Rutherford succeeded in generating hydrogen nuclei from a nuclear reaction between alpha particles and nitrogen gas,[7] and believed he had proven Prout’s law. He called the new heavy nuclear particles protons in 1920 (alternate names being proutons and protyles). It had been immediately apparent from the work of Moseley that the nuclei of heavy atoms have more than twice as much mass as would be expected from their being made of hydrogen nuclei, and thus there was required a hypothesis for the neutralization of the extra protons presumed present in all heavy nuclei. A helium nucleus was presumed to be composed of four protons plus two «nuclear electrons» (electrons bound inside the nucleus) to cancel two of the charges. At the other end of the periodic table, a nucleus of gold with a mass 197 times that of hydrogen was thought to contain 118 nuclear electrons in the nucleus to give it a residual charge of +79, consistent with its atomic number.
The discovery of the neutron makes Z the proton number[edit]
All consideration of nuclear electrons ended with James Chadwick’s discovery of the neutron in 1932. An atom of gold now was seen as containing 118 neutrons rather than 118 nuclear electrons, and its positive nuclear charge now was realized to come entirely from a content of 79 protons. Since Moseley had previously shown that the atomic number Z of an element equals this positive charge, it was now clear that Z is identical to the number of protons of its nuclei.
Chemical properties[edit]
Each element has a specific set of chemical properties as a consequence of the number of electrons present in the neutral atom, which is Z (the atomic number). The configuration of these electrons follows from the principles of quantum mechanics. The number of electrons in each element’s electron shells, particularly the outermost valence shell, is the primary factor in determining its chemical bonding behavior. Hence, it is the atomic number alone that determines the chemical properties of an element; and it is for this reason that an element can be defined as consisting of any mixture of atoms with a given atomic number.
New elements[edit]
The quest for new elements is usually described using atomic numbers. As of 2023, all elements with atomic numbers 1 to 118 have been observed. Synthesis of new elements is accomplished by bombarding target atoms of heavy elements with ions, such that the sum of the atomic numbers of the target and ion elements equals the atomic number of the element being created. In general, the half-life of a nuclide becomes shorter as atomic number increases,[citation needed] though undiscovered nuclides with certain «magic» numbers of protons and neutrons may have relatively longer half-lives and comprise an island of stability.
A hypothetical element composed only of neutrons has also been proposed and would have atomic number 0.
See also[edit]
- Atomic theory
- Chemical element
- Effective atomic number (disambiguation)
- Even and odd atomic nuclei
- Exotic atom
- History of the periodic table
- List of elements by atomic number
- Mass number
- Neutron number
- Neutron–proton ratio
- Prout’s hypothesis
References[edit]
- ^ a b The Periodic Table of Elements, American Institute of Physics
- ^ The Development of the Periodic Table, Royal Society of Chemistry
- ^ Ordering the Elements in the Periodic Table, Royal Chemical Society
- ^ Moseley, H.G.J. (1913). «XCIII.The high-frequency spectra of the elements». Philosophical Magazine. Series 6. 26 (156): 1024–1034. doi:10.1080/14786441308635052. Archived from the original on 22 January 2010.
- ^ Eric Scerri, A tale of seven elements, (Oxford University Press 2013) ISBN 978-0-19-539131-2, p.47
- ^ Scerri chaps. 3–9 (one chapter per element)
- ^ Ernest Rutherford | NZHistory.net.nz, New Zealand history online. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Загрузить PDF
Загрузить PDF
Атомный номер элемента — это число протонов в ядре одного атома этого элемента. Атомный номер элемента или изотопа остается постоянным, поэтому с его помощью можно узнать другие величины, например, количество электронов и нейтронов в атоме.
-

1
Найдите периодическую систему химических элементов (таблицу Менделеева). Если хотите, воспользуйтесь таблицей в этой статье. У каждого элемента свой атомный номер, а элементы в таблице упорядочены по атомным номерам. Найдите таблицу Менделеева или просто запомните ее.
- Таблицу Менделеева можно найти в большинстве учебников по химии.
-

2
Найдите нужный элемент. В таблице приводится полное название элемента и его химический символ (например, Hg для ртути). Если у вас не получается найти элемент, в поисковой системе введите «химический символ <название элемента>».
-

3
Найдите атомный номер. Как правило, он находится в верхнем левом или верхнем правом углу ячейки элемента, но может быть и в другом месте. Атомный номер всегда выражен целым числом.
- Если вы видите десятичную дробь, это атомная масса.
-

4
Убедитесь, что нашли атомный номер. Элементы таблицы упорядочены по возрастанию атомных номеров. Если атомный номер нужного элемента равен «33», то атомный номер предыдущего элемента должен быть равен «32», а следующего элемента — «34». Если это так, вы нашли атомный номер.
- Иногда таблица выглядит так, что после бария (56) и радия (88) есть пустые ячейки. На самом деле они не пустые — соответствующие элементы расположены внизу таблицы. Это сделано для того, чтобы записать таблицу в определенной форме.
-

5
Запомните, что такое атомный номер. Атомный номер — это число протонов в ядре одного атома элемента.[1]
Это фундаментальная величина, характеризующая элемент. Количество протонов определяет общий электрический заряд ядра, который указывает на число электронов, вращающихся вокруг атома. Поскольку электроны участвуют почти во всех химических взаимодействиях, атомный номер косвенно устанавливает большинство физических и химических свойств элемента.- Другими словами, любой атом с восемью протонами является атомом кислорода. Два атома кислорода могут иметь разное количество нейтронов или электронов (если один из атомов является ионом), но у них всегда будет по восемь протонов.
Реклама
-

1
Выясните атомный вес. В таблице атомный вес находится под названием элемента и представляет собой десятичную дробь с двумя или тремя знаками после десятичной запятой. Атомный вес — это средняя масса одного атома элемента по отношению к массе элемента, который находится в природе. Атомный вес измеряется в «атомных единицах массы» (а.е.м.).
- В некоторых учебниках и статьях атомный вес называется «относительной атомной массой».[2]
- В некоторых учебниках и статьях атомный вес называется «относительной атомной массой».[2]
-

2
Округлите атомный вес, чтобы найти массовое число. Массовое число — это общее количество протонов и нейтронов в одном атоме элемента. Это число легко найти: посмотрите в таблице атомный вес и округлите его до ближайшего целого числа. [3]
- Этот метод работает, потому что атомный вес нейтронов и протонов приблизительно равен 1 а.е.м., а атомный вес электронов приблизительно равен 0 а.е.м. Атомный вес измеряется довольно точно, поэтому в нем присутствуют цифры после десятичной запятой, но нас интересует только целое число, которое позволит узнать количество протонов и нейтронов.
- Помните, что атомный вес представляет собой усредненное значение. Например, среднее массовое число брома равно 80, но, как оказалось, массовое число одного атома брома практически всегда равно 79 или 81.[4]
-
3
Найдите количество электронов. Атом состоит из одинакового количества протонов и электронов, поэтому число электронов равно числу протонов. Электроны заряжены отрицательно, поэтому они уравновешивают и нейтрализуют протоны, которые заряжены положительно.[5]
- Если атом теряет или приобретает электроны, он превращается в ион, то есть становится электрически заряженным атомом.
-

4
Найдите количество нейтронов. Так как атомный номер = количество протонов, а массовое число = количество протонов + количество нейтронов, то число нейтронов = массовое число — атомный номер. Вот пара примеров:
- Один атом гелия (He) имеет массовое число 4 и атомный номер 2. Поэтому в нем 4 — 2 = 2 нейтрона.
- Атом серебра (Ag) имеет среднее массовое число 108 (из таблицы Менделеева) и атомный номер 47. Поэтому в атоме серебра 108 — 47 = 61 нейтрон.
-

5
Запомните, что такое изотопы. Изотоп — это разновидность атома с определенным количеством нейтронов. Если в химической задаче упоминается «Бор-10» или 10B, речь идет об элементах бора с массовым числом 10.[6]
Используйте это массовое число вместо массового числа бора из таблицы Менделеева.- Атомный номер изотопов никогда не меняется. Изотоп элемента имеет такое же количество протонов, как и сам элемент.
Реклама
Советы
- Атомный вес тяжелых элементов приводится в скобках. Это означает, что атомный вес вычислен на основе наиболее стабильного изотопа, а не среднего числа нескольких изотопов.[7]
(Это не влияет на атомный номер элемента.)
Реклама
Об этой статье
Эту страницу просматривали 14 310 раз.
Была ли эта статья полезной?
| Название элемента | Символ | Атомный номер | Атомная масса |
| Азот | N | 7 | 14,0067 |
| Алюминий | Al | 13 | 26,9815 |
| Аргон | Ar | 18 | 39,948 |
| Барий | Ba | 56 | 137,34 |
| Берилий | Be | 4 | 9,0122 |
| Бор | B | 5 | 10,811 |
| Бром | Br | 35 | 79,904 |
| Водород | H | 1 | 1,00797 |
| Гелий | He | 2 | 4,0026 |
| Железо | Fe | 26 | 55,847 |
| Золото | Au | 79 | 196,967 |
| Иод | I | 53 | 126,9044 |
| Калий | K | 19 | 39,102 |
| Кальций | Ca | 20 | 40,08 |
| Кислород | O | 8 | 15,994 |
| Кремний | Si | 14 | 28,086 |
| Литий | Li | 3 | 6,939 |
| Магний | Mg | 12 | 24,305 |
| Марганец | Mn | 25 | 54,9380 |
| Название элемента | Символ | Атомный номер | Атомная масса |
| Медь | Cu | 29 | 63,546 |
| Молибден | Mo | 42 | 95,94 |
| Натрий | Na | 11 | 22,9898 |
| Неон | Ne | 10 | 20,179 |
| Никель | Ni | 28 | 58,71 |
| Олово | Sn | 50 | 118,69 |
| Платина | Pt | 78 | 195,09 |
| Ртуть | Hg | 80 | 200,59 |
| Рубидий | Rb | 37 | 85,47 |
| Свинец | Pb | 82 | 207,19 |
| Селен | Se | 34 | 78,96 |
| Сера | S | 16 | 32,064 |
| Серебро | Ag | 47 | 107,868 |
| Углерод | C | 6 | 12,01115 |
| Фосфор | P | 15 | 30,9738 |
| Фтор | F | 9 | 18,9984 |
| Хлор | Cl | 17 | 35,453 |
| Хром | Cr | 24 | 51,996 |
| Цинк | Zn | 30 | 65,37 |
Таблица атомных масс химических элементов является частным случаем представления периодической системы Менделеева и применяется для теоретических расчетов в прикладной химии.
| Химический элемент | Символ | Атомная масса |
| Водород | H | 1,00794 |
| Гелий | He | 4,002602 |
| Литий | Li | 6,941 |
| Бериллий | Be | 9,012182 |
| Бор | B | 10,811 |
| Углерод | C | 12,0107 |
| Азот | N | 14,0067 |
| Кислород | O | 15,9994 |
| Фтор | F | 18,9984032 |
| Неон | Ne | 20,1797 |
| Натрий | Na | 22,98976928 |
| Магний | Mg | 24,3050 |
| Алюминий | Al | 26,9815386 |
| Кремний | Si | 28,0855 |
| Фосфор | P | 30,973762 |
| Сера | S | 32,065 |
| Хлор | Cl | 35,453 |
| Аргон | Ar | 39,948 |
| Калий | K | 39,0983 |
| Кальций | Ca | 40,078 |
| Скандий | Sc | 44,955912 |
| Титан | Ti | 47,867 |
| Ванадий | V | 50,9415 |
| Хром | Cr | 51,9961 |
| Марганец | Mn | 54,938045 |
| Железо | Fe | 55,845 |
| Кобальт | Co | 58,933195 |
| Никель | Ni | 58,6934 |
| Медь | Cu | 63,546 |
| Цинк | Zn | 65,409 |
| Галлий | Ga | 69,723 |
| Германий | Ge | 72,64 |
| Мышьяк | As | 74,92160 |
| Селен | Se | 78,96 |
| Бром | Br | 79,904 |
| Криптон | Kr | 83,798 |
| Рубидий | Rb | 85,4678 |
| Стронций | Sr | 87,62 |
| Иттрий | Y | 88,90585 |
| Цирконий | Zr | 91,224 |
| Ниобий | Nb | 92,90638 |
| Молибден | Mo | 95,94 |
| Технеций | Tc | 98,9063 |
| Рутений | Ru | 101,07 |
| Родий | Rh | 102,90550 |
| Палладий | Pd | 106,42 |
| Серебро | Ag | 107,8682 |
| Кадмий | Cd | 112,411 |
| Индий | In | 114,818 |
| Олово | Sn | 118,710 |
| Сурьма | Sb | 121,760 |
| Теллур | Te | 127,60 |
| Иод | I | 126,90447 |
| Ксенон | Xe | 131,293 |
| Цезий | Cs | 132,9054519 |
| Барий | Ba | 137,327 |
| Лантан | La | 138,90547 |
| Церий | Ce | 140,116 |
| Празеодим | Pr | 140,90765 |
| Неодим | Nd | 144,242 |
| Прометий | Pm | 146,9151 |
| Самарий | Sm | 150,36 |
| Европий | Eu | 151,964 |
| Гадолиний | Gd | 157,25 |
| Тербий | Tb | 158,92535 |
| Диспрозий | Dy | 162,500 |
| Гольмий | Ho | 164,93032 |
| Эрбий | Er | 167,259 |
| Тулий | Tm | 168,93421 |
| Иттербий | Yb | 173,04 |
| Лютеций | Lu | 174,967 |
| Гафний | Hf | 178,49 |
| Тантал | Ta | 180,9479 |
| Вольфрам | W | 183,84 |
| Рений | Re | 186,207 |
| Осмий | Os | 190,23 |
| Иридий | Ir | 192,217 |
| Платина | Pt | 195,084 |
| Золото | Au | 196,966569 |
| Ртуть | Hg | 200,59 |
| Таллий | Tl | 204,3833 |
| Свинец | Pb | 207,2 |
| Висмут | Bi | 208,98040 |
| Полоний | Po | 208,9824 |
| Астат | At | 209,9871 |
| Радон | Rn | 222,0176 |
| Франций | Fr | 223,0197 |
| Радий | Ra | 226,0254 |
| Актиний | Ac | 227,0278 |
| Торий | Th | 232,03806 |
| Протактиний | Pa | 231,03588 |
| Уран | U | 238,02891 |
| Нептуний | Np | 237,0482 |
| Плутоний | Pu | 244,0642 |
| Америций | Am | 243,0614 |
| Кюрий | Cm | 247,0703 |
| Берклий | Bk | 247,0703 |
| Калифорний | Cf | 251,0796 |
| Эйнштейний | Es | 252,0829 |
| Фермий | Fm | 257,0951 |
| Менделевий | Md | 258,0986 |
| Нобелий | No | 259,1009 |
| Лоуренсий | Lr | 266 |
| Резерфордий | Rf | 267 |
| Дубний | Db | 268 |
| Сиборгий | Sg | 269 |
| Борий | Bh | 270 |
| Хассий | Hs | 277 |
| Мейтнерий | Mt | 278 |
| Дармштадтий | Ds | 281 |
| Рентгений | Rg | 282 |
| Коперниций | Cn | 285 |
| Нихоний | Nh | 286 |
| Флеровий | Fl | 289 |
| Московий | Mc | 290 |
| Ливерморий | Lv | 293 |
| Теннессин | Ts | 294 |
| Оганесон | Og | 294 |
На этой странице представлена таблица химических элементов, упорядоченная в порядке возрастания их атомных номеров.

| Таблица 1. | ||
| Порядковый | ||
| Номер | ||
| 1 | Титан Z = 22, Германий Z = 32, Индий Z = 49, | |
| 2 | Изотоп железа Fe55 Z = 26, Молибден Z = 42, Сурьма Z = 51 | |
| 3 | Железо Z=26, Селен Z = 34, Серебро Z = 47 | |
| 4 | Кобальт Z = 27, Ниобий Z = 41, Сурьма Z = 51 | |
| 5 | Титан Z = 22, Медь Z = 29, Сурьма Z = 51 | |
| 6 | Титан Z=22, Селен Z = 34, Индий Z = 49 | |
| 7 | Изотоп железа Fe55 Z = 26, Галлий Z = 31, Серебро Z = 47 | |
| 8 | Железо Z = 26, Ниобий Z = 41, Индий Z = 49 | |
| 9 | Медь Z = 29, Молибден Z = 42, Сурьма Z = 51 | |
| 10 | Вольфрам Z = 74, Свинец Z = 82, Америций Z = 95 | |
| 11 | Вольфрам Z = 74, Золото Z = 79, Америций Z = 95 | |
| 12 | Вольфрам Z = 74, Радий Z = 88, Америций Z = 95 | |
| 13 | Тантал Z = 73, Висмут Z = 83, Америций Z = 95 | |
| 14 | Тантал Z = 73, Золото Z = 79, Америций Z = 95 | |
| 15 | Тантал Z = 73, Висмут Z = 83, Америций Z = 95 |
9.На приборной панели включите только жёлтую кнопку «ППД» для тита-
на, изотопа железа, кобальта, радия и америция (эти образцы выделе-
ны в таблице жирным шрифтом). Для всех остальных образцов включите две кнопки: «рентген» и «ППД». При этом загорится подсветка кнопок, а на экране монитора эти надписи станут красными.
10.Нажатием левой клавиши мыши запустите ярлык «эксперимент»
(находится в верхнем левом углу экрана).
11.Установите время экспозиции 50 секунд. Если эта цифра уже введена на панели управления, то остаётся только нажать на «ОК». Иначе придётся ввести число 50, установив мышью курсор в соответствующее окошко и набирая цифры с клавиатуры.
12.Произведите набор спектра. Для этого программа предложит нажать на панели прибора мигающую красную кнопку «набор спектра». После нажатия мигание прекратится.
13.Дождавшись конца измерения, сохраните спектр, запустив ярлык «со-
| хранить» в виде дискеты | в верхнем левом углу экрана. На- |
жмите клавишу “Enter” или ОК.
10

14. Повторите измерения для оставшихся образцов, выполняя указания пунктов 9-14. Для этого найдите на экране и нажмите кнопку «назад»
(жёлтый ромб с чёрной стрелкой).
15. Войдите в пункт меню «обработка спектра». Для возврата в меню ис-
| пользуйте значок | . В окне записанных спектров выберите |
нужный спектр и откройте его.
| 16. Нажмите на синий значок | идентификации линий на экра- |
не дисплея. После выбора нужного элемента и нажатия кнопки «ОК» на спектральных линиях появляются указатели типа линии. Если в спектре имеются «чужие» линии, то они не идентифицируются.
17. Для вариантов 1 — 9 найдите энергии линий Kα. Для 10 и 11 вариантов
— энергии линий Lα. Для 12 и 13 вариантов — энергии линий Lβ. Для 14
и 15 вариантов — энергии линий Lγ. С этой целью выделите участок спектра с соответствующей линией. Для выделения подведите курсор к началу участка (краю линии). Теперь нажмите и не отпускайте левую кнопку мыши, пока её смещением не приведёте курсор к другому краю участка. Выделенный участок оказывается затемнённым. Нажав на зна-
| чок | , увеличьте картинку. Затем установите курсор на центр |
(максимум) линии, нажмите на левую кнопку мыши.
18.Определите энергию линий в кэВ, взяв значения в правом нижнем углу экрана.
19.Запишите эти значения в приведённую ниже таблицу.
20.Для выключения компьютера наведите курсор на кнопку «Пуск», нажмите на левую клавишу мыши, выберите в окне «Завершение работы» выключить компьютер. Нажмите ОК. Когда на экране дисплея появится надпись «Теперь питание компьютера можно отключить», отключите компьютер.
21.Выразите энергию в джоулях, умножив значение в кэВ на 1,6 10-16 .
11
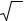
22.Определите частоту линии по формуле ν = Eh , где постоянная Планка
h = 6,63 10−34 Дж с. 23.Заполните таблицу 2.
24.Постройте график зависимости квадратного корня частоты линии от атомного номера элемента.
25.Продлив график до пересечения с осью абсцисс, найдите постоянную экранирования.
| Таблица 2. | ||||||
| Название | Атомный | Энергия E, в | Частота | ν | , | Корень из |
| элемента | номер Z | кэВ | в Гц | частоты ν | ||
Контрольные вопросы
1.Объясните природу линейчатых спектров атомов.
2.Поясните постулат Бора, объясняющий излучение света атомами, и его связь с формулой Бальмера.
3.Каково происхождение рентгеновских спектров.
4.Формула Мозли и её смысл.
5.Объясните работу рентгеновской трубки.
6.С чем связано тормозное рентгеновское излучение?
7.Какие применения рентгеновского излучения?
8.Объясните дифракцию рентгеновского излучения и смысл рентгеноструктурного анализа.
12
- Список химических элементов по атомным номерам
-
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
№ Название Символ Период,
группаМасса
(г/моль)Плотность
(г/см³)
при 20 °СТемпература
плавления (°C)Температура
кипения (°C)Год
открытияПервооткрыватель 1 Водород H 1, 1 1,00794 (7)* * * 0,084 г/л -259,1 -252,9 1766 Кавендиш 2 Гелий He 1, 18 4,002602 (2)* * 0,17 г/л -272,2 (при 2,5 МПа) -268,9 1895 Рамзай и Клеве 3 Литий Li 2, 1 6,941 (2)* * * * 0,53 180,5 1317 1817 Арфведсон 4 Бериллий Be 2, 2 9,012182 (3) 1,85 1278 2970 1797 Воклен 5 Бор B 2, 13 10,811 (7)* * * 2,46 2300 2550 1808 Дэви и Гей-Люссак 6 Углерод C 2, 14 12,0107 (8)* * 3,51 3550 4827 доисторический период неизвестен 7 Азот N 2, 15 14,0067 (2)* * 1,17 g/l -209,9 -195,8 1772 Резерфорд 8 Кислород O 2, 16 15,9994 (3)* * 1,33 г/л -218,4 -182,9 1774 Пристли и Шееле 9 Фтор F 2, 17 18,9984032 (5) 1,58 г/л -219,6 -188,1 1886 Муассан 10 Неон Ne 2, 18 20,1797 (6)* * 0,84 г/л -248,7 -246,1 1898 Рамзай и Трэверс 11 Натрий Na 3, 1 22,98976928 (2) 0,97 97,8 892 1807 Дэви 12 Магний Mg 3, 2 24,3050 (6) 1,74 648,8 1107 1755 Блэк 13 Алюминий Al 3, 13 26,9815386 (8) 2,70 660,5 2467 1825 Эрстед 14 Кремний Si 3, 14 28,0855 (3)* 2,33 1410 2355 1824 Берцелиус 15 Фосфор P 3, 15 30,973762 (2) 1,82 44 (P4) 280 (P4) 1669 Бранд 16 Сера S 3, 16 32,065 (5)* * 2,06 113 444,7 доисторический период неизвестен 17 Хлор Cl 3, 17 35,453 (2)* * * 2,95 г/л -101 -34,6 1774 Шееле 18 Аргон Ar 3, 18 39,948 (1)* * 1,66 г/л -189,4 -185,9 1894 Рамзай и Рэлей 19 Калий K 4, 1 39,0983 (1) 0,86 63,7 774 1807 Дэви 20 Кальций Ca 4, 2 40,078 (4)* 1,54 839 1487 1808 Дэви 21 Скандий Sc 4, 3 44,955912 (6) 2,99 1539 2832 1879 Нильсон 22 Титан Ti 4, 4 47,867 (1) 4,51 1660 3260 1791 Грегор и Клапрот 23 Ванадий V 4, 5 50,9415 (1) 6,09 1890 3380 1801 дель Рио 24 Хром Cr 4, 6 51,9961 (6) 7,14 1857 2482 1797 Воклен 25 Марганец Mn 4, 7 54,938045 (5) 7,44 1244 2097 1774 Ган 26 Железо Fe 4, 8 55,845 (2) 7,87 1535 2750 доисторический период неизвестен 27 Кобальт Co 4, 9 58,933195 (5) 8,89 1495 2870 1735 Брандт 28 Никель Ni 4, 10 58,6934 (2) 8,91 1453 2732 1751 Кронштедт 29 Медь Cu 4, 11 63,546 (3)* 8,92 1083,5 2595 доисторический период неизвестен 30 Цинк Zn 4, 12 65,409 (4) 7,14 419,6 907 доисторический период неизвестен 31 Галлий Ga 4, 13 69,723 (1) 5,91 29,8 2403 1875 де Буабодран 32 Германий Ge 4, 14 72,64 (1) 5,32 937,4 2830 1886 Винклер 33 Мышьяк As 4, 15 74,92160 (2) 5,72 613 613
(subl.)ca. 1250 Альберт Великий 34 Селен Se 4, 16 78,96 (3)* 4,82 217 685 1817 Берцелиус 35 Бром Br 4, 17 79,904 (1) 3,14 -7,3 58,8 1826 Балар 36 Криптон Kr 4, 18 83,798 (2)* * 3,48 г/л -156,6 -152,3 1898 Рамзай и Трэверс 37 Рубидий Rb 5, 1 85,4678 (3)* 1,53 39 688 1861 Бунзен и Кирхгоф 38 Стронций Sr 5, 2 87,62 (1)* * 2,63 769 1384 1790 Кроуфорд 39 Иттрий Y 5, 3 88,90585 (2) 4,47 1523 3337 1794 Гадолин 40 Цирконий Zr 5, 4 91,224 (2)* 6,51 1852 4377 1789 Клапрот 41 Ниобий Nb 5, 5 92,906 38 (2) 8,58 2468 4927 1801 Хэтчетт 42 Молибден Mo 5, 6 95,94 (2)* 10,28 2617 5560 1778 Шееле 43 Технеций Tc 5, 7 [98,9063]* 11,49 2172 5030 1937 Перрье и Сегре 44 Рутений Ru 5, 8 101,07 (2)* 12,45 2310 3900 1844 Клаус 45 Родий Rh 5, 9 102,90550 (2) 12,41 1966 3727 1803 Уолластон 46 Палладий Pd 5, 10 106,42 (1)* 12,02 1552 3140 1803 Уолластон 47 Серебро Ag 5, 11 107,8682 (2)* 10,49 961,9 2212 доисторический период неизвестен 48 Кадмий Cd 5, 12 112,411 (8)* 8,64 321 765 1817 Штромейер 49 Индий In 5, 13 114,818 (3) 7,31 156,2 2080 1863 Райх и Рихтер 50 Олово Sn 5, 14 118,710 (7)* 7,29 232 2270 доисторический период неизвестен 51 Сурьма Sb 5, 15 121,760 (1)* 6,69 630,7 1750 доисторический период неизвестен 52 Теллур Te 5, 16 127,60 (3)* 6,25 449,6 990 1782 фон Райхенштайн 53 Иод I 5, 17 126,90447 (3) 4,94 113,5 184,4 1811 Куртуа 54 Ксенон Xe 5, 18 131,293 (6)* * 4,49 г/л -111,9 -107 1898 Рамзай и Трэверс 55 Цезий Cs 6, 1 132,9054519 (2) 1,90 28,4 690 1860 Бунзен и Кирхгоф 56 Барий Ba 6, 2 137,327 (7) 3,65 725 1640 1808 Дэви 57 Лантан La 6 138,90547 (7)* 6,16 920 3454 1839 Мосандер 58 Церий Ce 6 140,116 (1)* 6,77 798 3257 1803 фон Хисингер и Берцелиус 59 Празеодим Pr 6 140,90765 (2) 6,48 931 3212 1895 фон Вельсбах 60 Неодим Nd 6 144,242 (3)* 7,00 1010 3127 1895 фон Вельсбах 61 Прометий Pm 6 [146,9151]* 7,22 1080 2730 1945 Маринский и Гленденин 62 Самарий Sm 6 150,36 (2)* 7,54 1072 1778 1879 де Буабодран 63 Европий Eu 6 151,964 (1)* 5,25 822 1597 1901 Демарсе 64 Гадолиний Gd 6 157,25 (3)* 7,89 1311 3233 1880 де Мариньяк 65 Тербий Tb 6 158,92535 (2) 8,25 1360 3041 1843 Мосандер 66 Диспрозий Dy 6 162,500 (1)* 8,56 1409 2335 1886 де Буабодран 67 Гольмий Ho 6 164,93032 (2) 8,78 1470 2720 1878 Соре 68 Эрбий Er 6 167,259 (3)* 9,05 1522 2510 1842 Мосандер 69 Тулий Tm 6 168,93421 (2) 9,32 1545 1727 1879 Клеве 70 Иттербий Yb 6 173,04 (3)* 6,97 824 1193 1878 де Мариньяк 71 Лютеций Lu 6, 3 174,967 (1)* 9,84 1656 3315 1907 Урбэн 72 Гафний Hf 6, 4 178,49 (2) 13,31 2150 5400 1923 Костер и де Хевеши 73 Тантал Ta 6, 5 180,9479 (1) 16,68 2996 5425 1802 Экеберг 74 Вольфрам W 6, 6 183,84 (1) 19,26 3407 5927 1783 Элюяр 75 Рений Re 6, 7 186,207 (1) 21,03 3180 5627 1925 Ноддак, Таке и Берг 76 Осмий Os 6, 8 190,23 (3)* 22,61 3045 5027 1803 Теннант 77 Иридий Ir 6, 9 192,217 (3) 22,65 2410 4130 1803 Теннант 78 Платина Pt 6, 10 195,084 (9) 21,45 1772 3827 1557 Скалигер 79 Золото Au 6, 11 196,966569 (4) 19,32 1064,4 2940 доисторический период неизвестен 80 Ртуть Hg 6, 12 200,59 (2) 13,55 -38,9 356,6 доисторический период неизвестен 81 Таллий Tl 6, 13 204,3833 (2) 11,85 303,6 1457 1861 Крукс 82 Свинец Pb 6, 14 207,2 (1)* * 11,34 327,5 1740 доисторический период неизвестен 83 Висмут Bi 6, 15 208,98040 (1) 9,80 271,4 1560 1753 Жоффруа 84 Полоний Po 6, 16 [208,9824]* 9,20 254 962 1898 Мария и Пьер Кюри 85 Астат At 6, 17 [209,9871]* 302 337 1940 Корсон, Маккензи и Сегре 86 Радон Rn 6, 18 [222,0176]* 9,23 г/л -71 -61,8 1900 Дорн 87 Франций Fr 7, 1 [223,0197]* 1,87 27 677 1939 Перей 88 Радий Ra 7, 2 [226,0254]* 5,50 700 1140 1898 Мария и Пьер Кюри 89 Актиний Ac 7 [227,0278]* 10,07 1047 3197 1899 Дебьерн 90 Торий Th 7 232,03806 (2)* * 11,72 1750 4787 1829 Берцелиус 91 Протактиний Pa 7 231,03588 (2)* 15,37 1554 4030 1917 Содди, Кранстон и Ган 92 Уран U 7 238,02891 (3)* * * 18,97 1132,4 3818 1789 Клапрот 93 Нептуний Np 7 [237,0482]* 20,48 640 3902 1940 Макмиллан и Абелсон 94 Плутоний Pu 7 [244,0642]* 19,74 641 3327 1940 Сиборг 95 Америций Am 7 [243,0614]* 13,67 994 2607 1944 Сиборг 96 Кюрий Cm 7 [247,0703]* 13,51 1340 1944 Сиборг 97 Берклий Bk 7 [247,0703]* 13,25 986 1949 Сиборг 98 Калифорний Cf 7 [251,0796]* 15,1 900 1950 Сиборг 99 Эйнштейний Es 7 [252,0829]* 860 1952 Сиборг 100 Фермий Fm 7 [257,0951]* 1952 Сиборг 101 Менделевий Md 7 [258,0986]* 1955 Сиборг 102 Нобелий No 7 [259,1009]* 1958 Сиборг 103 Лоуренсий Lr 7, 3 [260,1053]* 1961 Гиорсо 104 Резерфордий Rf 7, 4 [261,1087]* 1964/69 Флёров 105 Дубний Db 7, 5 [262,1138]* 1967/70 Флёров 106 Сиборгий Sg 7, 6 [263,1182]* 1974 Флёров 107 Борий Bh 7, 7 [262,1229]* 1976 Оганесян 108 Хассий Hs 7, 8 [265]* 1984 GSI (*) 109 Мейтнерий Mt 7, 9 [266]* 1982 GSI 110 Дармштадтий Ds 7, 10 [269]* 1994 GSI 111 Рентгений Rg 7, 11 [272]* 1994 GSI 112 Унунбий Uub 7, 12 [285]* 1996 GSI 113 Унунтрий Uut 7, 13 [284]* 2004 ОИЯИ (*), LLNL (*) 114 Унунквадий Uuq 7, 14 [289]* 1999 ОИЯИ 115 Унунпентий Uup 7, 15 [288]* 2004 ОИЯИ, LLNL 116 Унунгексий Uuh 7, 16 [292]* 1999 LBNL (*) 117 Унунсептий Uus 7, 17 [295]* ещё не получен ещё не получен 118 Унуноктий Uuo 7, 18 [294]* 2004 ОИЯИ Аббревиатуры
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- ОИЯИ, Объединённый институт ядерных исследований), Дубна, Московская область, Россия( == JINR, (Joint Institute for Nuclear Research,)
- LLNL, Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э.Лоуренса), Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
Примечания
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабильных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Список химических элементов по атомным номерам» в других словарях:
-
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
-
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
-
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
ПСХЭ — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Переодичная система — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая система — химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
-
Периодическая система Менделеева — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
-
Периодическая таблица — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Спи́сок хими́ческих элеме́нтов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный IUPAC, Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, относительная атомная масса элемента (с учётом их природной (процентной) распространённости в земной коре и атмосфере); а также плотность, температура плавления, температура кипения простого вещества, и год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Латинское название | Период, группа | Атомная масса (а.е.м.) | Плотность, г/см³ (при 20 °C) | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,08988 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorus | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfur, Sulphur | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum, Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период[источник не указан 2342 дня] | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | около 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | Франц Йозеф Мюллер |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lanthanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Praseodymium | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymium | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Promethium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolframium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Astatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berkelium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 13,5 | 860 | 1952 | Сиборг | |
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium, Mendeleevium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1965 | Флёров | |||
| 103 | Лоуренсий | Lr | Lawrencium, Laurentium | 7, 3 | [266][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [267][5] | 23 | 1964/69 | Флёров | ||
| 105 | Дубний | Db | Dubnium | 7, 5 | [268][5] | 29 | 1967/70 | Флёров | ||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [269][5] | 35 | 1974 | Флёров | ||
| 107 | Борий | Bh | Bohrium | 7, 7 | [270][5] | 37 | 1976 | Оганесян | ||
| 108 | Хассий | Hs | Hassium | 7, 8 | [277][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [278][5] | 37,4 | 1982 | GSI | ||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [281][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [282][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Нихоний | Nh | Nihonium | 7, 13 | [286][5] | 2004 | ОИЯИ (*), LLNL (*) | |||
| 114 | Флеровий | Fl | Flerovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Московий | Mc | Moscovium | 7, 15 | [290][5] | 2004 | ОИЯИ, LLNL | |||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [293][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Теннессин | Ts | Tennessine | 7, 17 | [294][5] | 2010 | ОИЯИ | |||
| 118 | Оганесон | Og | Oganesson | 7, 18 | [294][5] | 2004 | ОИЯИ | |||
| 119 | Унуненний | Uue | Ununennium | |||||||
| 120 | Унбинилий | Ubn | Unbinilium | |||||||
| 121 | Унбиуний | Ubu | Unbiunium | |||||||
| 122 | Унбибий | Ubb | Unbibium | |||||||
| 123 | Унбитрий | Ubt | Unbitrium | |||||||
| 124 | Унбиквадий | Ubq | Unbiquadium | |||||||
| 125 | Унбипентий | Ubp | Unbipentium | |||||||
| 126 | Унбигексий | Ubh | Unbihexium | |||||||
| 127 | Унбисептий | Ubs | Unbiseptium |
Дальше — смотрите по атомному номеру… Расширенная периодическая таблица элементов.
Аббревиатуры[править | править код]
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия.
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research).
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США.
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки[править | править код]
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
- M. E. Wieser. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure Appl. Chem. : journal. — IUPAC, 2006. — Vol. 78, no. 11. — P. 2051—2066. — doi:10.1351/pac200678112051. (for atomic weights of elements with atomic numbers from 1-102)
- M. E. Wieser. IUPAC Standard Atomic Weights Revised (2007). IUPAC (2007). Дата обращения: 7 июля 2008. Архивировано 5 января 2013 года.
- M. E. Wieser; T. B. Coplen. Atomic weights of the elements 2009 (IUPAC Technical Report). IUPAC (2010). Дата обращения: 10 февраля 2012. Архивировано 5 января 2013 года.
- Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. Дата обращения: 6 июня 2008. Архивировано 5 января 2013 года. (for atomic weights of elements with atomic numbers 103—118)
Часть I
1.
2. Вся масса атома сосредоточена в ядре. Число нейтронов N = A – Z, где Z – порядковый номер.
3. Порядковый номер элемента соответствует заряду атомного ядра, т.е. числу протонов в нём. Так как атом электронейтрален, то порядковый номер элемента также соответствует числу электронов.
4. Изменение числа протонов в ядре атома химического элемента приведёт к образованию атомов другого химического элемента. Следовательно, химический элемент – это совокупность атомов с одинаковым числом протонов.
5. Изменение числа нейтронов в ядре атома химического элемента приводит к образованию изотопов.
Часть II
1. Выберите верные утверждения.
1) Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
2) Нейтрон – это электронейтральная частица с массой, равной 1.
4) Электрон – это отрицательно заряженная частица с массой, равной 1.
2. Заполните таблицу «Состав атомов химических элементов».
3. Установите соответствие между названием химического элемента и условными обозначениями его атомов. Из букв, соответствующих правильным ответам, вы составите название самого лёгкого из изотопов водорода: протий.
4. Определите, в каких парах химических элементов число нейтронов в ядре атома одного из элементов вдвое больше.
5. Приведите примеры использования явления радиоактивности, применения ядерных процессов, подчеркнув их положительное и отрицательное влияние на человека.
6. Запишите названия и символы химических элементов, в атомах которых:
1) 5 протонов, 6 нейтронов и 5 электронов — бор В;
2) 10 протонов, 10 нейтронов и 9 электронов – неон Ne;
3) 15 протонов, 15 электронов и 16 нейтронов — фосфор Р.
7. Установите соответствие между понятием и его определением.

Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Период, группа | Масса (г/моль) | Плотность (г/см³) при 20 °С | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | 1, 1 | 1,00794 (7)[1] [2] [3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | 1, 18 | 4,002602 (2)[4] [5] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Рамзай и Клеве |
| 3 | Литий | Li | 2, 1 | 6,941 (2)[6] [7] [8] [9] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Вокелен |
| 5 | Бор | B | 2, 13 | 10,811 (7)[10] [11] [12] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | 2, 14 | 12,0107 (8)[13] [14] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | 2, 15 | 14,0067 (2)[15] [16] | 1,17 g/l | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | 2, 16 | 15,9994 (3)[17] [18] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | 2, 18 | 20,1797 (6)[19] [20] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Трэверс |
| 11 | Натрий | Na | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1755 | Блэк |
| 13 | Алюминий | Al | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | 3, 14 | 28,0855 (3)[21] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | 3, 16 | 32,065 (5)[22] [23] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | 3, 17 | 35,453 (2)[24] [25] [26] | 2,95 г/л | -34,6 | -101 | 1774 | Шееле |
| 18 | Аргон | Ar | 3, 18 | 39,948 (1)[27] [28] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | 4, 2 | 40,078 (4)[29] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | 4, 11 | 63,546 (3)[30] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | 4, 16 | 78,96 (3)[31] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | 4, 18 | 83,798 (2)[32] [33] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Трэверс |
| 37 | Рубидий | Rb | 5, 1 | 85,4678 (3)[34] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | 5, 2 | 87,62 (1)[35] [36] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | 5, 4 | 91,224 (2)[37] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | 5, 5 | 92,906 38 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | 5, 6 | 95,94 (2)[38] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | 5, 7 | [98,9063][39] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | 5, 8 | 101,07 (2)[40] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Уолластон |
| 46 | Палладий | Pd | 5, 10 | 106,42 (1)[41] | 12,02 | 1552 | 3140 | 1803 | Уолластон |
| 47 | Серебро | Ag | 5, 11 | 107,8682 (2)[42] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | 5, 12 | 112,411 (8)[43] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | 5, 14 | 118,710 (7)[44] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | 5, 15 | 121,760 (1)[45] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | 5, 16 | 127,60 (3)[46] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | 5, 18 | 131,293 (6)[47] [48] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Трэверс |
| 55 | Цезий | Cs | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | 6 | 138,90547 (7)[49] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | 6 | 140,116 (1)[50] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | фон Вельсбах |
| 60 | Неодим | Nd | 6 | 144,242 (3)[51] | 7,00 | 1010 | 3127 | 1895 | фон Вельсбах |
| 61 | Прометий | Pm | 6 | [146,9151][52] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | 6 | 150,36 (2)[53] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | 6 | 151,964 (1)[54] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | 6 | 157,25 (3)[55] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | 6 | 162,500 (1)[56] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | 6 | 167,259 (3)[57] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | 6 | 173,04 (3)[58] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | 6, 3 | 174,967 (1)[59] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Эвеси |
| 73 | Тантал | Ta | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5627 | 1925 | Ноддак, Таке и Берг |
| 76 | Осмий | Os | 6, 8 | 190,23 (3)[60] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | 6, 14 | 207,2 (1)[61] [62] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жофруа |
| 84 | Полоний | Po | 6, 16 | [208,9824][63] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | 6, 17 | [209,9871][64] | 302 | 337 | 1940 | Корсон, Маккензи и Сегре | |
| 86 | Радон | Rn | 6, 18 | [222,0176][65] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | 7, 1 | [223,0197][66] | 27 | 677 | 1939 | Перей | |
| 88 | Радий | Ra | 7, 2 | [226,0254][67] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | 7 | [227,0278][68] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | 7 | 232,03806 (2)[69] [70] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | 7 | 231,03588 (2)[71] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | 7 | 238,02891 (3)[72] [73] [74] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | 7 | [237,0482][75] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | 7 | [244,0642][76] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | 7 | [243,0614][77] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | 7 | [247,0703][78] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | 7 | [247,0703][79] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | 7 | [251,0796][80] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | 7 | [252,0829][81] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | 7 | [257,0951][82] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | 7 | [258,0986][83] | 1955 | Сиборг | |||
| 102 | Нобелий | No | 7 | [259,1009][84] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | 7, 3 | [260,1053][85] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | 7, 4 | [261,1087][86] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | 7, 5 | [262,1138][87] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | 7, 6 | [263,1182][88] | 1974 | Флёров | |||
| 107 | Борий | Bh | 7, 7 | [262,1229][89] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | 7, 8 | [265][90] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | 7, 9 | [266][91] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | 7, 10 | [269][92] | 1994 | GSI | |||
| 111 | Рентгений | Rg | 7, 11 | [272][93] | 1994 | GSI | |||
| 112 | Коперниций | Cn | 7, 12 | [285][94] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][95] | 2004 | JINR (*), LLNL (*) | |||
| 114 | Флеровий | Fl | 7, 14 | [289][96] | 1999 | JINR | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][97] | 2004 | JINR, LLNL | |||
| 116 | Ливерморий | Lv | 7, 16 | [292][98] | 1999 | LBNL (*) | |||
| 117 | Унунсептий | Uus | 7, 17 | [99] | 2010 | ОИЯИ | |||
| 118 | Унуноктий | Uuo | 7, 18 | [100] | 2004 | ОИЯИ |
Аббревиатуры[править | править код]
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- JINR, (Joint Institute for Nuclear Research, Объединённый институт ядерных исследований), Дубна, Московская область, Россия
- LLNL, Lawrence Livermore National Laboratory, Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
Примечания[править | править код]
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабилных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки[править | править код]
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
ast:Llistáu d’elementos por númberu atómicu
cy:Rhestr elfennau yn nhrefn eu rhif
eo:Listo de kemiaj elementoj laŭ atomnumero
hu:Kémiai elemek listája rendszám szerint
nn:Grunnstoffliste etter atomnummer
zh-min-nan:Goân-sò• ê pió
zh-yue:元素序數列表
Спи́сок хими́ческих элеме́нтов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный IUPAC, Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, относительная атомная масса элемента (с учётом их природной (процентной) распространённости в земной коре и атмосфере); а также плотность, температура плавления, температура кипения простого вещества, и год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Латинское название | Период, группа | Атомная масса (а.е.м.) | Плотность, г/см³ (при 20 °C) | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,08988 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorus | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfur, Sulphur | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum, Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период[источник не указан 2342 дня] | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | около 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | Франц Йозеф Мюллер |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lanthanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Praseodymium | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymium | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Promethium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolframium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Astatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berkelium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 13,5 | 860 | 1952 | Сиборг | |
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium, Mendeleevium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1965 | Флёров | |||
| 103 | Лоуренсий | Lr | Lawrencium, Laurentium | 7, 3 | [266][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [267][5] | 23 | 1964/69 | Флёров | ||
| 105 | Дубний | Db | Dubnium | 7, 5 | [268][5] | 29 | 1967/70 | Флёров | ||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [269][5] | 35 | 1974 | Флёров | ||
| 107 | Борий | Bh | Bohrium | 7, 7 | [270][5] | 37 | 1976 | Оганесян | ||
| 108 | Хассий | Hs | Hassium | 7, 8 | [277][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [278][5] | 37,4 | 1982 | GSI | ||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [281][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [282][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Нихоний | Nh | Nihonium | 7, 13 | [286][5] | 2004 | ОИЯИ (*), LLNL (*) | |||
| 114 | Флеровий | Fl | Flerovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Московий | Mc | Moscovium | 7, 15 | [290][5] | 2004 | ОИЯИ, LLNL | |||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [293][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Теннессин | Ts | Tennessine | 7, 17 | [294][5] | 2010 | ОИЯИ | |||
| 118 | Оганесон | Og | Oganesson | 7, 18 | [294][5] | 2004 | ОИЯИ | |||
| 119 | Унуненний | Uue | Ununennium | |||||||
| 120 | Унбинилий | Ubn | Unbinilium | |||||||
| 121 | Унбиуний | Ubu | Unbiunium | |||||||
| 122 | Унбибий | Ubb | Unbibium | |||||||
| 123 | Унбитрий | Ubt | Unbitrium | |||||||
| 124 | Унбиквадий | Ubq | Unbiquadium | |||||||
| 125 | Унбипентий | Ubp | Unbipentium | |||||||
| 126 | Унбигексий | Ubh | Unbihexium | |||||||
| 127 | Унбисептий | Ubs | Unbiseptium |
Дальше — смотрите по атомному номеру… Расширенная периодическая таблица элементов.
Аббревиатуры
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия.
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research).
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США.
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
- M. E. Wieser. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure Appl. Chem. : journal. — IUPAC, 2006. — Vol. 78, no. 11. — P. 2051—2066. — doi:10.1351/pac200678112051. (for atomic weights of elements with atomic numbers from 1-102)
- M. E. Wieser. IUPAC Standard Atomic Weights Revised (2007). IUPAC (2007). Дата обращения: 7 июля 2008. Архивировано 5 января 2013 года.
- M. E. Wieser; T. B. Coplen. Atomic weights of the elements 2009 (IUPAC Technical Report). IUPAC (2010). Дата обращения: 10 февраля 2012. Архивировано 5 января 2013 года.
- Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. Дата обращения: 6 июня 2008. Архивировано 5 января 2013 года. (for atomic weights of elements with atomic numbers 103—118)
Популярной визуализацией всех 118 элементов является периодический таблица элементов, удобное табличное расположение элементов по их химическим свойствам, в котором вместо полных имен элементов используются сокращенные химические символы, но также может быть полезен представленный здесь более простой формат списка. Как и в периодической таблице, в приведенном ниже списке элементы упорядочены по количеству протонов в их атомах; он также может быть организован по другим свойствам, таким как атомный вес, плотность и электроотрицательность. Для получения более подробной информации о происхождении названий элементов см. Список этимологий названий химических элементов.
Примечания
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
| № | Название | Символ | Период, группа | Масса (г/моль) | Плотность (г/см³) при 20 °С | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | 1, 1 | 1,00794 (7)[1] [2] [3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | 1, 18 | 4,002602 (2)[4] [5] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Рамзай и Клеве |
| 3 | Литий | Li | 2, 1 | 6,941 (2)[6] [7] [8] [9] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Вокелен |
| 5 | Бор | B | 2, 13 | 10,811 (7)[10] [11] [12] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | 2, 14 | 12,0107 (8)[13] [14] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | 2, 15 | 14,0067 (2)[15] [16] | 1,17 g/l | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | 2, 16 | 15,9994 (3)[17] [18] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | 2, 18 | 20,1797 (6)[19] [20] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Трэверс |
| 11 | Натрий | Na | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1755 | Блэк |
| 13 | Алюминий | Al | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | 3, 14 | 28,0855 (3)[21] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | 3, 16 | 32,065 (5)[22] [23] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | 3, 17 | 35,453 (2)[24] [25] [26] | 2,95 г/л | -34,6 | -101 | 1774 | Шееле |
| 18 | Аргон | Ar | 3, 18 | 39,948 (1)[27] [28] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | 4, 2 | 40,078 (4)[29] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | 4, 11 | 63,546 (3)[30] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | 4, 16 | 78,96 (3)[31] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | 4, 18 | 83,798 (2)[32] [33] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Трэверс |
| 37 | Рубидий | Rb | 5, 1 | 85,4678 (3)[34] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | 5, 2 | 87,62 (1)[35] [36] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | 5, 4 | 91,224 (2)[37] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | 5, 5 | 92,906 38 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | 5, 6 | 95,94 (2)[38] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | 5, 7 | [98,9063][39] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | 5, 8 | 101,07 (2)[40] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Уолластон |
| 46 | Палладий | Pd | 5, 10 | 106,42 (1)[41] | 12,02 | 1552 | 3140 | 1803 | Уолластон |
| 47 | Серебро | Ag | 5, 11 | 107,8682 (2)[42] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | 5, 12 | 112,411 (8)[43] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | 5, 14 | 118,710 (7)[44] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | 5, 15 | 121,760 (1)[45] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | 5, 16 | 127,60 (3)[46] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | 5, 18 | 131,293 (6)[47] [48] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Трэверс |
| 55 | Цезий | Cs | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | 6 | 138,90547 (7)[49] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | 6 | 140,116 (1)[50] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | фон Вельсбах |
| 60 | Неодим | Nd | 6 | 144,242 (3)[51] | 7,00 | 1010 | 3127 | 1895 | фон Вельсбах |
| 61 | Прометий | Pm | 6 | [146,9151][52] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | 6 | 150,36 (2)[53] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | 6 | 151,964 (1)[54] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | 6 | 157,25 (3)[55] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | 6 | 162,500 (1)[56] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | 6 | 167,259 (3)[57] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | 6 | 173,04 (3)[58] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | 6, 3 | 174,967 (1)[59] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Эвеси |
| 73 | Тантал | Ta | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5627 | 1925 | Ноддак, Таке и Берг |
| 76 | Осмий | Os | 6, 8 | 190,23 (3)[60] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | 6, 14 | 207,2 (1)[61] [62] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жофруа |
| 84 | Полоний | Po | 6, 16 | [208,9824][63] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | 6, 17 | [209,9871][64] | 302 | 337 | 1940 | Корсон, Маккензи и Сегре | |
| 86 | Радон | Rn | 6, 18 | [222,0176][65] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | 7, 1 | [223,0197][66] | 27 | 677 | 1939 | Перей | |
| 88 | Радий | Ra | 7, 2 | [226,0254][67] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | 7 | [227,0278][68] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | 7 | 232,03806 (2)[69] [70] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | 7 | 231,03588 (2)[71] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | 7 | 238,02891 (3)[72] [73] [74] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | 7 | [237,0482][75] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | 7 | [244,0642][76] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | 7 | [243,0614][77] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | 7 | [247,0703][78] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | 7 | [247,0703][79] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | 7 | [251,0796][80] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | 7 | [252,0829][81] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | 7 | [257,0951][82] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | 7 | [258,0986][83] | 1955 | Сиборг | |||
| 102 | Нобелий | No | 7 | [259,1009][84] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | 7, 3 | [260,1053][85] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | 7, 4 | [261,1087][86] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | 7, 5 | [262,1138][87] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | 7, 6 | [263,1182][88] | 1974 | Флёров | |||
| 107 | Борий | Bh | 7, 7 | [262,1229][89] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | 7, 8 | [265][90] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | 7, 9 | [266][91] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | 7, 10 | [269][92] | 1994 | GSI | |||
| 111 | Рентгений | Rg | 7, 11 | [272][93] | 1994 | GSI | |||
| 112 | Коперниций | Cn | 7, 12 | [285][94] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][95] | 2004 | JINR (*), LLNL (*) | |||
| 114 | Флеровий | Fl | 7, 14 | [289][96] | 1999 | JINR | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][97] | 2004 | JINR, LLNL | |||
| 116 | Ливерморий | Lv | 7, 16 | [292][98] | 1999 | LBNL (*) | |||
| 117 | Унунсептий | Uus | 7, 17 | [99] | 2010 | ОИЯИ | |||
| 118 | Унуноктий | Uuo | 7, 18 | [100] | 2004 | ОИЯИ |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Аббревиатуры[править | править код]
- GSI, Gesellschaft für Schwerionenforschung (Общество исследования тяжёлых ионов), Вихаузен, Дармштадт, Германия
- JINR, (Joint Institute for Nuclear Research, Объединённый институт ядерных исследований), Дубна, Московская область, Россия
- LLNL, Lawrence Livermore National Laboratory, Ливермор, Калифорния, США
- LBNL, Lawrence Berkeley National Laboratory, Беркли, Калифорния, США
Примечания[править | править код]
- ↑ Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ Данный элемент не имеет стабилных изотопов, и значение в скобках, например [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки[править | править код]
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107—1122, 2003. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers from 1-109 taken from this source.
- IUPAC Standard Atomic Weights Revised (2005).
- WebElements Periodic Table. Retrieved June 30, 2005. Atomic weights of elements with atomic numbers 110—116 taken from this source.
ast:Llistáu d’elementos por númberu atómicu
cy:Rhestr elfennau yn nhrefn eu rhif
eo:Listo de kemiaj elementoj laŭ atomnumero
hu:Kémiai elemek listája rendszám szerint
nn:Grunnstoffliste etter atomnummer
zh-min-nan:Goân-sò• ê pió
zh-yue:元素序數列表
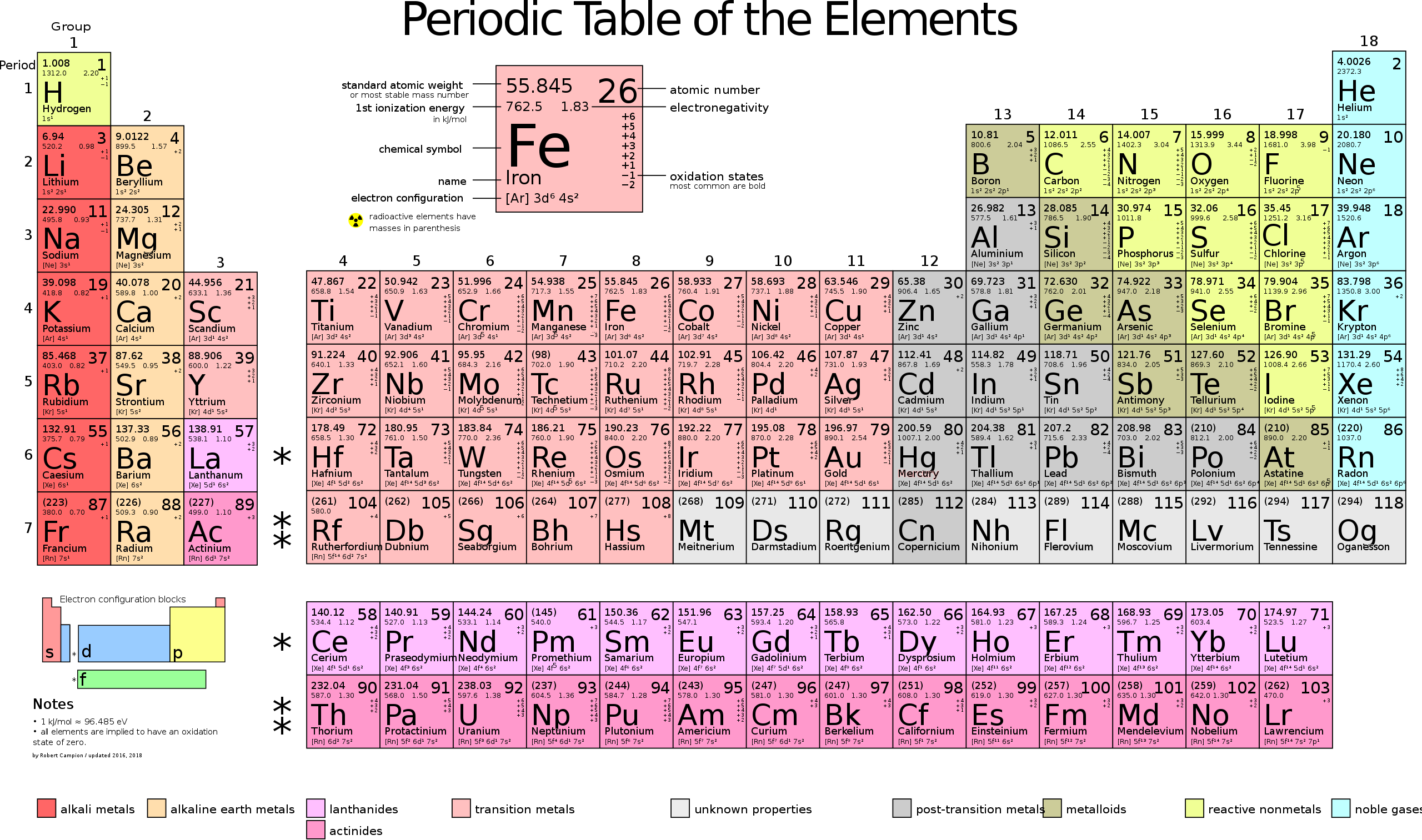 Периодическая система химических элементов (таблица Менделеева) — табличное отображение химических элементов, классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Это графическая формулировка периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году, который гласит, что свойства химических элементов проявляют периодическую зависимость от их атомного веса (в современных терминах, от атомной массы).
Периодическая система химических элементов (таблица Менделеева) — табличное отображение химических элементов, классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Это графическая формулировка периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году, который гласит, что свойства химических элементов проявляют периодическую зависимость от их атомного веса (в современных терминах, от атомной массы).
Первая периодическая таблица, получившая всеобщее признание, была разработана русским химиком Д. И. Менделеевым в 1869 и приведена к традиционному графическому виду в 1871 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, которая разделена на четыре примерно прямоугольные области, называемые блоками. Строки таблицы называются периодами, а столбцы называются группами. Элементы из одной и той же группы столбцов периодической таблицы имеют сходные химические характеристики.
История
В середине XIX века многие ученые пытались найти и выстроить некие закономерности среди открытых к тому времени 63 химических элементов.
В 1829 году Иоганном Дёберейнером был опубликован «закон триад», который гласил, что атомная масса многих элементов приблизительно равна среднему арифметическому двух других элементов, близких к исходному элементу по химическим свойствам. Так например, хлор, бром и йод образовали триаду; также как кальций, стронций и барий; литий, натрий и калий; и сера, селен и теллур.
В 1862 году Александр Эмиль Шанкуртуа решил расположить элементы в порядке возрастания атомных весов, разместив элементы на винтовой линии. Он отметил частое циклическое повторение химических свойств по вертикали. Так был создана модель «Земная спираль».
В 1864 году появилась таблица немецкого химика Юлиуса Лотара Мейера, разделенная на 6 столбцов, в которых располагались 28 элементов согласно их валентности.
В 1866 году английский химик и музыкант Джон Александр Ньюлендс описал «закон октав», сопоставив химические свойства элементов с их атомными массами. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом, то есть как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую.
Окончательный прорыв был сделан русским химиком Дмитрием Менделеевым. 17 февраля 1869 года (1 марта 1869 года по григорианскому календарю), и Периодическая система химических элементов получила название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» [1] . Менделеев начал упорядочивать элементы и сравнивать их по их атомным весам. Он расставил элементы по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами периодов современной системы) и по шести вертикальным столбцам (прообразам будущих групп). Менделеев в своей таблице оставил несколько свободных мест и предсказал ряд фундаментальных свойств ещё не открытых элементов и само их существование, а также свойства их соединений (экабор, экаалюминий, экасилиций, экамарганец — соответственно, скандий, галлий, германий, технеций).
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, их свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото — на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было в том, что основой для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев предпринял очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
В 1871 году Менделеев опубликовал длинную статью в «Основах химии» (ч. 2, вып. 2), включающую обновленную форму своей таблицы, в которой были изложены его предсказания для неизвестных элементов. Эта таблица имела более привычный нам вид: горизонтальные ряды сходных элементов превратились в восемь вертикально расположенные группы; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства. Заряд ядра, который соответствует номеру элемента в периодической системе, по праву назван числом Менделеева.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы.
В 2010 году с синтезом 118 элемента седьмой период периодической системы был завершён. Также есть ряд гипотетических элементов (с номерами от 119 до 126), которым присвоено временное систематическое название: Унуненний, Унбинилий, Унбиуний, Унбибий, Унбитрий, Унбиквадий, Унбипентий, Унбигексий. Предпринимались попытки получить некоторые из этих элементов (кроме 123 и 125), однако они успехом не увенчались. Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии[2].
Структура
Наиболее распространёнными являются три формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная».
В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Такая расширенн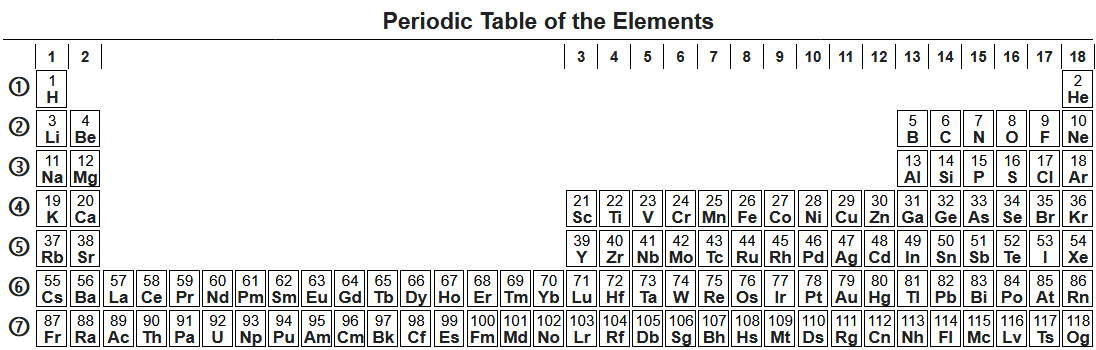 ая периодическая таблица элементов была предложена в 1970 году Теодором Сиборгом. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. Водород помещён в 17-ю группу таблицы. Такой вариант утверждён Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного.
ая периодическая таблица элементов была предложена в 1970 году Теодором Сиборгом. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. Водород помещён в 17-ю группу таблицы. Такой вариант утверждён Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного.
«Сверхдлинный» вариант таблицы Менделеева
В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по две строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Водород помещён в 7-ю группу таблицы. Короткая форма таблицы была официально отменена ИЮПАК в 1989 году, но ее продолжают иногда использовать.
Существует несколько сотен вариантов таблицы, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона. Например, Нильс Бор разрабатывал лестничную (пирамидальную) форму периодической системы. Многие учёные до сих пор предлагают всё новые варианты таблицы[3] [4].
Группы
Группа, или семейство — одна из колонок периодической таблицы. Для групп, как правило, характерны более выраженные периодические тенденции, нежели для периодов или блоков. Современные квантово-механические теории атомной структуры объясняют групповую общность тем, что элементы в пределах одной группы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках. Соответственно, элементы, которые принадлежат к одной и той же группе, традиционно располагают схожими химическими особенностями и демонстрируют явную закономерность в изменении свойств по мере увеличения атомного числа. Впрочем, в некоторых областях таблицы, например, в d-блоке и f-блоке, горизонтальные сходства могут быть столь же важны или даже более заметно выражены, нежели вертикальные. [5] [6] [7] [8]
В соответствии с международной системой именования группам присваиваются номера от 1-го до 18-го в направлении слева направо — от щелочных металлов к благородным газам. Ранее для их идентификации использовались римские цифры.
Изменение свойств элементов в зависимости от положения в периодической таблице Менделеева. Стрелки указывают на повышение
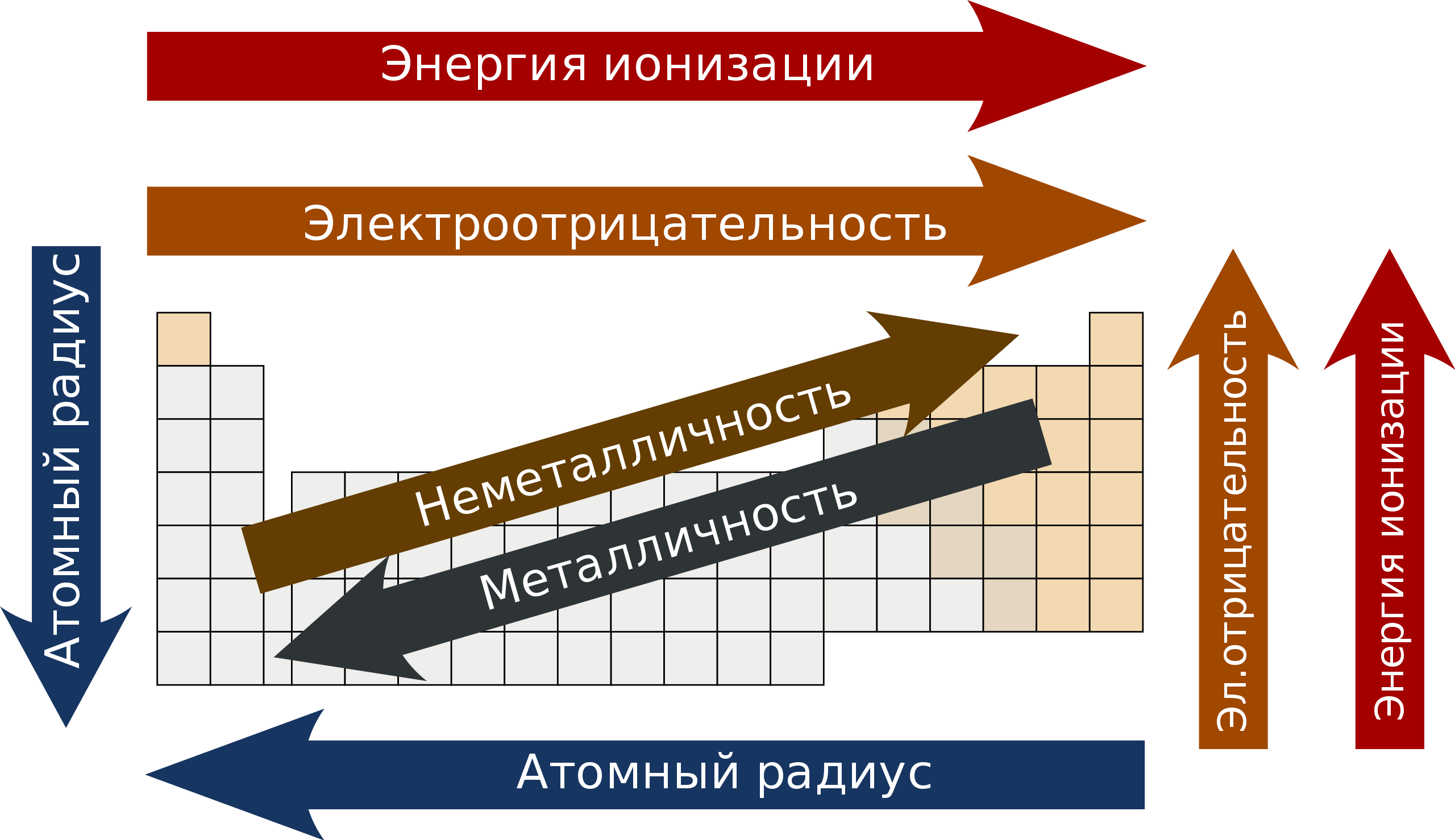 Некоторым из этих групп были присвоены тривиальные, несистематические названия (например, «щёлочноземельные металлы», «галогены» и т. п.); впрочем, некоторые из них используются редко. Группы с третьей по четырнадцатую включительно такими именами не располагают, и их идентифицируют либо по номеру, либо по наименованию первого представителя («титановая», «кобальтовая» и так далее), поскольку они демонстрируют меньшую степень сходства между собой или меньшее соответствие вертикальным закономерностям.
Некоторым из этих групп были присвоены тривиальные, несистематические названия (например, «щёлочноземельные металлы», «галогены» и т. п.); впрочем, некоторые из них используются редко. Группы с третьей по четырнадцатую включительно такими именами не располагают, и их идентифицируют либо по номеру, либо по наименованию первого представителя («титановая», «кобальтовая» и так далее), поскольку они демонстрируют меньшую степень сходства между собой или меньшее соответствие вертикальным закономерностям.
Изменение свойств элементов в зависимости от положения в периодической таблице Менделеева. Стрелки указывают на повышение
Элементы, относящиеся к одной группе, как правило, демонстрируют определённые тенденции по атомному радиусу, энергии ионизации и электроотрицательности. По направлению сверху вниз в рамках группы радиус атома возрастает (чем больше у него заполненных энергетических уровней, тем дальше от ядра располагаются валентные электроны), а энергия ионизации снижается (связи в атоме ослабевают, и, следовательно, изъять электрон становится проще), равно как и электроотрицательность (что, в свою очередь, также обусловлено возрастанием дистанции между валентными электронами и ядром). Случаются, впрочем, и исключения из этих закономерностей — к примеру, в группе 11 по направлению сверху вниз электроотрицательность возрастает, а не убывает.
Периоды
Период — строка периодической таблицы. Хотя для групп, как уже говорилось выше, характерны более существенные тенденции и закономерности, есть также области, где горизонтальное направление более значимо и показательно, нежели вертикальное — например, это касается f-блока, где лантаноиды и актиноиды образуют две важные горизонтальные последовательности элементов.
В рамках периода элементы демонстрируют определённые закономерности во всех трёх названных выше аспектах (атомный радиус, энергия ионизации и электроотрицательность), а также в энергии сродства к электрону. В направлении «слева направо» атомный радиус обычно сокращается (в силу того, что у каждого последующего элемента увеличивается количество заряженных частиц, и электроны притягиваются ближе к ядру), [9] и параллельно с ним возрастает энергия ионизации (чем сильнее связь в атоме, тем больше энергии требуется на изъятие электрона). Соответствующим образом увеличивается и электроотрицательность. Что касается энергии сродства к электрону, то металлы в левой части таблицы характеризуются меньшим значением этого показателя, а неметаллы в правой – большим (за исключением благородных газов). [10]
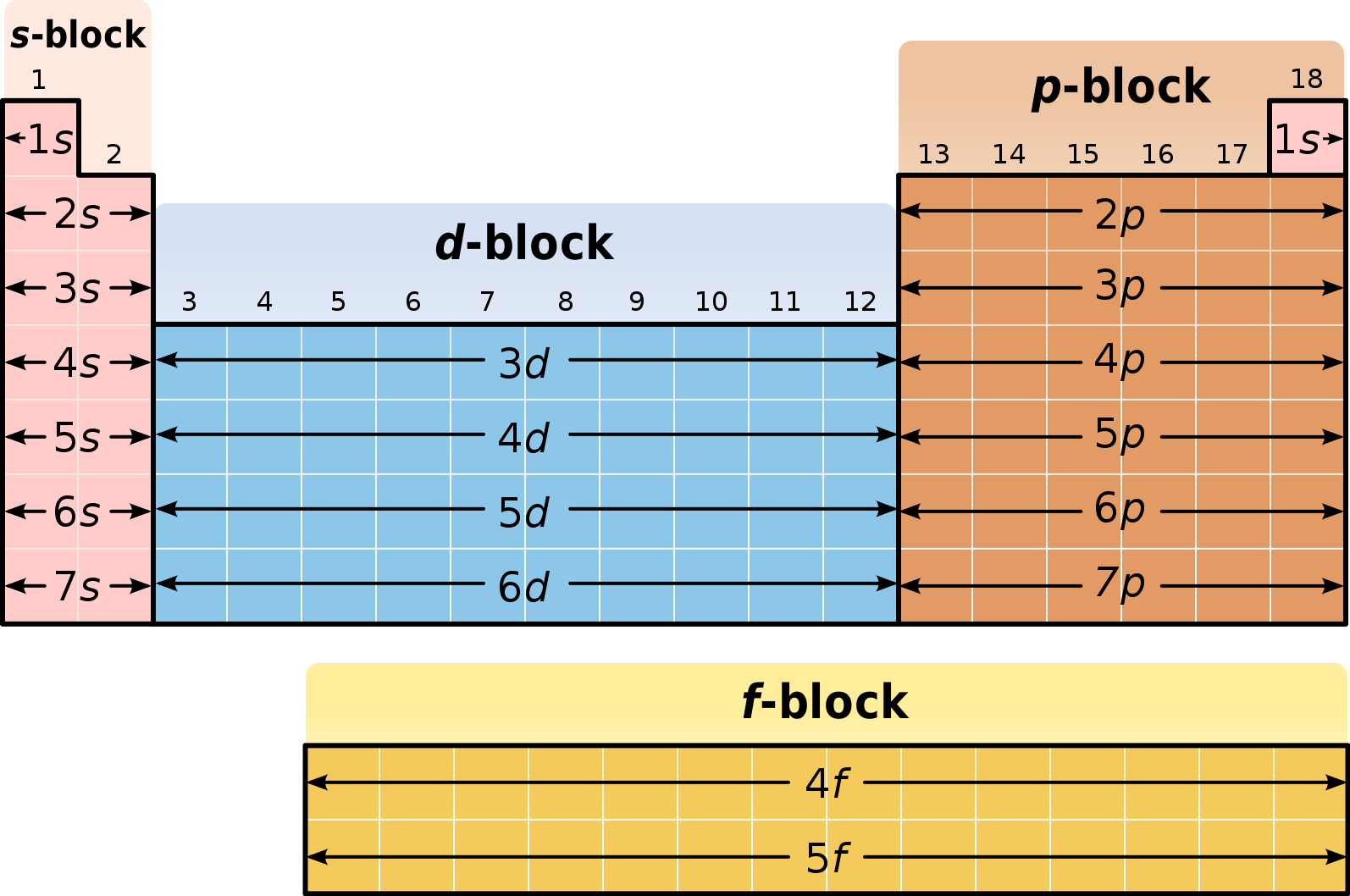 Блоки
Блоки
Из-за значимости внешней электронной оболочки атома различные области периодической таблицы иногда описываются как блоки, именуемые в соответствии с тем, на какой оболочке находится последний электрон.
- s-блок включает первые две группы, то есть щелочные и щёлочноземельные металлы, а также водород и гелий;
- p-блок состоит из последних шести групп (с 13-й по 18-ю, согласно стандарту именования ИЮПАК) и включает, помимо других элементов, все металлоиды;
- d-блок — это группы с 3-й по 12-ю (ИЮПАК), в которые входят все переходные металлы;
- f-блок, выносимый обычно за пределы таблицы, состоит из лантаноидов и актиноидов[11].
Другие периодические закономерности
Помимо перечисленных выше, периодическому закону соответствуют и некоторые другие характеристики элементов:
Электронная конфигурация. Организация электронов демонстрирует определённый повторяющийся периодический образец. Электроны занимают последовательность оболочек, которые идентифицируются числами (оболочка 1, оболочка 2 и т. д.), а те, в свою очередь, состоят из подуровней s, p, d, f и g. По мере увеличения атомного числа электроны постепенно заполняют эти оболочки; каждый раз, когда электрон впервые занимает новую оболочку, начинается новый период в таблице. Сходства в электронной конфигурации обусловливают подобие свойств элементов (наблюдение за которыми, собственно, и привело к открытию периодического закона). [12][13]
Металличность/неметалличность. По мере снижения показателей энергии ионизации, электроотрицательности и энергии сродства к электрону элементы приобретают черты, характерные для металлов, а по мере их возрастания — напротив, для неметаллов. В соответствии с закономерностями для упомянутых характеристик, наиболее ярко выраженные металлы располагаются в начале периода, а неметаллы — в его конце. В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. Сочетание горизонтальных и вертикальных закономерностей придаёт условной разделительной линии между металлами и неметаллами ступенчатый вид; расположенные вдоль этой линии элементы иногда определяются как металлоиды.
Значение
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей было предсказано существование неизвестных науке химических элементов, установлено их положение относительно известных в таблице и их свойства. Позже многие элементы были обнаружены и встали на те места, которые предсказал Менделеев в своей таблице. [14]
Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях. Д. И. Менделеевым и его последователями создана стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Примечания
- Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417
- Professor Witek Nazarewicz. Researchers Explore Limits of the Periodic Table of Elements. Sci-News.com (20 июня 2018)
- Трифонов Д. Н. Структура и границы периодической системы. — М.: Атомиздат, 1969. — 271 с.
- Химики предложили улучшить таблицу Менделеева. Lenta.Ru (7 октября 2009).
- Messler, R. W. The essence of materials for engineers (англ.). — Sudbury, MA: Jones & Bartlett Publishers (англ.)рус., 2010. — P. 32. — ISBN 0763778338.
- Bagnall, K. W. (1967), Recent advances in actinide and lanthanide chemistry, in Fields, PR & Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry, vol. 71, American Chemical Society, с. 1–12
- Day M. C., Selbin J. Theoretical inorganic chemistry (англ.). — 2nd. — New York, MA: Reinhold Book Corporation, 1969. — P. 103. — ISBN 0763778338
- Holman J., Hill G. C. Chemistry in context (англ.). — 5th. — Walton-on-Thames: Nelson Thornes, 2000. — P. 40. — ISBN 0174482760.
- Mascetta, Joseph. Chemistry The Easy Way. — 4th. — New York: Hauppauge, 2003. — С. 50. — ISBN 978-0-7641-1978-1.
- Kotz, John; Treichel, Paul; Townsend, John. Chemistry and Chemical Reactivity, Volume 2 (англ.). — 7th. — Belmont: Thomson Brooks/Cole, 2009. — P. 324. — ISBN 978-0-495-38712-1.
- Jones, Chris. d- and f-block chemistry. — New York: J. Wiley & Sons, 2002. — С. 2. — ISBN 978-0-471-22476-1.
- Chang, Raymond. Chemistry. — 7. — New York: McGraw-Hill Education, 2002. — С. 289—310; 340—42. — ISBN 0-07-112072-6.
- Yoder, C. H.; Suydam, F. H.; Snavely, F. A. Chemistry. — 2nd. — Harcourt Brace Jovanovich (англ.)рус., 1975. — С. 58. — ISBN 0-15-506465-7.
- Крицман В. А., Станцо В. В., Энциклопедический словарь юного химика, 1990, с. 180.
Литература
- Менделеев Д. И., —. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Евдокимов Ю., кандидат химич. наук. К истории периодического закона. Наука и жизнь, № 5 (2009), С. 12-15.
- Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. — М.: Просвещение, 1973. — 208 с.
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Eric R. Scerri. The Periodic Table: Its Story and Its Significance. — N. Y.: Oxford University Press, 2007. — 368 с. — ISBN 978-0-19-530573-9.
- Крицман В. А., Станцо В. В. Энциклопедический словарь юного химика / Ведущий редактор Минина Т. П. — 2-е изд., испр. — М.: Педагогика, 1990. — 320 с. — (ЭС). — ISBN 5-7155-0292-6.
- Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. — М.: Просвещение, 1969. — 160 с.
- Некрасов Б.В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. 1. — 656 с.
- Реми Г. Курс неорганической химии. — М.: Изд-во иностранной лит-ры, 1963. — Т. 1. — 920 с.
Это список химических элементов отсортированных по относительной атомной массе, с наиболее стабильными изотопами для искусственно полученных элементов. Цветом закодирован тип элемента. В таблице приведены атомный номер, название, символ химического элемента, а также группа и период элементов. Число в круглых скобках даёт неопределённость в последних цифрах (см. «краткое примечание» на IUPAC). Например, 1.00794 (7) означает 1.00794 ± 0.00007. Для искусственных элементов атомная масса приводится для наиболее устойчивого изотопа в квадратных скобках.
| Щелочные металлы | Щелочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Благородные газы |
| Атомный номер | Название | Символ | Относительная атомная масса | Группа | Период |
|---|---|---|---|---|---|
| 1 | Водород | H | 1.00794(7)[1] [2] [3] | 1 | 1 |
| 2 | Гелий | He | 4.002602(2)[1] [3] | 18 | 1 |
| 3 | Литий | Li | 6.941(2)[1] [2] [3] [4] | 1 | 2 |
| 4 | Бериллий | Be | 9.012182(3) | 2 | 2 |
| 5 | Бор (элемент) | B | 10.811(7)[1] [2] [3] | 13 | 2 |
| 6 | Углерод | C | 12.0107(8)[1] [3] | 14 | 2 |
| 7 | Азот | N | 14.0067(2)[1] [3] | 15 | 2 |
| 8 | Кислород | O | 15.9994(3)[1] [3] | 16 | 2 |
| 9 | Фтор | F | 18.9984032(5) | 17 | 2 |
| 10 | Неон | Ne | 20.1797(6)[1] [2] | 18 | 2 |
| 11 | Натрий | Na | 22.98976928(2) | 1 | 3 |
| 12 | Магний | Mg | 24.3050(6) | 2 | 3 |
| 13 | Алюминий | Al | 26.9815386(8) | 13 | 3 |
| 14 | Кремний | Si | 28.0855(3)[3] | 14 | 3 |
| 15 | Фосфор | P | 30.973762(2) | 15 | 3 |
| 16 | Сера | S | 32.065(5)[1] [3] | 16 | 3 |
| 17 | Хлор | Cl | 35.453(2)[1] [2] [3] | 17 | 3 |
| 19 | Калий | K | 39.0983(1) | 1 | 4 |
| 18 | Аргон | Ar | 39.948(1)[1] [3] | 18 | 3 |
| 20 | Кальций | Ca | 40.078(4)[1] | 2 | 4 |
| 21 | Скандий | Sc | 44.955912(6) | 3 | 4 |
| 22 | Титан | Ti | 47.867(1) | 4 | 4 |
| 23 | Ванадий | V | 50.9415(1) | 5 | 4 |
| 24 | Хром | Cr | 51.9961(6) | 6 | 4 |
| 25 | Марганец | Mn | 54.938045(5) | 7 | 4 |
| 26 | Железо | Fe | 55.845(2) | 8 | 4 |
| 28 | Никель | Ni | 58.6934(2) | 10 | 4 |
| 27 | Кобальт | Co | 58.933195(5) | 9 | 4 |
| 29 | Медь | Cu | 63.546(3)[3] | 11 | 4 |
| 30 | Цинк | Zn | 65.409(4) | 12 | 4 |
| 31 | Галлий | Ga | 69.723(1) | 13 | 4 |
| 32 | Германий | Ge | 72.64(1) | 14 | 4 |
| 33 | Мышьяк | As | 74.92160(2) | 15 | 4 |
| 34 | Селен | Se | 78.96(3)[3] | 16 | 4 |
| 35 | Бром | Br | 79.904(1) | 17 | 4 |
| 36 | Криптон | Kr | 83.798(2)[1] [2] | 18 | 4 |
| 37 | Рубидий | Rb | 85.4678(3)[1] | 1 | 5 |
| 38 | Стронций | Sr | 87.62(1)[1] [3] | 2 | 5 |
| 39 | Иттрий | Y | 88.90585(2) | 3 | 5 |
| 40 | Цирконий | Zr | 91.224(2)[1] | 4 | 5 |
| 41 | Ниобий | Nb | 92.906 38(2) | 5 | 5 |
| 42 | Молибден | Mo | 95.94(2)[1] | 6 | 5 |
| 43 | Технеций | Tc | [98][5] | 7 | 5 |
| 44 | Рутений | Ru | 101.07(2)[1] | 8 | 5 |
| 45 | Родий | Rh | 102.905 50(2) | 9 | 5 |
| 46 | Палладий | Pd | 106.42(1)[1] | 10 | 5 |
| 47 | Серебро | Ag | 107.8682(2)[1] | 11 | 5 |
| 48 | Кадмий | Cd | 112.411(8)[1] | 12 | 5 |
| 49 | Индий | In | 114.818(3) | 13 | 5 |
| 50 | Олово | Sn | 118.710(7)[1] | 14 | 5 |
| 51 | Сурьма | Sb | 121.760(1)[1] | 15 | 5 |
| 52 | Теллур | Te | 127.60(3)[1] | 16 | 5 |
| 53 | Иод | I | 126.904 47(3) | 17 | 5 |
| 54 | Ксенон | Xe | 131.293(6)[1] [2] | 18 | 5 |
| 55 | Цезий | Cs | 132.9054519(2) | 1 | 6 |
| 56 | Барий | Ba | 137.327(7) | 2 | 6 |
| 57 | Лантан | La | 138.90547(7)[1] | n/a | 6 |
| 58 | Церий | Ce | 140.116(1)[1] | n/a | 6 |
| 59 | Празеодим | Pr | 140.90765(2) | n/a | 6 |
| 60 | Неодим | Nd | 144.242(3)[1] | n/a | 6 |
| 61 | Прометий | Pm | [145][5] | n/a | 6 |
| 62 | Самарий | Sm | 150.36(2)[1] | n/a | 6 |
| 63 | Европий | Eu | 151.964(1)[1] | n/a | 6 |
| 64 | Гадолиний | Gd | 157.25(3)[1] | n/a | 6 |
| 65 | Тербий | Tb | 158.92535(2) | n/a | 6 |
| 66 | Диспрозий | Dy | 162.500(1)[1] | n/a | 6 |
| 67 | Гольмий | Ho | 164.930 32(2) | n/a | 6 |
| 68 | Эрбий | Er | 167.259(3)[1] | n/a | 6 |
| 69 | Тулий | Tm | 168.93421(2) | n/a | 6 |
| 70 | Иттербий | Yb | 173.04(3)[1] | n/a | 6 |
| 71 | Лютеций | Lu | 174.967(1)[1] | 3 | 6 |
| 72 | Гафний | Hf | 178.49(2) | 4 | 6 |
| 73 | Тантал | Ta | 180.94788(2) | 5 | 6 |
| 74 | Вольфрам | W | 183.84(1) | 6 | 6 |
| 75 | Рений | Re | 186.207(1) | 7 | 6 |
| 76 | Осмий | Os | 190.23(3)[1] | 8 | 6 |
| 77 | Иридий | Ir | 192.217(3) | 9 | 6 |
| 78 | Платина | Pt | 195.084(9) | 10 | 6 |
| 79 | Золото | Au | 196.966569(4) | 11 | 6 |
| 80 | Ртуть | Hg | 200.59(2) | 12 | 6 |
| 81 | Таллий | Tl | 204.3833(2) | 13 | 6 |
| 82 | Свинец | Pb | 207.2(1)[1] [3] | 14 | 6 |
| 83 | Висмут | Bi | 208.98040(1) | 15 | 6 |
| 84 | Полоний | Po | [210][5] | 16 | 6 |
| 85 | Астат | At | [210][5] | 17 | 6 |
| 86 | Радон | Rn | [220][5] | 18 | 6 |
| 87 | Франций | Fr | [223][5] | 1 | 7 |
| 88 | Радий | Ra | [226][5] | 2 | 7 |
| 89 | Актиний | Ac | [227][5] | n/a | 7 |
| 90 | Торий | Th | 232.03806(2)[5] [1] | n/a | 7 |
| 91 | Протактиний | Pa | 231.03588(2)[5] | n/a | 7 |
| 93 | Нептуний | Np | [237][5] | n/a | 7 |
| 92 | Уран | U | 238.02891(3)[5] [1] [2] | n/a | 7 |
| 94 | Плутоний | Pu | [244][5] | n/a | 7 |
| 95 | Америций | Am | [243][5] | n/a | 7 |
| 96 | Кюрий | Cm | [247][5] | n/a | 7 |
| 97 | Берклий | Bk | [247][5] | n/a | 7 |
| 98 | Калифорний | Cf | [251][5] | n/a | 7 |
| 99 | Эйнштейний | Es | [252][5] | n/a | 7 |
| 100 | Фермий | Fm | [257][5] | n/a | 7 |
| 101 | Менделевий | Md | [258][5] | n/a | 7 |
| 102 | Нобелий | No | [259][5] | n/a | 7 |
| 103 | Лоуренсий | Lr | [262][5] | 3 | 7 |
| 104 | Резерфордий | Rf | [261][5] | 4 | 7 |
| 105 | Дубний | Db | [262][5] | 5 | 7 |
| 106 | Сиборгий | Sg | [266][5] | 6 | 7 |
| 107 | Борий | Bh | [264][5] | 7 | 7 |
| 108 | Хассий | Hs | [277][5] | 8 | 7 |
| 109 | Мейтнерий | Mt | [268][5] | 9 | 7 |
| 110 | Дармштадтий | Ds | [271][5] | 10 | 7 |
| 111 | Рентгений | Rg | [272][5] | 11 | 7 |
| 112 | Унунбий | Uub | [285][5] | 12 | 7 |
| 113 | Унунтрий | Uut | [284][5] | 13 | 7 |
| 114 | Унунквадий | Uuq | [289][5] | 14 | 7 |
| 115 | Унунпентий | Uup | [288][5] | 15 | 7 |
| 116 | Унунгексий | Uuh | [292][5] | 16 | 7 |
| 118 | Унуноктий | Uuo | [294][5] | 18 | 7 |
| Щелочные металлы | Щелочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Благородные газы |
Сноски
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 1,23 1,24 1,25 1,26 1,27 1,28 1,29 1,30 1,31 1,32 1,33 1,34 1,35 1,36 1,37 1,38 Изотопический состав этого элемента изменяется по некоторым геологическим экземплярам, и изменение может превысить ошибку, заявленную в таблице.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 Изотопический состав элемента может измениться в коммерческих материалах, что приводит к значительному отклонению атомного веса от данного значения.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 Изотопический состав изменяется в земных материалах так, что более точный атомный вес нельзя указать.
- ↑ Атомный вес коммерческого лития может измениться между 6.939 и 6.996 — необходим анализ определенного материала, ятобы найти более точное значение.
- ↑ 5,00 5,01 5,02 5,03 5,04 5,05 5,06 5,07 5,08 5,09 5,10 5,11 5,12 5,13 5,14 5,15 5,16 5,17 5,18 5,19 5,20 5,21 5,22 5,23 5,24 5,25 5,26 5,27 5,28 5,29 5,30 5,31 5,32 5,33 5,34 5,35 Элемент не имеет никаких устойчивых изотопов, и значение в скобках, например [209], указывает массовое число самого долго живущего нуклида. Однако, три элемента: торий, протактиний и уран, имеют характерный земной изотопический состав и, поэтому, для них приведены стандартные атомные веса.
Ссылки
- Atomic Weights of the Elements 2001, Pure Appl. Chem. 75(8), 1107-1122, 2003. Проверено 30 июня, 2005. Атомные веса элементов с номерами 1-109 взяты здесь.
- Стандартные атомные веса (ИЮПАК) (2005).
- WebElements Periodic Table. Проверено 30 июня, 2005. Атомные веса элементов с номерами 110-116 взяты здесь.
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Список элементов по атомной массе. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
