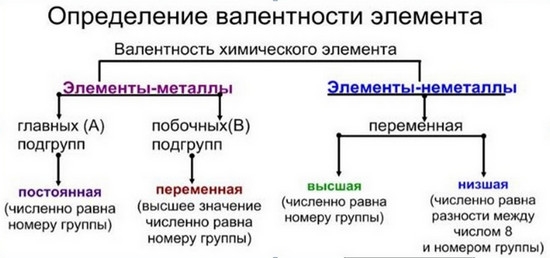
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Например, высшая валентность хлора равна VII, низшая валентность хлора равна I, промежуточные валентности — III, V.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
Например, валентность (число связей) атома кислорода в молекуле O2 равна II, а вот степень окисления атома кислорода равна 0.
Большинство элементов проявляют переменную валентность в соединениях, но некоторые элементы проявляют постоянную валентность. Их необходимо запомнить:
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s22s1.
+3Li 1s2 2s1
Следовательно, литий может образовывать одну связь и валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s22s2.
+4Be 1s2 2s2
В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s22s12p1.
+4Be* 1s2 2s1 2p1
Таким образом, на внешнем энергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Например, в хлориде бериллия валентность бериллия равна II:
Электронная конфигурация атома бора в основном состоянии +5B 1s22s22p1:
+5B 1s2 2s2 2p1
В возбужденном состоянии: +5B* 1s22s12p2.
+5B 1s2 2s1 2p2
Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Например, в трихлориде бора BCl3 валентность бора равна III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s22s12p3, следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может образовывать три связи (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s22s22p3.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | BeH2 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, CH4 |
| 7 | Азот / Nitrogen | N | I, II, III, IV | NH3 |
| 8 | Кислород / Oxygen | O | II | H2O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | PH3, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | H2S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | CaH2 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 | Титан / Titanium | Ti | II, III, IV | Ti2O3, TiH4 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, H3AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | H2SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, V | SbF5, SbH3 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | TeH2, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | LaH3 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, PbH4 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
Валентность
Материал по химии
Валентность — количество химических связей, которые может образовывать атом элемента с другими атомами за счет объединения неспаренных электронов в общую электронную пару (не зря ковалентная связь так названа). Валентность обозначают римской цифрой.
Валентность часто равна количеству неспаренных электронов у атома. Для элементов IV – VII А — групп валентность определить легко, задав вопрос: «Сколько электронов нужно данному элементу до завершения внешнего энергетического уровня?» или по формуле: 8 — № группы (действует только для элементов главных подгрупп IV – VII групп). Но не стоит забывать, что многие элементы в процессе возбуждения могут распаривать электроны, в таком состоянии валентность может достигать номера группы (это характерно для всех элементов, кроме азота, кислорода и фтора). Рассмотрим примеры.
Валентность азота и фосфора
Азот и фосфор, находящиеся в одной группе. Для них по формуле 8 – 5 = 3 мы можем найти низшую валентность (количество неспаренных электронов в основном состоянии), равную трем (III).
Валентность
Валентность азота и фосфора
В таком случае азот образует аммиак (NH3) и оксид азота III (N2O3), а фосфор – фосфин (PH3) или оксид фосфора III (P2O3).
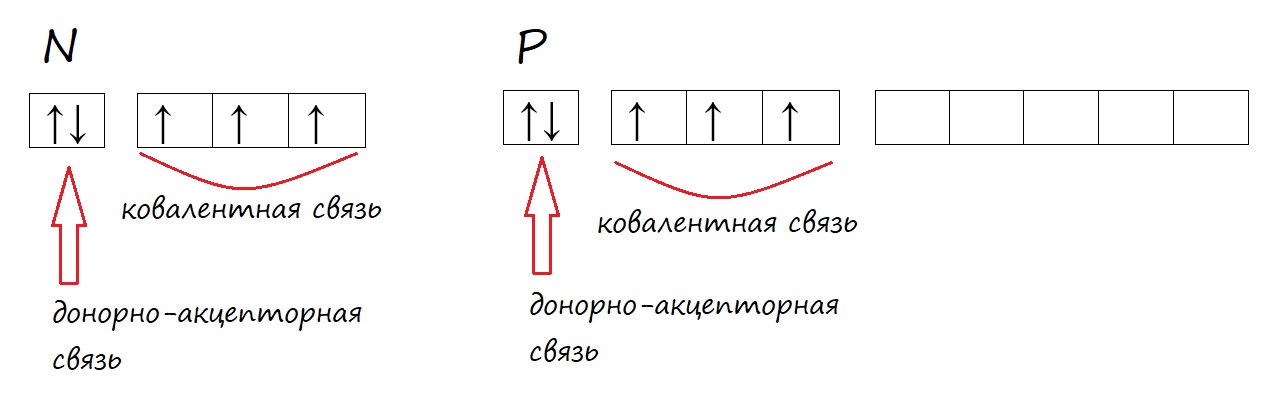
Но вспомним про возможность образовывать донорно-акцепторные связи некоторыми атомами. И азот, и фосфор имею такую возможность, поэтому кроме трех обычных ковалентных связей, они могут образовать дополнительную донорно-акцепторную. В таком случае, в основном состоянии оба могут иметь валентность IV, что соответствует катиону аммония и катиону фосфония (NH4+ и PH4+). Ковалентные связи обозначают черточкой («‒»).
Рис. Образование ковалентных и донорно-акцепторных (выделено красным) связей атомом азота.
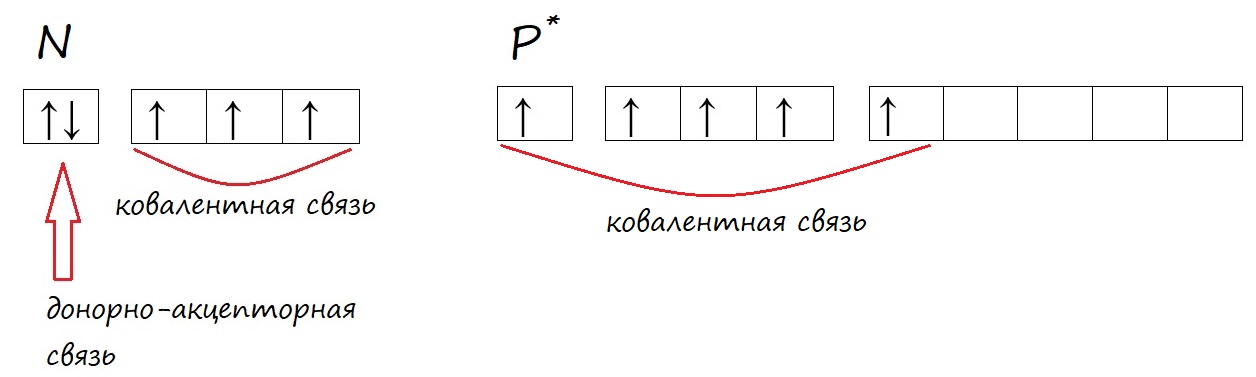
У фосфора, в отличие от азота, на внешнем уровне есть незаполненная d-орбиталь, на которую могут переходить электроны при возбуждении.
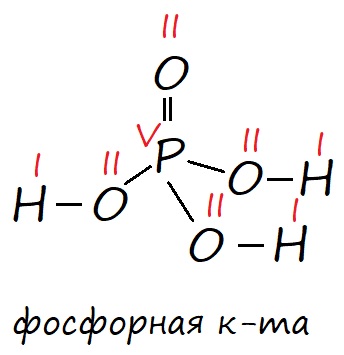
У фосфора в возбужденном состоянии появляется пять неспаренных электронов, поэтому он способен образовывать пять ковалентных связей, соответственно проявлять валентность V, например в ортофосфорной кислоте (H3PO4).
Рис. Строение фосфорной кислоты в соответствии с валентными состояниями атомов: фосфор в возбужденном состоянии имеет пять неспаренных электронов, его валентность равна V; кислород имеет два неспаренных электрона, поэтому его валентность равна II и он может образовывать две ковалентные связи; водород имеет один неспаренных электрон и его валентность равна I. Валентность обозначена красными римскими цифрами.
У азота нет свободной d-орбитали (она появляется с третьего энергетического уровня, а у азота всего два уровня), поэтому распарить электроны не может и высшую валентность, равную номеру группы, проявлять он не способен.
Валентность кислорода и серы
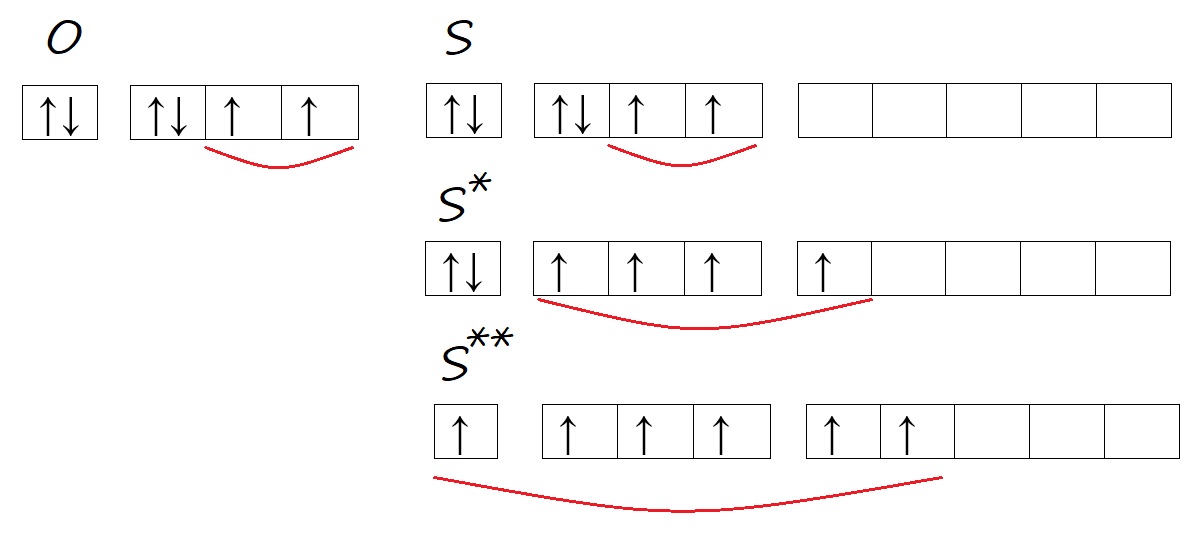
Аналогичную ситуацию можно наблюдать у атомов кислорода и серы. Кислород, находясь во втором периоде может иметь только два энергетических уровня, поэтому d-орбитали, появляющейся с третьего уровня, у него нет. Тогда как у серы три энергетических уровня, на внешнем уровне есть d-орбиталь и возможность распаривать на нее электроны в процессе возбуждения.
Рис. Количество неспаренных электронов у кислорода и серы в основном и возбужденном состоянии.
Таким образом, кислород способен проявлять валентность II, а сера – валентность II, IV, VI, например, в сероводороде (H2S) валентность равна двум; в сернистом газе и сернистой кислоте (SO2 и H2SO3) валентность равна четырём; в серном ангидриде и серной кислоте (SO3 и H2SO4) – шести.
Валентность фтора и хлора
По причинам, описанным выше, фтор так же не способен распаривать свои электроны и переходить в возбужденное состояние, а хлор может. Поэтому у фтора есть одно валентное состояние (I), например, в HF (H ‒ F) и OF2 (F ‒ O ‒ F).
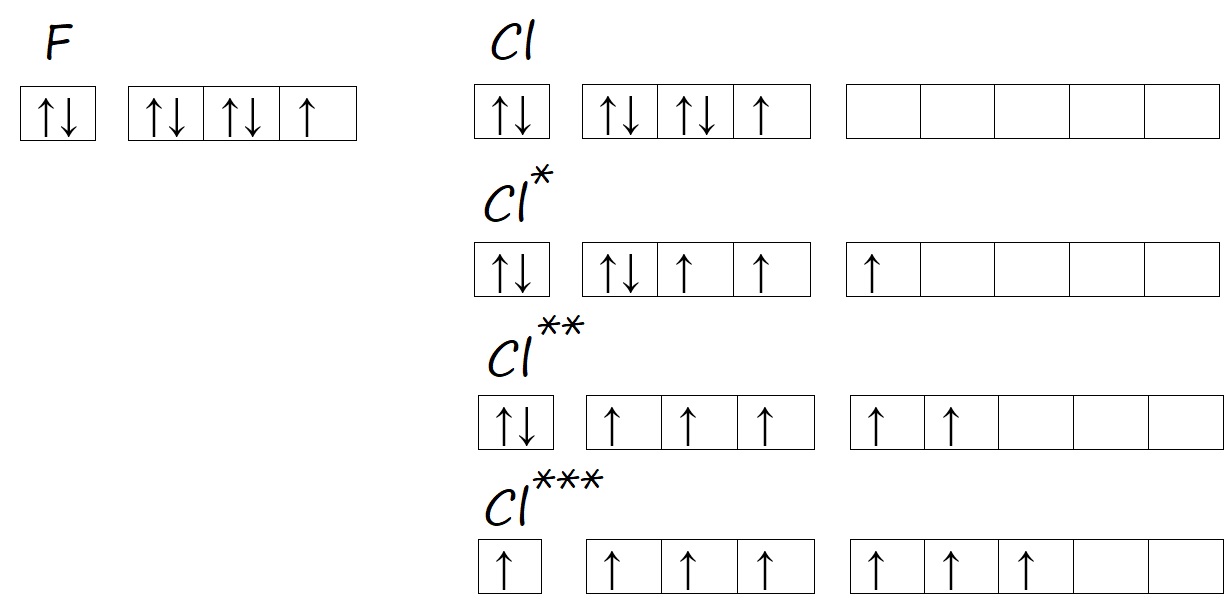
Хлор, как и другие нижестоящие галогены (элементы VIIА-подгруппы), может образовывать несколько возбужденных состояний, поэтому в разных соединениях имеет разную валентность. Например, валентность I хлор проявляет в хлороводороде HCl. Валентность III в хлористой кислоте HClO2. Валентность равную V – в хлорноватой кислоте HClO3. Равную VII – в хлорной кислоте HClO4.
Постоянная и непостоянная валентность
Как уже можно было заметить, некоторые элементы способны проявлять только одну валентность, тогда как другие могут иметь множество валентностей. По этой черте все элементы можно разделить на две группы: элементы с постоянной и непостоянной валентностью.
Таб. Классификация элементов по валентности
| С постоянной валентностью | С непостоянной валентностью |
| I: H и F II: O | Все остальные неметаллы. |
Иногда валентность определяют и у металлов, хотя для них характерна ионная, а не ковалентная связь, в таком случае таблица будет выглядеть следующим образом:
| С постоянной валентностью | С непостоянной валентностью |
| I: H, F, все металлы IА-подгруппы (Li, Na…). II: O и все металлы IIА-подгруппы, а также цинк. III: элементы IIIА-подгруппы. | Все остальные неметаллы и металлы. |
Низшая и высшая валентность
Высшая валентность равна номеру группы, в которой находится элемент (исключения: кислород, азот и фтор, как и было описано выше). Так, для брома высшей валентностью будет VII, для теллура – VI, для мышьяка V. Низшая валентность возможна для элементов четвёртой группы, она равна двум. Для элементов V – VII групп она определяется по описанной выше формуле (8 — №группы элемента). Поэтому у брома низшей валентностью будет I, у теллура II, а у мышьяка III.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ВАЛЕНТНОСТЬ
Это способность химических элементов к образованию химических связей; Она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле
Алюминий в 3 группе – валентность III
Кислород в 6 группе – валентность 8 – 6 = II
В кислородсодержащих бинарных соединениях проявляется высшая или промежуточная валентность, в водородных соединениях неметаллов – низшая валентность.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной.
При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается.
Высшая валентность, как правило, равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Исключения
1) азот, кислород, фтор;
2)инертные газы – гелий, неон, аргон;
3) металлы побочных подгрупп первой (кроме меди) и VIIIB группы (второй и третий элемент «триады»).
Валентные возможности определяются:
- наличием неподеленных пар электронов
- числом неспаренных электронов
- наличием свободных орбиталей
В органической химии понятие валентность замещает понятие степень окисления.
Это не одно и тоже. Валентность не имеет знака и не может быть нулевой.
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называется электроотрицательностью
Наибольшее значение у фтора
Электроотрицательность лития условно принимается за единицу. ЭО других элементов вычитается соответственно
В периодической системе слева направо по периоду электроотрицательность растет, по группе А сверху вниз уменьшается.
СТЕПЕНЬ ОКИСЛЕНИЯ
Это условный заряд атомов, вычисленный из предположения, что вещество состоит только из ионов.
С.О. показывает, сколько электронов отдал или присоединил элемент.
Высшая положительная степень окисления определяется числом внешних электронов и равна номеру группы.
Исключения
Как и в валентности.
Только азот, не проявляя высшей валентности, имеет высшую степень окисления
Благородные (инертные газы) могут иметь степень окисления 0 и +8.
Высшая степень окисления всех элементов равна номеру группы
Исключения:
1) азот, кислород, фтор;
2)инертные газы – гелий, неон, аргон;
3) металлы побочных подгрупп первой (кроме меди) и VIIIB группы (второй и третий элемент «триады»).
Низшая степень окисления неметаллов равна –(8-номер группы).Прмежуточные степени окисления неметаллов определяются по числу распадающихся электронных пар.
4(Б) Тесты к ЕГЭ ФИПИ 2015 к теме «Электроотрицательность. Степень окисления.»
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2H4 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- H2 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)H4(-), B2(+3)H6(-), B(+3)H3(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)H2(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
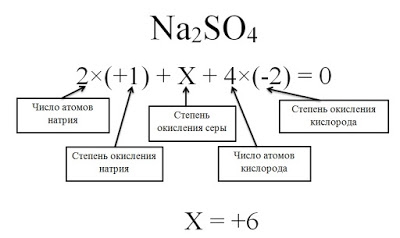
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)








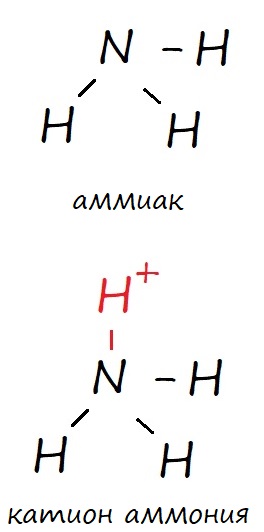
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)