Перейти к содержанию
Почему воды нет в таблице Менделеева?
На чтение 1 мин. Просмотров 156 Опубликовано 17.07.2021
Периодическая таблица элементов включает только отдельные химические элементы. Воду нет в периодической таблице, потому что она не состоит из одного элемента.
Элемент – это форма материи, которую невозможно разбить на более простые частицы с помощью любых химических средств. Вода состоит из водорода и кислорода. Самая маленькая частица воды – это молекула воды, состоящая из двух атомов водорода, связанных с одним атомом кислорода. Его формула – H 2 O, и он может быть разбит на компоненты, поэтому он не является элементом. Атомы водорода и кислорода воды не являются содержат одинаковое количество протонов – это разные вещества.
Сравните это с куском золота. Золото можно разделить на мелкие части, но самая маленькая частица, атом золота, имеет такую же химическую идентичность, как и все другие частицы. Каждый атом золота содержит одинаковое количество протонов.
Вода как элемент
Вода считалась элементом в некоторые культуры в течение очень длительного периода времени, но это было до того, как ученые поняли атомы и химические связи. Теперь определение элемента более точное. Вода считается типом молекулы или соединения.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА
 Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
Периодическая таблица Менделеева

Таблица Менделеева, (или периодическая система химических элементов) — это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
 Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» — для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» — после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме — возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке — с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок — D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
3. Почему водород, в отличие от всех других элементов, записывают в Периодической таблице Д.И. Менделеева дважды? Докажите правомочность двойственного положения водорода в Периодической системе, сравнив строение и свойства его атома, простого вещества и соединений с соответствующими формами существования других элементов — щелочных металлов и галогенов.
Водород можно записать в первую группу, т.к. его атом имеет на внешней оболочке 1 электрон, как и щелочные металлы, но также ему не хватает до завершения внешнего электронного слоя одного электрона, как и галогенам, поэтому его можно записать в седьмую группу. Водород при обычных условиях образует как и галогены двухатомную молекулу простого вещества с одинарной связью — газа, как фтор или хлор. Водород, как и галогены, соединяется с металлами, образуя нелетучие гидриды. Однако как и щелочные металлы водород может проявлять валентность только равную I, а галогены, как правило, образуют множество соединений, проявляя различную валентность.
- Обозначение — H (Hydrogen);
- Латинское название — Hydrogenium;
- Период — I;
- Группа — 1 (Ia);
- Атомная масса — 1,00794;
- Атомный номер — 1;
- Радиус атома = 53 пм;
- Ковалентный радиус = 32 пм;
- Распределение электронов — 1s 1 ;
- t плавления = -259,14°C;
- t кипения = -252,87°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,02/-;
- Степень окисления: +1; 0; -1;
- Плотность (н. у.) = 0,0000899 г/см 3 ;
- Молярный объем = 14,1 см 3 /моль.
Бинарные соединения водорода с кислородом:
Водород («рождающий воду») был открыт английским ученым Г. Кавендишем в 1766 году. Это самый простой элемент в природе — атом водорода имеет ядро и один электрон, наверное, по этой причине водород является самым распространенным элементом во Вселенной (составляет более половины массы большинства звезд).
Про водород можно сказать, что «мал золотник, да дорог». Несмотря на свою «простоту», водород дает энергию всем живым существам на Земле — на Солнце идет непрерывная термоядерная реакция в ходе которой из четырех атомов водорода образуется один атом гелия, данный процесс сопровождается выделением колоссального количества энергии (подробнее см. Ядерный синтез).
В земной коре массовая доля водорода составляет всего 0,15%. Между тем, подавляющее число (95%) всех известных на Земле химических веществ содержат один или несколько атомов водорода.

В соединениях с неметаллами (HCl, H 2 O, CH 4 …) водород отдает свой единственный электрон более электроотрицательным элементам, проявляя степень окисления +1 (чаще), образуя только ковалентные связи (см. Ковалентная связь).
В соединениях с металлами (NaH, CaH 2 …) водород, наоборот, принимает на свою единственную s-орбиталь еще один электрон, пытаясь, таким образом, завершить свой электронный слой, проявляя степень окисления -1 (реже), образуя чаще ионную связь (см. Ионная связь), т. к., разность в электроотрицательности атома водорода и атома металла может быть достаточно большой.
H 2
В газообразном состоянии водород находится в виде двухатомных молекул, образуя неполярную ковалентную связь.

Молекулы водорода обладают:
- большой подвижностью;
- большой прочностью;
- малой поляризуемостью;
- малыми размерами и массой.
Свойства газа водорода:
- самый легкий в природе газ, без цвета и запаха;
- плохо растворяется в воде и органических растворителях;
- в незначительных кол-вах растворяется в жидких и твердых металлах (особенно в платине и палладии);
- трудно поддается сжижению (по причине своей малой поляризуемости);
- обладает самой высокой теплопроводностью из всех известных газов;
- при нагревании реагирует со многими неметаллами, проявляя свойства восстановителя;
- при комнатной температуре реагирует со фтором (происходит взрыв): H 2 + F 2 = 2HF;
- с металлами реагирует с образованием гидридов, проявляя окислительные свойства: H 2 + Ca = CaH 2 ;
В соединениях водород гораздо сильнее проявляет свои восстановительные свойства, чем окислительные. Водород является самым сильным восстановителем после угля, алюминия и кальция. Восстановительные свойства водорода широко используются в промышленности для получения металлов и неметаллов (простых веществ) из оксидов и галлидов.
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Реакции водорода с простыми веществами
Водород принимает электрон, играя роль восстановителя
, в реакциях:
- с кислородом
(при поджигании или в присутствии катализатора), в соотношении 2:1 (водород:кислород) образуется взрывоопасный гремучий газ:
2H 2 0 +O 2 = 2H 2 +1 O+572 кДж - с серой
(при нагревании до 150°C-300°C):
H 2 0 +S ↔ H 2 +1 S - с хлором
(при поджигании или облучении УФ-лучами):
H 2 0 +Cl 2 = 2H +1 Cl - с фтором
:
H 2 0 +F 2 = 2H +1 F - с азотом
(при нагревании в присутствии катализаторов или при высоком давлении):
3H 2 0 +N 2 ↔ 2NH 3 +1
Водород отдает электрон, играя роль окислителя
, в реакциях с щелочными
и щелочноземельными
металлами с образованием гидридов металлов — солеобразные ионные соединения, содержащие гидрид-ионы H — — это нестойкие кристаллические в-ва белого цвета.
Ca+H 2 = CaH 2 -1
2Na+H 2 0 = 2NaH -1
Для водорода нехарактерно проявлять степень окисления -1. Реагируя с водой, гидриды разлагаются, восстанавливая воду до водорода. Реакция гидрида кальция с водой имеет следующий вид:
CaH 2 -1 +2H 2 +1 0 = 2H 2 0 +Ca(OH) 2
Реакции водорода со сложными веществами
- при высокой температуре водород восстанавливает многие оксиды металлов:
ZnO+H 2 = Zn+H 2 O - метиловый спирт получают в результате реакции водорода с оксидом углерода (II):
2H 2 +CO → CH 3 OH - в реакциях гидрогенизации водород реагирует с многими органическими веществами.
Более подробно уравнения химических реакций водорода и его соединений рассмотрены на странице «Водород и его соединения — уравнения химических реакций с участием водорода «.
Применение водорода
- в атомной энергетике используются изотопы водорода — дейтерий и тритий;
- в химической промышленности водород используют для синтеза многих органических веществ, аммиака, хлороводорода;
- в пищевой промышленности водород применяют в производстве твердых жиров посредство гидрогенизации растительных масел;
- для сварки и резки металлов используют высокую температуру горения водорода в кислороде (2600°C);
- при получении некоторых металлов водород используют в качестве восстановителя (см. выше);
- поскольку водород является легким газом, его используют в воздухоплавании в качестве наполнителя воздушных шаров, аэростатов, дирижаблей;
- как топливо водород используют в смеси с СО.
В последнее время ученые уделяют достаточно много внимания поиску альтернативных источников возобновляемой энергии. Одним из перспективных направлений является «водородная» энергетика, в которой в качестве топлива используется водород, продуктом сгорания которого является обыкновенная вода.
Способы получения водорода
Промышленные способы получения водорода:
- конверсией метана (каталитическим восстановлением водяного пара) парами воды при высокой температуре (800°C) на никелевом катализаторе: CH 4 + 2H 2 O = 4H 2 + CO 2 ;
- конверсией оксида углерода с водяным паром (t=500°C) на катализаторе Fe 2 O 3: CO + H 2 O = CO 2 + H 2 ;
- термическим разложением метана: CH 4 = C + 2H 2 ;
- газификацией твердых топлив (t=1000°C): C + H 2 O = CO + H 2 ;
- электролизом воды (очень дорогой способ при котором получается очень чистый водород): 2H 2 O → 2H 2 + O 2 .
Лабораторные способы получения водорода:
- действием на металлы (чаще цинк) соляной или разбавленной серной кислотой: Zn + 2HCl = ZCl 2 + H 2 ; Zn + H 2 SO 4 = ZnSO 4 + H 2 ;
- взаимодействием паров воды с раскаленными железными стружками: 4H 2 O + 3Fe = Fe 3 O 4 + 4H 2 .
Водород — неорганическое вещество, первый и самый легкий элемент таблицы Менделеева. Обозначается буквой H (Hydrogenium), переводится с греческого как «рождающий воду».
В природе существует три устойчивых атома водорода:
протий — стандартный вариант атома, состоящий из протона и электрона;
дейтерий — состоит из протона, нейтрона и электрона;
тритий — в ядре протон и два нейтрона.
Водорода на Земле достаточно много. Если исходить из числа атомов, то его примерно 17%. Больше лишь кислорода — около 52%. И это только в коре земли и атмосфере — ученые не знают, сколько его в мантии и ядре планеты. На Земле водород находится преимущественно в связанном состоянии. Он часть воды, всех живых клеток, природного газа, нефти, угля, некоторых горных пород и минералов. В несвязанном состоянии его можно обнаружить в вулканических газах, в продуктах разложения органики.
Свойства
Самый легкий газ. Не имеет цвета, вкуса и запаха. В воде плохорастворим, хорошо — в этаноле, во многих металлах, например, в железе, титане, палладии — в одном объеме палладия может раствориться 850 объемов Н2. Не растворяется в серебре. Лучше всех газов проводит тепло. При сильном охлаждении преобразуется в очень подвижную текучую бесцветную жидкость, и далее в твердое снегообразное вещество. Интересно, что жидкое состояние элемент сохраняет в очень узком температурном диапазоне: от −252,76 до −259,2 °C. Предполагается, что твердый водород при гигантских давлениях в сотни тысяч атмосфер приобретет металлические свойства. При высоких температурах вещество проникает сквозь мельчайшие поры металлов и сплавов.
Водород — важный биогенный элемент. Образует воду, содержится во всех живых тканях, в амино- и нуклеиновых кислотах, белках, липидах, жирах, углеводах.
 С точки зрения химии, водород обладает уникальной особенностью — его относят сразу к двум группам таблицы Менделеева: к щелочным металлам и галогенам. Как щелочной металл, проявляет сильные восстановительные свойства. Реагирует с фтором при обычных условиях, с хлором — под действием света, с другими неметаллами — только при нагревании или в присутствии катализаторов. Вступает в реакции с кислородом, азотом, серой, углеродом, галогенами, угарным газом и др. Образует такие важные соединения как аммиак, сероводород, углеводороды, спирты, фтороводород (фтористоводородную кислоту) и хлороводород (соляную кислоту). При взаимодействии с оксидами и галогенидами металлов восстанавливает их до металлов; это свойство используется в металлургии.
С точки зрения химии, водород обладает уникальной особенностью — его относят сразу к двум группам таблицы Менделеева: к щелочным металлам и галогенам. Как щелочной металл, проявляет сильные восстановительные свойства. Реагирует с фтором при обычных условиях, с хлором — под действием света, с другими неметаллами — только при нагревании или в присутствии катализаторов. Вступает в реакции с кислородом, азотом, серой, углеродом, галогенами, угарным газом и др. Образует такие важные соединения как аммиак, сероводород, углеводороды, спирты, фтороводород (фтористоводородную кислоту) и хлороводород (соляную кислоту). При взаимодействии с оксидами и галогенидами металлов восстанавливает их до металлов; это свойство используется в металлургии.
Как галоген Н2 проявляет окислительные свойства при взаимодействии с металлами.
Во Вселенной водорода 88,6%. Большей частью он содержится  в звездах и межзвездном газе.
в звездах и межзвездном газе.
Из-за своей легкости молекулы вещества двигаются с огромными скоростями, сопоставимыми со второй космической скоростью. Благодаря этому его теплопроводность превышает теплопроводность воздуха в 7,3 раза. Из верхних частей атмосферы молекулы Н2 легко улетают в космос. Таким образом наша планета теряет 3 кг водорода каждую секунду.
Техника безопасности
Водород нетоксичен, но пожаро- и взрывоопасен. Смесь с воздухом (гремучий газ) легко взрывается от малейшей искры. Сам водород горит. Это следует учитывать при его получении для лабораторных нужд или при проведении опытов, в ходе которых выделяется водород.
Пролив жидкий водород на кожу, можно получить серьезное обморожение.
Применение
В химпроме с помощью Н2 производят аммиак , спирты, соляную кислоту, мыло, полимеры, искусственное топливо, многие орг.вещества.
В нефтеперерабатывающей индустрии — для получения из нефти и нефтяных остатков различных производных (дизельного топлива, смазочных масел, бензинов, сжиженных газов и др.); для очистки нефтепродуктов, смазочных масел.
В пищепроме: при изготовлении твердых маргаринов методом гидрогенизации из растительных масел; используется как газ для упаковок некоторых продуктов (добавка Е949).
В металлургии в процессах получения металлов и сплавов. Для атомно-водородной (t пламени доходит до +4000 °С) и кислородно-водородной (до +2800 °С) резки и сварки жаростойких сталей и сплавов.
В метеорологии веществом наполняют воздушные зонды и шары.
Как топливо для ракет.
Как охладитель для крупных электрогенераторов.
В стекольной индустрии для выплавки кварцевого стекла в высокотемпературном пламени.
В газовой хроматографии; для заполнения (жидким Н2) пузырьковых камер.
Как хладагент в криогенных вакуумных насосах.
Дейтерий и тритий используются в атомной энергетике и военном деле.
Водород
(лат. hydrogenium), Н, химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. — газ; не имеет цвета, запаха и вкуса.
Историческая справка.
В трудах химиков 16 и 17 вв. неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 Г. Кавендиш
собрал и исследовал выделяющийся газ, назвав его «горючий воздух». Будучи сторонником теории флогистона
, Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 А. Лавуазье
путём анализа и синтеза воды доказал сложность её состава, а в 1787 определил «горючий воздух» как новый химический элемент (В.) и дал ему современное название hydrog e ne (от греч. h y d o r — вода и genn a o — рождаю), что означает «рождающий воду»; этот корень употребляется в названиях соединений В. и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование «В.» было предложено М. Ф. Соловьёвым в 1824.
Распространённость в природе
. В. широко распространён в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. В. входит в состав самого распространённого вещества на Земле — воды (11,19% В. по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (т. е. в состав белков, нуклеиновых кислот, жиров, углеводов и др.). В свободном состоянии В. встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного В. (0,0001% по числу атомов) присутствуют в атмосфере. В околоземном пространстве В. в виде потока протонов образует внутренний («протонный») радиационный пояс Земли
. В космосе В. является самым распространённым элементом. В виде плазмы
он составляет около половины массы Солнца и большинства звёзд, основную часть газов межзвёздной среды и газовых туманностей. В. присутствует в атмосфере ряда планет и в кометах в виде свободного h 2 , метана ch 4 , аммиака nh 3 , воды h 2 o, радикалов типа ch, nh, oh, sih, ph и т.д. В виде потока протонов В. входит в состав корпускулярного излучения Солнца и космических лучей.
Изотопы, атом и молекула.
Обыкновенный В. состоит из смеси 2 устойчивых изотопов: лёгкого В., или протия (1 h), и тяжёлого В., или дейтерия
(2 h, или d). В природных соединениях В. на 1 атом 2 h приходится в среднем 6800 атомов 1 h. Искусственно получен радиоактивный изотоп — сверхтяжёлый В., или тритий
(3 h, или Т), с мягким?-излучением и периодом полураспада t 1/2
= 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере его ничтожно мало (4 · 10 -15 % от общего числа атомов В.). Получен крайне неустойчивый изотоп 4 h. Массовые числа изотопов 1 h, 2 h, 3 h и 4 h, соответственно 1,2, 3 и 4, указывают на то, что ядро атома протия содержит только 1 протон, дейтерия — 1 протон и 1 нейтрон, трития — 1 протон и 2 нейтрона, 4 h —
1 протон и 3 нейтрона. Большое различие масс изотопов В. обусловливает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов.
Атом В. имеет наиболее простое строение среди атомов всех других элементов: он состоит из ядра и одного электрона. Энергия связи электрона с ядром (потенциал ионизации) составляет 13,595 эв
. Нейтральный атом В. может присоединять и второй электрон, образуя отрицательный ион Н — ; при этом энергия связи второго электрона с нейтральным атомом (сродство к электрону) составляет 0,78 эв
. Квантовая механика
позволяет рассчитать все возможные энергетические уровни атома В., а следовательно, дать полную интерпретацию его атомного спектра
. Атом В. используется как модельный в квантовомеханических расчётах энергетических уровней других, более сложных атомов. Молекула В. h 2 состоит из двух атомов, соединённых ковалентной химической связью. Энергия диссоциации (т. е. распада на атомы) составляет 4,776 эв
(1 эв
= 1,60210 · 10 -19 дж
). Межатомное расстояние при равновесном положении ядер равно 0,7414 · a . При высоких температурах молекулярный В. диссоциирует на атомы (степень диссоциации при 2000°С 0,0013, при 5000°С 0,95). Атомарный В. образуется также в различных химических реакциях (например, действием zn на соляную кислоту). Однако существование В. в атомарном состоянии длится лишь короткое время, атомы рекомбинируют в молекулы h 2 .
Физические и химические свойства
. В. — легчайшее из всех известных веществ (в 14,4 раза легче воздуха), плотность 0,0899 г/л
при 0°С и 1 атм
. В. кипит (сжижается) и плавится (затвердевает) соответственно при -252,6°С и -259,1°С (только гелий имеет более низкие температуры плавления и кипения). Критическая температура В. очень низка (-240°С), поэтому его сжижение сопряжено с большими трудностями; критическое давление 12,8 кгс/см
2 (12,8 атм
), критическая плотность 0,0312 г/см
3 . Из всех газов В. обладает наибольшей теплопроводностью, равной при 0°С и 1 атм
0,174 вт/
(м
· К
), т. е. 4,16 · 0 -4 кал/
(с
· см
· °С
). Удельная теплоёмкость В. при 0°С и 1 атм
С р
14,208 · 10 3 дж/
(кг
· К
), т. е. 3,394 кал/
(г
· °С
). В. мало растворим в воде (0,0182 мл/г
при 20°С и 1 атм
), но хорошо — во многих металлах (ni, pt, pd и др.), особенно в палладии (850 объёмов на 1 объём pd). С растворимостью В. в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия В. с углеродом (так называемая декарбонизация). Жидкий В. очень лёгок (плотность при -253°С 0,0708 г/см
3) и текуч (вязкость при — 253°С 13,8 спуаз
).
В большинстве соединений В. проявляет валентность (точнее, степень окисления) +1, подобно натрию и другим щелочным металлам; обычно он и рассматривается как аналог этих металлов, возглавляющий 1 гр. системы Менделеева. Однако в гидридах металлов ион В. заряжен отрицательно (степень окисления -1), т. е. гидрид na + h — построен подобно хлориду na + cl — . Этот и некоторые другие факты (близость физических свойств В. и галогенов, способность галогенов замещать В. в органических соединениях) дают основание относить В. также и к vii группе периодической системы. При обычных условиях молекулярный В. сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Атомарный В. обладает повышенной химической активностью по сравнению с молекулярным. С кислородом В. образует воду: h 2 + 1 / 2 o 2 = h 2 o с выделением 285,937 · 10 3 дж/моль
, т. е. 68,3174 ккал/моль
тепла (при 25°С и 1 атм
). При обычных температурах реакция протекает крайне медленно, выше 550°С — со взрывом. Пределы взрывоопасности водородо-кислородной смеси составляют (по объёму) от 4 до 94% h 2 , а водородо-воздушной смеси — от 4 до 74% h 2 (смесь 2 объёмов h 2 и 1 объёма О 2 называется гремучим газом
). В. используется для восстановления многих металлов, так как отнимает кислород у их окислов:
cuo +Н 2 = cu + h 2 o,
fe 3 o 4 + 4h 2 = 3fe + 4h 2 o, и т.д.
С галогенами В. образует галогеноводороды, например:
h 2 + cl 2 = 2hcl.
При этом с фтором В. взрывается (даже в темноте и при -252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с иодом только при нагревании. С азотом В. взаимодействует с образованием аммиака: 3h 2 + n 2 = 2nh 3 лишь на катализаторе и при повышенных температурах и давлениях. При нагревании В. энергично реагирует с серой: h 2 + s = h 2 s (сероводород), значительно труднее с селеном и теллуром. С чистым углеродом В. может реагировать без катализатора только при высоких температурах: 2h 2 + С (аморфный) = ch 4 (метан). В. непосредственно реагирует с некоторыми металлами (щелочными, щёлочноземельными и др.), образуя гидриды: h 2 + 2li = 2lih. Важное практическое значение имеют реакции В. с окисью углерода, при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например hcho, ch 3 oh и др. Ненасыщенные углеводороды реагируют с В., переходя в насыщенные, например:
c n h 2 n + h 2 = c n h 2 n +2.
Роль В. и его соединений в химии исключительно велика. В. обусловливает кислотные свойства так называемых протонных кислот. В. склонен образовывать с некоторыми элементами так называемую водородную связь
, оказывающую определяющее влияние на свойства многих органических и неорганических соединений.
Получение
. Основные виды сырья для промышленного получения В. — газы природные горючие
, коксовый газ
(см. Коксохимия
) и газы нефтепереработки
, а также продукты газификации твёрдых и жидких топлив (главным образом угля). В. получают также из воды
электролизом (в местах с дешёвой электроэнергией). Важнейшими способами производства В. из природного газа являются каталитическое взаимодействие углеводородов, главным образом метана, с водяным паром (конверсия): ch 4 + h 2 o = co + 3h 2 , и неполное окисление углеводородов кислородом: ch 4 + 1 / 2 o 2 = co + 2h 2 . Образующаяся окись углерода также подвергается конверсии: co + h 2 o = co 2 + h 2 . В., добываемый из природного газа, самый дешёвый. Очень распространён способ производства В. из водяного и паровоздушного газов, получаемых газификацией угля. Процесс основан на конверсии окиси углерода. Водяной газ содержит до 50% h 2 и 40% co; в паровоздушном газе, кроме h 2 и co, имеется значительное количество n 2 , который используется вместе с получаемым В. для синтеза nh 3 . Из коксового газа и газов нефтепереработки В. выделяют путём удаления остальных компонентов газовой смеси, сжижаемых более легко, чем В., при глубоком охлаждении. Электролиз воды ведут постоянным током, пропуская его через раствор koh или naoh (кислоты не используются во избежание коррозии стальной аппаратуры). В лабораториях В. получают электролизом воды, а также по реакции между цинком и соляной кислотой. Однако чаще используют готовый заводской В. в баллонах.
Применение
. В промышленном масштабе В. стали получать в конце 18 в. для наполнения воздушных шаров. В настоящее время В. широко применяют в химической промышленности, главным образом для производства аммиака
. Крупным потребителем В. является также производство метилового и других спиртов, синтетического бензина (синтина) и других продуктов, получаемых синтезом из В. и окиси углерода. В. применяют для гидрогенизации твёрдого и тяжёлого жидкого топлив, жиров и др., для синтеза hcl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке
(до 4000°С). Очень важное применение в атомной энергетике нашли изотопы В. — дейтерий и тритий.
Лит.:
Некрасов Б. В., Курс общей химии, 14 изд., М., 1962; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Егоров А. П., Шерешевский Д. И., Шманенков И. В., Общая химическая технология неорганических веществ, 4 изд., М., 1964; Общая химическая технология. Под ред. С. И. Вольфковича, т. 1, М., 1952; Лебедев В. В., Водород, его получение и использование, М., 1958; Налбандян А. Б., Воеводский В. В., Механизм окисления и горения водорода, М. — Л., 1949; Краткая химическая энциклопедия, т. 1, М., 1961, с. 619-24.
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА
 Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
![]()
Каждая буква,в любом алфавите,в том числе и в армянском, имеет свой порядковый номер. Если взять название любого элемента таблицы Менделеева, и сложить сумму номеров букв,из которых состоит это название,получится порядковый номер этого элемента в таблице химических элементов.
Например,название элемента золото состоит из армянских букв: Ո + Ս + Կ + Ի. Эти буквы по алфавиту соответственно 24-ая,29-ая,15-ая и 11-ая. Если сложить эти цифры,получится 79 — порядковый номер золота в таблице Менделеева.

![]()
Периодическая таблица Д.И.Менделеева является графическим изображением периодического закона (открытого тем же Менделеева), и состоит из групп и периодов.
Группа — вертикальные столбцы. В таблице таких групп всего 8. Каждая группа делится на главную подгруппу (группа А) и побочную подгруппу (группа Б). Если табличка цветная, то отличить их очень просто. Элементы, входящие в побочную группу окрашены в синий цвет. При дальнейшем изучении химии, вам объяснят причину разного цвета ячеек. Причина в расположении электронов в атоме, грубо говоря. Если же таблица черно-белая, тоже не беда. В этом случае символ элемента побочной группы пишется справа ячейки (главной — слева). К примеру, IIA (или главная подгруппа второй группы) включает в себя бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra; IIB (или побочная подгруппа второй группы) включает в себя цинк Zn, кадмий Cd и ртуть Hg.
Период — горизонтальный ряд элементов в таблице, который начинается с щелочного металла и заканчивается инертным газом. 1, 2, 3 периоды называют малыми периодами, так как они состоят из одного ряда элемента. 4, 5, 6, 7 периоды называют большими периодами, так как они состоят из двух рядов элементов (7 период незаконченный, поэтому состоит только из одного ряда). Так 4 период состоит из 18 элементов (K, Ca, Sc, Ti, V, Cr,…, Ni, Cu, Zn, Ga, … Kr). Начинается как и все периоды щелочным металлом (в данном случае K калий) и заканчивается инертным газом (Kr криптон). 4 ряд 4 периода — от калия K до никеля Ni. 5 ряд 4 периода — от меди Cu до криптона Kr.
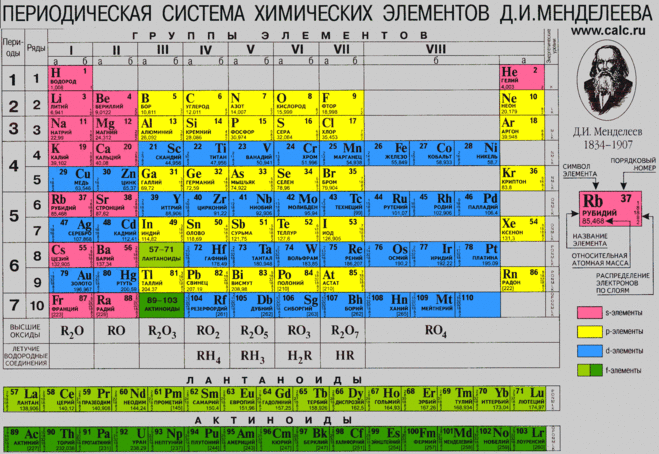
![]()
Технеций — первый элемент, не имеющий стабильных (не радиоактивных) изотопов.
А так — радиактивны все элементы, если брать иные изотопы, даже тот же водород (водородная бомба именно на радиоактивных работает). А так — водород самый лёгкий. Он вообще первый в таблице. 1 протон у самого простого изотопа, но он не радиоактивный.
![]()
Заинтересовал ваш вопрос, погуглила ради интереса. И вот что нашла:
Формула определения вашего знака в таблице Менделеева:
Н = (1200*Х+10*Х*У*Т + 120*К) /400 + 1. Важно помнить, что сначала выполняются действия умножения и деления в скобках, затем остальные действия в скобках, затем умножение и деление за скобками, затем остальные действия за скобками. Это я так, на всякий случай. Результат округляется до целого.
Значения символов по формуле:
Н — номер вашего хим. эл.
Х — число рождения
У — месяц рождения
Т — предпоследняя цифра года рождения
К -последняя цифра года рождения
Если в итоге получилось число больше, чем 107 — складываем все цифры в этом числе.
Далее, получив итоговое число, смотрим его значение по таблице Менделеева (есть в Википедии).
У меня, к примеру, получилось 66,77, я округлила до 67, оказалось, что я Гольмий, из группы лантаноидов. А мужу посчитала — он просто сера оказался (16).
![]()
К середине XIX века было уже открыто 63 химических элемента. И разными учеными делались попытки найти закономерности этого набора: Иоганн Вольфганг Дёберейнер («закон триад», 1817 для кальция, стронция, бария, 1829 — {литий, натрий, калий}, {сера, селен, теллур}, {хлор, бром, йод}), Джон Ньюлендс («закон октав», по аналогии с музыкой, 1865), Юлиус Лотар Мейер (1864, опубликовал таблицу 28 элементов — 6 столбцов по валентностям).
Д.И.Менделеев знал об этих исследованиях. Но в отличие от Ю.Л.Мейера он учел атомные веса элементов, о чем сначала сообщил ведущим химикам мира, а затем опубликовал свое открытие в статье «Соотношение свойств с атомным весом элементов». Гениальность прозрения Д.И.Менделеева заключалась в том, что он в своей «периодической системе» оставил несколько клеток пустыми! О чём до него никому в голову не приходило. И таким образом известные элементы «вписались» в закон Менделеева. Более того, он имел большую внутреннюю уверенность, что существуют ещё неоткрытые элементы, для которых он оставил пустые клетки. Как показала жизнь, он оказался прав. Первый вариант таблицы, описывающей периодический закон Д.И.Менделеева выглядел так:
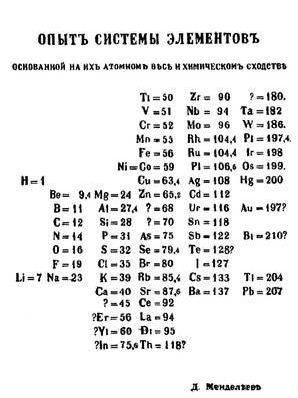
Вот так Менделеев создал Периодическую систему химических элементов.
<hr />
Есть легенда, что Д.И.Менделеев увидел свою Периодическую таблицу во сне. Эту версию распространял профессор А.А.Иностранцев, желая позабавить своих студентов. Он рассказывал, якобы, что Д.И.Менделеев во сне отчетливо увидел свою таблицу, где элементы оказались расставлены, как нужно. А дальше уже студенты распространили эту байку, как и байку про «открытие водки 40%». Однако, основания для такой истории были. Д.И.Менделеев часто много работал, как говорится, «без сна и отдыха». Однажды его застал А.А.Иностранцев в крайне изможденном состоянии. А днем Д.И.Менделеев прилег отдохнуть и заснул. Когда он проснулся, он тут же на клочке бумаги записал итоговый вариант таблицы.
Сам же он к этой легенде относился скептически и говорил:
«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
- Вопросы и Ответы
- Химия
- Каков состав воды по таблице менделеева
8 просмотров
Каков состав воды по таблице менделеева
- каков
- состав
- таблице
- менделеева
- 5 — 9 классы
- химия
спросил
28 Март, 18
от
Tanya1114022003_zn
(24 баллов)
в категории Химия
|
8 просмотров
2 Ответы
0 голосов
H2O или что про что именно
ответил
28 Март, 18
от
alberto00_zn
Начинающий
(596 баллов)
0 голосов
2 атома водорода и один атом кислорода
H₂O
ответил
28 Март, 18
от
MishaVoro_zn
Бакалавр
(12.3k баллов)
Связанных вопросов не найдено
Здравствуйте! На сайте Otvet-Master.ru собраны ответы и решения на все виды школьных задач и университетских заданий. Воспользуйтесь поиском решений на сайте или задайте свой вопрос онлайн и абсолютно бесплатно.
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д.И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 H водород | 2 He гелий | ||||||||
| 3 Li литий | 4 Be бериллий | 5 B бор | 6 С углерод | 7 N азот | 8 O кислород | 9 F фтор | 10 Ne неон | ||
| 11 Na натрий | 12 Mg магний | 13 Al алюминий | 14 Si кремний | 15 P фосфор | 16 S сера | 17 Cl хлор | 18 Ar аргон | ||
| 19 K калий | 20 Ca кальций | 21 Sc скандий | 22 Ti титан | 23 V ванадий | 24 Cr хром | 25 Mn марганец | 26 Fe железо | 27 Co кобальт | 28 Ni никель |
| 29 Cu медь | 30 Zn цинк | 31 Ga галлий | 32 Ge германий | 33 As мышьяк | 34 Se селен | 35 Br бром | 36 Kr криптон | ||
| 37 Rb рубидий | 38 Sr стронций | 39 Y иттрий | 40 Zr цирконий | 41 Nb ниобий | 42 Mo молибден | 43 Tc технеций | 44 Ru рутений | 45 Rh родий | 46 Pd палладий |
| 47 Ag серебро | 48 Cd кадмий | 49 In индий | 50 Sn олово | 51 Sb сурьма | 52 Te теллур | 53 I иод | 54 Xe ксенон | ||
| 55 Cs цезий | 56 Ba барий | 57 La лантан × | 72 Hf гафний | 73 Ta тантал | 74 W вольфрам | 75 Re рений | 76 Os осмий | 77 Ir иридий | 78 Pt платина |
| 79 Au золото | 80 Hg ртуть | 81 Tl таллий | 82 Pb свинец | 83 Bi висмут | 84 Po полоний | 85 At астат | 86 Rn радон | ||
| 87 Fr франций | 88 Ra радий | 89 Ac актиний ×× | 104 Rf резерфордий | 105 Db дубний | 106 Sg сиборгий | 107 Bh борий | 108 Hs хассий | 109 Mt мейтнерий | 110 Ds дармштадтий |
| 111 Rg рентгений | 112 Сn коперниций | 113 Nh нихоний | 114 Fl флеровий | 115 Mc московий | 116 Lv ливерморий | 117 Tn теннесин | 118 Og оганессон |
| 57 La лантан | 58 Ce церий | 59 Pr празеодим | 60 Nd неодим | 61 Pm прометий | 62 Sm самарий | 63 Eu европий | 64 Gd гадолиний | 65 Tb тербий | 66 Dy диспрозий | 67 Ho гольмий | 68 Er эрбий | 69 Tm тулий | 70 Yb иттербий | 71 Lu лютеций |
| 89 Ac актиний | 90 Th торий | 91 Pa протактиний | 92 U уран | 93 Np нептуний | 94 Pu плутоний | 95 Am америций | 96 Cm кюрий | 97 Bk берклий | 98 Cf калифорний | 99 Es эйнштейний | 100 Fm фермий | 101 Md менделевий | 102 No нобелий | 103 Lr лоуренсий |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.

Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
- Таблица Менделеева в хорошем качестве цветная
- Таблица Менделеева для печати черно-белая
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Вода
Брутто-формула:
H2O
CAS# 7732-18-5
Названия
Русский:
- Вода [Wiki]
- Оксид водорода(IUPAC)
English:
- Dihydrogen oxide
- Water(CAS) [Wiki]
- oxidane(IUPAC)
Варианты формулы:
Реакции, в которых участвует Вода
-
H2O <=> H^+ + OH^-
-
2H2 + O2 = 2H2O
-
2H2O <=> H3O^+ + OH^-
-
2{M} + 2H2O = 2{M}OH + H2″|^»
, где M =
Li Na K Rb -
2H2O2 -> 2H2O + O2″|^»
