Опыт
1. Гидролиз
соли, образованной сильным основанием
и слабой кислотой
Получите
у лаборанта навеску соли (карбоната,
гидрокарбоната, ацетата или нитрита
натрия) и приготовьте в мерной колбе на
100 мл её раствор.
Вычислите
молярную концентрацию приготовленного
раствора.
Измерьте
рН приготовленного раствора сначала с
помощью универсального индикатора,
а затем рН-метром.
Составьте
молекулярное и ионно-молекулярное
уравнения реакции гидролиза соли
(первая ступень) и вычислите рН
приготовленного раствора.
Закончите
оформление результатов опыта вычислением
рН раствора и сравнением его значения
с полученным экспериментально на
рН-метре.
Результаты
расчётов и измерений введите в таблицу.
| Навеска, | Объём | С (теор.), моль/литр | рН | рН | рН (теор.) |
Опыт
2. Гидролиз
соли, образованной слабым основанием
и сильной кислотой
Получите
у лаборанта навеску соли (хлорида железа
(Ш), хлорида или сульфата алюминия) и
приготовьте в мерной колбе на 100мл её
раствор.
Вычислите
молярную концентрацию приготовленного
раствора.
Измерьте
рН раствора сначала с помощью универсального
индикатора, а затем рН-метром.
Запишите
молекулярное и ионно-молекулярное
уравнения реакции гидролиза (первая
ступень) и вычислите молярную концентрацию
соли в растворе на основании найденного
значения водородного показателя среды.
Результаты
расчётов и измерений введите в таблицу.
| Навеска, | Объём | С (теор.) | рН | рН | С(эксп.), |
Опыт
3. Смещение
равновесия реакции гидролиза соли при
разбавлении раствора
Убедитесь
в том, что концентрированный раствор
ацетата свинца (II) прозрачен, В коническую
колбу налейте 50 мл водопроводной
воды, добавьте 1—2 капли концентрированного
раствора РЬ(СН3СОО)2.
Наблюдайте образование осадка.
При
оформлении результатов опыта:
-
Назовите
гидролизующийся ион, составьте
молекулярное и ионно-молекулярное
уравнения реакции гидролиза и объясните,
почему концентрированный раствор
РЬ(СН3СОО)г
прозрачен. -
Объясните,
почему при разбавлении в колбе появился
осадок. Составьте уравнение реакции
образования осадка. Имеет ли отношение
эта реакция к процессу гидролиза
рассматриваемой соли? -
Сделайте
вывод о влиянии разбавления растворов
гидролизующихся солей на гидролитическое
равновесие.
Опыт
4. Смещение
равновесия реакции гидролиза соли при
изменении температуры
В
пробирку внесите 5 — 6 мл раствора ацетата
натрия CH3COONa
и 1-2 капли индикатора (фенолфталеина).
Содержимое пробирки разделите на 2
части, одну из них оставьте для сравнения,
другую — нагрейте до кипения.
Сравните
окраску индикатора в обеих пробирках.
Дайте пробирке охладиться и снова
сравните окраску индикатора в обеих
пробирках. Опишите и поясните свои
наблюдения.
Составьте
молекулярное и ионно-молекулярное
уравнения реакции гидролиза соли,
назвав предварительно гидролизующийся
ион. Сделайте вывод о среде раствора и
о влиянии температуры на гидролитическое
равновесие.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
государственное автономное
профессиональное образовательное учреждение Чувашской Республики
«Межрегиональный центр компетенций –
Чебоксарский
электромеханический колледж»
Министерства образования и
молодежной политики Чувашской Республики
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
лабораторной работы
«Гидролиз солей. Свойства солей».
Автор:
Хлебникова Л.А. – преподаватель
ГАПОУ ЧР МЦК ЧЭМК
г. Чебоксары 2017г.
Цель работы: Исследовать с помощью индикаторов растворы солей;
закрепить умение
составлять схемы гидролиза солей.
Оборудование и
реактивы: штатив с
пробирками; растворы индикаторов – фенолфталеина, лакмус, метилоранжа; растворы
солей: хлорида калия, хлорида меди, карбоната калия.
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Гидролизом называется обменная реакция взаимодействия
соли с водой, приводящая к смещению равновесия диссоциации воды и, как правило,
к изменению кислотности среды.
Гидролизу могут подвергаться только те соли, ионы
которых способны связывать Н+ или ОН– – ионы воды в
малодиссоциированные соединения, т.е. соли, образованные слабыми кислотами и
(или) слабыми основаниями. Соли, образованные сильными кислотами и сильными
основаниями, гидролизу не подвергаются.
В результате гидролиза солей
образуется либо кислота (кислая соль) и основание, либо основание (основная
соль) и кислота. Следовательно, процесс гидролиза соли можно рассматривать как
процесс, обратный реакции нейтрализации. Так как реакции нейтрализации обычно
идут практически до конца (практически необратимо), то равновесие реакции
гидролиза смещено в сторону реагирующих веществ. Концентрация продуктов
гидролиза соли, как правило, мала.
1.1. Гидролиз
солей, образованных сильным основанием и слабой кислотой.
Гидролиз ацетата натрия CH3COONa.
В водном растворе:
CH3COONa CH3COO– +
Na+
H2O
H+ + OH–
Ионы CH3COO– и
H+ связываются, образуя слабую малодиссоциированную уксусную кислоту
и вызывая смещение равновесия диссоциации воды вправо, в сторону увеличения
концентрации OH–.
Уравнение реакции гидролиза ацетата
натрия:
![]() CH3COONa +H2O CH3COOH
CH3COONa +H2O CH3COOH
+ NaOH
в ионной форме:
![]() CH3COO–
CH3COO–
+ Na+ + H2O CH3COOH + Na+
+OH–,
![]() CH3COO– + H2O
CH3COO– + H2O
CH3COOH + OH–,
Реакция среды при гидролизе соли,
образованной сильным основанием и слабой кислотой – щелочная (pH>7).
Гидролиз
фосфата калия K3PO4.
Эта соль образована сильным основанием и трехосновной
слабой кислотой. Гидролиз солей, образованных многоосновными слабыми кислотами,
проходит ступенчато:
I ступень: ![]() K3PO4+
K3PO4+
H2O K2HPO4 + KOH![]()
![]() K3PO4 3K+
K3PO4 3K+
+ PO43–
= НРО42-
![]() H2O OH– + H+
H2O OH– + H+
PO43– + H2O
HPO42– +OH–,
II ступень: K2HPO4+
H2O KH2PO4 + KOH
![]() K2HPO4 2K+
K2HPO4 2K+
+ HPO4–
= H2PO4–
![]() H2O OH– + H+
H2O OH– + H+
![]() H2PO42–
H2PO42–
+ H2O H2PO4– +OH–,
III ступень:
![]() KH2PO4+
KH2PO4+
H2O H3PO4 + KOH
![]() KH2PO4 K+
KH2PO4 K+
+ H2PO4–
= H3PO4
![]() H2O OH– + H+
H2O OH– + H+
![]() H2PO4–
H2PO4–
+ H2O H3PO4 +OH–,
Наиболее полно гидролиз протекает по
I ступени и практически не протекает по второй и третьей.
Так как равновесие реакции гидролиза
сильно смещено в сторону реагирующих веществ, то в растворе при обычных
условиях обнаруживаются лишь продукты гидролиза по I ступени. Лишь при
условиях, особо благоприятствующих гидролизу, можно обнаружить продукты II и
III ступеней гидролиза.
1.2. Гидролиз солей,
образованных слабым основанием и сильной кислотой.
Гидролиз нитрата аммония NH4NO3.
Нитрат аммония диссоциирует на ионы
NO3– и ионы NH4+. Ионы NH4+
связывают ионы OH– воды, вызывая смещение равновесия диссоциации
воды в сторону увеличения концентрации H+ – ионов в растворе.
![]()
![]() NH4NO3
NH4NO3
NO3— + NH4+
= NH4OH
![]() H2O H+ + OH–
H2O H+ + OH–
Уравнение гидролиза
в молекулярной форме:
![]()
![]() NH4NO3 + H2O
NH4NO3 + H2O
NH4OH + HNO3;
В ионной форме:
NH4++
NO3– + H2O NH4OH + H+
+ NO3–
![]() NH4+ + H2O NH4OH
NH4+ + H2O NH4OH
+ H+
Реакция среды при гидролизе соли,
образованной слабым основанием и сильной кислотой, – кислая ( рН<7).
Гидролиз сульфата цинка ZnSO4.
Сульфат цинка образован сильной
кислотой и слабым двухкислотным основанием. Гидролиз этой соли может протекать
по 2 ступеням, хотя при обычных условиях практически ограничивается лишь I
ступенью.
I ступень:
![]() 2ZnSO4 + 2H2O
2ZnSO4 + 2H2O
(ZnOH)2SO4 + H2SO4![]()
![]() ZnSO4 SO42–
ZnSO4 SO42–
+ Zn2+
= ZnOH+
![]() H2O H+
H2O H+
+ OH–
![]() Zn2+ +H2O
Zn2+ +H2O
ZnOH+ + H+
II ступень:
![]() (ZnOH)2SO4 + 2H2O
(ZnOH)2SO4 + 2H2O
2Zn(OH)2 + H2SO4
![]() (ZnOH)2SO4 SO42–
(ZnOH)2SO4 SO42–
+ 2 ZnOH+
= Zn(OH)2
![]() H2O H+
H2O H+
+ OH–
![]() ZnOH+
ZnOH+
+ H2O Zn(OH)2 + H+
Реакция среды кислая (рН<7).
1.3 Степень
гидролиза.
Количественно процесс гидролиза можно
характеризовать степенью гидролиза h (%).
h (%) = число
гидролизованных молекул соли ∙ 100
общее число растворенных молекул соли
Степень
гидролиза зависит от химической природы, образующейся при гидролизе кислоты
(основания) при прочих равных условиях.
Например,
одномолярные растворы ацетата натрия и цианида натрия при 22°С гидролизованы
соответственно следующим образом:
CH3COONa ~ на
0,003% (Кдис.CH3COOH =1.8∙10-5)
NaCN ~ на 5%
(Кдис.HCN =7.9∙10-10)
1.4 Факторы,
влияющие на степень гидролиза соли
Основные
факторы, влияющие на степень гидролиза соли: природа соли, концентрация соли,
температура, добавление кислоты, щелочи или других солей.
Влияние природы
соли на степень ее гидролиза определяется тем, что чем более слабым
электролитом (основанием или кислотой) образована данная соль, тем в большей
степени она подвержена гидролизу.
По мере
уменьшения концентрации соли ее гидролиз усиливается, так как гидролиз соли
лимитирован ничтожным количеством H+ и OH–-ионов,
образующихся при диссоциации воды. Чем больше ионов воды приходится на долю
ионов соли, тем полнее идет гидролиз.
С увеличением
температуры диссоциация воды несколько возрастает, что благоприятствует
протеканию гидролиза.
Влияние
добавления в раствор соли кислоты, основания или другой соли можно определить
исходя из принципа Ле-Шателье. В том случае, когда добавляемые электролиты
связывают продукты гидролиза соли, гидролиз соли усиливается. Если же
добавляемый электролит увеличивает концентрацию продуктов гидролиза или
связывает исходные вещества, то гидролиз соли уменьшается.
Например:
CH3COONa +H2O CH3COOH + NaOH
![]() CH3COO– + H2O CH3COOH +OH–
CH3COO– + H2O CH3COOH +OH–
Прибавление к
этому раствору щелочи, т.е. ионов OH–, или другой соли, образованной
слабой кислотой и сильным основанием смещает равновесие гидролиза в сторону
реагирующих веществ, а добавление кислоты, т.е. ионов H+, или соли,
образованной сильной кислотой и слабым основанием смещает равновесие гидролиза
в сторону продуктов реакции.
Пример
взаимодействия растворов двух солей, взаимно усиливающих гидролиз друг друга.
В растворах карбоната
натрия Na2CO3 и сульфата алюминия Al2(SO4)3,
взятых порознь устанавливаются равновесия:
CO32–
+ H2O HCO3– + OH–
![]() Al3+ + H2O AlOH2++
Al3+ + H2O AlOH2++
H+
и гидролиз этих солей ограничивается
практически первой ступенью. Если смещать растворы этих солей, то ионы H+
и OH– уходят из сферы реакции в виде малодиссоциирующей воды, что
смещает оба равновесия вправо и активизирует последующие ступени гидролиза, что
приводит к образованию осадка Al(OH)3 и газа CO2.
Al2(SO4)3+
3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑
+ 3Na2SO4
2Al3+ + 3CO32–
+ 3H2O → 2Al(OH)3↓ + 3CO2↑.
Химические
свойства солей
Химические свойства солей
определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с
кислотами с образованием новой соли и
новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была
более сильная, чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 →
Na2SO4 + 2HCl↑.
2Na+ + 2H+ → 2HCl↑.
Каждый предыдущий металл в ряду
напряжений вытесняет последующий за ним из раствора его соли.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Основные соли при действии
кислот переходят в средние:
FeOHCl + HCl → FeCl2 + H2O.
3. Взаимодействуют с основаниями, образуя новую соль и новое
основание:
Ba(OH)2 + Mg SO4 →
BaSO4↓ + Mg(OH)2.
Ba2++ SO42- → BaSO4↓
4. Взаимодействуют друг с
другом с образованием новых солей:
NaCl + AgNO3 → AgCl↓ + NaNO3 .
Ag + + NO3— →
AgCl↓
5. Взаимодействуют с
металлами, которые стоят в раду
активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 +
Cu↓
Fe + Cu2+ → Fe2+ +
Cu↓.
6. Взаимодействуют с кислотными
оксидами:
Na2CO3 + SiO2 ![]() СО2 +
СО2 +
Na2SiO3
Экспериментальная часть.
Порядок выполнения работы
Опыт 1. Различные случаи гидролиза солей.
Задание 1. Испытайте с помощью индикаторов растворы выданных
солей, запишите схемы гидролиза, сделайте выводы о характере среды.
Взять четыре пробирки.
В первую пробирку налить 1 мл
раствора хлорида калия KCl, во вторую – 1 мл раствора хлорида меди (II) CuCl2,
в третью – 1 мл раствора карбоната натрия K2CO3, в
четвертую –1 мл воды.
Затем по капле испытуемых растворов нанесите
на отдельные полоски универсальной индикаторной бумаги и, по прилагаемой на
упаковке индикаторной бумаги цветной шкале, определите величину рН раствора,
пользуясь данными таблицы 1.
Окраска
универсального индикатора
в зависимости
от значения рН раствора
Таблица 1.
| рН | Окраска |
| 2 3 4 5 6 7 8 9 10 | розовая красно-оранжевая оранжевая желто-оранжевая желтая желто-зеленая зеленая сине-зеленая фиолетовая |
Результаты испытаний оформите в виде таблицы
2.
Таблица 2
| Испытуемый раствор | Окраска | Реакция среды | Величина по бумаге | ||
| фенолфталеин | | ||||
| Хлорид калия | |||||
| Хлорид меди | |||||
| Карбонат калия | |||||
| Вода |
Изменение
окраски индикаторов в зависимости от реакции среды
Таблица 3
Индикатор | Окраска в среде | ||
| Кислая | Нейтральная | Щелочная | |
Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | красный | оранжевый | желтый |
| Лакмус | красный | фиолетовый | синий |
Таблица 4
рН | Концентрация, | Среда | |
| | ионов | гидроксид | |
< | > | < | Кислая |
= | = | =10 | Нейтральная |
> | < | > | Щелочная |
Сделать выводы. Составить уравнения реакций
гидролиза в молекулярной и ионной форме.
Требования к отчету.
Отчет должен содержать цель работы, краткое
описание хода работы и наблюдаемых явлений, уравнения реакций гидролиза в
молекулярной и ионно-молекулярной формах с названием продуктов реакций и
выводы, включающие ответы на три первых пункта контрольных вопросов.
Контрольные вопросы и задания.
1. Что такое гидролиз солей? Дайте
определение.
2. Какие соли подвергаются гидролизу?
Приведите примеры.
3. Какие факторы влияют на гидролиз солей и
почему?
Запишите в тетради следующие выводы.
1.
Если соль образована
сильным основанием и слабой кислотой, то реакция среды …………….. .
2. Если соль образована сильной кислотой и слабым
основанием, то реакция среды …………….. .
3.
Если соль образована
сильной кислотой и сильным основанием, то реакция среды …………. .
Задание 2. Провести химические реакции, характерные для солей (3
реакции). Написать уравнения реакций.
1) взаимодействие раствора сульфата меди (2) с
железным гвоздем;
2) взаимодействие раствора сульфата меди (2) с
раствором гидроксида натрия;
3) взаимодействие раствора карбоната натрия с соляной
кислотой.
Список литературы:
Ерохин Ю.М. Химия: учеб. для студ.
учреждений сред. проф. образования / Ю.М. Ерохин.- М.: Академия,2014.
Подборка по базе: Практическая работа по Бизнес — комуникации.docx, Курсовая работа Порядок хранения денег и денежных документов в к, Лабораторная работа № 7.docx, практическая работа 1 Бородкин Р.В.rtf, Лабораторная работа 4.docx, Практическая работа Бизнес-комму никации.docx, Курсовая работа 2022.doc, Домашняя работа 7.doc, Самостоятельная работа по теме 2.9.docx, Самостоятельная работа по теме 2.8.docx
ЛАБОРАТОРНАЯ РАБОТА № 1.
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ. РАСТВОРЫ
ЭЛЕКТРОЛИТОВ. ГИДРОКСИДЫ (ОСНОВНЫЕ, АМФОТЕРНЫЕ,
КИСЛОТНЫЕ)
Опыт. Получение гидроксидов никеля (II), цинка и кремния.
Исследование их кислотно основных свойств. Ход работы:
− В двух пробирках получить гидроксид никеля (ΙΙ). Для этого налить в каждую из них 1 мл раствора соли никеля (NiSO4) и добавить по каплям раствор щелочи (NaOH) до образования осадка.
− В одну из пробирок с осадком гидроксида никеля (ΙΙ) добавить избыток раствора серной кислоты (H2SO4), в другую – избыток 10–40-процентного раствора гидроксида натрия (NaOH).
− В двух других пробирках аналогичным способом получить гидроксид цинка.
− В одну из пробирок с осадком гидроксида цинка добавить избыток раствора серной кислоты (H2SO4), в другую – избыток 10–40-процентного раствора гидроксида натрия (NaOH).
− В двух пробирках получить гидроксид кремния. Для этого налить в каждую по 1 мл раствора силиката натрия и добавить раствор соляной кислоты до образования гелеобразного осадка. Затем в одну пробирку прибавить избыток соляной кислоты, а в другую – избыток 10–40процентного раствора гидроксида натрия.
Результаты и наблюдения
Обработка результатов и выводы:
| Вещество | Отношение к кислоте (растворяется, не растворятся) | Отношение к щелочи (растворяется, не растворяется) | Кислотноосновный характер (основный, кислотный, амфотерный) |
| Ni(OH)2 | растворяется | Не растворяется | основный |
| Zn(OH)2 | растворяется | растворяется | амфотерный |
| H2SiO3 | Не растворимая | растворяется | кислотный |
− Уравнения реакций получения гидроксидов в молекулярном и ионном виде. Нерастворимые вещества отметить (↓). Указать цвет осадка.
NiSO4 + 2NaOH = Na2SO4 + Ni(OH)2
Ni2+ +2OH— =Ni(OH)2↓ выпадает осадок синего цвета
ZnSO4 + 2NaOH= Na2SO4 + Zn(OH)2
Zn2+ + 2OH= Zn(OH)2 ↓ выпадает белый студенистый осадок
Na2SiO3 + HCl = 2NaCl + H2SiO3 ↓
SiO32- + 2H+ = HSiO3↓ кремниевая кислота приобретает желтоватую окраску
− Уравнения наблюдаемых реакций взаимодействия полученных гидроксидов с растворами кислот и щелочи (в молекулярном и ионном виде):
Ni(OH)2 + H2SO4 = NiSO4 + H2O
Ni(OH)2 + 2H+ = Ni2- + H2O
Ni(OH)2 + NaOH = не взаимодействует
Zn(OH)2 + H2SO4 =ZnSO4 + H2O
Zn(OH)2 + 2H+ = Zn2+ + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
Zn2+ +4OH- = [Zn(OH)4]2-
H2SiO3 + H2SO4 = не взаимодействует
H2SiO3 + 2NaOH = Na2SiO3 + H2O
H2SiO3 + 2OH- = SiO3 2- + H2O
Выводы
− Нерастворимые гидроксиды получают смешением с щелочными растворами.
Гидроксид никеля (II) проявляет основные свойства.
гидроксид цинка – проявляет как основные, так и кислотные свойства; гидроксид кремния – проявляет слабые свойства кислот.
ЛАБОРАТОРНАЯ РАБОТА № 2. ГИДРОЛИЗ СОЛЕЙ
Опыт 1. Реакция среды в растворах различных солей Ход работы:
В пробирки поместить растворы солей Na3PO4, Al2(SO4)3, KNO3. Перемешать стеклянной палочкой. Опустить в каждую индикаторную бумажку и отметить изменение ее цвета. Результаты опыта внести в таблицу
| Вещество | Цвет индикатора | рН | среда |
| Na3PO4 | >7 | щелочная | |
| Al2(SO4)3 | <7 | кислая | |
| KNO3 | =7 | нейтральная |
− Уравнения реакций гидролиза (в молекулярном и ионном виде) по 1-й ступени:
- KNO3 + H2O
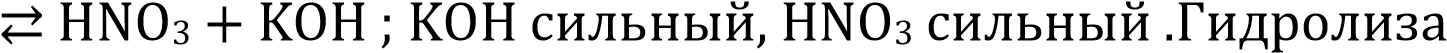
не будет т.к не образуется слабый эле
H+ + OH—+ H2O
- Na3PO4 + H2O
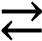 Na2HPO4 + NaOH
Na2HPO4 + NaOH
PO43 + HOH ⇄ (HPO4)2- + OH—
- Al2(SO4)3 + H2O
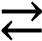 2AlOHSO4 + H2SO4
2AlOHSO4 + H2SO4
Al3+ + HOH ⇄ AlOH2+ + H+
Выводы
Гидролиз идет по иону слабого электролита. рН раствора определяет ион сильного электролита.
Опыт 2. Необратимый (совместный) гидролиз солей
Ход работы. В 2 пробирки поместить 1–2 мл раствора сульфата алюминия. В одну добавить такое же количество раствора карбоната натрия, в другую – сульфида натрия.
Результаты опыта. В обеих пробирках наблюдается выпадение в осадок гидроксида алюминия, в первой выделение углекислого газа (по пузырькам), во второй – сероводорода (по запаху).
Уравнения реакций в молекулярном и ионном виде:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 ↓ + 3Na2SO4 + 3CO2 |
2Al3+ + 3CO32 + 3H2O+ 3CO2 + 2Al(OH)3↓
Al2(SO4)3 + 3Na2S +6H2O =3Na2SO4 + 2Al(OH)3↓ + 3H2S |
2Al3+ + 3S2- + 6H2O+ 2Al(OH)3↓ + 3H2S
Выводы
В результате одновременного присутствия катионов слабого основания и анионов слабой кислоты гидролиз протекает одновременно и по катиону, и по аниону практически необратимо. Подтверждением совместного гидролиза является образование:
а) летучих продуктов (кислота)
б) нерастворимого основания
ЛАБОРАТОРНАЯ РАБОТА № 5.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Опыт 1. Соединения серы (+IV) в окислительно-восстановительных реакциях Ход работы:
В пробирки с раствором дихромата калия (№ 1) и раствором сульфида натрия (№ 2) внести по 1 мл 2 н. раствора серной кислоты и по 3 микрошпателя сульфита натрия.
Результаты и наблюдения
Изменение окраски раствора в пробирках
№ 1 оранжевый →зелёный
№ 2 выделение серобелого осадка
Уравнения реакций (электронно-ионная схема, ионное и молекулярное уравнения):
1) K2Cr2+6O7 + H2SO4 + Na2S+4O3 → Cr3+, S+6O42–
1 | Cr2O72– + 14H+ + 6ē = 2Cr3+ + 7H2O – процесс восстановления
3 | SO32– + H2O – 2ē = SO42– +2H+ – процесс окисления
Cr2O72– + 14H+ + 3SO32– + 3H2O = 2Cr3+ + 7H2O + 3SO42– +6H+
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
2) Na2S-2 + H2SO4 + Na2S+4O3 → S0
| 2 | S2– – 2ē = S0 | – процесс окисления | |
| 1 | SO32– + 6H+ + 4ē = S0 + 3H2O | – процесс восстановления |
2S2– + SO32– + 6H+ = 2S + S + 3H2O
2Na2S + Na2S+4O3 + 3H2SO4 = 3S + 3H2O + 3Na2SO4
Выводы
− В реакции взаимодействия сульфита натрия с дихроматом калия ион
SO32– является восстановителем.
− В реакции взаимодействия сульфита натрия с сульфидом натрия ион SO3 2– является окислителем.
− Таким образом, SO32–— ион может проявлять и окислительные, так и восстановительные свойства, так как сера находится в промежуточной степени окисления.
− Укажите значения высшей и низшей степени окисления серы: +6 и –2.
Опыт 2. Влияние рН среды на окислительные свойства перманганата калия Ход работы:
В три пробирки внести по 1 мл раствора KMnO4. В первую пробирку добавить 1 мл 2 н. раствора H2SO4, во вторую – столько же воды и в третью – 1 мл раствора NaOH. Во все пробирки внести по два микрошпателя кристаллического KNO2. Отметить изменение окраски.
Результаты и наблюдения
Изменение окраски растворов в пробирках:
№ 1 (H2SO4) обесцвечивание
№ 2 (Н2О) бурый осадок
№ 3 (NaOH) зеленый раствор
Уравнения реакций (электронно-ионная схема, ионное и молекулярное уравнения):
Среда кислая
KMn+7O4 + H2SO4 + KN+3O2 → Mn2+, N+5O3–
2 | MnO4– + 8H+ + 5ē = Mn2+ + 4H2O – процесс восстановления
5 | NO2– + H2O – 2ē = NO3– + 2H+ – процесс окисления
2MnO4– + 16H+ + 5NO2– + 5H2O = 2Mn2+ + 8H2O + 5NO3– + 10H+
2MnO4– + 6H+ + 5NO2– = 2Mn2+ + 3H2O + 5NO3–
2KMnO4 + 3H2SO4 + 5KNO2 = 2MnSO4 + K2SO4 + 3H2O + 5KNO3
Среда нейтральная
KMn+7O4 + Н2О + KN+3O2 → Mn+4O2↓, N+5O3–
- | MnO4– + 2H2O + 3ē = MnO2 + 4OH– – процесс восстановления
- | NO2– + H2O – 2ē = NO3– + 2H+ – процесс окисления
2MnO4– + 4H2O + 3NO2– + 3H2O = 2MnO2 + 8OH– + 3NO3– + 6H+
2KMnO4 + 3KNO2 + H2O = 2MnO2 + 2KOH + 3KNO3
Средащелочная
KMn+7O4 + NaOH + KN+3O2 → Mn+6O42–, N+5O3–
2 | MnO4– + 1ē = MnO42– – процесс восстановления
1 | NO2– + 2OH– – 2ē = NO3– + H2O – процесс окисления
2MnO4– + NO2– + 2OH– = 2MnO42– + NO3– + H2O
2KMnO4 + KNO2 + 2NaOH = Na2MnO4 + KNO3 + K2MnO4 + H2O
Выводы
Марганец в ходе этих реакций проявляет окислительные свойства, так как в ионе MnO4– находится в высшей степени окисления.
Перманганат калия проявляет более сильные окислительные свойства кислой среде.
Лабораторная работа по химии.
Тема: Испытание растворов неорганических соединений индикаторами. Гидролиз солей различного типа.
Цель работы: изучить свойства сложных неорганических веществ
Приборы и реактивы:
• пробирки, штативы.
• Растворы: HCl, NaOH, K2CO3
• неорганические вещества: ZnCl2, Na2S, MgCO3, NaNO3
• универсальные индикаторы.
Теоретическая часть
Гидролиз – это процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. Все соли можно разделить на 4 группы:
1. Соль, образованная сильным основанием и сильной кислотой (К2SО4, NaNO3,) – гидролиз не идет, среда нейтральная рН = 7 .
2. Соль, образованная слабым основанием и слабой кислотой (MgСО3, Al2S3, Zn(NO2) 2) — гидролиз протекает практически в нейтральной среде рН ближе к 7, гидролиз идет по катиону и аниону.
3. Соль, образованная сильным основанием и слабой кислотой (например: Na2СО3, К2S, Ва(NO2) 2, СН3СООLi ) -гидролиз протекает в щелочной среде рН 7 , гидролиз идет по аниону.
4. Соль, образованная слабым основанием и сильной кислотой (MgSО4, AlCl3, Zn(NO3)2) — гидролиз протекает в кислой среде рН
Глубина гидролиза зависит от температуры (чаще всего ее приходится повышать) и концентрации раствора (при разбавлении раствора гидролиз усиливается). Если продукты гидролиза летучи, или нерастворимы, то он необратим.
Ход работы
Опыт № 1. В одну пробирку налейте 3-4 мл соляной кислоты, во вторую – столько же раствора гидроксида натрия, в третью – карбоната калия.
При помощи универсального индикатора определите состав каждой пробирки.
1 пробирка ____________________________________
Цвет индикатора________________________________
2 пробирка ____________________________________
Цвет индикатора________________________________
3 пробирка ____________________________________
Цвет индикатора________________________________
Опыт № 2. Гидролиз соли по катиону. В пробирку насыпать 1 г хлорида цинка, растворить в воде и опустить в полученный раствор полоску универсального индикатора.
Наблюдения __________________________________________________
Запишите уравнение гидролиза соли:
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт № 3. Гидролиз соли по аниону. В пробирку насыпать 1 г сульфида натрия, растворить в воде и опустить в полученный раствор полоску универсального индикатора.
Наблюдения __________________________________________________
Запишите уравнение гидролиза соли:
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт № 4. Гидролиз соли по катиону и аниону. В пробирку насыпать 1 г карбоната магния, растворить в воде и опустить в полученный раствор полоску универсального индикатора.
Наблюдения __________________________________________________
Запишите уравнение гидролиза соли:
________________________________________________________________
________________________________________________________________
________________________________________________________________
Опыт № 5. Гидролиз соли не идет. В пробирку насыпать 1 г нитрата натрия, растворить в воде и опустить в полученный раствор полоску универсального индикатора.
Наблюдения __________________________________________________
Запишите уравнение гидролиза соли:
________________________________________________________________
________________________________________________________________
________________________________________________________________
Общий вывод
________________________________________________________________
________________________________________________________________
________________________________________________________________
