| ||
| Names | ||
|---|---|---|
| Preferred IUPAC name Propan-2-ol[2] | ||
| Other names 2-Propanol | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| Beilstein Reference | 635639 | |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| ECHA InfoCard | 100.000.601 | |
| Gmelin Reference | 1464 | |
| KEGG |
| |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| UN number | 1219 | |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | (CH3)2CHOH | |
| Molar mass | 60.096 g/mol | |
| Appearance | Colorless liquid | |
| Odor | Pungent alcoholic odor | |
| Density | 0.786 g/cm3 (20 °C) | |
| Melting point | −89 °C (−128 °F; 184 K) | |
| Boiling point | 82.6 °C (180.7 °F; 355.8 K) | |
| Solubility in water | Miscible with water | |
| Solubility | Miscible with benzene, chloroform, ethanol, diethyl ether, glycerol; soluble in acetone | |
| log P | −0.16[3] | |
| Acidity (pKa) | 16.5[4] | |
| Magnetic susceptibility (χ) | −45.794·10−6 cm3/mol | |
| Refractive index (nD) | 1.3776 | |
| Viscosity | 2.86 cP at 15 °C 1.96 cP at 25 °C[5] 1.77 cP at 30 °C[5] | |
| Dipole moment | 1.66 D (gas) | |
| Pharmacology | ||
| ATC code | D08AX05 (WHO) | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
| Main hazards | Flammable, mildly toxic[6] | |
| GHS labelling: | ||
| Pictograms | ||
| Signal word | Danger | |
| Hazard statements | H225, H302, H319, H336 | |
| Precautionary statements | P210, P261, P305+P351+P338 | |
| NFPA 704 (fire diamond) |
1 3 0 | |
| Flash point | Open cup: 11.7 °C (53.1 °F; 284.8 K) Closed cup: 13 °C (55 °F) | |
| Autoignition | 399 °C (750 °F; 672 K) | |
| Explosive limits | 2–12.7% | |
| Threshold limit value (TLV) | 980 mg/m3 (TWA), 1225 mg/m3 (STEL) | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) |
| |
| LC50 (median concentration) |
| |
| LCLo (lowest published) |
| |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 400 ppm (980 mg/m3)[7] | |
| REL (Recommended) | TWA 400 ppm (980 mg/m3), ST 500 ppm (1225 mg/m3)[7] | |
| IDLH (Immediate danger) | 2000 ppm[7] | |
| Safety data sheet (SDS) | [1] | |
| Related compounds | ||
| Related alcohols | 1-Propanol, ethanol, 2-butanol | |
| Supplementary data page | ||
| Isopropyl alcohol (data page) | ||
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
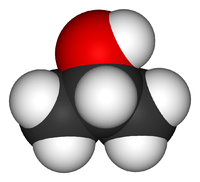
Isopropyl alcohol (IUPAC name propan-2-ol and also called isopropanol or 2-propanol) is a colorless, flammable organic compound with a pungent alcoholic odor.[9] As an isopropyl group linked to a hydroxyl group (chemical formula (CH3)2CHOH) it is the simplest example of a secondary alcohol, where the alcohol carbon atom is attached to two other carbon atoms. It is a structural isomer of propan-1-ol and ethyl methyl ether.
It is used in the manufacture of a wide variety of industrial and household chemicals and is a common ingredient in products such as antiseptics, disinfectants, hand sanitizer and detergents. Well over one million tonnes is produced worldwide annually.
Properties[edit]
Isopropyl alcohol is miscible in water, ethanol, and chloroform as, like these compounds, isopropyl is a polar molecule. It dissolves ethyl cellulose, polyvinyl butyral, many oils, alkaloids, and natural resins.[10] Unlike ethanol or methanol, isopropyl alcohol is not miscible with salt solutions and can be separated from aqueous solutions by adding a salt such as sodium chloride. The process is colloquially called salting out, and causes concentrated isopropyl alcohol to separate into a distinct layer.[11]
Isopropyl alcohol forms an azeotrope with water, which gives a boiling point of 80.37 °C (176.67 °F) and a composition of 87.7% by mass (91% by volume) isopropyl alcohol. Alcohol mixtures have depressed melting points.[11] It has a slightly bitter taste, and is not safe to drink.[11][12]
Isopropyl alcohol becomes increasingly viscous with decreasing temperature and freezes at −89 °C (−128 °F).
Isopropyl alcohol has a maximal absorbance at 205 nm in an ultraviolet-visible spectrum.[13][14]
Reactions[edit]
Isopropyl alcohol can be oxidized to acetone, which is the corresponding ketone. This can be achieved using oxidizing agents such as chromic acid, or by dehydrogenation of isopropyl alcohol over a heated copper catalyst:
- (CH3)2CHOH → (CH3)2CO + H2
Isopropyl alcohol is often used as both solvent and hydride source in the Meerwein-Ponndorf-Verley reduction and other transfer hydrogenation reactions. Isopropyl alcohol may be converted to 2-bromopropane using phosphorus tribromide, or dehydrated to propene by heating with sulfuric acid.
Like most alcohols, isopropyl alcohol reacts with active metals such as potassium to form alkoxides that are called isopropoxides. With titanium tetrachloride, isopropyl alcohol reacts to give titanium isopropoxide:
- TiCl4 + 4 (CH3)2CHOH → Ti(OCH(CH3)2)4 + 4 HCl
This and similar reactions are often conducted in the presence of base.
The reaction with aluminium is initiated by a trace of mercury to give aluminium isopropoxide.[15]
History[edit]
In 1920, Standard Oil first produced isopropyl alcohol by hydrating propene. Isopropyl alcohol was oxidized to acetone for the preparation of cordite, a smokeless, low explosive propellant.[16]
Production[edit]
In 1994, 1.5 million tonnes of isopropyl alcohol were produced in the United States, Europe, and Japan.[17]
It is primarily produced by combining water and propene in a hydration reaction or by hydrogenating acetone.[17][18]
There are two routes for the hydration process and both processes require that the isopropyl alcohol be separated from water and other by-products by distillation. Isopropyl alcohol and water form an azeotrope, and simple distillation gives a material that is 87.9% by mass isopropyl alcohol and 12.1% by mass water.[19] Pure (anhydrous) isopropyl alcohol is made by azeotropic distillation of the wet isopropyl alcohol using either diisopropyl ether or cyclohexane as azeotroping agents.[17]
Biological[edit]
Small amounts of isopropyl alcohol are produced in the body in diabetic ketoacidosis.[20]
Indirect hydration[edit]
Indirect hydration reacts propene with sulfuric acid to form a mixture of sulfate esters. This process can use low-quality propene, and is predominant in the USA. These processes give primarily isopropyl alcohol rather than 1-propanol, because adding water or sulfuric acid to propene follows Markovnikov’s rule. Subsequent hydrolysis of these esters by steam produces isopropyl alcohol, by distillation. Diisopropyl ether is a significant by-product of this process; it is recycled back to the process and hydrolyzed to give the desired product.[17]
- CH3CH=CH2 + H2O H2SO4→ (CH3)2CHOH
Direct hydration[edit]
Direct hydration reacts propene and water, either in gas or liquid phase, at high pressures in the presence of solid or supported acidic catalysts. This type of process usually requires higher-purity propylene (> 90%).[17] Direct hydration is more commonly used in Europe.
Hydrogenation of acetone[edit]
Isopropyl alcohol can be prepared via the hydrogenation of acetone; however, this approach involves an extra step compared to the above methods, as acetone is itself normally prepared from propene via the cumene process.[17] IPA cost is primarily driven by raw material (acetone or propylene) cost. A known issue is the formation of MIBK and other self-condensation products. Raney nickel was one of the original industrial catalysts, modern catalysts are often supported bimetallic materials.
Uses[edit]

In 1990, 45,000 metric tonnes of isopropyl alcohol were used in the United States, mostly as a solvent for coatings or for industrial processes. In that year, 5400 metric tonnes were used for household purposes and in personal care products. Isopropyl alcohol is popular in particular for pharmaceutical applications,[17] due to its low toxicity. Some isopropyl alcohol is used as a chemical intermediate. Isopropyl alcohol may be converted to acetone, but the cumene process is more significant.[17]
Solvent[edit]
Isopropyl alcohol dissolves a wide range of non-polar compounds. It evaporates quickly and the typically available grades tend to not leave behind oil traces when used as a cleaning fluid unlike some other common solvents. It is also relatively non-toxic. Thus, it is used widely as a solvent and as a cleaning fluid, especially for situations where there can be oils or other oil based residues which would not be easily cleaned with water, conveniently evaporating and (depending on water content, and other potential factors) posing less of a risk of corrosion or rusting than plain water. Together with ethanol, n-butanol, and methanol, it belongs to the group of alcohol solvents.
Isopropyl alcohol is commonly used for cleaning eyeglasses, electrical contacts, audio or video tape heads, DVD and other optical disc lenses, removing thermal paste from heatsinks on CPUs and other IC packages.
Intermediate[edit]
Isopropyl alcohol is esterified to give isopropyl acetate, another solvent. It reacts with carbon disulfide and sodium hydroxide to give sodium isopropylxanthate, a herbicide and an ore flotation reagent.[21] Isopropyl alcohol reacts with titanium tetrachloride and aluminium metal to give titanium and aluminium isopropoxides, respectively, the former a catalyst, and the latter a chemical reagent.[17] This compound may serve as a chemical reagent in itself, by acting as a dihydrogen donor in transfer hydrogenation.
Medical[edit]
Rubbing alcohol, hand sanitizer, and disinfecting pads typically contain a 60–70% solution of isopropyl alcohol or ethanol in water. Water is required to open up membrane pores of bacteria, which acts as a gateway for isopropyl alcohol. A 75% v/v solution in water may be used as a hand sanitizer.[22] Isopropyl alcohol is used as a water-drying aid for the prevention of otitis externa, better known as swimmer’s ear.[23]
Inhaled isopropyl alcohol can be used for treating nausea in some settings by placing a disinfecting pad under the nose.[24]
Early uses as an anesthetic[edit]
Although isopropyl alcohol can be used for anesthesia, its many negative attributes or drawbacks prohibit this use. Isopropyl alcohol can also be used similarly to ether as a solvent[25] or as an anesthetic by inhaling the fumes or orally. Early uses included using the solvent as general anesthetic for small mammals[26] and rodents by scientists and some veterinarians. However, it was soon discontinued, as many complications arose, including respiratory irritation, internal bleeding, and visual and hearing problems. In rare cases, respiratory failure leading to death in animals was observed.
Automotive[edit]
Isopropyl alcohol is a major ingredient in «gas dryer» fuel additives. In significant quantities, water is a problem in fuel tanks, as it separates from gasoline and can freeze in the supply lines at low temperatures. Alcohol does not remove water from gasoline, but the alcohol solubilizes water in gasoline. Once soluble, water does not pose the same risk as insoluble water, as it no longer accumulates in the supply lines and freezes but is dissolved within the fuel itself. Isopropyl alcohol is often sold in aerosol cans as a windshield or door lock deicer. Isopropyl alcohol is also used to remove brake fluid traces from hydraulic braking systems, so that the brake fluid (usually DOT 3, DOT 4, or mineral oil) does not contaminate the brake pads and cause poor braking. Mixtures of isopropyl alcohol and water are also commonly used in homemade windshield washer fluid.
Laboratory[edit]
As a biological specimen preservative, isopropyl alcohol provides a comparatively non-toxic alternative to formaldehyde and other synthetic preservatives. Isopropyl alcohol solutions of 70–99% are used to preserve specimens.
Isopropyl alcohol is often used in DNA extraction. A lab worker adds it to a DNA solution to precipitate the DNA, which then forms a pellet after centrifugation. This is possible because DNA is insoluble in isopropyl alcohol.
Safety[edit]
Isopropyl alcohol vapor is denser than air and is flammable, with a flammability range of between 2 and 12.7% in air. It should be kept away from heat and open flame.[27] Distillation of isopropyl alcohol over magnesium has been reported to form peroxides, which may explode upon concentration.[28][29] Isopropyl alcohol causes eye irritation[27] and is a potential allergen.[30][31] Wearing protective gloves is recommended.
Toxicology[edit]
Isopropyl alcohol, via its metabolites, is somewhat more toxic than ethanol, but considerably less toxic than ethylene glycol or methanol. Death from ingestion or absorption of even relatively large quantities is rare. Both isopropyl alcohol and its metabolite, acetone, act as central nervous system (CNS) depressants.[32] Poisoning can occur from ingestion, inhalation, or skin absorption. Symptoms of isopropyl alcohol poisoning include flushing, headache, dizziness, CNS depression, nausea, vomiting, anesthesia, hypothermia, low blood pressure, shock, respiratory depression, and coma.[32] Overdoses may cause a fruity odor on the breath as a result of its metabolism to acetone.[33]
Isopropyl alcohol does not cause an anion gap acidosis, but it produces an osmolal gap between the calculated and measured osmolalities of serum, as do the other alcohols.[32]
Isopropyl alcohol is oxidized to form acetone by alcohol dehydrogenase in the liver[32] and has a biological half-life in humans between 2.5 and 8.0 hours.[32] Unlike methanol or ethylene glycol poisoning, the metabolites of isopropyl alcohol are considerably less toxic, and treatment is largely supportive. Furthermore, there is no indication for the use of fomepizole, an alcohol dehydrogenase inhibitor, unless co-ingestion with methanol or ethylene glycol is suspected.[34]
In forensic pathology, people who have died as a result of diabetic ketoacidosis usually have blood concentrations of isopropyl alcohol of tens of mg/dL, while those by fatal isopropyl alcohol ingestion usually have blood concentrations of hundreds of mg/dL.[20]
References[edit]
- ^ «Alcohols Rule C-201.1». Nomenclature of Organic Chemistry (The IUPAC ‘Blue Book’), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979.
Designations such as isopropanol, sec-butanol, and tert-butanol are incorrect because there are no hydrocarbons isopropane, sec-butane, and tert-butane to which the suffix «-ol» can be added; such names should be abandoned. Isopropyl alcohol, sec-butyl alcohol, and tert-butyl alcohol are, however, permissible (see Rule C-201.3) because the radicals isopropyl, sec-butyl, and tert-butyl do exist.
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 631. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ «Isopropanol_msds». chemsrc.com. Archived from the original on 2020-03-10. Retrieved 2018-05-04.
- ^ Reeve, W.; Erikson, C. M.; Aluotto, P. F. (1979). «A new method for the determination of the relative acidities of alcohols in alcoholic solutions. The nucleophilicities and competitive reactivities of alkoxides and phenoxides». Can. J. Chem. 57 (20): 2747–2754. doi:10.1139/v79-444.
- ^ a b Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 978-0-07-073401-2.
- ^ Isopropyl alcohol toxicity
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0359». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d «Isopropyl alcohol». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Isopropanol». PubChem. Archived from the original on February 12, 2019. Retrieved February 10, 2019.
- ^ Doolittle, Arthur K. (1954). The Technology of Solvents and Plasticizers. New York: John Wiley & Sons, Inc. p. 628.
- ^ a b c The Merck Index (10th ed.). Rahway, NJ: Merck & Co. 1983. p. 749. ISBN 9780911910278.
- ^ Logsden, John E.; Loke, Richard A. (1999). «Propyl Alcohols». In Jacqueline I. (ed.). Kirk- Concise of Chemical Technology (4th ed.). New York: John Wiley & Sons, Inc. pp. 1654–1656. ISBN 978-0471419617.
- ^ «Isopropyl Alcohol, , Suitable for Liquid Chromatography, Extract/, UV-Spectrophotometry». VWR International. Archived from the original on 31 March 2016. Retrieved 25 August 2014.
- ^ «UV Cutoff» (PDF). University of Toronto. Archived (PDF) from the original on 8 October 2013. Retrieved 25 August 2014.
- ^ Ishihara, K.; Yamamoto, H. (2001). «Aluminum Isopropoxide». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.ra084. ISBN 0471936235.
- ^ Wittcoff, M. M.; Green, H. A. (2003). Organic chemistry principles and industrial practice (1. ed., 1. reprint. ed.). Weinheim: Wiley-VCH. p. 4. ISBN 978-3-527-30289-5.
- ^ a b c d e f g h i Papa, A. J. «Propanols». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_173.
- ^ Logsdon, John E.; Loke, Richard A. (December 4, 2000). «Isopropyl Alcohol». Kirk-Othmer Encyclopedia of Chemical Technology. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0919151612150719.a01. ISBN 978-0471238966.
- ^ CRC Handbook of Chemistry and Physics, 44th ed. pp. 2143–2184.
- ^ a b Petersen, Thomas H.; Williams, Timothy; Nuwayhid, Naziha; Harruff, Richard (2012). «Postmortem Detection of Isopropanol in Ketoacidosis». Journal of Forensic Sciences. 57 (3): 674–678. doi:10.1111/j.1556-4029.2011.02045.x. ISSN 0022-1198. PMID 22268588. S2CID 21101240.
- ^ «Sodium Isopropyl Xanthate, SIPX, Xanthate». 3DChem.com. Archived from the original on 2012-05-04. Retrieved 2012-06-17.
- ^ «Guide to Local Production: WHO-recommended Handrub Formulations» (PDF). World Health Organization. August 2009. Archived (PDF) from the original on 2009-05-19. Retrieved 2020-10-05.
- ^ Otitis Externa (Swimmers Ear). Medical College of Wisconsin.
- ^ Lindblad, Adrienne J.; Ting, Rhonda; Harris, Kevin (August 2018). «Inhaled isopropyl alcohol for nausea and vomiting in the emergency department». Canadian Family Physician. 64 (8): 580. ISSN 1715-5258. PMC 6189884. PMID 30108075.
- ^ Burlage, Henry M.; Welch, H.; Price, C. W. (2006). «Pharmaceutical applications of isopropyl alcohol II. Solubilities of local anesthetics». Journal of the American Pharmaceutical Association. 36 (1): 17–19. doi:10.1002/jps.3030360105. PMID 20285822.
- ^ Society for Experimental Biology and Medicine (1922). Proceedings of the Society for Experimental Biology and Medicine, Volume 19. p. 85. Archived from the original on 2021-12-20. Retrieved 2016-09-24.
- ^ a b «Isopropanol». Sigma-Aldrich. 19 January 2012. Archived from the original on 17 January 2021. Retrieved 6 July 2012.
- ^ Mirafzal, Gholam A.; Baumgarten, Henry E. (1988). «Control of peroxidizable compounds: An addendum». Journal of Chemical Education. 65 (9): A226. Bibcode:1988JChEd..65A.226M. doi:10.1021/ed065pA226.
- ^ «Chemical safety: peroxide formation in 2-propanol». Chemical & Engineering News. 94 (31): 2. August 1, 2016. Archived from the original on November 7, 2017. Retrieved November 2, 2017.
- ^ García-Gavín, Juan; Lissens, Ruth; Timmermans, Ann; Goossens, An (2011-06-17). «Allergic contact dermatitis caused by isopropyl alcohol: a missed allergen?». Contact Dermatitis. 65 (2): 101–106. doi:10.1111/j.1600-0536.2011.01936.x. ISSN 0105-1873. PMID 21679194. S2CID 42577253.
- ^ McInnes, A. (1973-02-10). «Skin reaction to isopropyl alcohol». British Medical Journal. 1 (5849): 357. doi:10.1136/bmj.1.5849.357-c. ISSN 0007-1447. PMC 1588210. PMID 4265463.
- ^ a b c d e Slaughter RJ, Mason RW, Beasley DM, Vale JA, Schep LJ (2014). «Isopropanol poisoning». Clinical Toxicology. 52 (5): 470–8. doi:10.3109/15563650.2014.914527. PMID 24815348. S2CID 30223646.
- ^ Kalapos, M. P. (2003). «On the mammalian acetone metabolism: from chemistry to clinical implications». Biochimica et Biophysica Acta (BBA) — General Subjects. 1621 (2): 122–39. doi:10.1016/S0304-4165(03)00051-5. PMID 12726989.
- ^ «Isopropyl alcohol poisoning». uptodate.com. Archived from the original on 2017-10-10. Retrieved 2017-10-10.
External links[edit]
- CDC – NIOSH Pocket Guide to Chemical Hazards — Isopropyl alcohol
- Environmental Health Criteria 103: 2-Propanol
| ||
| Names | ||
|---|---|---|
| Preferred IUPAC name Propan-2-ol[2] | ||
| Other names 2-Propanol | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| Beilstein Reference | 635639 | |
| ChEBI |
| |
| ChEMBL |
| |
| ChemSpider |
| |
| ECHA InfoCard | 100.000.601 | |
| Gmelin Reference | 1464 | |
| KEGG |
| |
| PubChem CID |
| |
| RTECS number |
| |
| UNII |
| |
| UN number | 1219 | |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | (CH3)2CHOH | |
| Molar mass | 60.096 g/mol | |
| Appearance | Colorless liquid | |
| Odor | Pungent alcoholic odor | |
| Density | 0.786 g/cm3 (20 °C) | |
| Melting point | −89 °C (−128 °F; 184 K) | |
| Boiling point | 82.6 °C (180.7 °F; 355.8 K) | |
| Solubility in water | Miscible with water | |
| Solubility | Miscible with benzene, chloroform, ethanol, diethyl ether, glycerol; soluble in acetone | |
| log P | −0.16[3] | |
| Acidity (pKa) | 16.5[4] | |
| Magnetic susceptibility (χ) | −45.794·10−6 cm3/mol | |
| Refractive index (nD) | 1.3776 | |
| Viscosity | 2.86 cP at 15 °C 1.96 cP at 25 °C[5] 1.77 cP at 30 °C[5] | |
| Dipole moment | 1.66 D (gas) | |
| Pharmacology | ||
| ATC code | D08AX05 (WHO) | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
| Main hazards | Flammable, mildly toxic[6] | |
| GHS labelling: | ||
| Pictograms | ||
| Signal word | Danger | |
| Hazard statements | H225, H302, H319, H336 | |
| Precautionary statements | P210, P261, P305+P351+P338 | |
| NFPA 704 (fire diamond) |
1 3 0 | |
| Flash point | Open cup: 11.7 °C (53.1 °F; 284.8 K) Closed cup: 13 °C (55 °F) | |
| Autoignition | 399 °C (750 °F; 672 K) | |
| Explosive limits | 2–12.7% | |
| Threshold limit value (TLV) | 980 mg/m3 (TWA), 1225 mg/m3 (STEL) | |
| Lethal dose or concentration (LD, LC): | ||
| LD50 (median dose) |
| |
| LC50 (median concentration) |
| |
| LCLo (lowest published) |
| |
| NIOSH (US health exposure limits): | ||
| PEL (Permissible) | TWA 400 ppm (980 mg/m3)[7] | |
| REL (Recommended) | TWA 400 ppm (980 mg/m3), ST 500 ppm (1225 mg/m3)[7] | |
| IDLH (Immediate danger) | 2000 ppm[7] | |
| Safety data sheet (SDS) | [1] | |
| Related compounds | ||
| Related alcohols | 1-Propanol, ethanol, 2-butanol | |
| Supplementary data page | ||
| Isopropyl alcohol (data page) | ||
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Isopropyl alcohol (IUPAC name propan-2-ol and also called isopropanol or 2-propanol) is a colorless, flammable organic compound with a pungent alcoholic odor.[9] As an isopropyl group linked to a hydroxyl group (chemical formula (CH3)2CHOH) it is the simplest example of a secondary alcohol, where the alcohol carbon atom is attached to two other carbon atoms. It is a structural isomer of propan-1-ol and ethyl methyl ether.
It is used in the manufacture of a wide variety of industrial and household chemicals and is a common ingredient in products such as antiseptics, disinfectants, hand sanitizer and detergents. Well over one million tonnes is produced worldwide annually.
Properties[edit]
Isopropyl alcohol is miscible in water, ethanol, and chloroform as, like these compounds, isopropyl is a polar molecule. It dissolves ethyl cellulose, polyvinyl butyral, many oils, alkaloids, and natural resins.[10] Unlike ethanol or methanol, isopropyl alcohol is not miscible with salt solutions and can be separated from aqueous solutions by adding a salt such as sodium chloride. The process is colloquially called salting out, and causes concentrated isopropyl alcohol to separate into a distinct layer.[11]
Isopropyl alcohol forms an azeotrope with water, which gives a boiling point of 80.37 °C (176.67 °F) and a composition of 87.7% by mass (91% by volume) isopropyl alcohol. Alcohol mixtures have depressed melting points.[11] It has a slightly bitter taste, and is not safe to drink.[11][12]
Isopropyl alcohol becomes increasingly viscous with decreasing temperature and freezes at −89 °C (−128 °F).
Isopropyl alcohol has a maximal absorbance at 205 nm in an ultraviolet-visible spectrum.[13][14]
Reactions[edit]
Isopropyl alcohol can be oxidized to acetone, which is the corresponding ketone. This can be achieved using oxidizing agents such as chromic acid, or by dehydrogenation of isopropyl alcohol over a heated copper catalyst:
- (CH3)2CHOH → (CH3)2CO + H2
Isopropyl alcohol is often used as both solvent and hydride source in the Meerwein-Ponndorf-Verley reduction and other transfer hydrogenation reactions. Isopropyl alcohol may be converted to 2-bromopropane using phosphorus tribromide, or dehydrated to propene by heating with sulfuric acid.
Like most alcohols, isopropyl alcohol reacts with active metals such as potassium to form alkoxides that are called isopropoxides. With titanium tetrachloride, isopropyl alcohol reacts to give titanium isopropoxide:
- TiCl4 + 4 (CH3)2CHOH → Ti(OCH(CH3)2)4 + 4 HCl
This and similar reactions are often conducted in the presence of base.
The reaction with aluminium is initiated by a trace of mercury to give aluminium isopropoxide.[15]
History[edit]
In 1920, Standard Oil first produced isopropyl alcohol by hydrating propene. Isopropyl alcohol was oxidized to acetone for the preparation of cordite, a smokeless, low explosive propellant.[16]
Production[edit]
In 1994, 1.5 million tonnes of isopropyl alcohol were produced in the United States, Europe, and Japan.[17]
It is primarily produced by combining water and propene in a hydration reaction or by hydrogenating acetone.[17][18]
There are two routes for the hydration process and both processes require that the isopropyl alcohol be separated from water and other by-products by distillation. Isopropyl alcohol and water form an azeotrope, and simple distillation gives a material that is 87.9% by mass isopropyl alcohol and 12.1% by mass water.[19] Pure (anhydrous) isopropyl alcohol is made by azeotropic distillation of the wet isopropyl alcohol using either diisopropyl ether or cyclohexane as azeotroping agents.[17]
Biological[edit]
Small amounts of isopropyl alcohol are produced in the body in diabetic ketoacidosis.[20]
Indirect hydration[edit]
Indirect hydration reacts propene with sulfuric acid to form a mixture of sulfate esters. This process can use low-quality propene, and is predominant in the USA. These processes give primarily isopropyl alcohol rather than 1-propanol, because adding water or sulfuric acid to propene follows Markovnikov’s rule. Subsequent hydrolysis of these esters by steam produces isopropyl alcohol, by distillation. Diisopropyl ether is a significant by-product of this process; it is recycled back to the process and hydrolyzed to give the desired product.[17]
- CH3CH=CH2 + H2O H2SO4→ (CH3)2CHOH
Direct hydration[edit]
Direct hydration reacts propene and water, either in gas or liquid phase, at high pressures in the presence of solid or supported acidic catalysts. This type of process usually requires higher-purity propylene (> 90%).[17] Direct hydration is more commonly used in Europe.
Hydrogenation of acetone[edit]
Isopropyl alcohol can be prepared via the hydrogenation of acetone; however, this approach involves an extra step compared to the above methods, as acetone is itself normally prepared from propene via the cumene process.[17] IPA cost is primarily driven by raw material (acetone or propylene) cost. A known issue is the formation of MIBK and other self-condensation products. Raney nickel was one of the original industrial catalysts, modern catalysts are often supported bimetallic materials.
Uses[edit]

In 1990, 45,000 metric tonnes of isopropyl alcohol were used in the United States, mostly as a solvent for coatings or for industrial processes. In that year, 5400 metric tonnes were used for household purposes and in personal care products. Isopropyl alcohol is popular in particular for pharmaceutical applications,[17] due to its low toxicity. Some isopropyl alcohol is used as a chemical intermediate. Isopropyl alcohol may be converted to acetone, but the cumene process is more significant.[17]
Solvent[edit]
Isopropyl alcohol dissolves a wide range of non-polar compounds. It evaporates quickly and the typically available grades tend to not leave behind oil traces when used as a cleaning fluid unlike some other common solvents. It is also relatively non-toxic. Thus, it is used widely as a solvent and as a cleaning fluid, especially for situations where there can be oils or other oil based residues which would not be easily cleaned with water, conveniently evaporating and (depending on water content, and other potential factors) posing less of a risk of corrosion or rusting than plain water. Together with ethanol, n-butanol, and methanol, it belongs to the group of alcohol solvents.
Isopropyl alcohol is commonly used for cleaning eyeglasses, electrical contacts, audio or video tape heads, DVD and other optical disc lenses, removing thermal paste from heatsinks on CPUs and other IC packages.
Intermediate[edit]
Isopropyl alcohol is esterified to give isopropyl acetate, another solvent. It reacts with carbon disulfide and sodium hydroxide to give sodium isopropylxanthate, a herbicide and an ore flotation reagent.[21] Isopropyl alcohol reacts with titanium tetrachloride and aluminium metal to give titanium and aluminium isopropoxides, respectively, the former a catalyst, and the latter a chemical reagent.[17] This compound may serve as a chemical reagent in itself, by acting as a dihydrogen donor in transfer hydrogenation.
Medical[edit]
Rubbing alcohol, hand sanitizer, and disinfecting pads typically contain a 60–70% solution of isopropyl alcohol or ethanol in water. Water is required to open up membrane pores of bacteria, which acts as a gateway for isopropyl alcohol. A 75% v/v solution in water may be used as a hand sanitizer.[22] Isopropyl alcohol is used as a water-drying aid for the prevention of otitis externa, better known as swimmer’s ear.[23]
Inhaled isopropyl alcohol can be used for treating nausea in some settings by placing a disinfecting pad under the nose.[24]
Early uses as an anesthetic[edit]
Although isopropyl alcohol can be used for anesthesia, its many negative attributes or drawbacks prohibit this use. Isopropyl alcohol can also be used similarly to ether as a solvent[25] or as an anesthetic by inhaling the fumes or orally. Early uses included using the solvent as general anesthetic for small mammals[26] and rodents by scientists and some veterinarians. However, it was soon discontinued, as many complications arose, including respiratory irritation, internal bleeding, and visual and hearing problems. In rare cases, respiratory failure leading to death in animals was observed.
Automotive[edit]
Isopropyl alcohol is a major ingredient in «gas dryer» fuel additives. In significant quantities, water is a problem in fuel tanks, as it separates from gasoline and can freeze in the supply lines at low temperatures. Alcohol does not remove water from gasoline, but the alcohol solubilizes water in gasoline. Once soluble, water does not pose the same risk as insoluble water, as it no longer accumulates in the supply lines and freezes but is dissolved within the fuel itself. Isopropyl alcohol is often sold in aerosol cans as a windshield or door lock deicer. Isopropyl alcohol is also used to remove brake fluid traces from hydraulic braking systems, so that the brake fluid (usually DOT 3, DOT 4, or mineral oil) does not contaminate the brake pads and cause poor braking. Mixtures of isopropyl alcohol and water are also commonly used in homemade windshield washer fluid.
Laboratory[edit]
As a biological specimen preservative, isopropyl alcohol provides a comparatively non-toxic alternative to formaldehyde and other synthetic preservatives. Isopropyl alcohol solutions of 70–99% are used to preserve specimens.
Isopropyl alcohol is often used in DNA extraction. A lab worker adds it to a DNA solution to precipitate the DNA, which then forms a pellet after centrifugation. This is possible because DNA is insoluble in isopropyl alcohol.
Safety[edit]
Isopropyl alcohol vapor is denser than air and is flammable, with a flammability range of between 2 and 12.7% in air. It should be kept away from heat and open flame.[27] Distillation of isopropyl alcohol over magnesium has been reported to form peroxides, which may explode upon concentration.[28][29] Isopropyl alcohol causes eye irritation[27] and is a potential allergen.[30][31] Wearing protective gloves is recommended.
Toxicology[edit]
Isopropyl alcohol, via its metabolites, is somewhat more toxic than ethanol, but considerably less toxic than ethylene glycol or methanol. Death from ingestion or absorption of even relatively large quantities is rare. Both isopropyl alcohol and its metabolite, acetone, act as central nervous system (CNS) depressants.[32] Poisoning can occur from ingestion, inhalation, or skin absorption. Symptoms of isopropyl alcohol poisoning include flushing, headache, dizziness, CNS depression, nausea, vomiting, anesthesia, hypothermia, low blood pressure, shock, respiratory depression, and coma.[32] Overdoses may cause a fruity odor on the breath as a result of its metabolism to acetone.[33]
Isopropyl alcohol does not cause an anion gap acidosis, but it produces an osmolal gap between the calculated and measured osmolalities of serum, as do the other alcohols.[32]
Isopropyl alcohol is oxidized to form acetone by alcohol dehydrogenase in the liver[32] and has a biological half-life in humans between 2.5 and 8.0 hours.[32] Unlike methanol or ethylene glycol poisoning, the metabolites of isopropyl alcohol are considerably less toxic, and treatment is largely supportive. Furthermore, there is no indication for the use of fomepizole, an alcohol dehydrogenase inhibitor, unless co-ingestion with methanol or ethylene glycol is suspected.[34]
In forensic pathology, people who have died as a result of diabetic ketoacidosis usually have blood concentrations of isopropyl alcohol of tens of mg/dL, while those by fatal isopropyl alcohol ingestion usually have blood concentrations of hundreds of mg/dL.[20]
References[edit]
- ^ «Alcohols Rule C-201.1». Nomenclature of Organic Chemistry (The IUPAC ‘Blue Book’), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979.
Designations such as isopropanol, sec-butanol, and tert-butanol are incorrect because there are no hydrocarbons isopropane, sec-butane, and tert-butane to which the suffix «-ol» can be added; such names should be abandoned. Isopropyl alcohol, sec-butyl alcohol, and tert-butyl alcohol are, however, permissible (see Rule C-201.3) because the radicals isopropyl, sec-butyl, and tert-butyl do exist.
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 631. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ «Isopropanol_msds». chemsrc.com. Archived from the original on 2020-03-10. Retrieved 2018-05-04.
- ^ Reeve, W.; Erikson, C. M.; Aluotto, P. F. (1979). «A new method for the determination of the relative acidities of alcohols in alcoholic solutions. The nucleophilicities and competitive reactivities of alkoxides and phenoxides». Can. J. Chem. 57 (20): 2747–2754. doi:10.1139/v79-444.
- ^ a b Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 978-0-07-073401-2.
- ^ Isopropyl alcohol toxicity
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0359». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d «Isopropyl alcohol». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ «Isopropanol». PubChem. Archived from the original on February 12, 2019. Retrieved February 10, 2019.
- ^ Doolittle, Arthur K. (1954). The Technology of Solvents and Plasticizers. New York: John Wiley & Sons, Inc. p. 628.
- ^ a b c The Merck Index (10th ed.). Rahway, NJ: Merck & Co. 1983. p. 749. ISBN 9780911910278.
- ^ Logsden, John E.; Loke, Richard A. (1999). «Propyl Alcohols». In Jacqueline I. (ed.). Kirk- Concise of Chemical Technology (4th ed.). New York: John Wiley & Sons, Inc. pp. 1654–1656. ISBN 978-0471419617.
- ^ «Isopropyl Alcohol, , Suitable for Liquid Chromatography, Extract/, UV-Spectrophotometry». VWR International. Archived from the original on 31 March 2016. Retrieved 25 August 2014.
- ^ «UV Cutoff» (PDF). University of Toronto. Archived (PDF) from the original on 8 October 2013. Retrieved 25 August 2014.
- ^ Ishihara, K.; Yamamoto, H. (2001). «Aluminum Isopropoxide». Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.ra084. ISBN 0471936235.
- ^ Wittcoff, M. M.; Green, H. A. (2003). Organic chemistry principles and industrial practice (1. ed., 1. reprint. ed.). Weinheim: Wiley-VCH. p. 4. ISBN 978-3-527-30289-5.
- ^ a b c d e f g h i Papa, A. J. «Propanols». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_173.
- ^ Logsdon, John E.; Loke, Richard A. (December 4, 2000). «Isopropyl Alcohol». Kirk-Othmer Encyclopedia of Chemical Technology. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.0919151612150719.a01. ISBN 978-0471238966.
- ^ CRC Handbook of Chemistry and Physics, 44th ed. pp. 2143–2184.
- ^ a b Petersen, Thomas H.; Williams, Timothy; Nuwayhid, Naziha; Harruff, Richard (2012). «Postmortem Detection of Isopropanol in Ketoacidosis». Journal of Forensic Sciences. 57 (3): 674–678. doi:10.1111/j.1556-4029.2011.02045.x. ISSN 0022-1198. PMID 22268588. S2CID 21101240.
- ^ «Sodium Isopropyl Xanthate, SIPX, Xanthate». 3DChem.com. Archived from the original on 2012-05-04. Retrieved 2012-06-17.
- ^ «Guide to Local Production: WHO-recommended Handrub Formulations» (PDF). World Health Organization. August 2009. Archived (PDF) from the original on 2009-05-19. Retrieved 2020-10-05.
- ^ Otitis Externa (Swimmers Ear). Medical College of Wisconsin.
- ^ Lindblad, Adrienne J.; Ting, Rhonda; Harris, Kevin (August 2018). «Inhaled isopropyl alcohol for nausea and vomiting in the emergency department». Canadian Family Physician. 64 (8): 580. ISSN 1715-5258. PMC 6189884. PMID 30108075.
- ^ Burlage, Henry M.; Welch, H.; Price, C. W. (2006). «Pharmaceutical applications of isopropyl alcohol II. Solubilities of local anesthetics». Journal of the American Pharmaceutical Association. 36 (1): 17–19. doi:10.1002/jps.3030360105. PMID 20285822.
- ^ Society for Experimental Biology and Medicine (1922). Proceedings of the Society for Experimental Biology and Medicine, Volume 19. p. 85. Archived from the original on 2021-12-20. Retrieved 2016-09-24.
- ^ a b «Isopropanol». Sigma-Aldrich. 19 January 2012. Archived from the original on 17 January 2021. Retrieved 6 July 2012.
- ^ Mirafzal, Gholam A.; Baumgarten, Henry E. (1988). «Control of peroxidizable compounds: An addendum». Journal of Chemical Education. 65 (9): A226. Bibcode:1988JChEd..65A.226M. doi:10.1021/ed065pA226.
- ^ «Chemical safety: peroxide formation in 2-propanol». Chemical & Engineering News. 94 (31): 2. August 1, 2016. Archived from the original on November 7, 2017. Retrieved November 2, 2017.
- ^ García-Gavín, Juan; Lissens, Ruth; Timmermans, Ann; Goossens, An (2011-06-17). «Allergic contact dermatitis caused by isopropyl alcohol: a missed allergen?». Contact Dermatitis. 65 (2): 101–106. doi:10.1111/j.1600-0536.2011.01936.x. ISSN 0105-1873. PMID 21679194. S2CID 42577253.
- ^ McInnes, A. (1973-02-10). «Skin reaction to isopropyl alcohol». British Medical Journal. 1 (5849): 357. doi:10.1136/bmj.1.5849.357-c. ISSN 0007-1447. PMC 1588210. PMID 4265463.
- ^ a b c d e Slaughter RJ, Mason RW, Beasley DM, Vale JA, Schep LJ (2014). «Isopropanol poisoning». Clinical Toxicology. 52 (5): 470–8. doi:10.3109/15563650.2014.914527. PMID 24815348. S2CID 30223646.
- ^ Kalapos, M. P. (2003). «On the mammalian acetone metabolism: from chemistry to clinical implications». Biochimica et Biophysica Acta (BBA) — General Subjects. 1621 (2): 122–39. doi:10.1016/S0304-4165(03)00051-5. PMID 12726989.
- ^ «Isopropyl alcohol poisoning». uptodate.com. Archived from the original on 2017-10-10. Retrieved 2017-10-10.
External links[edit]
- CDC – NIOSH Pocket Guide to Chemical Hazards — Isopropyl alcohol
- Environmental Health Criteria 103: 2-Propanol



Имена и идентификаторы |
| наименование товара | Изопропиловый |
| Синонимы | LABOTEST-BB LT02090809; CI 764; CI NO 764 (1924); BETZ 0212; 2-PROPANOL, DIST. ДЛЯ ВЭЖХ: 6X1 L; 2-PROPANOL RG, REAG. ACS, REAG. ISO, REAG. PH. EUR.; 2-PROPANOL, ГИСТОЛОГИЧЕСКАЯ СОРТА; 2-PROPANOL PESTANAL |
| Номер CAS Registry | 67-63-0 |
| Молекулярная формула | C3H8O |
| Молекулярная масса | 60.1 |
| EINECS | 200-661-7 |
| Другие номера реестра | |
| Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д.: | Имена IUPA, InChI, InChI Key, Canonical SMILES, И т.д. |
Химические и физические свойства
| Температура плавления | -89.5 ° C |
| Точка кипения | 82 ° C (лит.) |
| Плотность | 0.785 г / мл при 25 ° C (лит.) |
| плотность пара | 2.1 (против воздуха) |
| давление газа | 33 мм рт.ст. (20 ° C) |
| Показатель преломления | n20 / Д 1.377 (светится.) |
| FEMA | 2929 | ИЗОПРОПИЛОВЫЙ СПИРТ |
| Точка возгорания | 53 ° F |
| СХД | Область воспламеняемости |
| Solubulity | вода: растворимая (полностью) |
| ПКА | 17.1 (при 25 ℃) |
| форма | Низкоплавкое твердое вещество |
| цвет | Бесцветный |
| Относительная полярность | 0.546 |
| Предел взрываемости | 2-13.4% (V), |
| Растворимость воды | смешивающийся |
| Точка замерзания | -89.5 ℃ |
| Merck | 14,5208 |
| BRN | 635639 |
| Дополнительные свойства от PubChem | Топологическая полярная поверхность, моноизотопная масса и т. Д. |
| Справочник по химии NIST | Изопропиловый спирт (67-63-0) |
| Система регистрации веществ EPA | 2-пропанол (67-63-0) |
| Коды опасности | Xi, F, Xn |
| R-фраза | 11-36-67-40-10-36/38 |
| S Фраза | 7-16-24/25-26-36/37 |
| RIDADR | UN 1219 3 / PG 2 |
| WGK Германия | 1 |
| RTECS | NT8050000 |
| F | 3-10 |
| ЗКТВ | Да |
| Класс хранения | 3 |
| Группа упаковки | II |
| Данные о вредных веществах | 67-63-0 (данные о вредных веществах) |
Литература |
Патенты |
Транспортировка, хранение и использование |
| Применение | Нет информации |
Спектральные свойства |
Утвержденные производители | |
| Хотите, чтобы вас указали в списке одобренных производителей (бесплатное обслуживание, но требуется одобрение)? | Пожалуйста, скачайте и заполните эта форма и отправить обратно одобренные производители@chemwhat.com |
Свяжитесь с нами для получения другой помощи | |
| Свяжитесь с нами для получения других услуг, таких как передача технологий, синтетическая литература, поиск поставщиков, реклама и т. Д. | Нажмите здесь, чтобы связаться ChemWhat |
| Изопропанол | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пропан-2-ол |
| Сокращения | Изопропанол, 2-пропанол |
| Традиционные названия | Изопропиловый спирт |
| Химическая формула | CH3CH(OH)CH3 |
| Эмпирическая формула | C3H8O |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 60,09 а. е. м. |
| Молярная масса | 60,09 г/моль |
| Плотность | 0,7851 г/см³ |
| Динамическая вязкость (ст. усл.) | 0,00243 Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | -89,5 °C |
| Температура кипения | 82,4 °C |
| Температура вспышки | 11,7 °C |
| Температура самовоспламенения | 400 °C |
| Молярная теплоёмкость (ст. усл.) | 155,2 Дж/(моль·К) |
| Давление пара | 4,4 кПа при 20 °C |
| Химические свойства | |
| pKa | 16,5 |
| Растворимость в бензоле | хорошо растворим |
| Растворимость в ацетоне | растворим |
| Оптические свойства | |
| Показатель преломления | 1,3776 |
| Структура | |
| Дипольный момент | 1,66 Д |
| Классификация | |
| Рег. номер CAS | 67-63-0 |
| SMILES | CC(O)C |
| Безопасность | |
| Токсичность | довольно высокая |
Изопропиловый спирт, пропанол-2 (2-пропанол), изопропанол, диметилкарбинол, ИПС — простейший вторичный одноатомный спирт алифатического ряда. Существует изомер изопропанола — 1-пропанол. Принадлежит к веществам 3-го класса опасности (умеренно опасные вещества) по степени воздействия на организм, обладает наркотическим действием. Граница ПДК для паров изопропанола в воздухе составляет 10 мг/м3. Отравление изопропиловым спиртом возникает в результате вдыхания паров, содержащих концентрацию, превышающую ПДК, кумулятивными свойствами не обладает[1]. Потребление внутрь уже в небольших дозах вызывает отравление. Широко используется как технический спирт в средствах для чистки стёкол, оргтехники и т. п. и как растворитель в промышленности (где растворители необходимы).
Содержание
- 1 Свойства
- 1.1 Химические свойства
- 1.2 Физические свойства
- 2 Получение
- 3 Применение
- 3.1 Медицина
- 4 Влияние на человека
- 4.1 Наркотические свойства
- 5 Примечания
Свойства
Химические свойства
Химическая формула (рациональная) изопропилового спирта: CH3CH(OH)CH3.
Изопропанол обладает свойствами вторичных спиртов жирного ряда, в том числе образует простые и сложные эфиры. Гидроксильная группа может быть вытеснена представителями ряда галогенов. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. При дегидрировании превращается в ацетон.[2]
Реагирует с сильными окислителями. Агрессивен в отношении некоторых видов пластика и резины.
Физические свойства
Бесцветная жидкость с характерным спиртовым запахом, более резковатым по сравнению с этанолом (по чему их можно в некоторых случаях отличить), tплавления −89,5 °C, tкипения 82,4 °C, плотность 0,7851 г/см³ (при 20 °C), tвспышки 11,7 °C. Нижний предел взрываемости в воздухе 2,5 % по объёму (при 25 °C). Температура самовоспламенения 456 °C. Коэффициент преломления 1,3776 (в жидком состоянии, при 20 °C). Динамическая вязкость при стандартных условиях 2,43 мПа·с. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К).
Пар хорошо смешивается с воздухом, легко образует взрывчатые смеси. Давление паров — 4,4 кПа (при 20 °C). Относительная плотность пара — 2,1, относительная плотность смеси пар/воздух — 1,05 (при 20 °C).
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь (87,9 % изопропилового спирта, tкипения 83,38 °C).
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице[3]:
| Концентрация спирта об % | Концентрация спирта вес % | Температура замерзания °C |
| 0 | 0 | 0 |
| 10 | 8 | −4 |
| 20 | 17 | −7 |
| 30 | 26 | −15 |
| 40 | 34 | −18 |
| 50 | 44 | −21 |
| 60 | 54 | −23 |
| 70 | 65 | −29 |
| 80 | 76 | −37* |
| 90 | 88 | −57* |
| 100 | 100 | −90* |
(*Наблюдается переохлаждение)
Получение
Существует два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена.[4][5]
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена
- CH3CH=CH2 + H2SO4 → (CH3)2CHOSO3H + H2O → (CH3)2CHOH.
Сырьем может служить пропан-пропиленовая фракция с содержанием пропилена 30-90 % (фракция пиролиза и крекинга нефти). Однако наблюдается тенденция к использованию чистого пропилена, так как в этом случае процесс можно вести при невысоких давлениях, резко снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (CH3)2CHOSO2OH, H2SO4 и Н2О, на второй — сернокислотный экстракт нагревается с водой и удаляется образующийся изопропиловый спирт. Прямую гидратацию пропилена осуществляют в основном в присутствии твердого катализатора (в скобках указаны условия процессов): Н3РО4 на носителе (240—260°С; 2,5-6,5 МПа) или катионообменной смолы (130—160°С; 8,0-10,0 МПа). Изопропиловый спирт получают также окислением парафинов воздухом и другими способами.[2]
Современный способ:
Гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора.[6][7]
В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск)[8] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск)[9][7]
Применение
Изопропиловый спирт используют для получения:
- ацетона (дегидрированием или неполным окислением)
- пероксида водорода
- метилизобутилкетона
- изопропилацетата
- изопропиламина.
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители).
Медицина
70 % изопропиловый спирт применяется вместо этилового спирта как антисептик для пропитки медицинских салфеток.
Влияние на человека
Оказывает раздражающее воздействие на глаза и дыхательные пути, при кратком воздействии больших концентраций паров вызывает головную боль. Может оказывать угнетающее действие на центральную нервную систему. Воздействие на уровне, значительно превышающем ПДК, может вызвать потерю сознания. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обуславливает его токсическое действие. Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто уже при дозах порядка 50 мл и более.
Предельно допустимая концентрация изопропанола в воздухе равна 10 миллиграммов на кубический метр.
Изопропанол органолептически заметно отличается от этанола и не может быть ошибочно принят за этанол. Имеет отличный от этанола запах, более «грубый». При приеме внутрь вызывает опьянение, сходное с алкогольным. Изопропанол окисляется в организме при участии альдегиддегидрогеназы до ацетона. Скорость окисления в среднем в 2 — 2,5 раза ниже, чем у этанола, поэтому опьянение изопропанолом очень стойкое. При частом употреблении к изопропанолу быстро развивается непереносимость, а в отдельных случаях — гиперчувствительность и аллергия. Хотя токсичность изопропанола примерно в 3,5 раза больше, чем у этанола, но при этом опьяняющее действие его также выше в 10 раз[источник не указан 546 дней]. По этой причине смертельных отравлений изопропанолом не зафиксировано, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием.[1] Наркотический эффект изопропанола почти в 2 раза превышает аналогичный эффект этанола.[10] Концентрация 1,2 %, воздействующая в течение 4 часов оказывает наркотический эффект. При аналогичном воздействии в течение 8 часов — в половине случаев наблюдается смертельный исход.[11]
Примечания
- ↑ 1 2 ГОСТ 9805-84. Спирт изопропиловый. Технические условия[1]
- ↑ 1 2 ХиМиК.Ру — Изопропиловый спирт
- ↑ Ссылка один (англ.),Ссылка два
- ↑ «Isopropyl Alcohol, by John E. Logsdon and Richard A. Loke», Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc, Article Online Posting Date: December 4, 2000
- ↑ A. J. Papa (2005), «Propanols», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ СПОСОБ ПОЛУЧЕНИЯ ПРОПАНОЛА-2 — Патент РФ 2047590
- ↑ 1 2 ООО Синтез Ацетон
- ↑ О заводе | Завод синтетического спирта
- ↑ ПРОИЗВОДСТВО ИЗОПРОПИЛОВОГО СПИРТА В РОССИИ
- ↑ «Достоинства и недостатки современных кожных антисептиков» С. В. Волкова, Е. В. Клементенок
- ↑ Review of Inhalants: Euphoria to Dysfunction Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.,National Institute on Drug Abuse
| | |
|---|---|
| (0°) | Метанол |
| Первичные спирты (1°) | Этанол · Пропанол · Бутиловый спирт/Изобутанол · Амиловый спирт · Гексанол · Гептанол Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · 2-Бутанол · 2-Гексанол |
| Третичные спирты (3°) | 2-Метил-2-бутанол |
СПЕЦИФИКАЦИЯ изопропанола
ОПИСАНИЕ
Химическая формула: С3Н7ОН
Химическая структура: пропанол-2
СН3 — СН — СН3
|
ОН
Молекулярная масса: 60,09 г/моль
CAS # 67-63-0
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Внешний вид: прозрачная бесцветная жидкость с характерным спиртовым запахом
Удельная плотность: 0,78 г/см3
Температура плавления: 89,5 °С
Температура кипения: 81-83 °С
Взрывоопасная концентрация в воздухе: 1,8 — 12 объем.%
Температура самовоспламенения: 350 °С
Температура вспышки: 11,7 °С
ТОКСИКОЛОГИЯ
Токсичность пропилового спирта выше, чем этилового в 3,5 раза.
ПДК воздуха рабочей зоны — 10 мг/м3
Жидкость обезжиривает кожу.
СПЕЦИФИКАЦИЯ
| Показатель | Единицы измерения | Лимиты |
| Внешний вид | Бесцветная прозрачная жижкость | |
| Н-пропанол | % | ≥ 99,8 |
| Вода | % | ≤ 0,1 |
| Массовая доля кислот в пересчете на уксусную кислоту | % | ≤ 0,001 |
| Смешиваемость с водой | Соответствует | |
| Массовая доля нелетучего остатка | % | ≤ 0,0005 |
| Цветность, по Pt-Co шкале | ≤ 5 | |
| Плотность при 20 °С | г/см3 | ≥ 0,785 — 0,786 |
| Перегонка, IBP (начальная точка кипения) | °С | 81,8 — 82,2 |
| Показатель преломления при 20 °С | ≥ 1,376 — 1,378 | |
| УФ Абсорбция при 230 нм | ≤ 0,3 | |
| УФ Абсорбция при 250 нм | ≤ 0,1 | |
| УФ Абсорбция при 270 нм | ≤ 0,03 | |
| УФ Абсорбция при 290 нм | ≤ 0,02 | |
| УФ Абсорбция при 310 нм | ≤ 0,01 |
ПРИМЕНЕНИЕ
Изопропиловый спирт используется
- для получения ацетона, пероксида водорода, метилизобутилкетона, изопропилацетата, изопропиламина и ряда других органических продуктов;
- как растворитель в лакокрасочной, парфюмерно-косметической, фармацевтической, химической промышленности. В парфюмерной промышленности используется в косметических композициях как в чистом виде, так и в виде продуктов соединения с различными жирными кислотами (жировые и смягчающие компоненты, диспергаторы для пигментных красителей и пр.). В фармацевтической промышленности используется в тонких химических технологиях;
- как экстрагент масел, природных смол и натуральных латексов;
- как обледенитель и антифриз;
- как растворитель эфиров целлюлозы;
- как обезжиривающий и моющий агент;
- как теплоноситель в охлаждающих машинах;
- как алкилирующий агент;
- как интермедиат при синтезе ряда фармацевтических препаратов.
Изопропиловый спирт часто является заменителем этанола во многих областях его применения. Так, изопропанол входит в состав косметики, бытовой химии, дезинфицирующих средств, репеллентов и многое другое.
ХРАНЕНИЕ и ОБРАЩЕНИЕ
Изопропанол склонен адсорбировать влагу воздуха. Поэтому к его хранению предъявляются строгие требования: избегать прямого солнечного света; хранить в сухом прохладном месте, вдали от открытого пламени и источников тепла; складское помещение должно хорошо проветриваться.
Сильно огнеопасно!
Не допускать открытого огня, искр и курения. Не допускать контакта с окислителями. В огне выделяет раздражающие или токсичные пары (или газы). Пары могут формировать взрывоопасную смесь с воздухом. Взрывная волна может распространяться на большое расстояние. Используйте распыление воды для рассеивания паров. Продукт классифицируется как легко воспламеняющаяся жидкость.
Дополнительная информация по безопасности жизнедеятельности представлена в Паспорте безопасности данного продукта.
УПАКОВКА
Упаковка: металлические бочки по 165, 158, 200 кг.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
По вопросам получения дополнительной информации, технического обслуживания, получения образцов продукта обращайтесь к менеджерам нашей компании.
Описание:
Спирт изопропиловый по внешнему виду представляет собой бесцветную прозрачную жидкость с характерным запахом. В промышленности изопропиловый спирт получают в основном сернокислотной или прямой гидратацией пропилена. В качестве сырья используют пропан-пропиленовую фракцию газов крекинга, а также пропиленовую фракцию газов пиролиза нефти.
Применение:
В основном, спирт изопропиловый применяется для производства ацетона, который в свою очередь является необходимой составляющей для производства пластмасс, синтетического каучука, химических волокон и многих других органических продуктов. Изопропиловый спирт применяется и для синтеза изопропилацетата и других сложных эфиров. В роли растворителя изопропанол используется в лакокрасочной, нефтеперерабатывающей и химической промышленностях. Он растворяет производные природной целлюлозы, нитролаки, эфирные масла, алкалоиды, синтетические смолы и так далее. Причем в некоторых случаях растворимость в нем выше, чем в этиловом спирте. В автомобильной и авиапромышленности спирт изопропиловый применяется для улучшения свойств тормозной жидкости, авиационного бензина и антиобледенителя. В медицинской промышленности изопропиловый спирт применяется для обеззараживания, в косметической — в качестве составляющей различных средств. Кроме того, изопропанол можно применять для технической чистки и обезжиривания различных поверхностей, снятия старых лако-красочных покрытий. Широкий спектр применения и доступная цена изопропилового спирта делает его универсальным и весьма востребованным средством. Доказано, что в большинстве случаев изопропиловый спирт с успехом может заменить этиловый спирт. Исключение составляет лишь химический синтез различных веществ. В полиграфии изопропиловый спирт используют для увлажнения в печатных процессах.
- Спирт изопропиловый Корея
- Спирт изопропиловый Россия
Спирт изопропиловый
Стандарт GB/T7814-2017
| Технические характеристики | Норма |
|---|---|
| Содержание основного вещества %, не менее | 99,90 |
| Цветность, не более, % | 10 |
| Вода, не более, % | 0,2 |
| Кислотность, не более, % | 0,002 |
| Удельная плотность (20/20°С) (г/м3) | 0,784-0,786 |
| Нелетучее вещество мг/100мл, не более | 2,0 |
| Окись углерода | 0,02 |
Упаковка:
Спирт изопропиловый упаковывается в стальные бочки по 160 кг.
Хранение:
Спирт изопропиловый хранят в сухих складских вентилируемых помещениях на расстоянии не менее 1 м от нагревательных приборов, предохраняя от влаги и прямых солнечных лучей.Гарантийный срок хранения — один год.
Спирт изопропиловый
ГОСТ 9805-76
| Технические характеристики | Норма |
|---|---|
| Массовая доля изопропилового спирта, %, не менее | 99,7 |
| Массовая доля воды, %, не более | 0,15 |
| Плотность при 20°С, кг/л | 0,785-0,786 |
| Температура плавления, °С | 89,5 |
| Температура вспышки, °С | 11,7 |
Примечание: *При хранении допускается появление опалесценции.
Упаковка:
Изопропиловый спирт упаковывается в стальные бочки и пластмассовую тару.
Хранение:
Изопропиловый спирт требуется хранить в хорошо закрытой ёмкости, в проветриваемом сухом помещении.
Транспортировка:
Изопропиловый спирт можно транспортировать в специально оборудованных железнодорожных цистернах и автоцистернах, в стальных или металлических бочках, а также в пластиковой и стеклянной таре различного объема, в соответствии с правилами перевозки грузов, действующем на данном виде транспорта.
При транспортировке крупных объемов спирта следует обеспечить герметичность тары для транспортировки, а также обезопасить груз от попадания солнечных лучей, нагрева свыше 30 °C и прямого контакта с окислителями и горючими веществами.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Получите экспертную консультацию по продукту и условиям поставки
Изопропиловый спирт – органическое простейшее соединение, принадлежит к одноатомным спиртам алифатического ряда. Имеет изомер под названием пропанол-1. Синонимы: ИПС, диметилкарбинол, изопропанол, 2-пропанол (пропанол-2), вторичный пропиловый спирт.
Изопропанол или изопропиловый спирт часто используется не только в промышленности, но и в быту. Это простое органическое соединение в числе одноатомных спиртов в алифатическом ряду. Может встречаться под названиями: ИПС, диметилкарбинол, вторичный пропиловый спирт.
Изомер: пропанол-1.
Формула: C3H7OH (C3H8O)
Молярная масса: 60,1 г/моль
Номер CAS: 67-63-0
Свойства вещества
Изопропанол бесцветный, прозрачный и с резким запахом. Мгновенно воспламеняется и хорошо горит. Температура кипения – 83°С, плавления – 89°С, замерзания – минус 89,5°С. Как и другие представители вторичных спиртов, реактив отлично растворяется в бензоле, ацетоне, этаноле, метаноле, а также диэтиловом эфире.
При контакте с водой образовывается азеотропный состав. После процесса дегидратации принимает вид ацетона. С солями не даёт реакции. Для выделения вещества можно просто использовать NaCl (поваренную соль) или Na2SO4. Это то, чем изопропиловый спирт отличается от метанола или этанола.
ИПС в свою очередь отлично растворяет этилцелюлозу, многие масла, поливинил бутирал, материалы на основе резины, смоляные материалы.
Особенности работы с реактивом
Высокая токсичность и огнеопасность – главное, чего стоит опасаться при использовании изопропанола. При смешивании паров спиртового раствора с воздухом могут создать взрывоопасную смесь. При попадании в человеческий организм (желудок или лёгкие) вызывает сильное раздражение, отравление, не исключая возможность летального исхода. Негативно воздействует на нервную систему. Вызывает наркотическое опьянение.
Важно, придерживаться мер предосторожности: работать в проветриваемом пространстве, держать подальше от источников огня, нагревательных механизмов, всегда использовать защитную маску и очки.
Способы хранения
Изопропиловый спирт выпускается компаниями-производителями в разной фасовке. В продаже можно встретить и небольшие бутылочек до полу литра, и громадные бочки. Главное при хранении – не нарушать герметичности упаковки. Важно также держать вещество вдали от прямых солнечных лучей, источников тепла, в сухих хорошо проветриваемых помещениях.
Область применения
Главное предназначение изопропанола – растворение. Как абсолютированный, так и технический, он используется для разных видов очистки. Его невысокая цена позволяет применять его во многих сферах:
- автомобильная промышленность (антифризы, стеклоочистители);
- медицина (как дезинфицирующее средство);
- химическое производство (как промежуточное звено для получения других реактивов);
- фармакология;
- парфюмерия;
- металлургия;
- электроника;
Приобретают изопропиловый спирт и для использования в быту. Он отлично справляется с разного вида загрязнениями, в том числе пятнами клея, масел, краски практически на любых поверхностях.
Купить химически чистый (ХЧ) изопропанол можно даже в аптеке. Но чтобы быть уверенным в его качестве, или при необходимости большого объёма продукции лучше обратится в специализированный магазин. Himmagazin – надёжный поставщик химических реактивов в Москве. Здесь есть широкий ассортимент, возможность покупки в розницу, удобный способ оплаты. Заказать товар можно на сайте, или связавшись с нашими менеджерами.