This article is about the molecular ion. For the ancient city, see Siwa Oasis.
Not to be confused with the neutral compound Ammonia.
Ammonium
| ||
| Names | ||
|---|---|---|
| IUPAC name Ammonium ion | ||
| Systematic IUPAC name Azanium[1] | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| ChEBI |
| |
| ChemSpider |
| |
| MeSH | D000644 | |
| PubChem CID |
| |
| UNII |
| |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | [NH4]+ | |
| Molar mass | 18.039 g·mol−1 | |
| Acidity (pKa) | 9.25 | |
| Conjugate base | Ammonia | |
| Structure | ||
| Molecular shape | Tetrahedral | |
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
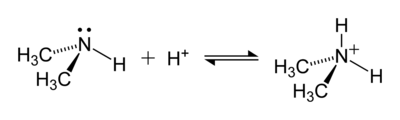
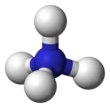
The ammonium cation is a positively-charged polyatomic ion with the chemical formula NH+4 or [NH4]+. It is formed by the protonation of ammonia (NH3). Ammonium is also a general name for positively charged or protonated substituted amines and quaternary ammonium cations ([NR4]+), where one or more hydrogen atoms are replaced by organic groups (indicated by R).
Acid–base properties[edit]
The ammonium ion is generated when ammonia, a weak base, reacts with Brønsted acids (proton donors):
The ammonium ion is mildly acidic, reacting with Brønsted bases to return to the uncharged ammonia molecule:
Thus, treatment of concentrated solutions of ammonium salts with strong base gives ammonia. When ammonia is dissolved in water, a tiny amount of it converts to ammonium ions:
The degree to which ammonia forms the ammonium ion depends on the pH of the solution. If the pH is low, the equilibrium shifts to the right: more ammonia molecules are converted into ammonium ions. If the pH is high (the concentration of hydrogen ions is low and hydroxide ions is high), the equilibrium shifts to the left: the hydroxide ion abstracts a proton from the ammonium ion, generating ammonia.
Formation of ammonium compounds can also occur in the vapor phase; for example, when ammonia vapor comes in contact with hydrogen chloride vapor, a white cloud of ammonium chloride forms, which eventually settles out as a solid in a thin white layer on surfaces.
Salts[edit]
Ammonium cation is found in a variety of salts such as ammonium carbonate, ammonium chloride and ammonium nitrate. Most simple ammonium salts are very soluble in water. An exception is ammonium hexachloroplatinate, the formation of which was once used as a test for ammonium. The ammonium salts of nitrate and especially perchlorate are highly explosive, in these cases ammonium is the reducing agent.
In an unusual process, ammonium ions form an amalgam. Such species are prepared by the addition of sodium amalgam to a solution of ammonium chloride.[2] This amalgam eventually decomposes to release ammonia and hydrogen.[3]
To find whether the ammonium ion is present in the salt, first the salt is heated in presence of alkali hydroxide releasing a gas with characteristic smell which of course is ammonia.
To further confirm ammonia it passed through glass rod dipped in HCl solution (hydrochloric acid) creating white dense fumes of ammonium chloride.
Ammonia when passed through CuSO4 (copper(II) sulphate) solution turns from blue to deep blue color forming Schweizer’s reagent.
Ammonia or ammonium ion when added to Nessler’s reagent gives brown color precipitate known as iodide of Million’s base in basic medium.
Ammonium ion when added to chloroplatinic acid gives a yellow precipitate.
Ammonium ion when added to sodium cobaltinitrite gives a yellow precipitate.
Ammonium ion when added to potassium bitartrate gives a white precipitate.
Structure and bonding[edit]
The lone electron pair on the nitrogen atom (N) in ammonia, represented as a line above the N, forms the bond with a proton (H+). Thereafter, all four N–H bonds are equivalent, being polar covalent bonds. The ion has a tetrahedral structure and is isoelectronic with methane and the borohydride anion. In terms of size, the ammonium cation (rionic = 175 pm)[citation needed] resembles the caesium cation (rionic = 183 pm).[citation needed]
Organic ions[edit]
The hydrogen atoms in the ammonium ion can be substituted with an alkyl group or some other organic group to form a substituted ammonium ion (IUPAC nomenclature: aminium ion). Depending on the number of organic groups, the ammonium cation is called a primary, secondary, tertiary, or quaternary. With the exception of the quaternary ammonium cations, the organic ammonium cations are weak acids.
An example of a reaction forming an ammonium ion is that between dimethylamine, (CH3)2NH, and an acid to give the dimethylammonium cation, [(CH3)2NH2]+:
Quaternary ammonium cations have four organic groups attached to the nitrogen atom, they lack a hydrogen atom bonded to the nitrogen atom. These cations, such as the tetra-n-butylammonium cation, are sometimes used to replace sodium or potassium ions to increase the solubility of the associated anion in organic solvents. Primary, secondary, and tertiary ammonium salts serve the same function, but are less lipophilic. They are also used as phase-transfer catalysts and surfactants.
An unusual class of organic ammonium salts are derivatives of amine radical cations, [R3N•]+ such as tris(4-bromophenyl)ammoniumyl hexachloroantimonate.
Biology[edit]
Ammonium ions are a waste product of the metabolism of animals. In fish and aquatic invertebrates, it is excreted directly into the water. In mammals, sharks, and amphibians, it is converted in the urea cycle to urea, because urea is less toxic and can be stored more efficiently. In birds, reptiles, and terrestrial snails, metabolic ammonium is converted into uric acid, which is solid and can therefore be excreted with minimal water loss.[4]
Ammonium is an important source of nitrogen for many plant species, especially those growing on hypoxic soils. However, it is also toxic to most crop species and is rarely applied as a sole nitrogen source.[5]
Metal[edit]
The ammonium ion has very similar properties to the heavier alkali metals cations and is often considered a close equivalent.[6][7][8] Ammonium is expected to behave as a metal ([NH4]+ ions in a sea of electrons) at very high pressures, such as inside gas giant planets such as Uranus and Neptune.[7][8]
Under normal conditions, ammonium does not exist as a pure metal, but does as an amalgam (alloy with mercury).[9]
See also[edit]
- Ammonium transporter
- f-ratio
- Hydronium (H3O+)
- Iminium
- Nitrification
- Onium compounds
- The Magnificent Possession (Isaac Asimov short story)
References[edit]
- ^ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 71,105,314. Electronic version.
- ^ «Pseudo-binary compounds». Archived from the original on 2020-07-27. Retrieved 2007-10-12.
- ^ «Ammonium Salts». VIAS Encyclopedia.
- ^ Campbell, Neil A.; Jane B. Reece (2002). «44». Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 978-0-8053-6624-2.
- ^ Britto, DT; Kronzucker, HJ (2002). «NH4+ toxicity in higher plants: a critical review» (PDF). Journal of Plant Physiology. 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ a b Stevenson, D. J. (November 20, 1975). «Does metallic ammonium exist?». Nature. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. S2CID 4199721.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (February 3, 1954). «Metallic Ammonium». Monthly Notices of the Royal Astronomical Society. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ^ Reedy, J.H. (October 1, 1929). «Lecture demonstration of ammonium amalgam». Journal of Chemical Education. 6 (10): 1767. Bibcode:1929JChEd…6.1767R. doi:10.1021/ed006p1767.
This article is about the molecular ion. For the ancient city, see Siwa Oasis.
Not to be confused with the neutral compound Ammonia.
Ammonium
| ||
| Names | ||
|---|---|---|
| IUPAC name Ammonium ion | ||
| Systematic IUPAC name Azanium[1] | ||
| Identifiers | ||
| CAS Number |
| |
| 3D model (JSmol) |
| |
| ChEBI |
| |
| ChemSpider |
| |
| MeSH | D000644 | |
| PubChem CID |
| |
| UNII |
| |
| CompTox Dashboard (EPA) |
| |
| InChI
| ||
| SMILES
| ||
| Properties | ||
| Chemical formula | [NH4]+ | |
| Molar mass | 18.039 g·mol−1 | |
| Acidity (pKa) | 9.25 | |
| Conjugate base | Ammonia | |
| Structure | ||
| Molecular shape | Tetrahedral | |
| Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). Infobox references |
The ammonium cation is a positively-charged polyatomic ion with the chemical formula NH+4 or [NH4]+. It is formed by the protonation of ammonia (NH3). Ammonium is also a general name for positively charged or protonated substituted amines and quaternary ammonium cations ([NR4]+), where one or more hydrogen atoms are replaced by organic groups (indicated by R).
Acid–base properties[edit]
The ammonium ion is generated when ammonia, a weak base, reacts with Brønsted acids (proton donors):
The ammonium ion is mildly acidic, reacting with Brønsted bases to return to the uncharged ammonia molecule:
Thus, treatment of concentrated solutions of ammonium salts with strong base gives ammonia. When ammonia is dissolved in water, a tiny amount of it converts to ammonium ions:
The degree to which ammonia forms the ammonium ion depends on the pH of the solution. If the pH is low, the equilibrium shifts to the right: more ammonia molecules are converted into ammonium ions. If the pH is high (the concentration of hydrogen ions is low and hydroxide ions is high), the equilibrium shifts to the left: the hydroxide ion abstracts a proton from the ammonium ion, generating ammonia.
Formation of ammonium compounds can also occur in the vapor phase; for example, when ammonia vapor comes in contact with hydrogen chloride vapor, a white cloud of ammonium chloride forms, which eventually settles out as a solid in a thin white layer on surfaces.
Salts[edit]
Ammonium cation is found in a variety of salts such as ammonium carbonate, ammonium chloride and ammonium nitrate. Most simple ammonium salts are very soluble in water. An exception is ammonium hexachloroplatinate, the formation of which was once used as a test for ammonium. The ammonium salts of nitrate and especially perchlorate are highly explosive, in these cases ammonium is the reducing agent.
In an unusual process, ammonium ions form an amalgam. Such species are prepared by the addition of sodium amalgam to a solution of ammonium chloride.[2] This amalgam eventually decomposes to release ammonia and hydrogen.[3]
To find whether the ammonium ion is present in the salt, first the salt is heated in presence of alkali hydroxide releasing a gas with characteristic smell which of course is ammonia.
To further confirm ammonia it passed through glass rod dipped in HCl solution (hydrochloric acid) creating white dense fumes of ammonium chloride.
Ammonia when passed through CuSO4 (copper(II) sulphate) solution turns from blue to deep blue color forming Schweizer’s reagent.
Ammonia or ammonium ion when added to Nessler’s reagent gives brown color precipitate known as iodide of Million’s base in basic medium.
Ammonium ion when added to chloroplatinic acid gives a yellow precipitate.
Ammonium ion when added to sodium cobaltinitrite gives a yellow precipitate.
Ammonium ion when added to potassium bitartrate gives a white precipitate.
Structure and bonding[edit]
The lone electron pair on the nitrogen atom (N) in ammonia, represented as a line above the N, forms the bond with a proton (H+). Thereafter, all four N–H bonds are equivalent, being polar covalent bonds. The ion has a tetrahedral structure and is isoelectronic with methane and the borohydride anion. In terms of size, the ammonium cation (rionic = 175 pm)[citation needed] resembles the caesium cation (rionic = 183 pm).[citation needed]
Organic ions[edit]
The hydrogen atoms in the ammonium ion can be substituted with an alkyl group or some other organic group to form a substituted ammonium ion (IUPAC nomenclature: aminium ion). Depending on the number of organic groups, the ammonium cation is called a primary, secondary, tertiary, or quaternary. With the exception of the quaternary ammonium cations, the organic ammonium cations are weak acids.
An example of a reaction forming an ammonium ion is that between dimethylamine, (CH3)2NH, and an acid to give the dimethylammonium cation, [(CH3)2NH2]+:
Quaternary ammonium cations have four organic groups attached to the nitrogen atom, they lack a hydrogen atom bonded to the nitrogen atom. These cations, such as the tetra-n-butylammonium cation, are sometimes used to replace sodium or potassium ions to increase the solubility of the associated anion in organic solvents. Primary, secondary, and tertiary ammonium salts serve the same function, but are less lipophilic. They are also used as phase-transfer catalysts and surfactants.
An unusual class of organic ammonium salts are derivatives of amine radical cations, [R3N•]+ such as tris(4-bromophenyl)ammoniumyl hexachloroantimonate.
Biology[edit]
Ammonium ions are a waste product of the metabolism of animals. In fish and aquatic invertebrates, it is excreted directly into the water. In mammals, sharks, and amphibians, it is converted in the urea cycle to urea, because urea is less toxic and can be stored more efficiently. In birds, reptiles, and terrestrial snails, metabolic ammonium is converted into uric acid, which is solid and can therefore be excreted with minimal water loss.[4]
Ammonium is an important source of nitrogen for many plant species, especially those growing on hypoxic soils. However, it is also toxic to most crop species and is rarely applied as a sole nitrogen source.[5]
Metal[edit]
The ammonium ion has very similar properties to the heavier alkali metals cations and is often considered a close equivalent.[6][7][8] Ammonium is expected to behave as a metal ([NH4]+ ions in a sea of electrons) at very high pressures, such as inside gas giant planets such as Uranus and Neptune.[7][8]
Under normal conditions, ammonium does not exist as a pure metal, but does as an amalgam (alloy with mercury).[9]
See also[edit]
- Ammonium transporter
- f-ratio
- Hydronium (H3O+)
- Iminium
- Nitrification
- Onium compounds
- The Magnificent Possession (Isaac Asimov short story)
References[edit]
- ^ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 71,105,314. Electronic version.
- ^ «Pseudo-binary compounds». Archived from the original on 2020-07-27. Retrieved 2007-10-12.
- ^ «Ammonium Salts». VIAS Encyclopedia.
- ^ Campbell, Neil A.; Jane B. Reece (2002). «44». Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 978-0-8053-6624-2.
- ^ Britto, DT; Kronzucker, HJ (2002). «NH4+ toxicity in higher plants: a critical review» (PDF). Journal of Plant Physiology. 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ^ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ a b Stevenson, D. J. (November 20, 1975). «Does metallic ammonium exist?». Nature. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. S2CID 4199721.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (February 3, 1954). «Metallic Ammonium». Monthly Notices of the Royal Astronomical Society. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172.
- ^ Reedy, J.H. (October 1, 1929). «Lecture demonstration of ammonium amalgam». Journal of Chemical Education. 6 (10): 1767. Bibcode:1929JChEd…6.1767R. doi:10.1021/ed006p1767.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
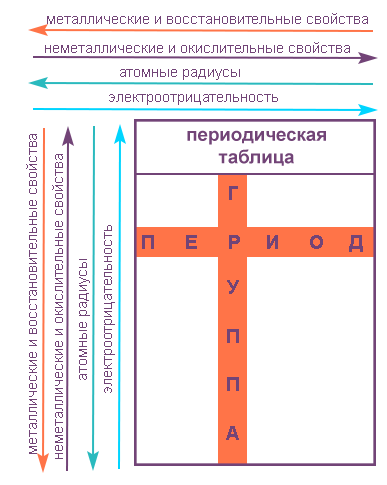
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.

![]()
Модель катиона аммония

![]()
Образование аммония
Аммоний (свободный радикал) – атомная группа (или радикал) состава NH4, не существующая в свободном виде[1][2]. Аммоний (свободный радикал), так же как и короткоживущие свободные радикалы, склонен к рекомбинации и как атом водорода образует молекулу водорода[3].Аммоний (свободный радикал) можно стабилизировать замораживанием или в матрице в виде амальгамы.[3][4]
Аммоний (катион) – положительно заряженный полиатомный ион с химической формулой NH4+. Аммоний (катион) с противоионом образуют соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений.[5]
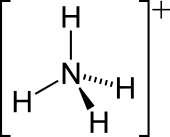
Аммо́ний (лат. Ammonium) — многоатомный неорганический катион, продукт протонирования аммиака. В соединениях играет роль одновалентного металла. Химическая формула — NH4+. При растворении аммиака в растворах кислот происходит реакция протонирования:
-
- NH3 + H+ = NH4+
Ион аммония является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1,43 Å[6].
Существует также короткоживущий свободный радикал аммония с формулой NH4[7] (см. Свободный аммоний).
Содержание
- 1 Диссоциация солей аммония
- 2 Свойства солей аммония
- 3 Реакция для обнаружения аммония
- 4 Свободный аммоний
- 5 Замещённые соединения аммония
- 5.1 Органические
- 5.2 Неорганические
- 6 См. также
- 7 Литература
- 8 Примечания
Диссоциация солей аммония
При диссоциации солей аммония в водных растворах образуется катион аммония, например:
-
- NH4CI = NH4+ + Cl−.
Свойства солей аммония
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
- Прочность солей аммония сильно различается. Если записать реакцию аммиака с кислотами следующим образом:
-
- NH3 + Н+X− → [NH4]+X−,
то чем сильнее кислотный остаток Х− удерживает катион Н+, тем труднее происходит прямой процесс и легче — обратный. Поэтому, чем меньше константа диссоциации кислоты, тем менее устойчива её аммонийная соль. Так, соль сильной кислоты HCl хлорид аммония NH4Cl вполне стабилен при комнатной температуре, а соль слабой угольной кислоты в этих условиях заметно разлагается.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
-
- NH4Cl → NH3 + HCl → NH4Cl
Если соль образована нелетучей кислотой, то нагреванием можно удалить NH3:
-
- NH4H2PO4 → Н3PO4 + NH3
- Если анион соли аммония содержит атом-окислитель, то при её нагревании происходит реакция внутримолекулярного окисления-восстановления, например:
-
- (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
- NH4NO3 → N2O + 2H2O
Реакция для обнаружения аммония
Реакция для обнаружения аммония — выделение аммиака при действии едких щелочей на соли аммония:
-
- NH4CI + NaOH = NH3 + H2O + NaCI
Широко используется для спектрофотометрического количественного анализа также реакция с реактивом Несслера.
Свободный аммоний
При попытке получения в свободном виде аммоний распадается на аммиак и водород. Однако при определенных условиях возможно выделение очень нестабильного свободного аммония NH4. Впервые он был получен при восстановлении раствора хлорида аммония амальгамой натрия в виде тестообразной массы, выделяющей водород и аммиак. В дальнейшем его удалось получить в жидком аммиаке. Если действовать NH4I на синий раствор металлического натрия в жидком аммиаке, то он обесцвечивается вследствие реакции по схеме:
-
- Na + NH4I = NaI + NH4.
Так как выделение водорода при этом не наблюдается и образовавшаяся бесцветная жидкость легко присоединяет иод (предположительно – по схеме: 2NH4 + I2 = 2NH4I), весьма вероятно, что в ней содержится свободный радикал – NH4. Заметное разложение последнего с выделением водорода начинает идти лишь выше минус 40 °C.[3]
Существует также амальгама аммония. Последний в амальгаме значительно устойчивее, чем в свободном состоянии, и разлагается на аммиак и водород сравнительно медленно[4].
Замещённые соединения аммония
Органические
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические
Тетрафтораммоний [NF4]+ представляет собой аммоний, все четыре атома водорода в котором замещены фтором. Тетрафтораммоний является одним из немногих соединений, в которых азот имеет степень окисления +5, является сильнейшим окислителем и устойчив только в соединении с комплексными фтористыми анионами, например, тетрафторборатом [BF4]−.
См. также
- Аммониевые соединения
- Гидроксоний
Литература
- Некрасов Б. В. Основы общей химии. — 14-е изд. — М.: Госхимиздат, 1962. — 976 с.
- Аммоний, аммониум // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Примечания
- ↑ Аммоний, аммониум//ЭСБЕ
- ↑ Словарь иностранных слов. — 15-е изд., испр.. — М.: Русс.яз, 1988. — С. 32. — 608 с.
- ↑ 1 2 3 Некрасов, 1962, с. 347
- ↑ 1 2 Некрасов, 1962, с. 659
- ↑ Onium compounds// IUPAC Gold Book
- ↑ Н. С. Ахметов. Неорганическая химия. Учебное пособие для ВУЗов. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1975. — С. 394. — 672 с.
- ↑ Некрасов, 1962, с. 339
Периодическая система химических элементов Д. И. Менделеева
| Период | Ряд | Группа | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||||
| 1 | 1 | 1HВодород1,0079 | (H) | 2HeГелий4,0026 | |||||||
| 2 | 2 | 3LiЛитий6,941 | 4BeБериллий9,012 | 5BБор10,811 | 6CУглерод12,011 | 7NАзот14,007 | 8OКислород15,999 | 9FФтор18,998 | 10NeНеон20,18 | ||
| 3 | 3 | 11NaНатрий22,99 | 12MgМагний24,305 | 13AlАлюминий26,982 | 14SiКремний28,086 | 15PФосфор30,974 | 16SСера32,065 | 17ClХлор35,453 | 18ArАргон39,948 | ||
| 4 | 4 | 19KКалий39,098 | 20CaКальций40,078 | 21ScСкандий44,956 | 22TiТитан47,867 | 23VВанадий50,942 | 24CrХром51,996 | 25MnМарганец54,938 | 26FeЖелезо55,845 | 27CoКобальт58,933 | 28NiНикель58,693 |
| 5 | 29CuМедь63,546 | 30ZnЦинк65,409 | 31GaГаллий69,723 | 32GeГерманий72,64 | 33AsМышьяк74,992 | 34SeСелен78,96 | 35BrБром79,904 | 36KrКриптон83,798 | |||
| 5 | 6 | 37RbРубидий85,468 | 38SrСтронций87,62 | 39YИттрий88,906 | 40ZrЦирконий91,224 | 41NbНиобий92,906 | 42MoМолибден95,94 | 43TcТехнеций[98,906] | 44RuРутений101,07 | 45RhРодий102,906 | 46PdПалладий106,42 |
| 7 | 47AgСеребро107,868 | 48CdКадмий112,411 | 49InИндий114,818 | 50SnОлово118,71 | 51SbСурьма121,76 | 52TeТеллур127,60 | 53IИод126,904 | 54XeКсенон131,293 | |||
| 6 | 8 | 55CsЦезий132,905 | 56BaБарий137,327 | 57La*Лантан138,905 | 72HfГафний178,49 | 73TaТантал180,948 | 74WВольфрам183,84 | 75ReРений186,207 | 76OsОсмий190,23 | 77IrИридий192,217 | 78PtПлатина195,084 |
| 9 | 79AuЗолото196,967 | 80HgРтуть200,59 | 81TlТаллий204,383 | 82PbСвинец207,2 | 83BiВисмут208,98 | 84PoПолоний[208,98] | 85AtАстат[209,98] | 86RnРадон[222,02] | |||
| 7 | 10 | 87FrФранций[223,02] | 88RaРадий[226,03] | 89Ac**Актиний[227,03] | 104RfРезерфордий[261,1087] | 105DbДубний[262,1138] | 106SgСиборгий[263,1182] | 107BhБорий[262,1229] | 108HsХассий[265] | 109MtМейтнерий[266] | 110DsДармштадтий[269] |
| 11 | 111RgРентгений[272] | 112CnКоперниций[285] | 113UutУнунтрий[284] | 114FlФлеровий[289] | 115UupУнунпентий[288] | 116LvЛиверморий[293] | 117UusУнунсептий[295] | 118UuoУнуноктий[294] | |||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие соединения с водородом | RH4 | RH3 | H2R | HR |
*Лантаноиды
| 58CeЦерий140,12 | 59PrПразеодим140,91 | 60NdНеодим144,24 | 61PmПрометий[146,9] | 62SmСамарий[150,36] | 63EuЕвропий151,96 | 64GdГадолиний157,25 | 65TbТербий158,93 | 66DyДиспрозий162,50 | 67HoГольмий164,93 | 68ErЭрбий167,26 | 69TmТулий168,93 | 70YbИттербий173,04 | 71LuЛютеций174,97 |
**Актиноиды
| 90ThТорий232,04 | 91PaПротактиний231,04 | 92UУран238,03 | 93NpНептуний[237,05] | 94PuПлутоний[244,06] | 95AmАмериций[243,06] | 96CmКюрий[247,07] | 97BkБерклий[247,07] | 98CfКалифорний[251,08] | 99EsЭйнштейний[252,08] | 100FmФермий[257,1] | 101MdМенделевий[258,1] | 102NoНобелий[259,1] | 103LrЛоуренсий[260,11] |
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Выше приведена «короткая» форма таблицы.
ТАБЛИЦА МЕНДЕЛЕЕВА — периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА
 Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH |
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Аммоний
Брутто-формула:
H4N^+
CAS# 14798-03-9
Категории:
Катион
, Неорганическое вещество
PubChem CID: 223
| ChemSpider ID: 218
| CHEBI:28938
Названия
Русский:
- Аммоний [Wiki]
- ион аммония
- катион аммония
English:
- Ammonium [Wiki]
- Ammonium cation
- Ammonium ion
Варианты формулы:
NH4^+
H/N^+<_(A80,w+)H><`|H>_(A15,d+)H
H/N`^+<_q4H><_p4H>/H
Вещества, имеющие отношение…
Соль:
Сульфат аммония; Хлорид аммония; Нитрат аммония; Карбонат аммония; Гидрокарбонат аммония; Молибдат аммония; Дихромат аммония; Мурексид; Нитрит аммония; Фторид аммония; Гидрофосфат аммония; Фосфат аммония; Дигидроортофосфат аммония; Карбамат аммония; Гидросульфит аммония; Сульфит аммония; ортованадат аммония; Малат аммония; Бромид аммония; Иодид аммония; Перхлорат аммония; Хлорат аммония; Иодат аммония; Формиат аммония; Ацетат аммония; Гексафторофосфат(V) аммония; Азид аммония; Цианат аммония; Адипат аммония; Гексафторогафниат(IV) аммония; Тетрафенилборат аммония; Пероксодисульфат аммония; Перренат аммония; Гексахлороренит аммония; Фторсульфонат аммония; Стеарат аммония; Арсенат аммония; Гексахлоротехнетат(IV) аммония
Химический состав
Реакции, в которых участвует Аммоний
-
NH3 + H2O <=> NH4^+ + OH^-



![{displaystyle {ce {H+ + NH3 -> [NH4]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09135f318a8156b2e420e7e8649d42fefa2bc51)
![{displaystyle {ce {[NH4]+ + B- -> HB + NH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/919cc6fb00019fee68ccc7bcfa8214910853628f)
![{displaystyle {ce {H2O + NH3 <=> OH- + [NH4]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/631270c1ff852ddf6fc0ca7335761ec5874731d7)

![{displaystyle {ce {[NH4]+ + OH- ->[heat] NH3 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ddfc9836963f68746656202104369566b8520cd6)
![{displaystyle {ce {NH3_{(g)}{}+ HCl_{(aq)}-> [NH4]Cl_{(s)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d3eca1f053c4fdde9d569ee4a93828f0bba05a2)
2_{(aq)}{}+ H2SO4_{(aq)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2210b7ab5b263f73ff03a5cb3ed4355d86a043ca)
![{displaystyle {ce {H2[PtCl6]_{(aq)}{}+ [NH4]+_{(aq)}-> [NH4]2[PtCl6]_{(s)}{}+ 2 H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a75267fc6072184833d909420ff49c63951deba)
![{displaystyle {ce {Na3[Co(NO2)6]_{(aq)}{}+ 3 [NH4]+_{(aq)}-> [NH4]3[Co(NO2)6]_{(s)}{}+ 3 Na+_{(aq)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ab602493ba082c23d3c48ab02f82485d204634b)
![{displaystyle {ce {KC4H5O6_{(aq)}{}+ [NH4]+_{(aq)}-> [NH4]C4H5O6_{(s)}{}+ K+_{(aq)}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97696c043f49cf51916efa72d98bdb61caab155c)